
- •664074, Г. Иркутск, ул. Лермонтова, 83 дисперсные системы и поверхностные явления
- •Поверхностные явления
- •Дисперсные системы
- •Вопросы
- •1. Поверхностные явления и адсорбция
- •2. Дисперсные системы
- •3. Коллоидные растворы
- •4. Свойства коллоидных растворов
- •Аналитическая химия
- •Качественный химический анализ
- •Количественный анализ
- •Вопросы
- •1. Качественный химический анализ
- •2.Количественный анализ
- •3.Физико-химические и физические методы анализа
- •Органическая химия
- •Некоторые особенности органических соединений
- •Классификация органических соединений
- •Классификация химических реакций по механизму разрыва химической связи
- •Углеводороды
- •Алканы (предельные, или насыщенные, углеводороды)
- •Алкены (непредельные, или ненасыщенные, углеводороды ряда этилена, или олефины)
- •1. Реакции присоединения
- •Алкадиены (диеновые углеводороды)
- •Алкины (непредельные углеводороды ряда ацетилена)
- •Ароматические углеводороды
- •Гомологи бензола
- •Галогенопроизводные углеводородов
- •Спирты, фенолы, простые эфиры
- •Предельные одноатомные спирты
- •1. Реакции гидроксильного водорода
- •2. Реакции гидроксильной группы
- •Простые эфиры
- •Карбонильные соединения
- •Альдегиды и кетоны
- •Карбоновые кислоты
- •Одноосновные предельные карбоновые кислоты
- •Оксикислоты
- •Ароматические кислоты
- •Вопросы
- •1. Теория строения органических соединений
- •2. Углеводороды
- •3. Спирты и карбонильные соединения
- •4. Карбоновые кислоты и их производные
- •Высокомолекулярные соединения
- •Органические полимеры
- •Способы получения полимеров
- •Строение и свойства полимеров
- •Неорганические полимеры
- •Элементоорганические полимеры
- •Биополимеры
- •Вопросы
- •1. Органические и неорганические полимеры
- •2. Методы получения полимеров
- •3. Строение и свойства полимеров
- •4. Биополимеры
- •Библиографический список
- •Оглавление
Галогенопроизводные углеводородов
Галогенопроизводные углеводородов представляют собой продукты замещения одного или нескольких атомов водорода в молекулах углеводородов на атомы галогенов.
Химические свойства
Для галогенопроизводных алканов характерны реакции:
1. Гидролиза. При действии на галогенопроизводные алканов водного раствора щелочи происходит замещение атома галогена на гидроксильную группу и образование спирта:
H3C−CH2−СНCl−CH3
+ КОН
![]() H3C−
CH2−CHOH−CH3
+ КCl
H3C−
CH2−CHOH−CH3
+ КCl
2-хлорбутан бутанол-2
2. Дегидрогалогенирования. При действии на галогенопроизводные алканов спиртового раствора щелочи происходит отщепление молекул галогеноводорода и образование непредельных соединений, например:
H3C−СН2−CHCl−СН3 + KOH Н3С−СН=CH−CH3 + KCl + H2O
2-хлорбутан бутен-2
Отщепление молекулы галогеноводорода происходит в соответствии с правилом Зайцева: атом водорода отщепляется от наименее гидрогенизированного атома углерода.
3. Взаимодействия с натрием и магнием. Галогенопроизводные алканов реагируют с металлическим натрием (реакция Вюрца) и магнием:
2 CH3Br + 2 Na → CH3−СН3 + 2 NaBr
бромметан этан
C2H5Br + Mg → C2H5MgBr
бромэтан этилмагнийбромид
Спирты, фенолы, простые эфиры
Спирты – это производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильные группы −ОН.
В зависимости от углеводородов, спирты подразделяются на предельные и непредельные. По числу гидроксильных групп, входящих в состав молекулы спирта, различают одноатомные (например, С2Н5ОН) и многоатомные (например, глицерин СН2ОН−СНОН−СН2ОН) спирты.
В зависимости от числа углеродных атомов, соединенных с атомом углерода, у которого расположена гидроксильная группа, спирты делят на первичные, вторичные и третичные.
Предельные одноатомные спирты
К предельным одноатомным спиртам относятся спирты, молекулы которых содержат одну гидроксильную группу, связанную с алкильным радикалом.
Общая формула гомологического ряда предельных спиртов CnH2n+2O, где n = 1,2,3,4…
Первыми членами этого ряда являются:
СН3ОН – метанол, С2Н5ОН – этанол, С3Н7ОН – пропанол, С4Н9ОН – бутанол.
Изомерия спиртов связана как с разветвлением углеродной цепи, так и с различным положением гидроксильной группы. Например, бутанол может иметь следующие изомеры:
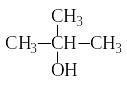
С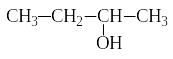
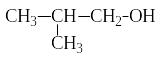 Н3−СН2−СН2−СН2−ОН;
; ;
Н3−СН2−СН2−СН2−ОН;
; ;
бутанол-1 бутанол-2 2-метил-пропанол-1 2-метил-пропанол-2
(первичный спирт) (вторичный спирт) (первичный спирт) (третичный спирт)
Свойства
Спирты имеют достаточно высокие температуры кипения. Это связано с ассоциацией молекул спирта за счет возникновения между ними водородных связей:
δ+ δ‾ δ+ δ‾ δ+ δ‾
![]()
Химические свойства спиртов определяются гидроксильной группой −ОН, входящей в состав молекулы. Химические реакции спиртов могут идти или по водороду гидроксильной группы (с разрывом связи О−Н), или протекать с участием всей группы (с разрывом связи С−О).
