- •664074, Г. Иркутск, ул. Лермонтова, 83 дисперсные системы и поверхностные явления
- •Поверхностные явления
- •Дисперсные системы
- •Вопросы
- •1. Поверхностные явления и адсорбция
- •2. Дисперсные системы
- •3. Коллоидные растворы
- •4. Свойства коллоидных растворов
- •Аналитическая химия
- •Качественный химический анализ
- •Количественный анализ
- •Вопросы
- •1. Качественный химический анализ
- •2.Количественный анализ
- •3.Физико-химические и физические методы анализа
- •Органическая химия
- •Некоторые особенности органических соединений
- •Классификация органических соединений
- •Классификация химических реакций по механизму разрыва химической связи
- •Углеводороды
- •Алканы (предельные, или насыщенные, углеводороды)
- •Алкены (непредельные, или ненасыщенные, углеводороды ряда этилена, или олефины)
- •1. Реакции присоединения
- •Алкадиены (диеновые углеводороды)
- •Алкины (непредельные углеводороды ряда ацетилена)
- •Ароматические углеводороды
- •Гомологи бензола
- •Галогенопроизводные углеводородов
- •Спирты, фенолы, простые эфиры
- •Предельные одноатомные спирты
- •1. Реакции гидроксильного водорода
- •2. Реакции гидроксильной группы
- •Простые эфиры
- •Карбонильные соединения
- •Альдегиды и кетоны
- •Карбоновые кислоты
- •Одноосновные предельные карбоновые кислоты
- •Оксикислоты
- •Ароматические кислоты
- •Вопросы
- •1. Теория строения органических соединений
- •2. Углеводороды
- •3. Спирты и карбонильные соединения
- •4. Карбоновые кислоты и их производные
- •Высокомолекулярные соединения
- •Органические полимеры
- •Способы получения полимеров
- •Строение и свойства полимеров
- •Неорганические полимеры
- •Элементоорганические полимеры
- •Биополимеры
- •Вопросы
- •1. Органические и неорганические полимеры
- •2. Методы получения полимеров
- •3. Строение и свойства полимеров
- •4. Биополимеры
- •Библиографический список
- •Оглавление
Алкены (непредельные, или ненасыщенные, углеводороды ряда этилена, или олефины)
А![]() лкены
– углеводороды,
в молекулах которых между атомами
углерода имеется одна двойная связь:
.
лкены
– углеводороды,
в молекулах которых между атомами
углерода имеется одна двойная связь:
.
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации и связаны одной σ- и одной π-связью.
Общая формула углеводородов ряда алкенов – CnH2n.
Представители алкенов:
С2Н4 С3Н6 С4Н8 С5Н10 С6Н12
этен (этилен) пропен (пропилен) бутен (бутилен) пентен гексен
Алкены образуют радикалы, например СН2=СН− СН2=СН−СН2−.
этенил (винил) пропенил (аллил)
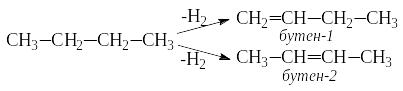
Изомерия алкенов обусловлена различным положением двойной связи в углеводородной цепи и разветвлением цепи. Например, бутен имеет такие изомеры:
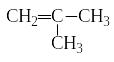 СН2=СН−СН2−СН3
СН3−СН=СН−СН3
СН2=СН−СН2−СН3
СН3−СН=СН−СН3
бутен -1 бутен-2 2-метилпропен
Химические свойства
Наличие двойной связи в молекулах алкенов обусловливает их высокую реакционную способность. Для них характерны реакции присоединения, окисления и полимеризации.
1. Реакции присоединения
а) Гидрирование (присоединение водорода). Алкены, присоединяя водород под давлением и в присутствии катализатора (Pt, Pd, Ni), переходят в алканы:
Н2С=СН2 + Н2 → Н3С−СН3.
б) Галогенирование (присоединение галогенов) с образованием дигалогенопроизводных:
Н3С−СН=СН2 + Br2 → Н3С−СHBr−CH2Br
пропилен 1,2-дибромпропан
На этой реакции основано качественное определение алкенов (бромная вода обесцвечивается).
в) Гидрогалогенирование (присоединение галогеноводородов) осуществляется в соответствии с правилом В.В.Марковникова: атом водорода галогеноводородов и других несимметричных водородных соединений присоединяется к наиболее гидрогенизированному атому углерода двойной связи.
Н3С−СН=СН2 + HBr → H3C−CHBr−CH3
пропилен 2-бромпропан
г) Гидратация (присоединение воды). Реакция протекает в присутствии катализатора (H2SO4) в соответствии с правилом Марковникова. При этом образуются спирты:
СН2=СН2 + Н2О → СН3−СН2ОН
этилен этиловый спирт (первичный спирт)
СН3−СН=СН2 + Н2О → СН3−СНOH−СН3
пропилен изопропиловый спирт (вторичный спирт)
2. Реакции окисления. Алкены легко окисляются, причем в зависимости от силы окислителей реакции могут протекать с разрывом только π-связи или с полным разрывом двойной связи.
а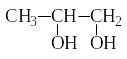 )
Перманганат калия в нейтральной или
слабощелочной среде окисляет алкены с
разрывом π-связи с образованием
двухатомных спиртов − реакция
Вагнера:
)
Перманганат калия в нейтральной или
слабощелочной среде окисляет алкены с
разрывом π-связи с образованием
двухатомных спиртов − реакция
Вагнера:
3Н3С−CH=CH2 + 2KMnO4 + 4H2O → 3 + 2MnO2 + 2KOH
пропен пропандиол-1,2
Эта реакция служит для качественного определения алкенов (фиолетовый раствор KMnO4 обесцвечивается).
б) Сильные окислители (KMnO4 или K2Cr2O7 в присутствии H2SO4) окисляют алкены с разрывом молекулы по месту двойной связи:
Н3С−СН=СН2
+ 4[O]
![]() H3C−COOH
+ HCOOH
H3C−COOH
+ HCOOH
пропилен уксусная кислота муравьиная кислота
в) При высокотемпературном окислении алкенов в кислороде или на воздухе они сгорают:
Н2С=СН2 + 3О2 → 2СО2 + 2Н2О
Получение
В лаборатории алкены можно получить:
1. Дегидратацией (отщепление воды) спиртов:
Н3С−СН2ОН
![]() Н2С=СН2
+ Н2О
Н2С=СН2
+ Н2О
этиловый спирт этилен
2. Действием спиртового раствора щелочи на галогенопроизводные алканов:
H3C−CH2Cl
+ KOH
![]() Н2С=СН2
+ КCl
+ Н2О
Н2С=СН2
+ КCl
+ Н2О
хлорэтан этилен
3. Гидрированием ацетилена:
Н−С≡С−Н
+ Н2
![]() Н2С=СН2
Н2С=СН2
ацетилен этилен
4. В промышленности алкены получают дегидрированием алканов в присутствии катализаторов (Cr2O3), при этом образуется смесь изомеров: