
- •664074, Г. Иркутск, ул. Лермонтова, 83 дисперсные системы и поверхностные явления
- •Поверхностные явления
- •Дисперсные системы
- •Вопросы
- •1. Поверхностные явления и адсорбция
- •2. Дисперсные системы
- •3. Коллоидные растворы
- •4. Свойства коллоидных растворов
- •Аналитическая химия
- •Качественный химический анализ
- •Количественный анализ
- •Вопросы
- •1. Качественный химический анализ
- •2.Количественный анализ
- •3.Физико-химические и физические методы анализа
- •Органическая химия
- •Некоторые особенности органических соединений
- •Классификация органических соединений
- •Классификация химических реакций по механизму разрыва химической связи
- •Углеводороды
- •Алканы (предельные, или насыщенные, углеводороды)
- •Алкены (непредельные, или ненасыщенные, углеводороды ряда этилена, или олефины)
- •1. Реакции присоединения
- •Алкадиены (диеновые углеводороды)
- •Алкины (непредельные углеводороды ряда ацетилена)
- •Ароматические углеводороды
- •Гомологи бензола
- •Галогенопроизводные углеводородов
- •Спирты, фенолы, простые эфиры
- •Предельные одноатомные спирты
- •1. Реакции гидроксильного водорода
- •2. Реакции гидроксильной группы
- •Простые эфиры
- •Карбонильные соединения
- •Альдегиды и кетоны
- •Карбоновые кислоты
- •Одноосновные предельные карбоновые кислоты
- •Оксикислоты
- •Ароматические кислоты
- •Вопросы
- •1. Теория строения органических соединений
- •2. Углеводороды
- •3. Спирты и карбонильные соединения
- •4. Карбоновые кислоты и их производные
- •Высокомолекулярные соединения
- •Органические полимеры
- •Способы получения полимеров
- •Строение и свойства полимеров
- •Неорганические полимеры
- •Элементоорганические полимеры
- •Биополимеры
- •Вопросы
- •1. Органические и неорганические полимеры
- •2. Методы получения полимеров
- •3. Строение и свойства полимеров
- •4. Биополимеры
- •Библиографический список
- •Оглавление
Алканы (предельные, или насыщенные, углеводороды)
В молекулах алканов атомы углерода находятся в состоянии sp3-гибридизации, связаны друг с другом s-связями и максимально, до предела «насыщены» водородом.
Общая формула гомологического ряда алканов – СnH2n+2.
Представители алканов:
СН4 С2Н6 С3Н8 С4Н10 С5Н12 С6Н14 С7Н16
метан этан пропан бутан пентан гексан гептан
Если от молекулы углеводорода отщепить один или несколько атомов водорода, то образуется углеводородный радикал. Название радикалов происходит от названий соответствующих алканов с заменой окончания -ан на –ил.
СН3− С2Н5− СН3−СН2−СН2− СН3−СН2−СН2−СН2−
метил этил пропил бутил
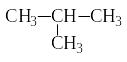
Изомерия алканов обусловлена разветвлением углеродной цепи молекул. Число изомеров возрастает по мере увеличения числа атомов углерода в молекуле. Например, бутан имеет два изомера:
 СН3−СН2−СН2−СН3
СН3−СН2−СН2−СН3
нормальный бутан изобутан (2-метилпропан)
У пентана существует 3 изомера, гексана – 5, гептана – 9, октана – 18 и т.д.
Атомы углерода могут быть соединены с разным числом других атомов углерода: одним, двумя, тремя и четырьмя. В зависимости от этого различают первичные, вторичные, третичные и четвертичные углеродные атомы.
Например, в соединении

2,2,5-триметилгептан
атомы углерода 1 и 7 – первичные, атомы 3, 4, 6 – вторичные, атом 5 – третичный и атом 2 – четвертичный.
Химические свойства
В химическом отношении алканы – инертные вещества, что определяется прочностью связей С−С и С−Н. Кроме того, эти связи малополярны, поэтому для алканов характерны реакции, протекающие с гомолитическим разрывом связей. Для предельных углеводородов характерны два типа реакций.
1. Реакции замещения водорода с разрывом связи С−Н. В этих реакциях легче происходит замещение атома водорода, связанного с третичным углеродным атомом, труднее – со вторичным и совсем трудно – с первичным.
а) Галогенирование (замещение водорода на галоген):
CH4
+ Cl2
![]() CH3Cl
+ HCl; CH3Cl
+ Cl2
CH2Cl2
+ HCl и
т.д.
CH3Cl
+ HCl; CH3Cl
+ Cl2
CH2Cl2
+ HCl и
т.д.
хлорметан дихлорметан
б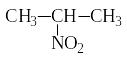 )
Нитрование (замещение водорода на
нитрогруппу) – реакция
Коновалова:
)
Нитрование (замещение водорода на
нитрогруппу) – реакция
Коновалова:
CH3−CH2−CH3
+ HNO3
![]() Н2О
+
Н2О
+
пропан 2-нитропропан
2. Реакции расщепления молекулы алкана с разрывом связей С−Н и С−С.
а) Отщепление водорода (дегидрирование алканов) с разрывом связей С−Н и образованием непредельных углеводородов:
CH3−CH2−CH3
![]() CH3−CH=CH2
+ Н2
CH3−CH=CH2
+ Н2
пропан пропилен
б) Крекинг – расщепление молекул органических соединений под действием высоких температур с разрывом связей С−С и образованием алканов с меньшим числом атомов углерода и непредельных соединений, например:
С4Н10 → СН4 + CH3−CH=CH2 или С4Н10 → С2Н6 + СН2=СН2
бутан метан пропилен бутан этан этилен
Получение
Алканы можно получить:
1. Гидрированием непредельных углеводородов (катализаторы – Pt, Pd, Ni):
H2C=CH2
+ H2
![]() H3C−CH3
H−C≡C−H
+ 2H2
H3C−CH3;
H3C−CH3
H−C≡C−H
+ 2H2
H3C−CH3;
этилен этан ацетилен этан
2. Действием металлического натрия на галогенопроизводные алканов – реакция Вюрца:
Н3C−I + 2Na + I−CH2−CH3 → H3C−CH2−CH3 + 2NaI
йодметан йодэтан пропан
3. Сплавлением солей карбоновых кислот со щелочами:
CH3COONa + NaOH → CH4 + Na2CO3.
