
- •1. Строение атома
- •1.1. Энергетическое состояние электронов в атоме
- •1.2. Основные принципы распределения электронов в атомах
- •В соответствии с этим правилом последовательность заполнения подуровней:
- •1.3. Периодический закон и электронные формулы атомов
- •1.4. Примеры решения и оформления заданий
- •1.5. Задания для самостоятельной подготовки
- •2. Классы неорганических веществ
- •2.1. Оксиды
- •Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •2.2. Гидроксиды
- •Основания
- •Кислоты
- •Амфотерные гидроксиды
- •2.3. Соли
- •Средние соли
- •Кислые соли
- •Основные соли
- •2.4. Примеры решения заданий
- •2.5. Задания для самостоятельной подготовки
- •3. Основы химической термодинамики
- •3.1. Энтальпия
- •3.2. Энтропия
- •3.3 Энергия Гиббса и ее изменение в ходе химических реакций
- •3.4. Примеры решения заданий
- •3.5. Задания для самостоятельной подготовки
- •4. Химическое равновесие
- •4.1. Константа химического равновесия
- •4.2. Принцип Ле Шателье
- •Влияние концентраций компонентов системы
- •Влияние температуры
- •Влияние общего давления в системе
- •4.3 Примеры решения заданий
- •4.4. Задания для самостоятельной подготовки
- •5. Растворы
- •5.1. Примеры решения заданий
- •5.2. Задания для самостоятельной подготовки
- •5.3. Электролиты
- •Теория электролитической диссоциации Степень диссоциации
- •5.4. Ионные реакции
- •5.5. Примеры решения заданий
- •5.6. Задания для самостоятельной подготовки
- •5.7. Диссоциация воды. Водородный показатель
- •5.8. Гидролиз
- •5.9. Примеры решения заданий
- •5.10 Задания для самостоятельной подготовки
- •6. Окислительно-восстановительные процессы
- •6.1. Степень окисления
- •6.2. Окислительно-восстановительные реакции
- •6.3. Составление уравнений окислительно-восстановительных реакций
- •Правила составления полуреакций в разных средах
- •Овр в кислой среде
- •Овр в щелочной среде
- •Овр в нейтральной среде
- •6.4. Примеры решения заданий
- •6.5. Задания для самостоятельной подготовки
- •6.6 Взаимодействие металлов с кислотами, водой и растворами щелочей
- •6.7. Примеры решения и оформления заданий
- •6.8. Задания для самостоятельной подготовки
- •6.9. Электрохимическая коррозия
- •Описание процесса гальванокоррозии
- •6.10. Примеры решения заданий
- •6.11. Задания для самостоятельной подготовки
- •6.12. Электролиз растворов
- •Катодные процессы
- •Анодные процессы
- •Законы фарадея
- •6.13. Примеры решения и оформления заданий
- •6.14 Задания для самостоятельной подготовки
- •Библиографический список Основная литература
- •Дополнительная литература
- •Стандартные энтальпии образования и энтропии
- •Названия некоторых кислот и их солей
- •Стандартные окислительно-восстановительные потенциалы металлов
- •Окислительно-восстановительные потенциалы водорода, кислорода и металлов в разных средах
Описание процесса гальванокоррозии
1. Выписать стандартные потенциалы металлов в данной среде (табл. П. 7), определить анод (металл – с меньшим значением электродного потенциала) и катод (металл – с бóльшим значением потенциала).
2. Выписать значения потенциалов возможных окислителей (деполяризаторов). Окислителем будет частица с наибольшим потенциалом (наиболее сильный окислитель).
3. Записать электронно-ионные уравнения полуреакций:
– анодного процесса – окисления материала анода;
– катодного процесса – восстановления окислителя.
4. Записать суммарные ионное и молекулярное уравнения окислительно-восстановительной реакции, протекающей при гальванокоррозии.
5. Указать на схеме анод (А), катод (К), направление движения электронов.
6.10. Примеры решения заданий
Пример 1. Гальванопара алюминий-железо в воде (среда нейтральная). В воде растворен кислород.
Al / H2O, O2 / Fe
1. Потенциалы металлов:
![]() =
-1,88
B;
=
-1,88
B;
![]() =
-
0,46B.
=
-
0,46B.
2. Потенциалы возможных окислителей (деполяризаторов):
![]() =
– 0,41 В;
=
– 0,41 В;
![]() =
+ 0,814 B.
=
+ 0,814 B.
Al – анод (А); Fe – катод (К)$ окислитель - О2.
3. Электронно-ионные уравнения полуреакций анодного и катодного процессов:
A (Al): 4 Al -
3ē + 3Н2О
= Al(OH)3+
3Н+
-
процесс
окисления;
(Al): 4 Al -
3ē + 3Н2О
= Al(OH)3+
3Н+
-
процесс
окисления;
K (Fe): 3 О2
+ 4ē + 2Н2
О = 4ОН–
-
процесс
восстановления
(Fe): 3 О2
+ 4ē + 2Н2
О = 4ОН–
-
процесс
восстановления
4. Суммарные ионное и молекулярное уравнения:
4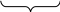 Al + 12 Н2О
+ 3 О2
+ 6 Н2О
= 4 Al(OH)3+
12 Н+
+ 12 ОН–
Al + 12 Н2О
+ 3 О2
+ 6 Н2О
= 4 Al(OH)3+
12 Н+
+ 12 ОН–
12 Н2О
4 Al + 3 О 2 + 6 Н2О = 4 Al(OH)3.
5. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом (от анода к катоду):
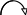 ē
ē
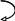 А–
Al │ Fe К+
ē
А–
Al │ Fe К+
ē
O2, H2O .
Пример 2. Определить процессы, протекающие при коррозии луженого железа (в растворе HCl), если нарушена сплошность покрытия:
Fe / Н2О, НCl / Sn.
1. Потенциалы металлов:
![]() =
-
0,44 B;
=
-
0,44 B;
![]() =
-
0,136 B.
=
-
0,136 B.
2. Потенциалы возможных окислителей (деполяризаторов):
![]() =
– 0,00 В
=
– 0,00 В
Fe – анод (А); Sn – катод (К); окислитель - H+.
3. Электронно-ионные уравнения полуреакций анодного и катодного процессов:
A (Fe): 1
Fe -
2ē = Fe 2+
–процесс окисления
(Fe): 1
Fe -
2ē = Fe 2+
–процесс окисления
K (Sn): 1 2Н+ + 2ē = Н2 – процесс восстановления.
4. Суммарные ионное и молекулярное уравнения:
Fe + 2Н+ = Fe2+ + Н2
Fe + 2НCl = FeCl2 + Н2.
5. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом (от анода к катоду):
ē
А– Fe │ Sn К+ ē
Н2О, НCl .
Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
Al / КОН, H2O / Fe
1. Потенциалы металлов:
![]() =
-2,36
B;
=
-2,36
B;
![]() =
-
0,874 B.
=
-
0,874 B.
2. Потенциал окислителя (деполяризатора):
![]() =
-
0,827 B.
=
-
0,827 B.
Al – анод (А); Fe – катод (К); окислитель - Н2О.
3 . Электронно-ионные уравнения полуреакций анодного и катодного процессов:
A (Al): 2 Al - 3ē + 4OH – = AlO2– + 2H2O – процесс окисления
K (Fe): 3 2 H2O
+ 2ē = 2 OH
–
+ H2
– процесс восстановления.
(Fe): 3 2 H2O
+ 2ē = 2 OH
–
+ H2
– процесс восстановления.
4. Суммарные ионное и молекулярное уравнения:
2 Al + 8 OH– + 6 H2O = 2 AlO2– + 4 H2O + 6 OH– + 3 H2
2 Al + 2 OH – + 2H2O = 2 AlO2– + 3 H2
2 Al + 2 КOH + 2H2O = 2 КAlO2 + 3 H2.
5. Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом (от анода к катоду):
ē
А– Al │ Fe К+ ē
H2O, KOH .
