
- •Е.В. Серебрякова химия биологически активных веществ
- •1 )Изомерия углеродного скелета
- •2) Изомерия положения аминогруппы
- •3) Межклассовая изомерия
- •2) Реакции по карбоксильной группе
- •3) Образование амидов по карбоксильной группе
- •4)Реакции по аминогруппе
- •5) Специфические реакции
- •1) Биуретовая реакция
- •2) Нингидриновая реакция на α-аминокислоты
- •4) Реакция с азотно-ртутным реактивом Миллона
- •5) Реакция Адамкевича на триптофан
- •6) Реакция Сакагучи на аргинин
- •7)Реакция Фоля на серосодержащие аминокислоты
- •1) Восстановительное
- •2)Гидролитическое
- •1 По числу аминокислотных остатков:
- •4 Классификация может сочетаться:
- •1) Регулирующая функция:
- •1 Структурные белки
- •2 Каталитическая (ферментативная) функция
- •3 Транспортные белки
- •4 Защитные белки
- •7 Рецепторная (сигнальная) функция белков
- •9 Энергетическая функция
- •2. Реакция спиртовых гидроксидов:
- •4. Образование хелатных комплексов.
- •Крахмал
- •6.1 Гидролиз или омыление, жиров
2) Реакции по карбоксильной группе
Образование солей по карбоксильной группе. Подобно карбоновым кислотам, аминокислоты образуют соли при действии оснований, активных металлов, основных оксидов и солей более слабых кислот.
3) Образование амидов по карбоксильной группе
4)Реакции по аминогруппе
В растворе аминокислоты могут выступать в роли, как кислот, так и оснований, т. е. они являются амфотерными соединениями. Карбоксильная группа -СООН способна отдавать протон, функционируя как кислота, а аминная - NH2 — принимать протон, проявляя таким образом свойства основания.
Реакциями алкилирования называют реакции, включающие замену атома водорода органического соединения алкильным радикалом.
Алкилы (алкильные радикалы) — одновалентные радикалы насыщенных углеводородов (алканов), например метил - СН3 — это радикал метана CH4, этил -C2H5 — радикал этана C2H6.
Подобно аминам, аминокислоты образуют соли при действии кислот:
Н2N–CH2–COOH + HCl [H3N–CH2–COOH]+ Cl–
а) Алкилирование аминогруппы
Н2N–CH2–COOH CH3–J CH3–NH–CH2–COOH + HJ
б) Ацилирование аминогруппы (образование амидов по аминогруппе).
Реакция может протекать как под действием карбоновых кислот, так и под действием их производных – ангидридов и галогенангидридов.
H2N–CH2–COOH + CH3–COCl HN–CH2–COOH + HCl
CH3–C = O
с) Реакция с азотистой кислотой
CH3–CH–COOH + HO–N=O CH3–CH–COOH + N2 + H2O
NH2 OH
5) Специфические реакции
Образование пептидов. Аминогруппа одной аминокислоты может взаимодействовать с карбоксильной группой второй, образуя пептиды (соединения, состоящие из остатков аминокислот, связанных пептидной связью):
O
H
пептидная связь
глицин аланин CH3
дипептид глицилалании
Дипептид имеет свободные –NH2 и –COOH группы и может взаимодействовать еще с одной молекулой аминокислоты, образуя трипептид, затем еще с одной молекулой – тетрапептид и т.д. При соединении друг с другом большого числа аминокислот образуются полипептиды.

дипептид глицилалании серин трипептид глицилаланинсерин
Полипептидная цепь – основа белковых молекул, белки – это природные полипептиды.
Поликонденсация. Поликонденсацией ε – аминокапроновой кислоты (6-аминогексановой кислоты) получают синтетическое волокно «капрон».

Как мы увидим далее, поликонденсация аминокислот (отличных от тех, которые образуют полипептиды и белки) используется при получении очень ценных синтетических волокон, например капрона.
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОКИСЛОТ
1)Гидролиз белков:

Если в недавнем прошлом α-аминокислоты получали в небольших количествах, преимущественно для научных исследований, то в настоящее время налажено их многотоннажное промышленное производство. Это связано, например, с тем, что α-аминокислоты являются необходимым компонентом комбикормов и синтетической пищи на углеводной основе.
2) Из галогенопроизводных карбоновых кислот
 где:
Х – Cl,
Br
где:
Х – Cl,
Br

Монохлорпропионовая Аланин,
к-та α-аминопропионовая кислота
NH3
C H2–COOH
CH2COOH
H2–COOH
CH2COOH
–HCl
Cl NH2
Монохлоруксусная Глицин
кислота α-аминоуксусная кислота

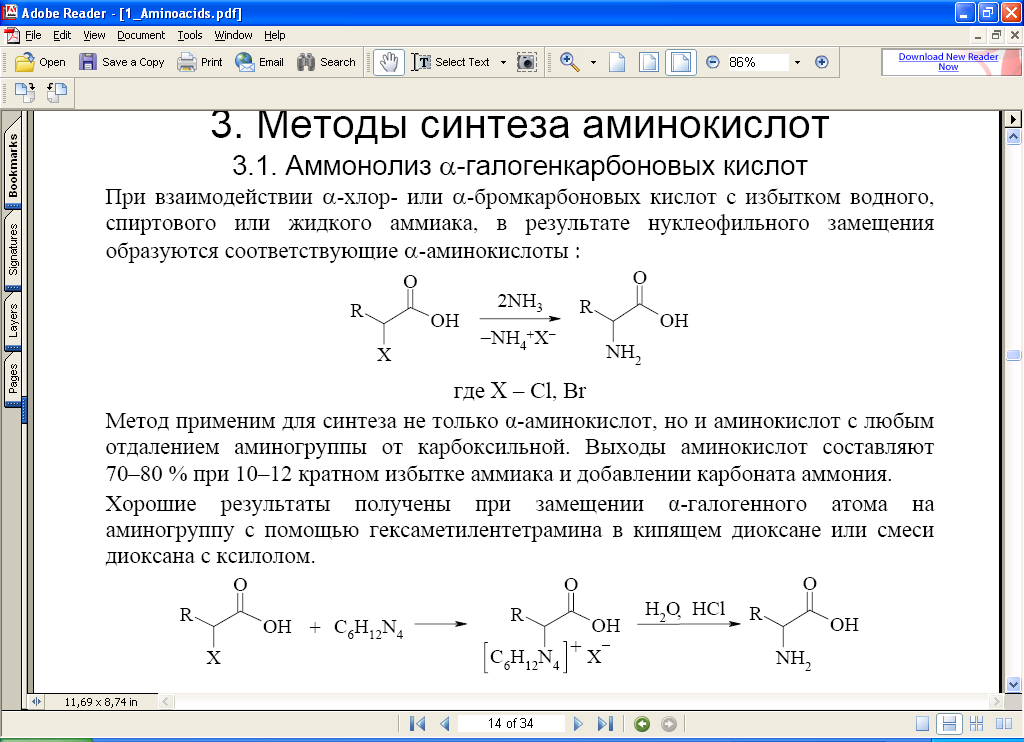
Метод применим для синтеза не только α-аминокислот, но и аминокислот с любым отдалением аминогруппы от карбоксильной. Выход аминокислот составляют 70-80% при 10-12 кратном избытке аммиака и добавлении карбоната аммония.
При взаимодействии α-хлор- или α-бромкарбоновых кислот с избытком водного, спиртового или жидкого аммиака, в результате нуклеофильного замещения образуются соответствующие α-аминокислоты.
2) В лабораторных условиях химический синтез аминокислот осуществляют при взаимодействии галогенокарбоновых кислот с аммиаком.
Исходные α-галогенокислоты обычно получают по реакции Гелля–Фольгарда–Зелинского:
По этому методу из аммиака, альдегидов и синильной кислоты получают α-аминонитрилы, гидролиз которых дает α-аминокислоты.
3) Синтез Штреккера
В синтезе Штреккера альдегид превращают в α-аминокислоту с удлинением углеродной цепи на один атом углерода.
По этому методу из аммиака, альдегидов и синильной кислоты получают α-аминонитрилы, гидролиз которых дает α-аминокислоты.
Процесс проходит в две стадии.
На первой стадии в результате реакции альдегида с NH4Cl и NaCN получают α-аминонитрил, на второй – при гидролизе нитрильной группы α-аминонитрила получают аминокислоту.
а) получение аланина:
б) получение фенилаланина:

Основными недостатками метода являются:
- относительно низкий выход α – аминокислот,
- применение токсичного цианистого водорода.
4) Очень распространен способ получения α-аминокислот с использованием малонового эфира.
При этом один из атомов водорода метиленовой группы малонового эфира замещается на аминогруппу, а другой – на соответствующий требуемой аминокислоте углеводородный радикал. В результате гидролиза полученного диэтилового эфира и последующего декарбоксилирования дикислоты получают нужную аминокислоту:
5) Еще один способ синтеза аминокислот заключается в восстановительном аминировании (восстановлении водородом в присутствии аммиака) α-оксокарбоновых кислот:
(
Pd, t

O NH2
4- метил-2-оксипентановая лейцин
кислота
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
В растворе аминокислоты могут выступать
в роли как кислот, так и оснований, т. е.
они являются амфотерными соединениями.
Карбоксильная группа -СООН способна
отдавать протон, функционируя как
кислота, а аминная - NH2
— принимать протон, проявляя таким
образом свойства основания.
растворе аминокислоты могут выступать
в роли как кислот, так и оснований, т. е.
они являются амфотерными соединениями.
Карбоксильная группа -СООН способна
отдавать протон, функционируя как
кислота, а аминная - NH2
— принимать протон, проявляя таким
образом свойства основания.
1)Аминокислоты взаимодействуют с кислотами:
NH2 – CH2 – COOH + HCI → HCI• NH2 – CH2 –COOH
(хлороводородная соль глицина)
2)Аминокислоты взаимодействуют с щелочами:
NH2 —CH2 —COOH + NaOH → NH2 —CH2 —COONa + H2O
(натриевая соль глицина)
3) Дезаминирование азотистой кислотой:
H 2N-CH(R)-COOH
+ HNO2 →
HO-CH(R)-COOH + N2↑+
H2O
2N-CH(R)-COOH
+ HNO2 →
HO-CH(R)-COOH + N2↑+
H2O
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота — в гидроксикислоту:
Измерение объема выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
4) Реакция этерификации (со спиртами в присутствии газообразного хлороводорода (НСI)
H2N-CH(R)-COOH + R'OH → H2N-CH(R)-COOR' + Н2О.
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир (точнее, в хлороводородную соль эфира).
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Реакция этерификации – реакция между спиртом и кислотой с выделением воды и образованием сложного эфира. Эта реакция имеет внешнюю аналогию с реакцией нейтрализации кислоты щелочью, хотя сложные эфиры по свойствам нисколько не напоминают соли.
NH2–CH2– COOH+CH3OH → H2O+NH2–CH2 COOCH3
(метиловый эфир глицина)
Реакция этерификации – реакция между спиртом и кислотой с выделением воды и образованием сложного эфира. Эта реакция имеет внешнюю аналогию с реакцией нейтрализации кислоты щелочью, хотя сложные эфиры по свойствам нисколько не напоминают соли.
6) Алкилирование аминогруппы:
Реакциями алкилирования называют реакции, включающие замену атома водорода органического соединения алкильным радикалом.
Алкилы (алкильные радикалы) — одновалентные радикалы насыщенных углеводородов (алканов), например метил -СН3 — это радикал метана CH4, этил -C2H5 — радикал этана C2H6.
7) Превращение аминокислот в различных средах

1) Аминокислоты - это органические амфотерные соединения. Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами. Аминокислоты реагируют как с кислотами, так и с основаниями:
2) При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
+NH3– CH COO —
|
R
3) Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:
4) Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин - щелочной (одна группа -СООН, две -NH2).
8) Важнейшее свойство аминокислот — их способность к конденсации с образованием пептидов.
А миногруппа
одной аминокислоты может взаимодействовать
с карбоксильной группой второй, образуя
пептиды (соединения, состоящие из
остатков аминокислот, связанных пептидной
связью):
миногруппа
одной аминокислоты может взаимодействовать
с карбоксильной группой второй, образуя
пептиды (соединения, состоящие из
остатков аминокислот, связанных пептидной
связью):
Дипептид имеет свободные –NH2 и –COOH группы и может взаимодействовать еще с одной молекулой аминогруппы, образуя трипептид, затем еще с одной молекулой – тетрапептид и т.д. При соединении друг с другом большого числа аминокислот образуются полипептиды.
Полипептидная цепь – основа белковых молекул, белки – это природные полипептиды.
БИОЛОГИЧЕСКИЙ СИНТЕЗ АМИНОКИСЛОТ
В живых организмах аминокислоты синтезируются без участия неорганических катализаторов и высоких температур с помощью ферментативных процессов включения аммиака в органические соединения.
Известны три основные реакции такого включения:
аминирование,
переаминирование и
включение аммиака в пиримидины и мочевину.
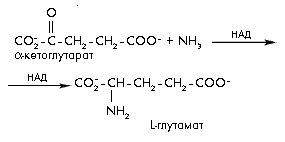
Реакция первого типа – образование глутамата из α-кетоглутарата и аммиака – катализируется ферментом глутаматдегидрогеназой.
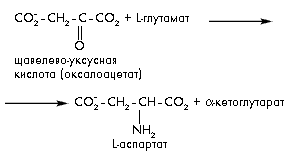
В реакциях переаминирования аминокислоты
образуются из органических кислот в
результате переноса аминогруппы от
другой аминокислоты-донора при участии
пиридоксальфосфата:
реакциях переаминирования аминокислоты
образуются из органических кислот в
результате переноса аминогруппы от
другой аминокислоты-донора при участии
пиридоксальфосфата:
3) Наконец, большое значение имеют реакции третьего типа, приводящие к включению аммиака в мочевину и катализируемые карбамоилфосфатсинтазой:
С

 O2
+
NH3
+ 2AТФ
+ H2O
NH2–C–OPO3H–
+ 2АДФ + Ф
O2
+
NH3
+ 2AТФ
+ H2O
NH2–C–OPO3H–
+ 2АДФ + Ф
O
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде, нерастворимые в неполярных растворителях, растворы многих аминокислот имеют сладкий вкус. Аминокислоты при нагревании разлагаются, поэтому не имеют точных температур кипения и плавления.
ПЕПТИДЫ
А миногруппа
одной аминокислоты способна вступать
в реакцию с карбоксильной группой другой
аминокислоты. Образующаяся при этом
молекула представляет собой дипептид,
а связь -CO-NH- называется пептидной связью.
миногруппа
одной аминокислоты способна вступать
в реакцию с карбоксильной группой другой
аминокислоты. Образующаяся при этом
молекула представляет собой дипептид,
а связь -CO-NH- называется пептидной связью.
На одном конце молекулы дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды. Если таким образом соединяется много аминокислот (более десяти), то получается полипептид.
Пептиды играют важную роль в организме. Многие олиго- и полипептиды являются гормонами, антибиотиками, токсинами.
К олигопептидам относятся окситоцин, вазопрессин, тиреотропин, а также брадикинин (пептид боли) и некоторые опиаты («естественные наркотики» человека), выполняющие функцию обезболивания. Принятие наркотиков разрушает опиатную систему организма, поэтому наркоман без дозы наркотиков испытывает сильную боль — «ломку», которая в норме снимается опиатами. К олигопептидам относятся и некоторые антибиотики (например, грамицидин S).
Многие гормоны (инсулин, адренокортикотропный гормон и др,), антибиотики (например, грамицидин А), токсины (например, дифтерийный токсин) являются полипептидами.
Образование пептидной связи


В природе в составе белков встречается 20 аминокислот, при этом все они обычно являются левовращающими (L-изомеры), т.е. закручивают угол поляризации плоскополяризованного света влево при прохождении им раствора АК.
Постройка полипептидной (белковой) цепи происходит путем образования между молекулами АК пептидных связей. Белки, в зависимости от последовательности АК в их составе, образуют сложные пространственные структуры, соответствующие их клеточным функциям. Для нас важно, что и в процессе репликации, и в процессе трансляции в современных организмах белки принимают непосредственное участие, реализуя свою ферментативную функцию.
Синтезировать можно многие тысячи различных аминокислот, и множество различных аминокислот встречается в природе, но для синтеза белков используется только 20 видов аминокислот: аланин, аргинин, аспарагин, аспарагиновая кислота, валин, гистидин, глицин, глутамин, глутаминовая кислота, изолейцин, лейцин, лизин, метионин, пролин, серин, тирозин, треонин, триптофан, фенилаланин и цистеин (в белках цистеин может присутствовать в виде димера - цистина). Правда, в некоторых белках присутствуют и другие аминокислоты, помимо регулярно встречающихся двадцати, но они образуются в результате модификации какой-нибудь из двадцати перечисленных уже после того, как она включилась в белок.
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АМИНОКИСЛОТЫ
