
- •1 Лабораторная работа №1. Исследование электрокардиографических сигналов
- •1.1 Сердечнососудистая система человека
- •1.2 Строение сердца
- •1.3 Функциональные узлы сердца
- •1.4 Кровеносные сосуды сердца
- •1.5 Методы получения электрокардиограммы
- •1.6 Описание электрокардиограммы
- •2 Экспериментальная часть. Исследования биопотенциалов сердца анализатор-монитором «Нейровизор–бмм
- •2.1 Ключевые слова
- •Цель работы
- •2.3 Аппаратный комплекс
- •2.4 Подготовка к регистрации электрокардиограмм
- •2.5 Проведение эксперимента
- •2.6 Анализ электрокардиограмм и обсуждение результатов
- •2.7 Отчет о лабораторной работе
- •2.8 Вопросы по теме «Исследование электрокардиографических сигналов»
- •Электрофизиологические измерения лабораторный практикум
- •Часть 2 Электроэнцефалографические исследования головного мозга
- •119454, Москва, пр. Вернадского, д. 78
Содержание
|
Введение. Электрофизиологические исследования |
4 |
В.1 |
Методы электрофизиологической диагностики |
4 |
В.2 |
Возникновение биоэлектрических потенциалов |
6 |
В.3 |
Виды биоэлектрических отведений |
9 |
В.4 |
Биоэлектрические электроды и их характеристики |
11 |
В.5 |
Помехи, возникающие при измерении биопотенциалов, и способы их уменьшения |
14 |
1 |
Лабораторная работа №1. Исследование электрокардиографических сигналов
|
16 |
1.1 |
Сердечнососудистая система человека
|
16 |
1.2 |
Строение сердца
|
16 |
1.3 |
Функциональные узлы сердца
|
19 |
1.4 |
Кровеносные сосуды сердца |
22 |
1.5 |
Методы получения электрокардиограммы |
25 |
1.6 |
Описание электрокардиограммы |
28 |
2 |
Экспериментальная часть. Исследования биопотенциалов сердца анализатор-монитором «Нейровизор–БММ |
32 |
2.1 |
Ключевые слова
|
32 |
2.2 |
Цель работы
|
33 |
2.3 |
Аппаратный комплекс
|
33 |
2.4 |
Подготовка к регистрации электрокардиограмм
|
34 |
2.5 |
Проведение эксперимента
|
35 |
2.6 |
Анализ электрокардиограмм и обсуждение результатов |
39 |
2.7 |
Отчет о лабораторной работе
|
39 |
2.8 |
Вопросы по теме «Исследование электрокардиографических сигналов»
|
40 |
|
Список литературы |
40 |
Введение. Электрофизиологические исследования сердца
В.1 Методы электрофизиологической диагностики
Методы электрофизиологической диагностики основаны на регистрации биоэлектрических сигналов, источниками которых могут быть отдельные клетки и органы биологического объекта, а также организм в целом и его различные системы.
При диагностике заболеваний основной информацией для врача является состояние органов человека, их биоэлектрическая активность, которая лежит в основе следующих методов электрофизиологической диагностики:
– электрокардиография, ЭКГ (исследование электрической активности сердца);
– электроэнцефалография, ЭЭГ (исследование электрической активности головного мозга);
– электромиография, ЭМГ (исследование электрической активности мышц);
– электроокулография, ЭОГ (исследование изменения потенциалов, обусловленных движением глазного яблока);
– электрогастрография (анализ электрических сигналов, вызванных деятельностью желудка и кишечника);
– электрокохлеография (исследование биопотенциалов, вызванных активностью структур наружного, среднего и внутреннего уха).
Как правило, в методах электрофизиологических исследований регистрируются биопотенциалы целого сообщества клеток. Например, в электрокардиографии изучаются электрические процессы, протекающие в сердце, и фиксируются суммарные потенциалы действия сердечной мышцы. Потенциалы отводятся с поверхности тела на значительном расстоянии от сердца (источника сигналов). Волна возбуждения, распространяющаяся по сердцу, отображается на кривой (электрокардиограмме) – зависимости изменения потенциала от времени. Каждому положению отводящих электродов на поверхности тела соответствуют своя форма и амплитуда сигналов электрокардиограммы.
Процессы в электроэнцефалографии еще более сложные, так как головной мозг характеризуется большим разнообразием клеточных структур и сложным характером взаимодействия между ними. Активность клеток и причины ее проявления различны, распределение вызванных при этом биосигналов на поверхности головы представляет собой сложную картину, зависящую от зоны измерения, поэтому существуют разнообразные методы регистрации биопотенциалов, а также способы их интерпретации и использования в задачах диагностики.
Биопотенциалы, регистрируемые при различных видах электрофизиологических исследований, являются малыми по амплитуде и находятся в области низких и инфранизких частот. Типичные значения диапазонов амплитуд и частот сигналов приведены в табл. 1 [1].
Таблица 1 Амплитуды и частотные диапазоны отведений сигналов от различных органов и тканей
Органы, ткани |
Диапазон частот, Гц |
Диапазон амплитуд, мВ |
|
|
|
Сердце Головной мозг: - на поверхности скальпа - на открытом мозге Желудок Мышечные ткани Глазные мышцы Костные ткани Спинной мозг: - медленные колебания, - быстрые колебания |
0,05–2000
3,5–4 0,1–120 0,02–0,5 5–5000 0,5–50 менее 1
2–10 8–30 |
0,03–5
0,002–0,2 0,05–5 0,01–10 0,1–10 0,002–0,2 до 10
0,01–0,02 0,04–0,06 |
Наряду со сложной зависимостью биоэлектрических сигналов, обусловленных внутренними процессами в организме, существует неоднозначная их зависимость от параметров внешней среды. Поэтому регистрация сигналов должна осуществляться при тщательном контроле способов отведения биопотенциалов, а при анализе информации следует применять методы оптимальной обработки сигналов с использованием статистических, спектральных и вейвлет пакетов программ.
В.2 Возникновение биоэлектрических потенциалов
Механизм возникновения электрических потенциалов в живом организме связан с неравномерным распределением ионов (в первую очередь ионов натрия и калия) между внутренним содержимым клетки (цитоплазмой) и окружающей клетку средой.
Внутреннее пространство живых клеток (цитоплазма) отделено от межклеточной среды мембраной, которая представляет собой липидный бислой, непроницаемый, для заряженных частиц, в т.ч. для ионов. У большинства клеток мембрана ведет себя как конденсатор, удерживая противоположные по знаку заряды в тонких прилежащих к мембране слоях внутриклеточной и внеклеточной жидкости. Активными участниками ионного транспорта являются следующие ионы, присутствующие по обе стороны мембраны: К+, Na+, Ca++, Cl–.
В цитоплазме нервных и мышечных клеток концентрация ионов калия К+ примерно в 30–40 раз больше, а концентрация ионов натрия Na+ на порядок меньше, чем в межклеточной жидкости, в то же время концентрация Ca++ в межклеточной жидкости ~ в 104 раз выше, чем внутри клетки. Разности концентраций формируют трансмембранные градиенты, определяющие поведение ионов.
Клеточная мембрана в состоянии покоя заряжена, причем ее внутренняя поверхность отрицательна относительно межклеточной среды.
Наличие заряда, удерживаемого мембраной клетки, приводит к возникновению разности потенциалов между внеклеточной средой и цитоплазмой. Внеклеточный потенциал принято считать равным нулю.
Мембрана для ионов может быть проницаемой через определенные молекулярные структуры, встроенные в липидный бислой мембраны. Известны два типа таких структур:
- ионные насосы, осуществляющие активный транспорт ионов через мембрану (в обе стороны) и создающие градиент концентрации этих ионов;
- ионные каналы, избирательно пропускающие определенные типы ионов и позволяющие им переходить из цитоплазмы во внеклеточную среду (или обратно) в направлении градиента концентрации.
Каждый тип клетки характеризуется своим мембранным потенциалом, отражающим обменные процессы в данной клетке. Потенциал покоя формируется быстрой диффузией через клеточную мембрану катионов К+ по сравнению с анионами органических полимеров, содержащихся в цитоплазме, при этом избирательная проницаемость мембраны препятствует полному выравниванию концентрации ионов между клеткой и средой. Как правило, внутри клетки концентрация К+ выше, чем во внеклеточной среде, а концентрации Na+, хлора Cl– и кальция Ca++ – ниже. Мембрана в состоянии покоя проницаема, в основном, для К+, что обуславливает отрицательный потенциал покоя, а сама мембрана становится поляризованной. Величина мембранного потенциала покоя (МПП) зависит от вида ткани и варьирует от «минус» 9 до «минус» 100 мВ.
При увеличении избирательной проницаемости клеточной мембраны, возникающей под действием раздражителя выше пороговой величины (в основном для ионов Na+), происходит быстрое изменение мембранного потенциала покоя (МПП), возникает скачок потенциала (потенциал инверсии) и появляется потенциал действия (ПД), при этом внутренняя поверхность мембраны заряжается положительно относительно межклеточной среды. Уменьшение абсолютной величины МПП называют деполяризацией, увеличение абсолютной величины – гиперполяризацией, восстановление исходного значения МПП – реполяризацией мембраны.
Изменения мембранного потенциала связаны с изменением вероятности открытия или закрытия ионных каналов. В результате открытия ионных каналов наблюдаются:
– повышение проницаемости Na+ вызывает вход ионов натрия в клетку и возникновение деполяризации;
– повышение проницаемости Ca++ вызывает вход ионов кальция в клетку и возникновение деполяризации;
– повышение проницаемости К+ вызывает выход ионов калия из клетки и возникновение гиперполяризации;
– повышение проницаемости Cl– вызывает вход ионов хлора в клетку и возникновение гиперполяризации;
На открытие и закрытие ионных каналов могут влиять следующие факторы:
– мембранный потенциал (например, в каналах нервных и мышечных волокон, чувствительных к величине потенциала);
– связывание канального белка с определенными сигнальными молекулами (происходящее в постсинаптической мембране нервных и мышечных клеток, а также в хеморецепторах стенок сосудов);
– растяжение мембраны (как это происходт в механорецепторах и слуховых рецепторах);
– поглощение кванта света (в рецепторах сетчатки глаза).
В деятельности сердечной мышцы особую роль играют ионы Ca++, которые в соответствии с высоким трансмембранным градиентом концентрируются в т.н. сакроплазматическом ретикулуме и, благодаря наличию чувствительных к Ca++ белковых молекул, запускается процесс сокращения миофибрилл и в целом сердечной мышцы. Высвобождение ионов Ca++ из сакроплазматического ретикулума и их удаление через каналы из клетки приводит к расслаблению миофибрилл.
Возникшее изменение потенциала может распространяться по ткани несколькими различными способами:
1. Пассивной диффузией ионов через цитоплазму (например, вдоль дендрита нервной клетки), через внеклеточную среду или между цитоплазмами разных клеток через электрические синапсы.
2. Путем активного проведения потенциала действия (ПД) вдоль возбудимых участков мембраны (нервных и мышечных клеток). ПД представляет собой кратковременную инверсию и мембранного потенциала (вплоть до +100 мВ), вызванную лавинообразным входом натрия или кальция через каналы, чувствительные к величине потенциала и активируемые первичной надпороговой деполяризацией. ПД регенерируется заново в каждом следующем участке мембраны, а предыдущие участки переходят в состояние рефрактерности, что обеспечивает однонаправленное проведение сигнала.
3. Опосредованно при помощи сигнальных веществ, которые выделяются клеткой в ответ на изменение потенциала, диффундируют к месту назначения, связываются с мембранными рецепторами, вызывая изменение потенциала в месте связывания. Примером такой передачи является изменение потенциала в химических синапсах между нейронами.
Мягкие ткани организма являются проводящими, в результате чего изменения потенциала распространяются от места их возникновения и могут быть зарегистрированы кожными электродами. Поскольку сигнал затухает при удалении от места генерации, на поверхности тела может быть зарегистрирована только суммарная активность большого числа источников.
Для разных тканей амплитуда ПД различна, но всегда положительна относительно потенциала покоя и может достигать нескольких десятков милливольт.
Особенностью ПД является его способность распространяться вдоль клеточной мембраны из области локального возбуждения, передавая возбуждение по тканям. Скорость распространения волны возбуждения вдоль волокон существенно зависит от емкости мембраны и сопротивления цитоплазмы.
Существуют и другие виды электрической активности, например потенциал повреждения, который регистрируется между поврежденным и неповрежденным участками ткани и участвует в восстановительных (регенерационных) процессах в ткани. Механизм мембранных потенциалов и возбудимость клеточных структур очень чувствительны к влиянию самых слабых изменений физических и биохимических факторов. Следовательно, величина биопотенциала является индикатором состояния клеток и клеточных структур, тканей и органов.
В.3 Виды биоэлектрических отведений
Измерения электрических параметров живых организмов проводят с помощью электродов, соединенных с измерительной схемой. Отведение электрофизиологических сигналов исследуемых биохимических процессов осуществляется в зоне контакта биообъекта с электродом с использованием специального контактного вещества.
Используемые отведения делят на биполярные (двухполюсные), когда оба электрода являются измерительными и разность потенциалов регистрируется между двумя точками поверхности тела, и униполярные (однополярные). При униполярных отведениях один электрод является измерительным, а другой – нулевым (индифферентным). Униполярное отведение позволяет регистрировать биоэлектрическую активность в точке наложения измерительного электрода. Существуют также многоэлектродные отведения, когда в требуемых точках биообъекта накладываются две группы электродов и электроды каждой группы соединяются, образуя две ветви отведения. Реализация каждого вида отведений индивидуальна.
При регистрации электрокардиограммы наибольшее распространение получили 12 способов отведения, основанных на концепции треугольника Эйнтховена. При этом предполагается, что человеческое тело можно рассматривать в виде однородного проводника; генератор сердечной ЭДС заменяется точечным диполем и помещается в центре равностороннего треугольника, вершины которого расположены на правой и левой руке (у кистей) и левой ноге (у ступни), как изображено на рис. В.1.
Наиболее часто применяемые стандартные отведения от конечностей являются биполярными. В биполярном отведении к каждому каналу регистрации подключают два электрода.
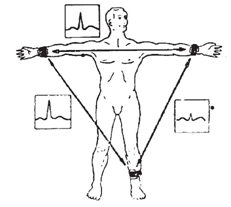
Рис. В.1. Треугольник Эйнтховена
При униполярном отведении от конечностей искусственно создается нейтральный электрод, а измерительный электрод можно помещать в любой точке тела.
В.4 Биоэлектрические электроды и их характеристики
Биоэлектрический электрод представляет собой устройство, имеющее токосъемную поверхность и выходные элементы. Токосъемной поверхностью является часть поверхности электрода, непосредственно или через контактное вещество контактирующая с биообъектом и обеспечивающая съем биопотенциалов. Биоэлектрический электрод имеет также опорную поверхность, выполняющую функцию крепления электрода на биообъекте. При помощи электродов происходит преобразование ионных потенциалов в электронные.
Биоэлектрические электроды в зависимости от вида и характера исследований отличаются следующими признаками:
– особенностями участия электродов в съеме биопотенциалов;
– характером исследуемого источника биоэлектрического поля;
– местом наложения, или введения;
– кратностью применения;
– продолжительностью контакта с биообъектом при одном исследовании;
– способом удержания в контакте с поверхностью биообъекта и др.
В зависимости от участия в съеме биопотенциалов различают следующие виды электродов:
Потенциальный (отводящий электрод, контактирующий с участком биообъекта и находящийся в электрическом поле исследуемого органа);
Нулевой (отводящий электрод, контактирующий с участком биообъекта, в котором потенциал электрического поля исследуемого органа, ткани, клетки близок к нулю);
Нейтральный (электрод, не участвующий в съеме биоэлектрических потенциалов, подключенный к нейтральной клемме измерительного прибора).
В зависимости от исследуемого источника биоэлектрического поля электроды делятся на следующие основные типы:
– электрокардиографические и электроэнцефалографические (электроды накладываются без нарушений кожных и костных покровов);
– электрокортикографические, (накладываются на поверхность обнаженной коры головного мозга);
– электромиелографические (используются для исследования биопотенциалов спинного мозга, вводятся непосредственно в спинной мозг);
– электромиографические (используются для съема биопотенциалов мышечных волокон, накладываются на кожный покров или вводятся внутрь мышечной ткани);
– электроокулографические (используются для съема биопотенциалов, возникающих при движении глазного яблока, накладываются вблизи глазного яблока);
– электроретинографические (накладываются на сетчатку глаза);
– электрогастрографические (используются для исследования биопотенциалов, вызванных электрической активностью желудка);
– электрокохлеографические (используются для съема биопотенциалов, вызванных активностью структур наружного, среднего и внутреннего уха).
По месту наложения, или введения выделяют кожные, роговичные электроды, электроды для вскрытых органов, полостные электроды для введения в естественные полости организма, внутритканевые электроды и микроэлектроды, токосъемная поверхность которых предназначена для съема электрических потенциалов клетки и ее структур. Первые три вида электродов относятся к поверхностным. Регистрация биопотенциалов с использованием поверхностных электродов может производиться длительно и многократно без каких–либо болезненных ощущений и вредного действия на организм.
Внутриполостные электроды в свою очередь подразделяются в зависимости от места введения в организм.
Типы, размеры и некоторые конструктивные особенности электродов, используемых в различных видах электрофизиологических исследований, определяются стандартами.
Форма поверхностных электродов определяется их целевой функцией, размеры – размерами исследуемого органа или его проекцией на поверхность тела. Так, поверхностные электроды для регистрации ЭКГ, ЭЭГ, ЭМГ изготавливают в виде круглых, овальных, прямоугольных пластин разных размеров. Отведение электрического сигнала осуществляется через разъемное или неразъемное соединение и гибкий многожильный провод.
Внутритканевые электроды подразделяются на игольчатые, стержневые и проволочные. Наиболее распространенными являются игольчатые электроды. Металлические микроэлектроды, предназначенные для съема биопотенциалов, изготавливаются из тонкой (прямой или завитой в спираль) проволоки. Диаметр рабочей части микроэлектрода составляет 0,05–10 мкм. По всей длине, за исключением рабочего торца, электрод обычно изолируется. Металлические микроэлектроды изготавливаются из материалов, обладающих необходимой твердостью и жесткостью (нержавеющая сталь, платино–иридиевый сплав, вольфрам).
Независимо от типа применяемого электрода стабильность контакта последнего с биообъектом является одним из наиболее существенных факторов, определяющих наличие сигналов помех и частотных искажений биоэлектрических сигналов.
Обеспечение стабильности электрического контакта поверхностных электродов с биообъектом достигается различными приемами:
– фиксацией электродов с помощью присосок, ремней, поясов, жилетов, корсетов, шлемов;
– использованием подпружиненных электродов;
– использованием зубчатых электродов, уменьшающих вероятность соскальзывания;
– использованием электродного контактного вещества.
Электродное контактное вещество должно хорошо смачивать кожу, иметь низкое электрическое сопротивление, не давать сдвигов электрических потенциалов, не менять своих свойств после нанесения на кожу и должно быть безвредным. При электрическом контакте через жидкую фазу случайные относительные смещения электрода и кожи не приводят к появлению артефактов движения.
В.5 Помехи при измерении биопотенциалов и способы их уменьшения
Помехи, возникающие при любых измерениях, искажают результат и увеличивают погрешность. Анализ причин появления помех и нахождение способов их устранения является основной задачей любого измерения.
Сложная структура отведений приводит к возникновению методических погрешностей, основными составляющими которых являются:
– падение части сигнала на сопротивлении кожа–электрод;
– искажение электрического поля проводящим материалом электрода и входными токами усилителя биопотенциалов;
– усреднение потенциалов поверхности тела под электродом вследствие его конечных размеров;
– разбаланс суммирующих цепей нулевых электродов с учетом сопротивления кожи и входного сопротивления усилителя;
– неточность наложения электрода в выбранную точку и различие в свойствах токопроводящих жидкостей и крема.
Помехи, возникающие при съеме биопотенциалов и их усилении и влияющие на результат измерения, могут проявлять себя независимо от наличия сигнала как случайные помехи, вызываемые определенными процессами в диагностируемом организме. Их причинами может быть биоэлектрическая активность органов, не имеющих непосредственного отношения к работе диагностируемого органа, а также кожно–гальванические рефлексы, непостоянство поляризационных эффектов на электродах и др. Например, в электрокардиографии артефактами могут быть сигналы, связанные с активностью различных групп мышц, которые при миографических исследованиях являются полезными. Такие сигналы имеют широкую полосу частот.
Действие помехи может проявляться в нерегулярном изменении уровня сигнала вследствие изменения сопротивления электрод-кожа, вызванного внешними раздражителями, при высыханинии электропроводного крема или физиологического раствора, а также при возникновении электрохимических процессов на переходах контакта. Помехи появляются в инфранизком частотном диапазоне и возникают в основном при длительных исследованиях. Для уменьшения их влияния на результат измерений ограничивают время диагностики.
Помехи могут вызываться внешними причинами в виде наводок от электрических полей электроустановок, силовой и осветительной сети (50 Гц), от магнитных полей, создаваемых трансформаторами и другими магнитными приборами; а также от электромагнитных полей, сопровождающих работу высокочастотных физиотерапевтических и хирургических аппаратов. Провода отведений образуют виток, в котором электромагнитное поле наводит помеху, величина которой пропорциональна площади витка.
Собственные шумы активных и пассивных элементов входных цепей и усилителей биопотенциалов, а также преобразователей сигналов в цифровую форму вносят свой вклад в помеховую составляющую измеряемого сигнала.
Существуют несколько способов уменьшения сетевых помех.
Для ослабления влияния сетевой помехи обычно используется дополнительный нейтральный (индифферентный) электрод, с помощью которого биообъект соединяют с заземляющим проводом. Уровень сетевых наводок уменьшится, но в большинстве видов электрофизиологических измерений он может оставаться выше уровня полезных сигналов.
Сетевую наводку ослабляют с помощью режекторных фильтров, обеспечивающих подавление в узкой полосе частот 47–53 Гц, устанавливаемых на входах усилителей биопотенциалов.
Диапазоны частот используемых усилителей как правило перекрываются и составляют в различных режимах:
ЭКГ 0,5–74 Гц,
ЭЭГ, ЭОГ 1–25 Гц,
ЭМГ 0,08–5 кГц.
Наводки от сетей питания 50 Гц и их гармоник 100 Гц, 150 Гц и др. могут находиться в этих полосах частот.
В качестве усилителей биоэлектрических сигналов используются дифференциальные усилители, которые имеют большое входное сопротивление не менее 10 МОм, обеспечивают увеличение биопотенциалов до 1000 раз и имеют чувствительность порядка 1…10 мкВ.
Снижение влияния биологических и физических помех достигается применением усилителей с достаточно большим коэффициентом подавления этих помех. Устранение влияния помех и наводок, связанных с проводами отведений, достигается уменьшением площади замкнутого контура, образованного этими проводами и применением методов экранирования.
Дифференциальные усилители должны быть малошумящими. Шум, возникающий при использовании аналого-цифрового преобразования, следует минимизировать путем согласования цифровых и аналоговых цепей или предусмотреть специальные меры.
1 Лабораторная работа №1. Исследование электрокардиографических сигналов
1.1 Сердечнососудистая система человека
Сердечнососудистая система человека – сложный и чувствительный механизм, обеспечивающий снабжение кровью всех органов и тканей организма. В состав сердечнососудистой системы входят сердце и сосуды – кровеносные и лимфатические.
1.2 Строение сердца
Сердце представляет собой биологический насос с производительностью ~ 7 000 литров в сутки. Работа сердца обеспечивает непрерывное движение крови по сложнейшей замкнутой системе сосудов. Фактически в сердце заключены два идентичных и синхронно действующих насоса, каждый из которых содержит предсердие, желудочек и два клапана (рис.1.1). Насосы (левый и правый) разделены толстой и прочной мышечной перегородкой и кроме того разделены функционально.
Мышечную основу четырех камер сердца (два предсердия и два желудочка) составляют стенки и перегородки. Мышечные волокна камер расположены по спирали, поэтому при их сокращении кровь буквально выбрасывается из сердца.
Правая половина сердца «прокачивает» богатую углекислым газом венозную кровь в легкие по легочным артериям. В легких кровь насыщается кислородом, после чего возвращается по легочным венам в левую часть сердца – левое предсердие и, пройдя через двухстворчатый (митральный) клапан, попадает в левый желудочек, заканчивая т.н. малый круг кровообращения. Задача клапанов – пропускать кровь только в одном направлении.
Левый желудочек больше по размеру и мускулистее правого. Его задача – перекачивать обогащенную кислородом кровь по аорте и другим главным артериям во все части тела, обеспечивая движение по большому кругу кровообращения. [2].
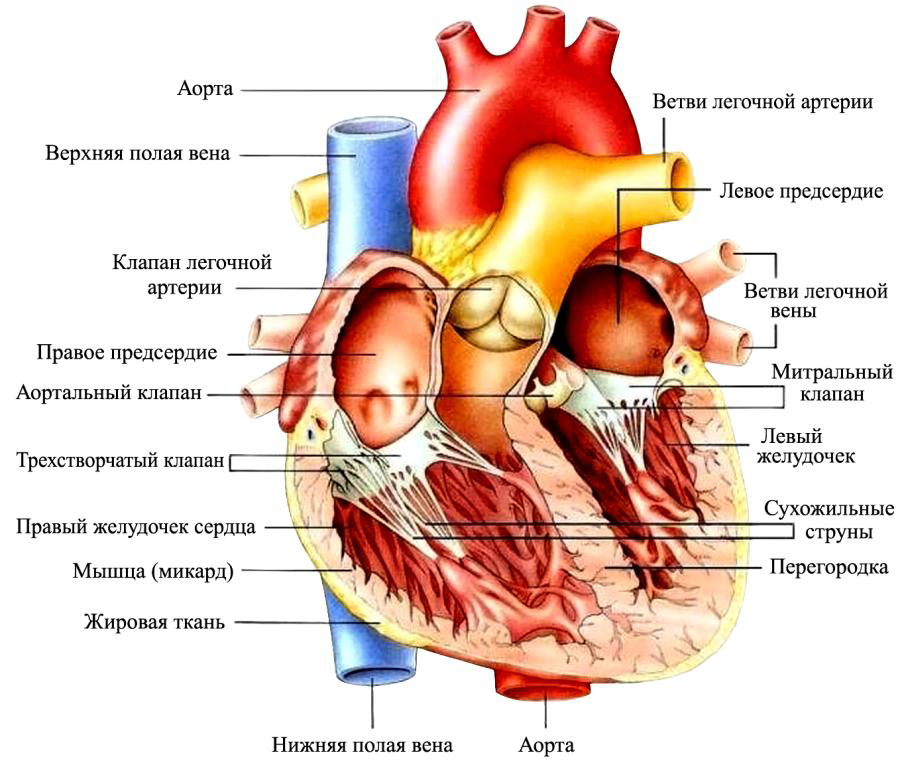
Рис. 1.1 Строение сердца (URL: http://www.fiziolog.isu.ru)
Между желудочками и отходящими от них аортами малого и большого круга кровообращения находятся полулунные клапаны, которые обеспечивают течение крови только в одном направлении. Клапаны состоят из двух или трех створок, смыкающихся после прохождения крови через клапан.
Трехстворчатый клапан и клапан легочной артерии контролируют прохождение насыщенной углекислотой крови с правой стороны; а митральный и аортальный клапаны управляют потоком обогащенной кислородом крови слева.
Работа сердца состоит в периодической смене сокращений (систолы) и расслаблений (диастолы). При систоле объем полостей сердца уменьшается и кровь выбрасывается из сердца в систему кровеносных сосудов. Во время диастолы камеры расширяются, и сердце наполняется кровью.
Строго определенную последовательность сокращения и расслабления сердца называют сердечным циклом. Длительность систолы и диастолы одинакова, поэтому половину времени сердце находится в расслабленном состоянии.
Непрерывно перекачиваемая кровь циркулирует по телу, разносит по нему кислород и питательные вещества и удаляет из тканей двуокись углерода и продукты обмена.
Сердце покрыто плотной фиброзной оболочкой (перикардом), заполненной небольшим количеством жидкости, предотвращающей трение при сокращениях.
Как и всякий другой орган, сердце имеет свою кровеносную систему, обеспечивающую все клетки постоянно работающего «насоса» питанием и кислородом.
Система кровеносных сосудов получила название собственное коронарное (или венечное) кровоснабжение. Здесь особые ветви аорты – коронарные артерии, снабжают сердце насыщенной кислородом кровью (рис. 1.2).
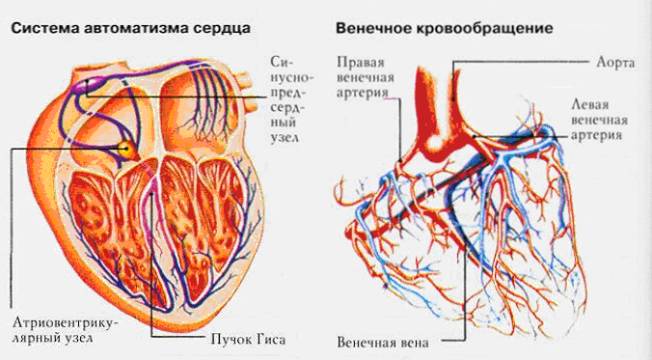
Рис. 1.2 Коронарное (венечное) кровообращение сердца
