
- •Самостійна робота
- •Основні поняття і закони хімії
- •Основні положення атомно-молекулярної теорії
- •НайВажливіші поняття атомно-молекулярного вчення
- •1.2.1 Атом
- •1.2.2 Молекула
- •1.2.3 Хімічний елемент
- •Основні закони хімії
- •1.3.1 Закон збереження маси і енергії
- •1.3.2 Закон сталості складу
- •1.3.3 Закон об’ємних співвідношень Гей-Люссака
- •1.3.4 Закон Авогадро
- •I Наслідок закона Авогадро:
- •II Наслідок закону Авогадро
- •1.3.5 Основні газові закони
- •1.3.6 Закон еквівалентів
I Наслідок закона Авогадро:
Один моль будь-якого газа зо нормальних умовх (н.у.) займає об’єм приблизно 22,4 л (0,0224 м3).
Ця величина називається молярним об’ємом, позначається VM і вимірюється у [л/моль] або [м3/моль] (рис.1.17). Нормальними умовами вважаються: Р = 101325Па (~105Па) = 1атм = = 760мм рт.ст., Т = 273,15К, або t = 00С. Молярний об’єм – це емпірично встановлена величина на основі співвідношень:
де – густина газу, [г/л], або [кг/м3]. |
Рисунок 1.17 – Молярний oб’єм газів: за н.у. VM = 22,4л/моль |
Молярний об’єм на відміну від молярної маси не є постійною величиною, а залежить від умов (Р, Т), тому VM як поняття вживають звичайно для газів за н.у.
Молярний об’єм пов’язаний з іншими величинами (об’ємом V, кількістю речовини , молярною масою М, густиною , числом Авогадро NA і кількістю частинок N) співвідношеннями:
 (1.5)
(1.5)
II Наслідок закону Авогадро
Відношення густини одного газу до густини іншого газу за однакових умов дорівнює відношенню їх молярних мас М або відносних молекулярних мас Мr.
Ця величина називається відносною густиною одного газу за іншим і позначається буквою d або D:
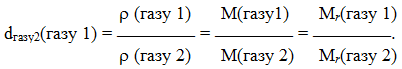 (1.6)
(1.6)
Звідки 1 = 2d2(газу1); 2 = 1/d2(газу1), (1.7)
М(газу1) = d2(1)M(газу2); M(газу2) = M(газу1)/d2(газу1). (1.8)
Відносна густина d – це величина безрозмірна, вона показує, наскільки один газ важче за інший (рис.1.28).
1.3.5 Основні газові закони
Стан газу характеризується його об’ємом, тиском і температурою. Між цими величинами експериментально були встановлені такі закони:
Закон Бойля-Маріотта (ізотермічний) скорочено записується так:
при Т = const Р1·V1 = Р2·V2, або Р·V = const;
Закон Гей-Люссака (ізобаричний)
при Р = const V1/T1 = V2/T2, або V/T = const.
Закон Шарля (ізохоричний)
при V = const Р1/T1 = Р2/T2 , або Р/T = const.
Усі три закони можна поєднати в один універсальний газовий закон, що описується рівнянням Клапейрона:
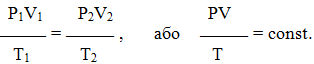 (1.9)
(1.9)
Залежність для одного моля газу була виведена Менделєєвим, тому називається рівнянням Менделєєва-Клапейрона. Воно містить постійну величину – універсальну газову сталу R (табл.1.2):
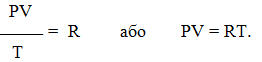
Для довільної кількості газу рівняння Менделєєва-Клапейрона має вигляд:
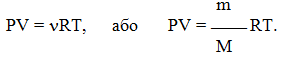 (1.10)
(1.10)
Таблица 1.2 – Розрахунки значень універсальної газової сталої R
Тиск Р (н.у.) |
Темперутура Т, К (н.у.) |
Молярний об'єм VМ (н.у.) |
Універсальна газова стала R = РV/T |
101325Па |
273,15 |
22,410–3м3/моль |
|
1атм |
273,15 |
22,4л/моль |
|
760мм рт.ст. |
273,15 |
22400мл/моль |
|
1.3.6 Закон еквівалентів
Із закону сталості складу випливає, що елементи сполучаються один із одним у певних кількісних співвідношеннях, для характеристики яких було введено поняття еквівалента і еквівалентної маси (слово еквівалентний у перекладі означає рівноцінний).
Еквівалентом називається умовна чи реальна частинка речовини, яка може приєднувати, заміщати, віддавати або взаємодіяти іншим чином з одним йоном Гідрогену Н+ чи гідроксилу ОН– у кислотно-основних (або йоннообмінних) реакціях чи одному електрону в окисно-відновних реакціях.
Наприклад, еквівалентом нітратної (азотної) кислоти є реальна частинка – молекула HNO3, що містить один Йов Н+; еквівалентом ортофосфатної (фосфорної) кислоти – умовна частинка, що відповідає 1/3 молекулі Н3РО4, до складу якої входять три йони Н+.
Але еквіваленти одного елемента можуть бути різними – залежно від валентності елемента. Так само складна сполука може мати різні еквіваленти, що зумовлюється характером її хімічної взаємодії. Наприклад, в реакції нейтралізації ортофосфатної кислоти калій гідроксидом
H3PO4 + 2KOH K2HPO4 + 2H2O.
тільки два атоми Н кислоти заміщуються атомами К (тобто кислота виявляє основність 2). Тоді згідно з визначенням, еквівалентом H3PO4 буде умовна частинка, яка складає 1/2H3PO4, оскільки на один атом Н припадає саме половина молекули H3PO4.
Отже, еквівалент – це фактично одна частка молекули, яка відповідає одному атому Н чи йону Н+ (рис.1.18).
Число, що показує, яка частина молекули чи іншої частинки речовини відповідає еквіваленту, називається фактором еквівалентності fЕ.
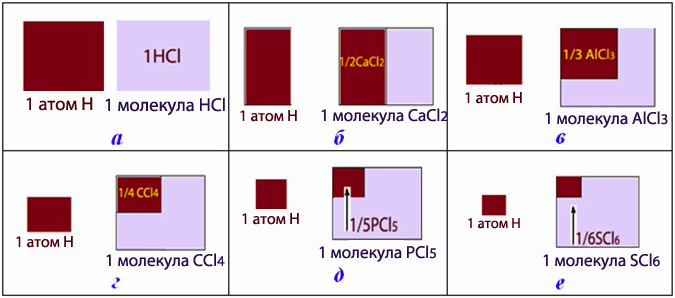
Рисунок 1.18 – Еквівалент і фактор еквівалентності: а) fЕ(HCl) = 1; б) fЕ(CaCl2) = 1/2; в) fЕ(AlCl3) = 1/3; г) fЕ(CCl4) = 1/4; д) fЕ(PCl5) = 1/5; д) fЕ(SCl6) = 1/6. (Еквіваленти сполук забарвлені темним відтінком)
Як частинка еквівалент характеризується кількістю речовини nекв і молярною масою еквівалента mекв, яку частіше для скорочення називають просто еквівалентною масою.
Еквівалентна маса елемента – це маса одного моль еквівалентів, яка дорівнює відношенню молярної маси елемента до його валентності в сполуці (або добутку фактора еквівалентності на молярну масу елемента):
![]() (1.11)
(1.11)
Або: mекв.елемента = fE·Мелемента. (1.12)
Еквівалентна маса оксиду дорівнює відношенню його молярної маси М до добутку валентності елемента В на число атомів елемента ч:
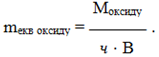 (1.15)
(1.15)
Еквівалентна маса кислоти дорівнює відношенню її молярної маси М до основності – кількості атомів Н, здатних заміщуватися атомами металу:
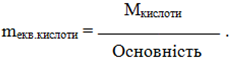 (1.16)
(1.16)
Еквівалентна маса основи дорівнює відношенню її молярної маси М до кислотності – кількості гідроксильних груп ОН, що заміщуються на кислотний залишок:
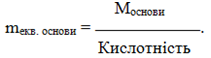 (1.17)
(1.17)
Еквівалентна маса солі дорівнює відношенню її молярної маси М до добутку валентності В металу на кількість його атомів ч:
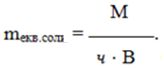 (1.18)
(1.18)
Закон еквівалентів був експериментально встановлений Ріхтером (1797 р.) і остаточно сформульований Дальтоном (1803 р.):
Хімічні сполуки реагують між собою в еквівалентних співвідношеннях.
З цього випливає, що для двох будь-яких речовин однієї хімічної реакції (вихідних реагентів чи продуктів реакції) закон еквівалентів можна виразити так:
nекв1 = nекв2. (1.20)
Підставивши (1.13) і (1.14) в останнє одержимо ще один вираз закону еквівалентів:
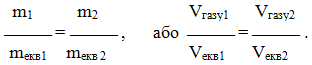 (1.21)
(1.21)
Однак при практичних розрахунках іноді зручніше користуватися іншим формулюванням закону еквівалентів:
маси речовин(об’єми газів), що взаємодіють між собою, пропорційні їх еквівалентним масам (об’ємам газів):
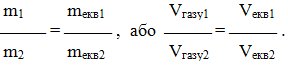

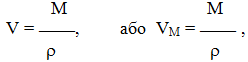 (1.4)
(1.4)


