
- •18. Теория сильных электролитов. Ионная сила
- •19. Ионное произведение воды. Водородный показатель.
- •20. Буферные растворы. Классификация. Механизм действия.
- •21. Расчет рН буферных растворов через уравнение Гендерсона–Гассельбаха
- •22. Кислотно–щелочное равновесие крови. Буферные системы крови.
- •23. Кинетика – учение о скоростях химических реакций. Закон действующих масс.
- •24. Зависимость скорости химической реакции от температуры. Уравнение Аррениуса и Вант–Гоффа.
- •33.Координационная теория Вернера и её развитие Чугаевым.
- •34.Понятия о координационном числе, комплексообразователе, лигандах.
- •35.Классификация, номенклатура, изомерия комплексных соединений.
- •36.Ионное равновесие в растворах комплексных соединений.
- •37.Природа химической связи в растворах комплексных соединений.
- •38.Константа нестойкости комплексных соединений.
- •39.Значение комплексных соединений в биологии и медицине.
 1
Растворы. Общая характеристика растворов.
Раствором
называется, наход.
в сост. равновесии гомогенная система
переменного состава, сост. из 2 или более
в-в. Вещества, сост. раствор, назыв.
Компонентами р-ров.
По
агрегатному сост. растворы могут
существовать в газообразном, жидком
или твердом агрегатном состоянии.
Воздух, например, можно рассматривать
как раствор кислорода и других газов
в азоте; морская вода - это водный раствор
различных солей в воде. Металлические
сплавы относятся к твердым растворам
одних металлов в других.
Р-ры
электролитов – р-ры диссоциир. На ионы
солей,к-т,оснований,амфолитов.( р-ры
KNO3,
HCL,
KOH,
глицин).Электрическая проводимость
р-ров элект. выше, чем растворителя.
Р-ры
неэлектролитов – р-ры в-в, практически
не диссоциир. в воде.(р-ры сахарозы,
глюкозы, мочевины). Электролическая
провод.. р-ро неэлект. Мало отличается
от от растворителя.
2.
Способы выражения состава растворов.Основные
понятия:
Растворимость –
способность вещества растворяться в
том или ином растворителе.
Растворитель –
компонент раствора, агрегатное состояние
которого не изменяется при образовании
раствора.
Растворенное
вещество –
компоненты раствора за исключением
растворителя.
Концентрация
– величина, характеризующая содержание
вещества в единице массы или объема
смеси.
Классификация растворов
Насыщенный
раствор –
термодинамически устойчивая равновесная
система, в которой скорость растворения
вещества равна скорости выделения его
из раствора. Ненасыщенный
раствор –
термодинамически устойчивая неравновесная
система, в которой концентрация вещества
меньше, чем в насыщенном растворе, и
поэтому скорость растворения больше
скорость выделения. Пересыщенный
раствор –
термодинамически неустойчивая
псевдоравновесная система, в которой
концентрация вещества больше, чем в
насыщенном растворе, и поэтому скорость
выделения больше скорости растворения.
Концентрированный
раствор –
раствор с высоким содержанием
растворенного вещества. Разбавленный –
с низким содержанием растворенного
вещества. Гомогенные
растворы –
истинные растворы. Гетерогенные
растворы –
коллоидные растворы. Массовая
доля –
отношение массы растворенного вещества
к массе раствора
ω(в-ва)
= m(в-ва)/m(р-ра)
Объемная
доля –
отношение объема газа к объему всей
смеси газов
φ(газа)
= V(газа)/V(смеси)
Мольная
доля –
отношение количества вещества в сумме
количеств вещества и растворителя
χ(в-ва)
= n(в-ва)/(n(в-ва)+n(р-ра))
Моляльная
концентрация,
или моляльность –
отношение количества вещества к массе
растворителя
B(в-ва)
= n(в-ва)/m(р-ля) (моль/кг)
Массовая
концентрация –
отношение массы вещества к объему
раствора
Р(в-ва)
= m(в-ва)/V(р-ра) (г/л)
Титр –
масса растворенного в-ва в 1 мл раствора
Т(в-ва)
= m(в-ва)/V(р-ра) (г/мл)
Молярная
концентрация –
отношение количества растворенного
вещества к объему раствора
С(в-ва)
= n(в-ва)/V(р-ра) (моль/л)
3.
понятие о химическом эквиваленте и
факторе эквивалентности.
Эквивалентом
называют реальную или условную частицу
в-ва X,
которая в данной кислотно-основной
р-ции эквивалента одному иону водорода
или в данной окислительно –восст. р-ции
– одному электрону, или в данной обменной
р-ции между солями – единице заряда.
Фактор
эквивалентности
1
Растворы. Общая характеристика растворов.
Раствором
называется, наход.
в сост. равновесии гомогенная система
переменного состава, сост. из 2 или более
в-в. Вещества, сост. раствор, назыв.
Компонентами р-ров.
По
агрегатному сост. растворы могут
существовать в газообразном, жидком
или твердом агрегатном состоянии.
Воздух, например, можно рассматривать
как раствор кислорода и других газов
в азоте; морская вода - это водный раствор
различных солей в воде. Металлические
сплавы относятся к твердым растворам
одних металлов в других.
Р-ры
электролитов – р-ры диссоциир. На ионы
солей,к-т,оснований,амфолитов.( р-ры
KNO3,
HCL,
KOH,
глицин).Электрическая проводимость
р-ров элект. выше, чем растворителя.
Р-ры
неэлектролитов – р-ры в-в, практически
не диссоциир. в воде.(р-ры сахарозы,
глюкозы, мочевины). Электролическая
провод.. р-ро неэлект. Мало отличается
от от растворителя.
2.
Способы выражения состава растворов.Основные
понятия:
Растворимость –
способность вещества растворяться в
том или ином растворителе.
Растворитель –
компонент раствора, агрегатное состояние
которого не изменяется при образовании
раствора.
Растворенное
вещество –
компоненты раствора за исключением
растворителя.
Концентрация
– величина, характеризующая содержание
вещества в единице массы или объема
смеси.
Классификация растворов
Насыщенный
раствор –
термодинамически устойчивая равновесная
система, в которой скорость растворения
вещества равна скорости выделения его
из раствора. Ненасыщенный
раствор –
термодинамически устойчивая неравновесная
система, в которой концентрация вещества
меньше, чем в насыщенном растворе, и
поэтому скорость растворения больше
скорость выделения. Пересыщенный
раствор –
термодинамически неустойчивая
псевдоравновесная система, в которой
концентрация вещества больше, чем в
насыщенном растворе, и поэтому скорость
выделения больше скорости растворения.
Концентрированный
раствор –
раствор с высоким содержанием
растворенного вещества. Разбавленный –
с низким содержанием растворенного
вещества. Гомогенные
растворы –
истинные растворы. Гетерогенные
растворы –
коллоидные растворы. Массовая
доля –
отношение массы растворенного вещества
к массе раствора
ω(в-ва)
= m(в-ва)/m(р-ра)
Объемная
доля –
отношение объема газа к объему всей
смеси газов
φ(газа)
= V(газа)/V(смеси)
Мольная
доля –
отношение количества вещества в сумме
количеств вещества и растворителя
χ(в-ва)
= n(в-ва)/(n(в-ва)+n(р-ра))
Моляльная
концентрация,
или моляльность –
отношение количества вещества к массе
растворителя
B(в-ва)
= n(в-ва)/m(р-ля) (моль/кг)
Массовая
концентрация –
отношение массы вещества к объему
раствора
Р(в-ва)
= m(в-ва)/V(р-ра) (г/л)
Титр –
масса растворенного в-ва в 1 мл раствора
Т(в-ва)
= m(в-ва)/V(р-ра) (г/мл)
Молярная
концентрация –
отношение количества растворенного
вещества к объему раствора
С(в-ва)
= n(в-ва)/V(р-ра) (моль/л)
3.
понятие о химическом эквиваленте и
факторе эквивалентности.
Эквивалентом
называют реальную или условную частицу
в-ва X,
которая в данной кислотно-основной
р-ции эквивалента одному иону водорода
или в данной окислительно –восст. р-ции
– одному электрону, или в данной обменной
р-ции между солями – единице заряда.
Фактор
эквивалентности
![]() - число,обозначающее, какая доля реальной
частицы в-ва X
эквивалента одному иону водорода в
данной кислотно-восст. р-ции или одному
электронц в данной окислит.-восст. р-ции
или единице заряда в данной обменной
р-ции между солями.
=
1/z
Молярной
массой эквивалента в-ва X
называют величину, измеряемую
произведением фактора эквивалентости
на молярную массу в-ва X
.
Mэкв =
fэкв×M
= 1/z
M(X)
4.
Объемный или титрометрический анализ,
его сущность и методы.
Титриметрический
анализ - это метод количественного
химического анализа, основанный на
измерении объема раствора реактива с
точно известной концентрацией,
расходуемого для реакции с определяемым
веществом.
Основной
операцией титриметрического анализа
является титрование
– постепенное смешивание веществ до
полного окончания реакции.
-
достоинство титриметрического метода
- быстрота; вместо длительных и кропотливых
операций: осаждение, фильтрование,
промывание осадка - проводят только
одну - титрование, которая при некотором
навыке аналитика занимает несколько
минут;
-
недостаток титриметрического анализа
- меньшая точность определения, т.к.
взвешивание на аналитических весах
точнее измерения объемов
с помощь мерной посуды.
Тетрометрический
метод анализ подраздел. на 3 способа
титрования: -прямое: постепенное
добавление титранта к анал.р-ру до
достижения точки эквивалентности ( CL2
+ 2NaOH—2NaCL
+ 2H2O)
-заместительное:
к опред.в-ву добавляем спец.реагент
вступ. с ним в р-цию. Один из продуктов
взаимод., затем оттитровывается рабочим
р-ром – р-ром титрантом.(A+BZ—AB+Z;Z+C—ZC)
-обратное
титрование:
заключается в добавл.к анализ.в-ву
точного известного избытка –
титранта1.Остаток которого после р-ции
оттитровывается с помощью титранта
2.( A+B—D;
B+C—Z)
Кислотноосновное
титрование подраздел.на ацидиметрическое
и алкалиметрическое.(В 1 в качестве
титрантов применяют р-ры сильных
к-т.Метод используется для
опред.оснований,солей слаб.к-т,аминов
и их производных; В 2 примеют для
опред.сильных и слаб.к-т,фенолов,солей
и слабых оснований.Титрантами в данном
методе явл.р-р сильных оснований.
5.
Кислотно–основное титрование применение
в медицине. Кислотно – основанные
индикаторы.
Кислотно-основные
индикаторы — органические
соединения,
способные изменять цвет в растворе при
изменении кислотности (pH).
Индикаторы широко используют
в титровании в аналитической
химии и биохимии.
Ph=7(нейитральная
среда) Ph>7(щелочная
среда) Ph<7(кислая)
У
фенофтолеина Ph
8-10, у метилоранжа Ph
3,1-4,4, у лакмус Ph
5-8.
6.
Окислительно–восстановительные
реакции. Оксидиметрия. Пермангонатометрия
и иодометрия. Применение данного метода
в медицине.
Окислительно-восст.р-циями
называют хим.процессы, сопровожд.переносом
электронов от одних молекул или ионов
к другим.
Окислением
называют процесс потери электронов.
Восстановлением-
процесс присоединения электронов.
Виды
ОВР:
Межмолекулярные —
реакции, в которых окисляющиеся и
восстанавливающиеся атомы находятся
в молекулах разных веществ, например:
Н2S + Cl2 → S +
2HCl
Внутримолекулярные —
реакции, в которых окисляющиеся и
восстанавливающиеся атомы находятся
в молекулах одного и того же вещества,
например:
2H2O →
2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) —
реакции, в которых один и тот же элемент
выступает и как окислитель, и как
восстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование
(конпропорционирование)
— реакции, в которых из двух различных
степеней окисления одного и того же
элемента получается одна степень
окисления, например:
NH4NO3 → N2O +
2H2O
Оксидиметрия
— титриметрические
методы в аналитической
химии,
основанные на реакциях
окисления-восстановления.
В процессе титрования
изменяется окислительно-восстановительный
потенциал системы,
вблизи точки
эквивалентности наблюдается
резкое изменение потенциала. Оксидиметрию
классифицируют в зависимости от
применяемого в данной реакции раствора
вещества — окислителя или восстановителя.
К оксидиметрии относятся перманганатометрия,
периметрия, хроматометрия, иодометрия
и др.
ПЕРМАНГАНАТОМЕТРИЯ,
титриметрич. метод анализа, основанный
на р-циях:
- число,обозначающее, какая доля реальной
частицы в-ва X
эквивалента одному иону водорода в
данной кислотно-восст. р-ции или одному
электронц в данной окислит.-восст. р-ции
или единице заряда в данной обменной
р-ции между солями.
=
1/z
Молярной
массой эквивалента в-ва X
называют величину, измеряемую
произведением фактора эквивалентости
на молярную массу в-ва X
.
Mэкв =
fэкв×M
= 1/z
M(X)
4.
Объемный или титрометрический анализ,
его сущность и методы.
Титриметрический
анализ - это метод количественного
химического анализа, основанный на
измерении объема раствора реактива с
точно известной концентрацией,
расходуемого для реакции с определяемым
веществом.
Основной
операцией титриметрического анализа
является титрование
– постепенное смешивание веществ до
полного окончания реакции.
-
достоинство титриметрического метода
- быстрота; вместо длительных и кропотливых
операций: осаждение, фильтрование,
промывание осадка - проводят только
одну - титрование, которая при некотором
навыке аналитика занимает несколько
минут;
-
недостаток титриметрического анализа
- меньшая точность определения, т.к.
взвешивание на аналитических весах
точнее измерения объемов
с помощь мерной посуды.
Тетрометрический
метод анализ подраздел. на 3 способа
титрования: -прямое: постепенное
добавление титранта к анал.р-ру до
достижения точки эквивалентности ( CL2
+ 2NaOH—2NaCL
+ 2H2O)
-заместительное:
к опред.в-ву добавляем спец.реагент
вступ. с ним в р-цию. Один из продуктов
взаимод., затем оттитровывается рабочим
р-ром – р-ром титрантом.(A+BZ—AB+Z;Z+C—ZC)
-обратное
титрование:
заключается в добавл.к анализ.в-ву
точного известного избытка –
титранта1.Остаток которого после р-ции
оттитровывается с помощью титранта
2.( A+B—D;
B+C—Z)
Кислотноосновное
титрование подраздел.на ацидиметрическое
и алкалиметрическое.(В 1 в качестве
титрантов применяют р-ры сильных
к-т.Метод используется для
опред.оснований,солей слаб.к-т,аминов
и их производных; В 2 примеют для
опред.сильных и слаб.к-т,фенолов,солей
и слабых оснований.Титрантами в данном
методе явл.р-р сильных оснований.
5.
Кислотно–основное титрование применение
в медицине. Кислотно – основанные
индикаторы.
Кислотно-основные
индикаторы — органические
соединения,
способные изменять цвет в растворе при
изменении кислотности (pH).
Индикаторы широко используют
в титровании в аналитической
химии и биохимии.
Ph=7(нейитральная
среда) Ph>7(щелочная
среда) Ph<7(кислая)
У
фенофтолеина Ph
8-10, у метилоранжа Ph
3,1-4,4, у лакмус Ph
5-8.
6.
Окислительно–восстановительные
реакции. Оксидиметрия. Пермангонатометрия
и иодометрия. Применение данного метода
в медицине.
Окислительно-восст.р-циями
называют хим.процессы, сопровожд.переносом
электронов от одних молекул или ионов
к другим.
Окислением
называют процесс потери электронов.
Восстановлением-
процесс присоединения электронов.
Виды
ОВР:
Межмолекулярные —
реакции, в которых окисляющиеся и
восстанавливающиеся атомы находятся
в молекулах разных веществ, например:
Н2S + Cl2 → S +
2HCl
Внутримолекулярные —
реакции, в которых окисляющиеся и
восстанавливающиеся атомы находятся
в молекулах одного и того же вещества,
например:
2H2O →
2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) —
реакции, в которых один и тот же элемент
выступает и как окислитель, и как
восстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование
(конпропорционирование)
— реакции, в которых из двух различных
степеней окисления одного и того же
элемента получается одна степень
окисления, например:
NH4NO3 → N2O +
2H2O
Оксидиметрия
— титриметрические
методы в аналитической
химии,
основанные на реакциях
окисления-восстановления.
В процессе титрования
изменяется окислительно-восстановительный
потенциал системы,
вблизи точки
эквивалентности наблюдается
резкое изменение потенциала. Оксидиметрию
классифицируют в зависимости от
применяемого в данной реакции раствора
вещества — окислителя или восстановителя.
К оксидиметрии относятся перманганатометрия,
периметрия, хроматометрия, иодометрия
и др.
ПЕРМАНГАНАТОМЕТРИЯ,
титриметрич. метод анализа, основанный
на р-циях: ![]() +
8H+ +
5е
+
8H+ +
5е ![]() 4H2O
+ Mn2+ и
4H2O
+ Mn2+ и ![]() +
4H2O
+ Зе
+
4H2O
+ Зе ![]() MnO2 +
4OH— Титрантом
служит водный р-р KMnO4,
к-рый в чистом виде очень устойчив и
долго хранится. Перманганатометрию
применяют для определения Fe(II), Sb(III),
Mn(II), V(IV), W(V), U(IV), Tl(I), Cr(III), H2O2,
H2C2O4 и
ее солей, арсенитов, гидразина и
ряда орг. в-в .
Перманганатометрию используют также
для косвенных определений.
Напр., концентрации очень
сильных восстановителей,
окисляющихся в обычных условиях
растворенным кислородом,
- Cr (II), V(II), Ti(III), Nb(III), Mo(III), Cu(I), Sn(II) и др.
Иодометрические
методы основаны на применении стандартного
раствора тиосульфата
натрия для
титрования иода,
выделившегося при взаимодействии
определяемого окислителяс
избытком иодида
калия (при титровании
по замещению)
или оставшегося в избытке при медленном
взаимодействии определяемого восстановителя с
фиксированным объемом стандартного
раствора иода (в случае обратного
титрования).
7.
Основные понятия термодинамики: система,
процесс, параметры, функции состояния.
Процесс-
это переход системы из одного состояния
в другое, сопровожд.необратимым или
обратимым изменением хотя бы одного
параметра,хар.данную систему.
Системаой
называют тело или группу взаимод.тел,
фактически или мысленно выделяемых из
окруж.среды.
Открытая
система
обменивается с окр.срредой энергией и
веществом.
Закрытой
называт систему, в которой отсутствием
обмнеа энергией и веществом с окр.средой,
но она может обмениваться с ней энергией.
Изолированнаая
система
хар. отсутствием обмнеа энергией и
в-вом с окр.средой.
Экстенсивные
параметры-
параметры, значения которых пропорциональны
числу частиц в системе(масса,объем,кол-во
в-ва)
Интенсивные
параметры-
параметры, значения которых не зависит
от кол-ва частиц в системе( температура,
давление)
Параметры,
описывающие сост.ситемы, назыв.функциями.
Термодинами́ческая
фу́нкция состоя́ния —
в термодинамике некая функция,
зависящая от нескольких независимых
параметров, которые однозначно
определяют состояние термодинамической
системы.
Значение термодинамической функции
состояния зависит только от состояния
термодинамической системы и не зависит
от того, как система пришла в это
состояние. Частным случаем функций
состояний являются термодинамические
потенциалы.
8.
Первое начало термодинамики. Энтальпия.
1
з.термодинамики.: энергия не исезает и
не появл.вновь. она только переходит
из одного состояния в другое в строго
эквивалентных кол-вах.
MnO2 +
4OH— Титрантом
служит водный р-р KMnO4,
к-рый в чистом виде очень устойчив и
долго хранится. Перманганатометрию
применяют для определения Fe(II), Sb(III),
Mn(II), V(IV), W(V), U(IV), Tl(I), Cr(III), H2O2,
H2C2O4 и
ее солей, арсенитов, гидразина и
ряда орг. в-в .
Перманганатометрию используют также
для косвенных определений.
Напр., концентрации очень
сильных восстановителей,
окисляющихся в обычных условиях
растворенным кислородом,
- Cr (II), V(II), Ti(III), Nb(III), Mo(III), Cu(I), Sn(II) и др.
Иодометрические
методы основаны на применении стандартного
раствора тиосульфата
натрия для
титрования иода,
выделившегося при взаимодействии
определяемого окислителяс
избытком иодида
калия (при титровании
по замещению)
или оставшегося в избытке при медленном
взаимодействии определяемого восстановителя с
фиксированным объемом стандартного
раствора иода (в случае обратного
титрования).
7.
Основные понятия термодинамики: система,
процесс, параметры, функции состояния.
Процесс-
это переход системы из одного состояния
в другое, сопровожд.необратимым или
обратимым изменением хотя бы одного
параметра,хар.данную систему.
Системаой
называют тело или группу взаимод.тел,
фактически или мысленно выделяемых из
окруж.среды.
Открытая
система
обменивается с окр.срредой энергией и
веществом.
Закрытой
называт систему, в которой отсутствием
обмнеа энергией и веществом с окр.средой,
но она может обмениваться с ней энергией.
Изолированнаая
система
хар. отсутствием обмнеа энергией и
в-вом с окр.средой.
Экстенсивные
параметры-
параметры, значения которых пропорциональны
числу частиц в системе(масса,объем,кол-во
в-ва)
Интенсивные
параметры-
параметры, значения которых не зависит
от кол-ва частиц в системе( температура,
давление)
Параметры,
описывающие сост.ситемы, назыв.функциями.
Термодинами́ческая
фу́нкция состоя́ния —
в термодинамике некая функция,
зависящая от нескольких независимых
параметров, которые однозначно
определяют состояние термодинамической
системы.
Значение термодинамической функции
состояния зависит только от состояния
термодинамической системы и не зависит
от того, как система пришла в это
состояние. Частным случаем функций
состояний являются термодинамические
потенциалы.
8.
Первое начало термодинамики. Энтальпия.
1
з.термодинамики.: энергия не исезает и
не появл.вновь. она только переходит
из одного состояния в другое в строго
эквивалентных кол-вах.
![]() Сообщенная
системе теплота расходуется на приращение
внутренней энергии и на совершение
работы против внешних сил:
Сообщенная
системе теплота расходуется на приращение
внутренней энергии и на совершение
работы против внешних сил:![]() Энтальпия
— это энергосодержание системы,
включающее внутреннюю энергию и
работу. Тогда
Энтальпия
— это энергосодержание системы,
включающее внутреннюю энергию и
работу. Тогда
![]()
Кол-во теплоты ,которое выделяется или поглащается при проведении хим.р-ций в изобарно-изотермических условиях, характер. изменением этальпии системы и назыв. энтальпией р-ции. Энтальпия очень зависит от агригатного состояния в-в.Энтальпия простых в-в = 0. Энтальпия образования – теплота, которая образ. При образовании из простых в-в в сложные.
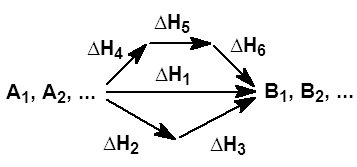
9. Закон Гесса и следствия из него. Тепловой эффект хим.р-ции зависит только от природы и состояния исходных в-в и конечных продуктов р-ции и не зависит от пути реализации процесса,т.е. от пути перехода от начального сост.. к конечному.
![]()
Следствие из з.Гесса: энтальпия р-ции образования равна разности алгебр.суммы энтальпий обр.всех продуктов р-ции и алгебр. суммы энтальпий обр.всех исходных в-в.
![]()
Энтальпия р-ции сгорания равна разности алгебр.суммы теплот сгорнаия исх.в-в и алгебр.суммы теплот сгорания конечных продуктов р-ции:
![]()
Энтальпия прямой р-ции численно равна энталььпии обратной р-ции, но противоположна по знаку.
9) Закон Гесса и его следствия
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. (Тепловой эффект хим реакции зависит от сост исход в-в и конечных продуктов и не зависит от пути по котор протекает данный процесс)
1 следствие-тепловой эффект р. Образования равен сумме теплообразования конечных продуктов за вычетом суммы теплообразования исходных веществ (ΔНреак обр=алгебр сумме ΔНкон прод-алг сумм ΔНисх вв)
2. тепловой эффект реакции сгорания равен сумме теплосгорания исх в-в за вычетом суммы теплосгорания конечных продуктов (ΔНсгор=алг сумм ΔНисх вв-алг сумм ΔНкон прод)
10)второе начало термодинамики. Энтропия.Энтропия предст собой функцию состояния , изменение которой равно отношению теплоты подведённой к системе и абсолютной температуры. ΔS=Q/T ΔS=алг сумма ΔSконеч прод-алг сумма ΔSисх в-в.
S=R/N*lnW (N-число авагадро, W-колво состояний в сист)
2 закон термодинамики: в изолированных системах самопроизв протек процессы в сторону увел энтропии
11) Энергия Гиббса. Связь свободной энергии Гиббса с константой равновесия.
ΔG=ΔH-TΔS Своб э гиббса может прогнозировать сомопроизвольное протекание процессов
Процесс наз самопроизв, если он осуществляется без каких-либо действий, в то время как система сама себе предоставлена.
2закон термодинамики с точки зр Э.Гиббса: В изобарноизотермических условиях (P, t)в системе самопроизвольно могут протекать только те процессы, когда ΔG<0
Хим.р при котор происх уменьш э Гиббса и выполн работа назыв экзэргоническими
Хим р при котор происх увел э Гиббса и выполн работа наз эндэргоническими
Следствие закона гесса для э гиббса. Энегрия реакции равна алгебр сумме энергий гиббса образования стехиометрического кол-ва продуктов за вычетом алгебраич суммы энергий гиббса образования стехиометрического количества реагентов ΔGр-я=(ncΔGc=nDΔGD)-(nAΔGA+nBΔGB)
К равновес={C}c*{D}d/{A}a*{B}b с точки зр термодинамики сост равновесия определяется минимумом э гиббса
12) Давление насыщенного пара над жидкостью и факторы, от которых оно зависит
Пар, находящийся в равновесии с жидкостью, наз насыщ.
Давление такого пара р0 наз давлением или скоростью насыщ пара чистого растворителя.
Давление насыщенного пара связано определённой для данного вещества зависимостью от температуры. Когда внешнее давление падает ниже давления насыщенного пара, происходит кипение (жидкости) или возгонка (твёрдого тела); когда оно выше — напротив, конденсация илидесублимация.
Расчет давл нас пара для электролитов р0-p/ р0=х(в-ва)
Для неэлектролитов р0-p/ р0=хl(в-ва)
13) Относительное понижение давления насыщенного пара. Закон Рауля
Для идеальных растворов давление насыщенного пара определяется законом Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества, т.е. отношению количества данного вещества к общему количеству растворителя и растворенного вещества: (повышение темпер кип ΔТкип и пониж темпер замерзания ΔТзам, разбавленных р-ров неэлектролитов прямопроп молярной концентрации раствора)p=Крх(Х1) (Кр-конст рауля, х(Х1)моляр доля рас-ля Х1)
Относительное пониж давл насыщ пара- Р0-P/P0=N(x)
14) Криоскопическая и эбулиометрическая зависимости. Физический смысл их постоянных
ΔTкип=Еэ*b(x) Е-эбулиоскопич постоянная
ΔТзам=Кз*b(x) К-криоскоп конст Криоскопическая и эбулиометрическая зависимости. Физический смысл их постоянных.
Δtз =К· m,(Δt-понижениетемпературыамерзания,m –моляльностьр-ра, К - криоск пост) Физический смысл криоскопической постоянной К состоит в том, что она равна понижению tз. раствора, содержащего 1 моль растворенного вещества на 1 кг растворителя. Величина К зависит от природы растворенного вещества, если его молекулы не диссоциируют и не ассоциируют.
Темпер замерз(кристал) наз ту темп при кот давл насыщ пара над жидкостью равно давл насщ пара над кристаллами твердой фазы.
Для разбавленных растворов таких веществ Рауль установил, что повышение температуры кипения раствора Δtк. = t - t0пропорционально его моляльности:Δtк. = Е · m Величина Е численно равна повышению tк моляльного раствора при условии сохранения свойств раствора до этой концентрации.
темпер кип жидк наз ту темп при кот давл насыщ пара над раствором равно внешней
15) Осмос, его механизм. Закон Вант – Гоффа.
Осмос-явление одностороннего проникновения молекулы растворителя через полунепроницаемую мембрану в сторону градиента концентрации
Осотич давл-величина измеряемая минимальным гидравлическим давл, кот нужно приложить к р-ру чтоб осмос прекратился
Закон вант-гофа: осмот давл прямомпроп молярной концентрации р-ра
Для неэлектролитов: П=с(х)RT
Для электролитов: П=ic(x)RT
ΔTкип=iECм
ΔTзам=iKCм
По закону вант-гофа осмот давл р-ра равно тому давлению, кот производило бы растворённое в-во если бы оно нах. При той же темп в газообр сост и занимало бы тот же объём
16) Законы Дальтона, Генри, Сеченова
Закон генри: растворимость газов, выраженная в моле делён на кг растворитеоя прямопропорц его давлению над раствором С=К / Р
Закон Сеченова: наличие электролита в растворе резко пониж растворимость газов С=С0е
Закон Дальтона: суммарное давл смеси газов равно сумме пропорциональных давлений газов
Робщ=Р1+Р2+Рn
17. Реакция среды в растворах слабых электролитов. Закон разведения Оствальда.
Слабые кислоты и основания диссоциируют незначительно. В растворе большая их часть находиться в виде молекул, поэтому в растворе слабой кислоты, можно выделить:
Активную кислотность обусловленную присутствием р
Резервную кислотность обусловленную не про диссоц молекулами.
Общая кислотность обусловлена общим количеством растворённой кислоты. Аналогично в растворах оснований.
Слабые электролиты подчиняются закону Оствальда. Согласно которому степень диссоциации слабо го электролита пропорциональна L=(Корень) KV/ L =(корень) K/C.
18. Теория сильных электролитов. Ионная сила
Сильные электролиты полностью диссоциируют на ионы. В водных растворах сильных электролитов существуют простые или сольватированные катионы и анионы.Опытным путем найдено, что электропроводность водных растворов сильных электролитов не эквивалентна той электропроводности, которую можно было бы ожидать при 100%-ной диссоциации молекул на ионы. Такое несоответствие объясняется теорией сильных электролитов, предложенной Дебаем и Хюккелем. Согласно этой теории, в растворах сильных электролитов между ионами существует электростатическое взаимодействие. Каждый ион окружен ионной атмосферой из противоионов. Ионная атмосфера тормозит движение ионов в электрическом поле, в результате чего создается эффект неполной диссоциации сильного электролита. Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории показывает связь между коэффициентом активности иона ze и ионной силы раствора I в виде:
![]() ,
,
где γ - коэффициент активности, А - постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
19. Ионное произведение воды. Водородный показатель.
Вода также диссоциирует, хотя и в небольшой степени: H2O " H+ + ОН- Константа диссоциации для этого процесса равна: Концентрация недиссоциированных молекул воды равна общему числу моль в 1 л воды, т. е. [H2O] = 1000/18 = 55,56 моль и [H+]*[ОН-] = 10-14. Произведение концентрации ионов H+ и ОН- при определенной температуре постоянно. При температуре 25°С его называют ионным произведением воды Концентрации ионов H+ и OH- равны, следовательно [H+] = [OH-] = 10-7 моль/л. Раствор с одинаковыми концентрациями ионов называется нейтральным. Если [H+] > [OH-] то раствор кислый, наоборот - [H+] < [ОН-] - щелочной или основный. Для удобства используют отрицательный десятичный логарифм концентрации водородных ионов, называемый водородным показателем рН:рН = -lg[H+] Для нейтральной среды рН = 7, для кислой рН < 7 и для щелочной рН > 7.
20. Буферные растворы. Классификация. Механизм действия.
БС - это водные растворы, препятствующие изменения рН при добавлении небольших количеств сильных кислот, оснований, а также при разбавлении и концентрировании.
Состав БС вкл 2 компонента:
1)Слабая кислота и её соль, образованная сильным основанием
2)Слабое основание и его соль, образованная сильной кислотой
Способность БС поддерживать рН не беспредельна она характеризуется буферной ёмкостью. Это количество сильной кислоты, которая необходимо добавить к 1л. БС для смещения рН на единицу. Буферная ёмкость тем выше, чем концентрация БС и чем ближе соотношение компонентов к единице.
Механизм буферного действия рассматривается на примерере ацетатной БС. при добавлении сильной кислоты ацетат-анион связывает избыток протонов с образованием эквивалентного количества слабой уксусной кислоты CH3COO+H<->CH3COOH. несмотря на увеличение общей кислотности, активная кислотность возрастает мало, так как оно произошло за счет увеличения концентрации слабой кислоты, степень диссоциации которой понизится согласно закону Оствальда. при добавлении щелочи она нейтрализуется за счет резервной кислотности: CH3COOH+OH<->CH3COO +H2O.
активная кислотность при этом изменяется незначительно, так как согласно закону Оствальда уменьшение концентрации слабой кислоты приводит к росту степени ее диссоциации.
