
I таблица 3.2 I
ВРЕМЯ ПОЛУВЫВЕДЕНИЯ ЛЕКАРСТВЕННЫХ
СРЕДСТВ ИЗ ПЛАЗМЫ КРОВИ
В ЗАВИСИМОСТИ ОТ ИХ ОКСИДАЦИИ
И ЭЛИМИНАЦИИ
Лекарственное |
Время полувыведения (ч) |
|
средство |
новорожденные |
взрослые |
Амилобарбитон |
17-60 |
12-27 |
Бупивакаин |
25 |
1,3 |
Кофеин |
95 |
4 |
Диазепам |
25-100 |
15-25 |
Индометацин |
14-20 |
2-11 |
Мепивакаин |
8,7 |
3,2 |
Меперидин |
22 |
3-4 |
Фенитоин |
21 |
11—29 |
Теофиллин |
24-36 |
3-9 |
Из Rane A: Basic principles of drug disposition and action in infants and children. In Yaffee SJ (ed): Pediatric Pharmacology: Therapeutic Principles in Practice. New York, Grune & Stratton, 1980, p 15, с разрешения.
32 Анестезия в педиатрии
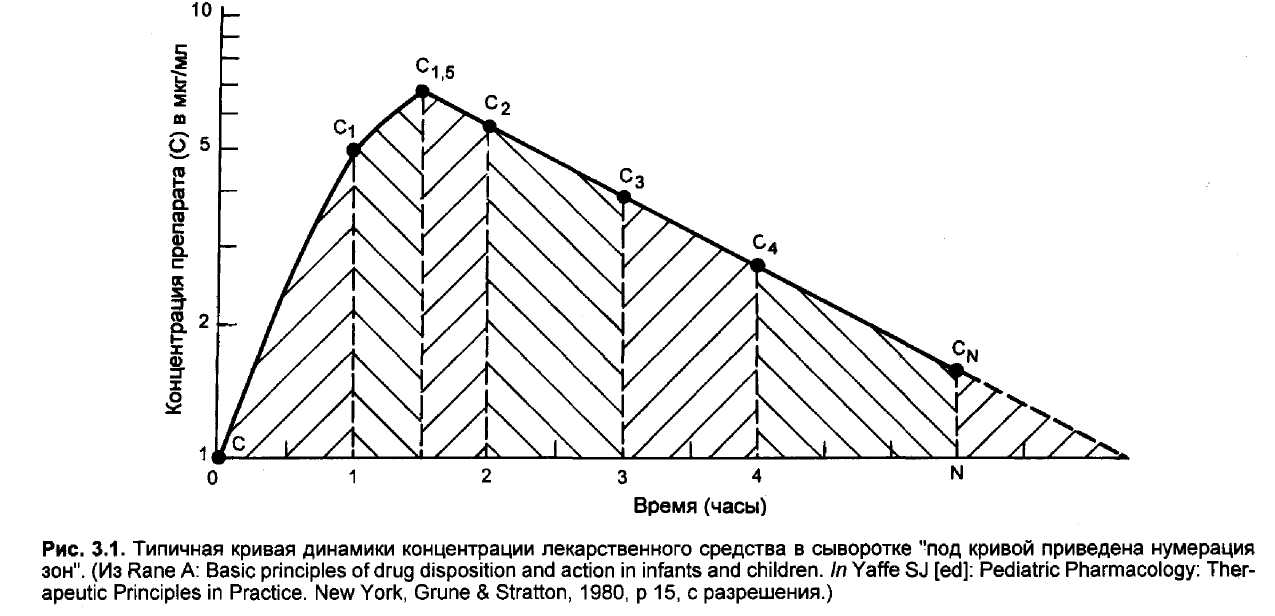
При необходимости быстро создать нужную концентрацию препарата в крови вначале вводят его болюсную дозу, переходя затем на продолжительную инфузию. Величина болюсной дозы определяется по средней терапевтической дозе, а скорость инфузии устанавливают по следующей формуле:
К, = DO(DO) = 0,63/ti/2,
где Do — это доза препарата. Данная формула весьма удобна для быстрого создания и поддержания на постоянном уровне в крови таких лекарственных средств, как аминофиллин, антибиотики и миорелаксанты у младенцев и детей.
Дозировки препаратов необходимо пересматривать у пациентов с заболеваниями почек или печени, поскольку у них могут возрастать величины Vd. В подобных случаях начальная (или нагрузочная) доза препарата должна повышаться для получения желаемого эффекта. Введение повышенных дозировок препарата увеличивает их задержку в организме и удлиняет сроки полувыведения. Единственным способом установить, создался ли желаемый уровень препарата в плазме крови таких больных, остается его непосредственное определение. Так, период полувыведения кураре из организма новорожденных удлинен из-за относительно увеличенного объема
внеклеточной жидкости у них и снижения функции почек (см. ниже).
Желаемая величина концентрации лекарственного средства на постоянной стадии (плато) Срй может быть установлена у пациентов с почечной патологией по следующей формуле:
Ср^ = F х доза/С1 х Т,
где Cpss — это концентрация лекарственного средства на стабильной стадии, F — фракция абсорбированного препарата (при внутривенном введении F = 1), С1 — клиренс лекарственного средства, установленный по динамике его концентрации в крови, и Т — интервал между введением отдельных доз лекарственного средства. Поражение почек вызывает замедление клиренса, поэтому при реаранжировании уравнения следует особо вычислять сроки между введением доз лекарственного средства.
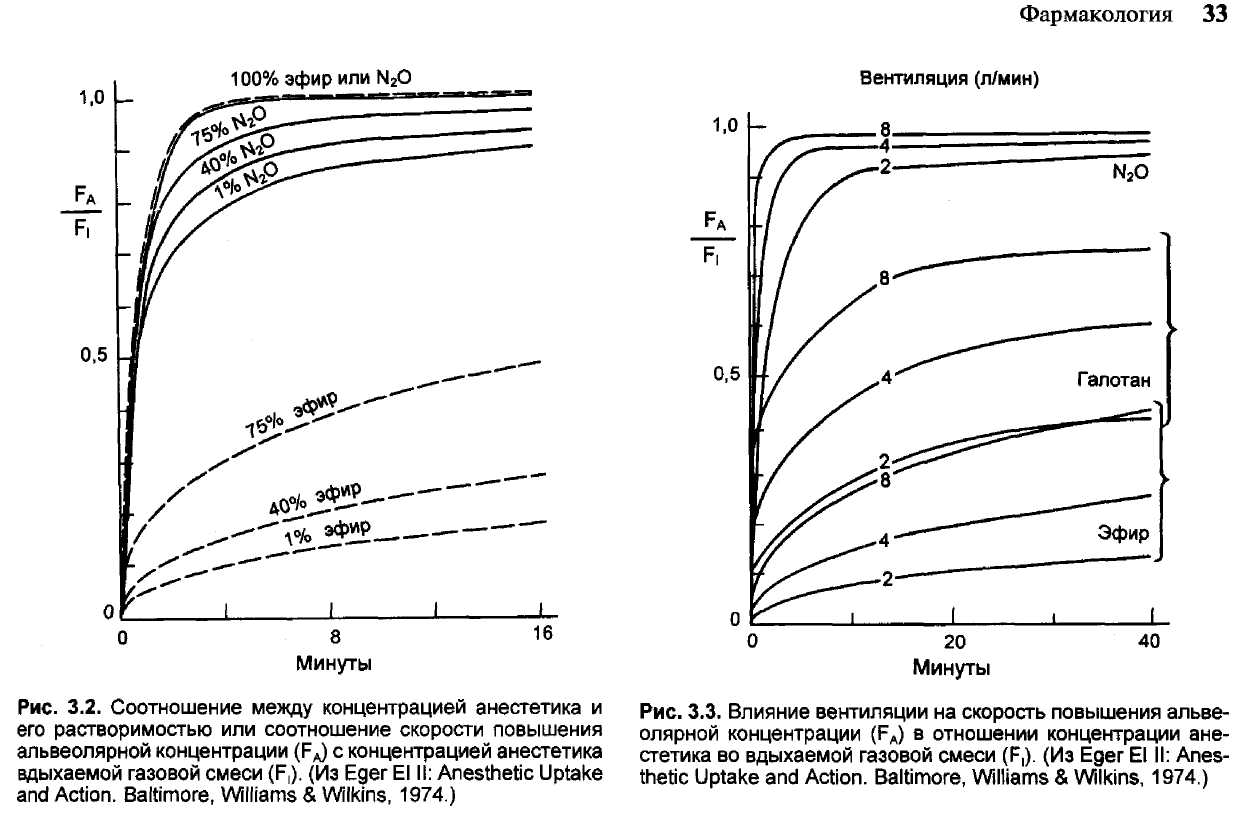
Поступление препаратов, вводимых ингаляционным путем, зависит от ряда факторов и в первую очередь от их концентрации во вдыхаемой газовой смеси (анестетики) (F,); от альвеолярной вентиляции; коэффициента разделения на границе газ/кровь (X); от сердечного выброса и его распределения. Все указанные факторы влияют
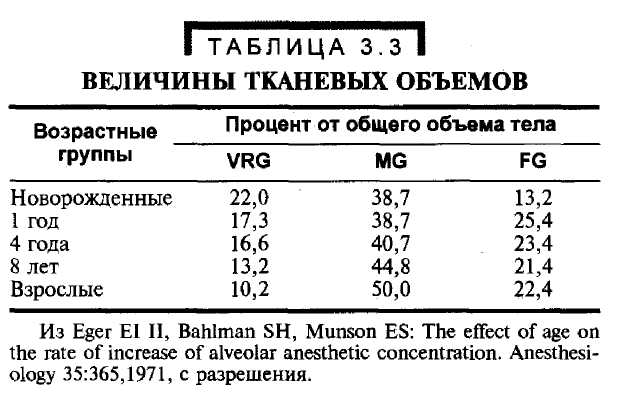
Органы человека можно разделить на несколько групп в зависимости от их обеспеченности кровотоком. Это группа органов с богатым сосудистым обеспечением (VRG), представленная мозгом, сердцем и внутренними органами; мышечная группа (MG), куда включены поперечнополосатые мышцы, кроме сердца; группа жировой ткани (FG), включающая все ткани с отложением жира; и группа органов с наиболее бедным сосудистым обеспечением (VPG), включающая кости, сухожилия и другие слабо перфузи-руемые ткани. В табл. 3.3 приведено соотношение этих тканей в организме человека. Как видно
из представленных в ней данных, у новорожденных величина VRG больше, a MG и FG меньше, чем у взрослых.
Концентрация анестетика во вдыхаемой газовой смеси влияет на скорость повышения соотношения FE/Fj (рис. 3.3). Чем выше концентрация анестетика во вдыхаемой смеси, тем быстрее возрастает FE по отношению к Fj (концентрационный эффект), так как соответственно большее количество препарата вымывается из легких. При этом имеет место снижение легочных объемов и увеличение концентрации газа в альвеолах. Чем меньше концентрация анестетика в альвеолах,
34
Анестезия в педиатрии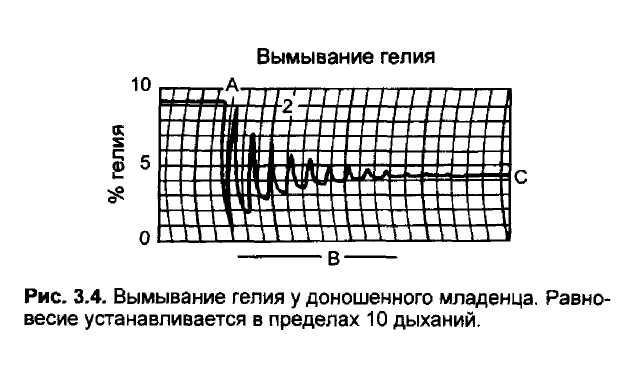
Изменения вентиляции влияют на скорость повышения FE по отношению к Ft (см. рис. 3.3). Увеличение минутной вентиляции ускоряет темпы этого роста (при стабильном сердечном выбросе), особенно выраженные при назначении хорошо растворимых газов. Соотношение FE/Fr также в значительной степени зависит от величин дыхательного объема и от остаточного объема легких (FRC). Чем меньше последний показатель, тем быстрее растет соотношение Fe/Fj (при стабильном сердечном выбросе). Величина FRC у младенцев заметно меньше, чем у взрослых, но дыхательный объем в расчете на килограмм массы тела такой же, как и у взрослых [81]. На рис. 3.4 представлена скорость вымывания из легких новорожденных малорастворимого газа (гелия).
Шунтирование кровотока справа налево через легкие значительно увеличивает соотношение ¥ъ/¥ь так как при каждом дыхании из альвеол удаляется меньшее количество газа, чем в норме. Вводный наркоз в подобных условиях наступает медленнее, поскольку соответственно замедляется рост концентрации анестетика в крови. Шунтирование справа налево весьма часто имеет место у новорожденных, младенцев и детей (см. гл. 18).
Степень растворимости анестетика в крови также влияет на скорость повышения соотношения Fe/F]. Нарастание его происходит быстрее при использовании нерастворимых газов типа закиси азота и медленнее при ингаляции галотана и других хорошо растворимых в крови анестетиков. Коэффициент разделения галотана, энфлу-рана и изофлурана в крови у новорожденных ни-
же на 18 % (метоксифлурана — на 12 %), чем у взрослых (от 20 до 40 лет). У детей (от 1 года до 7 лет) этот показатель ниже, чем у взрослых на 12 % [82—84\. Подобные различия в некоторой степени обусловлены меньшей концентрацией альбумина в крови новорожденных, способствующей более быстрому повышению соотношения Fe/Fj. Однако при этом замедляются темпы повышения концентрации анестетика в тканях.
Связывание анестетика тканями мозга, сердца и печени у новорожденных на 50 % ниже, чем у лиц среднего возраста [85]. Это в некоторой степени обусловлено уменьшением содержания воды и увеличением липидов в этих органах по мере взросления [86].
Повышение растворимости ингаляционных анестетиков в мышечной ткани происходит в четкой линейной зависимости от возраста. Это объясняется скорее всего увеличением содержания белков в мышцах на протяжении первых 5 десятилетий жизни и нарастанием жировых отложений в них на последующих этапах [87].
Скорость нарастания парциального давления анестетиков в тканях у новорожденных примерно на 30 % выше, чем у взрослых, что частично связано с более быстрым повышением у них соотношения Fe/Fj. Парциальное давление анестетика в тканях, крови и альвеолах у новорожденных возрастает быстрее, чем у взрослых, также благодаря более высоким показателям кровотока в расчете на единицу тканевой массы. Соответственно у них быстрее наступает и наркоз. Во время поддерживающей анестезии коэффициент распределения на границе газ/кровь снижается примерно на 10 % из-за гемодилюции инфузируемыми растворами кристаллоидов и соответствующего уменьшения гематокрита [87].
Пониженная растворимость галотана в крови новорожденных лишь незначительно снижает его концентрацию в крови (17,1 против 18,5 мг/100 мл у взрослых) при минимальной анестезирующей концентрации (MAC). Тем не менее содержание галотана в конечном объеме выдыхаемого воздуха у новорожденных следует поддерживать на более высоком уровне, чтобы повысить концентрацию анестетика в крови до уровня, имеющего место у взрослых. Cook и соавт. [88] отметили пониженную концентрацию галотана, создающуюся в мозге 15-дневных крыс по сравнению с взрослыми животными, несмотря на введение молодым крысам более высокой средней эффективной дозы (ED50) этого анестетика. Данное различие исчезало после снижения содержания воды в мозге молодых животных. По заключению авторов, для обеспечения анестезии у молодых крыс требуется такое же, как и у взрослых, количество галотана в расчете на сухую массу мозговой ткани, а для достижения необходимой
Фармакология 35
концентрации необходимо повышение парциального давления газа. Повышение кардиального выброса замедляет темпы повышения концентрации анестетика в альвеолах, так как при этом большее количество газа вымывается из легких с током крови. Положение с кардиальным выбросом имеет противоположные характеристики. В норме у новорожденных он вдвое выше, чем у взрослых, при расчете на килограмм массы тела (см. гл. 18) [89]. Распределение крови по органам влияет на скорость повышения FE по отношению к Fj. Преимущественное направление кровотока к обильно васкуляризированным органам (VRG) и ослабленное — к другим тканям (как это происходит у детей младшего возраста) обильно насыщает первые и затем снижает экстракцию препарата из крови. Концентрация анестетика в крови легочной артерии возрастает, а это снижает градиент концентрации анестетика на границе альвеолярного воздуха и крови, а затем ускоряет повышение его альвеолярной концентрации. Распределение кардиального выброса у младенцев преимущественно среди органов группы VRG способствует более быстрому росту соотношения FE/F[.
Врожденная сердечная патология также влияет на поглощение ингаляционных анестетиков. При шунтировании справа налево (рис. 3.5) концентрация анестетика в крови нарастает медленнее, соответственно и вводный наркоз наступает позднее. Это запаздывание выражено тем сильнее, чем значительнее величина шунтирования. Изменения Fe/F[ при шунтировании слева направо зависят от величины последнего. При массивном шунтировании (свыше 80 % кардиального выброса) рециркулирующая кровь содержит такое же количество анестетика, как и кровь, покидающая левый желудочек, т. е. концентрация анестетика в крови альвеолярных капилляров оказывается высокой, и соотношение Fe/Fj быстро возрастает. Если шунтируется не более 50 % кардиального выброса, то Fe/F, изменяется незначительно, так как содержание анестетика в общем кровотоке почти не отличается от его концентрации в нормальных условиях.
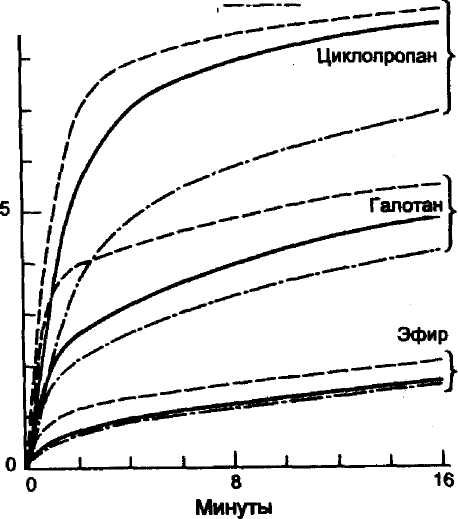
Альвеолярная концентрация галотана [90], закиси азота [91] и циклопропана [92] у детей возрастает быстрее, чем у взрослых, что сокращает у них сроки наступления вводного наркоза. Это объясняется более значительной минутной вентиляцией у детей, меньшей величиной FRC, а также пониженной растворимостью анестетика в крови. По данным Deming [93], концентрация циклопропана в крови у детей была выше, чем у взрослых, при одинаковой глубине наркоза. Потребность в анестетиках (минимальная анестезирующая концентрация — MAC), например для галотана, четко зависит от возраста. Она равна
0,55 ± 0,02 % у младенцев до 33 нед гестации; 0,87 ± 0,03 % — у новорожденных от 0 до 1 мес жизни и 1,20 ± 0,06 % — от 1 до 6 мес жизни [94]. Подобная же закономерность прослеживается и в отношении изофлурана [95, 96]. После 6-месячного возраста величина MAC прогрессивно снижается [97, 98]. Аналогичные сдвиги имеют место в отношении севофлурана и десфлурана [99-101].
Новорожденные нуждаются также в более высоких дозах кетамина (в расчете на 1 кг массы тела) для обеспечения поддерживающего наркоза [102]. Причины подобной повышенной потребности остаются нерасшифрованными. Возможно, эта особенность объясняется более высокой скоростью метаболизма анестетика, большим количеством нейронов на единицу массы мозга, повышенным потреблением кислорода мозговой тканью, усиленным кровотоком или всеми указанными факторами одновременно. Вполне возможно, что концентрация анестетика в мозге у детей оказывается такой же, как и у взрослых (см. выше) [88]. Предпочтительное распределение сердечного выброса к органам VRC группы у новорожденных связано с тем, что именно они составляют значительную
Конечный
1,0
дыхательный объем, " 50 % шунтирование Норма
"ет
- Артериальная
кровь
50%
шунтирование
Артериальная
кровь
50%
шунтирование
ИЛИ
Рис. 3.5. Влияние 50 % шунтирования крови справа налево на отношение скорости повышения концентрации анестетика в конечном объеме выдыхаемого воздуха (Pet) к его концентрации во вдыхаемой газовой смеси (Р,) либо отношение концентрации анестетика в артериальной крови (Р.) к его концентрации во вдыхаемой газовой смеси (Р,). (Из Едет EIII: Anesthetic Uptake and Action. Baltimore, Williams & Wilkins, 1974.)
36 Анестезия в педиатрии
часть всего их тела (см. табл. 3.3). В результате этого VRC быстрее насыщаются анестетиком, что сокращает сроки наступления вводного наркоза. Препараты проникают в ЦНС новорожденных легче и быстрее, чем у взрослых. Это можно объяснить повышенной проницаемостью гематоэнцефалического барьера у них [103] либо же замедленным кровотоком в мозге, предрасполагающим к более полному высвобождению препаратов от связи с протеинами плазмы [57\. Кроме того, гипоксия и ацидоз оказывают на гематоэнцефалический барьер у новорожденных гораздо более разрушительное воздействие, чем у взрослых.
Метаболизм анестетиков у детей происходит заметно медленнее, чем у взрослых. В моче детей обнаруживают достоверно меньшее количество продуктов распада метоксифлурана, чем у взрослых [104]. Четыреххлористый углерод и хлороформ оказывают менее токсическое действие на печень молодых животных по сравнению со старыми [105]. Еще одним из подтверждений меньшей скорости метаболизма анестетиков в препу-бертатном возрасте может считаться редкость развития вызванного галотаном гепатита, несмотря на повторное применение этого анестетика при процедурах типа смены повязок или при проведении лучевой терапии у детей. В определенной степени эту особенность можно объяснить снижением под влиянием галотана печеночного кровотока у детей, в то время как у взрослых этот анестетик, напротив, усиливает кровоток в печени [106]. Соответственно у детей меньшее количество препарата попадает в печень, и в ней продуцируется меньшее количество токсичных метаболитов. Метаболизм галотана у младенцев происходит в меньшей степени (образуется меньше бромидов), чем у взрослых, а пик концентрации метаболитов в крови наступает раньше (через 12—24 ч), чем у взрослых (через 48 ч) [107]. Приведенные сведения подтверждают, что биотрансформация галотана у младенцев происходит в меньшей степени, а очищение их организма от ингаляционных анестетиков происходит быстрее, чем у взрослых.
Влияние ингаляционных анестетиков на дыхание
Ингаляционные анестетики подавляют дыхание у младенцев и у детей точно так же, как и у взрослых, в прямом соответствии с величиной их дозировки [108]. Смесь из 1,5 % галотана с 70 % закиси азота снижает минутную вентиляцию примерно на 25 %, дыхательный объем — на 35 %, среднюю величину потока на вдохе — на 20 %, функциональный цикл (время вдоха/общее респираторное время) — менее чем на 5 %. Содер-
жание СО2 в выдыхаемом воздухе и частота дыханий возрастают соответственно на 15 и 10 %. Общее действие анестетиков также снижает альвеолярную вентиляцию и увеличивает содержание СО2. Оно наиболее выражено у галотана, а при ингаляции энфлурана может иметь место не только влияние на ЦНС, но и на периферические структуры [109]. Севофлуран снижает минутную вентиляцию и частоту дыхания значительно сильнее, чем галотан [110]. Торакоабдо-минальная асинхрония на фоне приема севофлу-рана выражена слабее. Повышение Ретсо2 остается умеренным в обеих группах.
Под влиянием 0,75 MAC галотана смеси с кислородом у новорожденных снижается дыхательный объем (на 20 %), минутная вентиляция (на 34 %), работа дыхания (на 20 %) и функциональная остаточная емкость (на 32 %) [111]. Сопротивление в дыхательных путях при этом возрастает на 59 %, хотя растяжимость легких остается неизменной. Величина РаСО2 увеличивается на 50 %, a (AA)DO2 — на 26 %. Нарастание СО2 становится следствием снижения вентиляции и повышения сопротивления в дыхательных путях даже при неизменной работе дыхания.
Дополнительное введение небольших концентраций СО2 при наркозе галотаном в смеси с закисью азота несколько увеличивает минутную вентиляцию, однако повышение содержания галотана смещает кривую реакции на СО2 вправо и уплощает ее, что сопровождается снижением минутной вентиляции и дыхательного объема. Следовательно, повышение дозировки галотана снижает чувствительность к СО2. При MAC галотана 1,1 петля кривой реакции на СО2 составляет всего 38 % от нормы, а при MAC галотана, равном 2, понижается до 17 % контрольной величины. Подобные сдвиги обусловлены прямым влиянием галотана на ЦНС и на ее механизмы регулирования дыхания [112].
Анестезия 0,5 % галотаном у детей увеличивает дыхательную нагрузку и в течение первых 5 мин снижает дыхательный объем [113]. Скорость потока воздуха при дыхании и продолжительность вдоха при этом не меняются, а это указывает на то, что снижение дыхательного объема не связано с нарушениями рецепторных механизмов легких, реагирующих на их растяжение. Компенсация дыхания, наступающая после 5 мин анестезии, скорее всего объясняется стимуляцией хеморецепторов или рефлексами со стороны рецепторных соединений или гладких мышц дыхательных путей.
Все приведенные данные убеждают в том, что наркоз подавляет вентиляцию у младенцев и детей младшего возраста, и указывают на необходимость соответствующего контроля дыхания во время общей анестезии.
Влияние ингаляционных анестетиков на сердечно-сосудистую систему
Все ингаляционные анестетики подавляют функцию клеток миокарда при исследованиях in vitro в прямой зависимости от их дозировки. Подобное же действие прослеживается в опытах in vivo.
В опытах на ягнятах 0,5 MAC галотана снижает потребление кислорода на 25 %, а под влиянием 1,0 MAC происходит его снижение на 43 % [114\. Точно так же последняя доза галотана уменьшает величину кардиального выброса на 48 % по сравнению с контролем. Правда, при этом потребность тканей в кислороде удовлетворяется и ацидоз не развивается. Можно полагать, что снижение кардиального выброса становится результатом снижения потребности тканей в кислороде. Кровоток в органах не изменяется при наркозе 0,5 MAC галотана, но значительно сокращается при 1,0 MAC. Концентрация эпинеф-рина и норэпинефрина в плазме значительно снижается при наркозе 1,0 MAC галотана, что указывает на снижение стрессовых воздействий в этот период. Подобные же сдвиги прослеживаются при назначении фентанила [115] и галотана [776].
Гипоксия, сопровождающая наркоз 0,5 или 1,0 MAC галотана, снижает потребление кислорода по сравнению с нормой, но не вызывает метаболического ацидоза [1Щ. Сердечный выброс остается таким же, как и при нормоксии. Распределение кровотока между периферическими органами, мозгом и сердцем остается таким же, как и при гипоксии у бодрствующих животных. Соответственно поступление кислорода к мозгу и сердцу сохраняется в пределах нормы. При 1,0 MAC галотана и гипоксии снижается концентрация катехоламинов в плазме у животных. По нашему мнению, гипоксия не угнетает перераспределения кровотока от периферии к мозгу и к сердцу во время галотанового наркоза и не препятствует функционированию этого протектив-ного механизма.
Наркоз снижает артериальное давление у новорожденных в гораздо большей степени, чем у взрослых, не изменяя при этом частоту сердечных сокращений [117—120]. Это подтверждает угнетающее влияние ингаляционных анестетиков на барорецепторные рефлексы, имеющиеся уже у недоношенных младенцев [ 121] и животных [ 122, 123]. По наблюдениям Ebert и соавт. [124], гало-тан подавляет кардиопульмональные и артериальные барорецепторные рефлексы у взрослых. Кгапе и Su [125] показали, что галотановый наркоз в более значительной степени подавляет пиковое напряжение мышц правого желудочка у новорожденных по сравнению с взрослыми. Возможно, это различие связано с особенностями
Фармакология 37
клеточного строения сердечных миоцитов у новорожденных [126]. Wolf и соавт. [118] показали, что галотан угнетает функцию миокарда у детей от 2 до 7 лет гораздо сильнее, чем изофлуран. Оба этих анестетика оказывают одинаковое воздействие на частоту сердечных сокращений и на артериальное давление. Ни один из анестетиков не изменяет конечной диастолической величины и преднагрузки левого желудочка. Ухудшение функции миокарда во время галотанового наркоза, вероятнее всего, вызвано ухудшением его сократительной способности. Влияние изофлурана в этом отношении остается недостаточно изученным, но в любом случае угнетающее воздействие этого анестетика на миокард менее выражено, чем у галотана. Похожая закономерность прослежена в отношении воздействия анестетиков на папиллярные мышцы взрослых кроликов [127]. У младенцев как 1,0 MAC галотана, так и 1,0 MAC изофлурана снижают кардиальный выброс на 25 %, а ударный объем — примерно на 20 %. Извергаемая фракция при этом уменьшается на 25 % [128].
Закись азота также оказывает влияние на функцию сердечно-сосудистой системы у новорожденных. При ее назначении отмечается угнетение барорецепторных рефлексов у новорожденных кроликов [123], а также повышение сосудистого сопротивления в легких у ягнят [129] с гипоксией и без, а также у детей [130].
Севофлуран
Севофлуран (Ултан) является относительно новым анестетиком из группы галогенов, обладающим низким коэффициентом разделения между кровью и газом (слабое растворение в крови). Следовательно, при вдыхании 8 % севофлурана введение в наркоз происходит на 1 мин быстрее, чем при использовании 5 % галотана. Весьма интересно, что при сравнительном тестировании севофлурана и галотана 56 % анестезиологов совершенно четко идентифицировали, в каких случаях введение в наркоз осуществлялось каждым из этих анестетиков [131]. Наркоз наступает быстрее, если с самого начала используется 8 %, а не 1 % севофлуран с последующим повышением его концентрации через каждые 2—3 вдоха [132]. Запах севофлурана воспринимается большинством пациентов чуть менее едким, чем галотана. Гладкая интубация трахеи может быть произведена при MAC севофлурана в выдыхаемом воздухе, равной 1,87 % [133].
Прохождение севофлурана через натриевую известь, абсорбирующую двуокись углерода, приводит к возникновению потенциально токсичного компонента А. Продукция этого компонента зависит от габитуса, величины тела пациента, а
38 Анестезия в педиатрии
также от температуры натриевой извести. Не менее двух проведенных исследований показали, что назначение севофлурана детям сопровождается возникновением низких концентраций этого компонента [134] и что концентрация падает на 2/з в течение 24 ч [135]. Максимальная концентрация компонента А во вдыхаемом воздухе была 5,5 ± 4,4 ррт (частиц на миллион), а выдыхаемом — 3,7 ± 2,7 ррт. Максимальная концентрация его, зарегистрированная у отдельного пациента, равнялась 15 ррт. Во время наркоза концентрация компонента А остается относительно постоянной. Пик концентрации неорганического фторида у больных во время наркоза севофлура-ном бывает выше, чем при использовании гало-тана [135]. Спустя 24 ч концентрация фторида снижается на 2/3. Концентрация как компонента А, так и фторида не столь высока, чтобы представлять какую-либо опасность для ребенка. Ни у одного из детей не отмечено признаков повреждения печени или почек. Оба анестетика — се-вофлуран и изофлуран ассоциируются с заметным возрастанием креатининфосфатазы, наступающим вслед за назначением сукцинилхолина [136]. Значение отмеченных сдвигов остается неясным.
Преимуществами севофлурана являются более быстрое введение в наркоз и интубация трахеи. Однако, по данным нескольких исследований, при использовании галотана интубацию трахеи удается выполнить быстрее и с меньшим кашле-вым раздражением, чем при назначении севофлурана [137, 138]. Следующим достоинством севофлурана является быстрый выход из наркоза. Данное преимущество обнаруживается, если в операционной пациенту не вводят наркотики. В этих случаях время пробуждения после наркоза, выполненного севофлураном, такое же, как и при использовании галотана. Посленаркозный делирий при использовании севофлурана наблюдается чаще, чем в случае галотана, возможно, именно из-за более быстрого выхода из наркоза [139—140]. Необходимость в назначении наркотиков после операции чаще возникает после наркоза, выполненного севофлураном. Следовательно, время перевода из послеоперационной палаты оказывается одинаковым в случае наркоза как севофлураном, так и галотаном (примерно 2 ч)
Ц41\-
Степень снижения вентиляции под влиянием
севофлурана выше, чем при действии галотана [110]. Действительно, при назначении высоких его концентраций нередко наблюдаются периоды апноэ у младенцев и детей. Величины вентиляции в минуту (4,5 против 5,4 л/м2) и частота дыханий в минуту (37,5 против 47,6 bpm) при использовании севофлурана достоверно ниже, чем галотана. Характер дыхательных движений при
этом остается одинаковым, хотя форма дыхательных волн меняется по-разному под влиянием этих двух анестетиков. Пик потока на выдохе наступает быстрее в случае севофлурана. Торакоаб-доминальная асинхрония отмечается значительно реже во время наркоза севофлураном.
Различия во влиянии севофлурана и галотана на сердечно-сосудистую систему весьма невелики. По данным одного сопоставления действия севофлурана и галотана, первый из этих препаратов повышал частоту сердечных сокращений и артериальное давление на 20 % [142]. Однако в большинстве работ не отмечалось подобных различий во влиянии севофлурана и галотана на пульс и артериальное давление [143]. Отмечено также, что оба сравниваемых анестетика могут в одинаковой степени снижать артериальное давление и повышать скорость церебрального кровотока, измеренную транскраниально по методу Допплера [144]. Не отмечено никаких различий между двумя этими агентами по показателям Spor
Несмотря на отсутствие различий в скорости кровотока, у некоторых детей во время наркоза севофлураном развиваются подергивания мышц и аномальные движения. По меньшей мере у одного во всех отношениях нормального ребенка было документально подтверждено развитие судорог [145].
Отсутствуют какие-либо подтверждения нарушений со стороны функции печени и почек, связанные с севофлураном. У нескольких больных отмечено развитие злокачественной гипертермии при назначении севофлурана.
Миорелаксанты Недеполяризующие миорелаксанты
В течение многих лет продолжаются споры по вопросу, не обладают ли новорожденные и младенцы более высокой чувствительностью к неде-поляризующим миорелаксантам, чем взрослые. Некоторые исследования дают на этот вопрос положительный ответ [146—151], а другие — отрицательный [152, 153]. По некоторым данным, младенцы обладают повышенной резистентно-стью к rf-тубокурарину (кураре). Эти противоречия в значительной степени вызваны различиями в методологии исследований и неточным определением концентрации анестетиков. Заключение о повышенной чувствительности новорожденных к недеполяризующим миорелаксантам основано на более выраженном снижении вентиляции да-
Фармакология 39
же при назначении пониженных доз этих препаратов. Данную особенность можно объяснить также меньшими размерами диафрагмы у младенцев и более быстрым ее утомлением при стрессовой нагрузке, чем у взрослых [154\. Само строение диафрагмальной мышцы у младенцев отличается от ее структуры у взрослых [155\. Кроме того, паралич диафрагмы под воздействием миорелаксантов у новорожденных наступает одновременно с параличом периферических мышц, а не позднее, как это имеет место у взрослых.
Если чувствительность к недополяризующим миорелаксантам изучается с использованием метода стимуляции периферического нерва и учета сокращений соответствующих мышц, то заметных различий реакции у новорожденных и взрослых не удается отменить. Однако все подобные исследования проводились без учета концентрации анестетиков, существенно влияющей на результаты получаемой реакции [156]. Если же дозировки ингаляционных анестетиков у детей и взрослых были одинаковыми, то глубина наркоза оказывалась гораздо меньшей у новорожденных и младенцев, чем у взрослых. Соответственно подавление мышечных реакций на раздражение нерва было более значительным у взрослых, чем у новорожденных.
Fisher и соавт. [757] разрешили этот вопрос, использовав фармакодинамическую-фармакоки-нетическую модель, позволяющую определять как действие препарата (подавление интенсивности мышечного сокращения), так и чувствительность нейромышечных синапсов. По их данным, новорожденные дети действительно обладают повышенной чувствительностью к кураре, но дозировка миорелаксантов у них в расчете на величину поверхности тела (м2) должна быть такой же, как и у взрослых в связи с более значительным объемом распределения препаратов у них. Элиминация препаратов кураре у новорожденных происходит более медленно из-за большего объема распределения и сниженной клубочковой фильтрации. У взрослых кураре выводится преимущественно с мочой (40 %) в неизмененном виде [158\ и около 12 % выделяется с желчью. В отношении детей соответствующие сведения отсутствуют.
По наблюдениям Kroenigsberger и соавт. [159\, постсудорожное истощение наступает у недоношенных детей при стимуляции нерва током в 20 Гц, а у доношенных — лишь при 60 Гц. У взрослых подобного истощения при таком раздражении не наступает. Закись азота и метокси-гекситал (Бревитал) также ослабляют нейромы-шечную трансмиссию у новорожденных [160\. Приведенные данные, а также исследования Fisher и соавт. [157\ подтвердили более высокую
чувствительность новорожденных и младенцев к производным кураре, а также показали, что их нейромышечные синапсы не только отличаются от синапсов взрослых, но и более восприимчивы к действию анестетиков. Поэтому каждое исследование действия миорелаксантов у детей должно проводиться с учетом глубины создаваемого наркоза.
Действие кураре у новорожденных проявляется раньше (1,56 ± 0,34 мин), чем у детей от 3 до 10 лет (5,20 ± 1,16 мин) [161\. Сроки ликвидации паралича у них также удлинены. Назначение панкурониума (0,07 мг/кг) за 3 мин до введения кураре ускоряет наступление паралича у больных любого возраста, но ликвидация паралича в этих случаях у младенцев происходит гораздо медленнее, чем у взрослых. Аминогликозиды потенцируют наступление нейромышечного блока, вызываемого кураре и другими недеполяризующими миорелаксантами. В основе подобного действия аминогликозидов лежит угнетение высвобождения ацетилхолина из пресинаптических мембран и стабилизации постсинаптических мембран.
По наблюдениям Cameron и соавт. [162], d-ту-бокурарин и панкурониум (Павулон) не влияют на потребление кислорода ягнятами в условиях нормоксии. Однако в условиях гипоксии оба этих препарата снижали потребление кислорода на 35 %. Гипоксия приводила к повышению содержания молочной кислоты в плазме вне зависимости от того, наблюдался ли паралич мышц. Величина кардиального выброса не изменялась при параличе мышц. Неожиданным оказалось повышение давления в правом желудочке, рост сопротивления в сосудах легких и среднего давления в легочной артерии под влиянием rf-тубо-курарина и панкурониума. Механизм этих сдвигов остался неизвестным, но связь его с высвобождением гистамина была исключена, так как панкурониум не способствует его нарастанию. Кроме того, под влиянием гистамина происходит расширение легочных сосудов у новорожденных. Более вероятным представляется потенцирование миорелаксантами действия ангиотензина и катехоламина, нарастающих при гипоксии. Ожоговые больные нуждаются в повышенных дозах миорелаксантов для получения такой же степени расслабления мышц, как у пациентов с другой патологией. Последняя особенность скорее всего связана с циркуляцией в крови ингибиторов миорелаксантов [163\.
Панкурониум
Миорелаксирующее действие бромида панкурониума выражено в 5—10 раз сильнее, чем у кураре, хотя сроки его наступления оказываются почти одинаковыми у обоих препаратов (1,5 + 0,2 мин
40 Анестезия в педиатрии
с колебаниями от 0,5 до 3,0 мин). Панкурониум в дозе 0,06 мг/кг на 95 % устраняет сокращения мышц, вызываемые стимуляцией локтевого нерва у больных, находящихся под наркозом галота-ном или закисью азота [164\. Восстановление сократительной способности мышц у детей, как и у взрослых, наступает спустя 54,7 ±11,1 мин. По наблюдениям Meretoja и Luosto [165], младенцам требуется меньшая дозировка панкурониума, чем детям более старшего возраста, хотя сроки прекращения действия препарата остаются одинаковыми в любом возрасте. Более длительная миоре-лаксация у ненаркотизированных младенцев отмечается при недоношенности, при почечной недостаточности или при анасарке. Goudsouzian и соавт. [ 166] отметили, что ликвидация миорелак-сации у младенцев, поддерживавшейся несколько дней, может быть устранена через 3 ч после введения последней дозы препарата. Чем глубже недоношенность, тем медленнее ликвидируется миорелаксация у младенцев. По мнению авторов, это объясняется более значительным количеством волокон типа I (замедленные сокращения, высокое потребление кислорода) в периферических мышцах недоношенных младенцев U67].
Действие миорелаксантов, клиренс которых зависит в основном от функции почек, может быть таким же или отличаться от действия препаратов, подвергающихся метаболизму или выделяющихся другими путями [168]. Около 30— 40 % панкурониума выделяется в неизмененном виде с желчью [169]. Еще около 45 % метаболи-зируется преимущественно под влиянием гид-ролизации. Треть образовавшихся метаболитов сохраняет активность, хотя и вдвое меньшую, чем исходный препарат. Гидроксилирование ослаблено у новорожденных, но это компенсируется другими путями его инактивации и выведения. Указанные особенности фармакокинетики панкурониума у новорожденных затрудняют предсказание его действия. Если альтернативные пути метаболизма не функционируют, то продолжительность действия панкурониума увеличивается. Если же они сохраняются, то и метаболизм препарата может проходить в обычные сроки. В условиях клиники эти эффекты могут быть слабо выражены.
У некоторых детей панкурониум вызывает умеренную или тяжелую тахикардию как в состоянии наркоза [170], так и без него [171]. Иногда подобная тахикардия становится причиной развития застойной сердечной недостаточности. Оба препарата — кураре и панкурониум — угнетают повышение кардиального выброса, возникающего как реакция на гипоксию, и заметно усиливают кровоток в миокарде. Они не влияют на перераспределение кровотока от перифериче-
ских органов к мозгу и сердцу у животных с гипоксией [162].
Панкурониум повышает артериальное давление у недоношенных. Это обстоятельство в сочетании с увеличением концентрации эпинефрина и норэпинефрина в общей циркуляции, также спровоцированное панкурониумом, увеличивает опасность внутричерепных кровоизлияний [172]. Однако в условиях адекватного наркоза панкурониум не оказывает заметного влияния на артериальное давление. Миорелаксация, вызванная панкуронием, не влияет на волемию плазмы у недоношенных младенцев [173]. Однако при этом отмечается снижение вариабельности мозгового кровотока [174], которое ассоциируется с меньшей вероятностью внутричерепных геморрагии у таких пациентов [175—177].
Панкурониум не изменяет показатели потребления кислорода во время наркоза у собак [178]. Общее потребление кислорода у детей в состоянии седации под влиянием панкурониума снижается, особенно если перед миорелаксацией дети активно двигались. Если же они оставались спокойными, то потребление кислорода оставалось на прежнем уровне [179].
Атракуриум
Атракуриум (Тракриум) представляет собой че-тырехаммониевое соединение. Элиминация его из организма наполовину происходит за счет эфирного гидролиза и элиминации по Гофману, а оставшаяся половина подвергается малоизученным процессам метаболизма в тканях [180]. Атракуриум сохраняет стабильность в нормальном солевом растворе, но постепенно разрушается (на 6 % за каждые 5 ч) в лактированном растворе Рингера. Последнее обстоятельство приобретает значение при продолжительной инфузии препарата [181]. Нейромышечная блокада под влиянием атракуриума наступает у детей, как и у взрослых, через 3,8 ± 0,09 мин [182]. Величина ED50 понижена у новорожденных [183], а также у детей [184—186] и заметно возрастает в подростковом возрасте. Эти данные подтверждают более высокую чувствительность новорожденных к ат-ракуриуму, чем взрослых. Влияние анестетиков на ED50 атракуриума зависит от их дозировки: 170 мкг/кг у тиопентала/фентанила, 130 мкг/кг у галотана и 120 мкг/кг у изофлурана. Действие атракуриума прекращается через 20—30 мин и не зависит от возраста пациентов. Возможно, подобное сходство объясняется единым механизмом элиминации препарата во всех возрастных группах. У новорожденных эффект действия атракуриума зависит не только от времени после рождения, но и от температуры [187].
Полная миорелаксация у новорожденных пер-
). Падение температуры тела новорожденных ниже 36 "С удлиняет сроки миорелакса-ции (до 47,5 ± 11,8 мин). Следовательно, при необходимости восстановить спонтанное дыхание к концу операции у новорожденного температура тела к этому сроку должна быть нормальной.
Паралич, вызываемый атракуриумом, продолжается около 32 мин, а восстановление мышечных подергиваний при нейростимуляции на 25— 95 % по сравнению с контролем происходит в течение 10 мин. Отличия атракуриума от панкуро-ниума и векурониума в этом отношении зависят от особенностей его метаболизма.
Введение атракуриума взрослым сопровождается высвобождением гистамина, но у новорожденных, младенцев и детей это не вызывает заметных проблем, так как ритм сердечных сокращений и артериальное давление у них не изменяются даже после введения удвоенной ED95 дозы атракуриума. Остается неизвестным, проникает ли лауданосин (препарат судорожного действия и один из главных антагонистов атракуриума) через гематоэнцефалический барьер новорожденных быстрее, чем у взрослых, однако после его введения младенцам судороги обычно не развиваются. Незрелость почек у новорожденных не оказывает заметного влияния на кинетику атракуриума, так как и у взрослых его фармакодина-мика остается одинаковой при почечной недостаточности и при нормальной функции почек [188].
Векуроний
Векуроний (Норкурон) — моночетвертичное соединение, почти в 10 раз активнее панкурониу-ма, но оказывает кратковременное действие [189], что делает его особенно ценным при непродолжительных хирургических вмешательствах. У младенцев влияние препарата проявляется гораздо быстрее (1,5 + 0,6 мин), чем у детей и взрослых (2,4 ± 1,4 и 2,9 + 0,2 мин соответственно) при анестезии адекватными дозировками га-лотана/закисью азота. Миорелаксант весьма удобен при выполнении интубации трахеи, однако его приходится назначать в дозе 0,4 мг/кг для обеспечения таких же условий интубации, как и при введении сукцинилхолина [190]. Величина ED50 векурония у новорожденных равна 0,16 мг/кг, у младенцев — 0,19 мг/кг и у детей — 0,15 мг/кг, что иллюстрирует почти одинаковую чувстви-
Фармакология 41
тельность к нему в разных возрастных группах. Значительно более высокие ED50, указанные Meretoja и соавт. [191] по сравнению с данными Fisher и соавт., можно объяснить разной методикой исследований. Первые из этих авторов применяли методику, предусматривающую кумулятивное введение препарата, a Fisher и соавт. использовали однократное болюсное введение мио-релаксанта [ 191, 192\. Продолжительность нейро-мышечной блокады различается в зависимости от возраста пациентов [193, 194\. У новорожденных примерно вдвое дольше (73 ± 23 мин), чем у взрослых, и примерно на 30 % выше у новорожденных, чем у детей. Причиной этих различий можно считать более значительный объем распределения препарата у новорожденных и замедленное его выведение. Сроки восстановления движений наиболее продолжительные у новорожденных (20 ± 8 мин) по сравнению с детьми (9 + 3 мин) и взрослыми (13 ± 7 мин). Это скорее всего обусловлено большим объемом распределения препарата, а не замедленным его клиренсом. Правда, время полувыведения векурония у младенцев больше, чем у детей и взрослых, но клиренс одинаков. Так, сроки восстановления движений у новорожденных составляют 55 мин, а у детей от 3 до 15 лет — 20—24 мин [195]. Показатель Vd векурония оказался гораздо выше, а концентрация его в крови — заметно ниже при подавлении на 50 % судорожной реакции мышц на раздражение. В этом отношении векуроний не отличается от кураре, возможно, благодаря одинаковым механизмам действия. Введение векурония не отражается на частоте сердечных сокращений и на артериальном давлении. Препарат можно без опасений применять у пациентов, склонных к злокачественной гипертермии [196].
Мивакуриум
Действие мивакуриума, недеполяризующего мио-релаксанта из группы бензилизохинолина, было недавно изучено у детей [197]. Величина ED95 этого препарата оказалась одинаковой в условиях наркоза галотаном/закисью азота и закисью азота/наркотиками (0,051 и 0,059 мг/кг соответственно). Ликвидация нейромышечной блокады в 95 % случаев происходила спустя 10 мин. Введение атропина (0,03 мг/кг) или эдрофониума (0,3 мг/кг) ревертировало миорелаксацию. Препарат не вызывал достоверных изменений сердечного ритма и артериального давления. Эти данные были подтверждены и другими наблюдениями [198]. Никаких различий не было отмечено во времени наступления максимального мышечного блока или во времени его устранения на 90 % при наркозе 66 % закисью азота и 1,5 MAC севофлурана, или изофлурана, или пропофола
42 Анестезия в педиатрии
[199\. У больных с ожогами мивакуриум в дозе 0,2 мг/кг обеспечивал хорошую миорелаксацию в ожидаемые сроки [200\. При этом отмечено замедление метаболизма мивакуриума, связанное со снижением активности холинэстеразы в плазме крови ожоговых больных. Данное свойство делает мивакуриум полезной альтернативой сук-цинилхолину, противопоказанному у больных с ожогами. Markakis и соавт. [201] продемонстрировали положительную взаимозависимость между активностью псевдохолинэстеразы и темпами инфузии рокурониума. Степень выраженности патологии печени не влияет на продолжительность миорелаксации, обеспечиваемой миваку-риумом [202]. У пациентов с заболеваниями печени через 2 мин после введения мивакуриума создавались такие же условия для интубации, как и через 1 мин после введения сукцинилхолина. Сроки ликвидации мышечного блока находились в обратной зависимости от активности холинэстеразы в плазме крови.
Рокурониум
Продолжаются поиски препарата, способного заменить сукцинилхолин. В последнее время разработан рокурониум, миорелаксатор из группы аминостероидов. По данным нескольких исследований, рокурониум в дозах 1,0—1,2 мг/кг создает такие же условия для интубации, какие обеспечивает сукцинилхолин примерно через 60 с после его внутривенного введения [203, 204]. Восстановление после внутривенного введения рокурониума наступает примерно в 8 раз медленнее, чем после использования сукцинилхолина [204, 205]. Reynolds и соавт. [206] указали на создание хороших условий для интубации под влиянием рокурониума, введенного в дельтовидную мышцу младенцев в дозе 1 мг/кг, а у детей — в дозе 1,8 мг/кг. Хорошие и даже отличные условия для интубации удерживались на протяжении 3 и 2,5 мин у младенцев и детей соответственно. Время устранения релаксации и появления первых подергиваний после внутримышечного введения препарата равнялось 70 ± 23 мин у детей и 57 ± 13 мин у младенцев. При данном пути введения биодоступность рокурониума достигает 80 % [206].
Фармакокинетика рокурониума изучена как у младенцев, так и у детей. Младенцы отличаются от детей по клиренсу препарата в плазме крови (4,2 ± 0,4 против 6,7 ± 1,1 мл/кг/мин) и по объему распределения в стабильном состоянии (Vdss) (231 ± 32 против 165 ± 44 мл/кг), а также по петле соотношения концентрация — эффект (5,7 ± 1,3 против 3,9 ± 0,5 соответственно) [207— 209]. Нарушения функции печени и почек не оказывают видимого влияния на клиренс препарата
[210]. Наиболее высокая активность препарата по показателю ED95 отмечается у младенцев и меньшая — у детей (251 ± 73 и 409 ± 71 мкг/кг соответственно) [211].
Рокурониум повышает частоту сердечных со-кращений (в среднем на 6 дыханий в минуту, bpm) и несколько снижает артериальное давление [212]. Тем не менее среднее артериальное давление остается достоверно выше у младенцев на фоне применения рокурониума, чем при использовании векурониума. Однако при неглубоком наркозе может наблюдаться значительное учащение пульса и подъем артериального давления. Миорелаксация, индуцированная рокуро-ниумом, легче устраняется неостигмином [213]. Двадцати микрограммов неостигмина достаточно, чтобы уже через 10 мин устранить паралич более чем у 80 % младенцев. Для достижения подобного эффекта у 90 % взрослых требуется не менее 50 мкг/кг этого препарата. Период времени, необходимый для устранения мышечного блока примерно на 94 %, равен 6,6 мин у младенцев, детей и взрослых [277].
Рапакурониум
Рапакурониум — это новый препарат, разработанный для замены сукцинилхолина. Он один из стероидных недеполяризующих миорелаксантов, назначаемых внутримышечно или внутривенно. Благоприятные условия для интубации трахеи при наркозе галотаном наступают при внутривенном введении препарата новорожденным в дозе 1,5 мг/кг и детям — в дозе 2,0 мг/кг [214]. Устранение мышечного блока на 3/4 происходит не позднее 10 мин у обеих групп пациентов. При сбалансированной анестезии мышечный блок наступает и достигает максимума в одинаковые сроки у новорожденных, младенцев и детей, начинающих ходить, под влиянием препарата в дозе 1 или 2 мг/кг [215]. Максимальная миорелаксация наступает в одинаковые сроки (через 1 ± 0,5 мин) после внутривенного введения препарата. Степень блокады уже через 60 с оказывается одинаковой во всех возрастных группах. Устранение мышечного блока по показателю 4/1 наступает через 10—11 мин. По сравнению с сук-цинилхолином, рапакурониум в дозе 1—1,5 мг/кг уже за 60 с устраняет мышечные сокращения на 98—100 %. Восстановление при использовании сукцинилхолина наступает скорее (5,7 мин) по сравнению с рапакурониумом (8 мин). Meakin и соавт. [214] сообщили о нескольких осложнениях при внутривенном введении рапакурониума, в том числе о бронхоспазме, тахикардии и усиленной саливации [214]. Ни одно из этих осложнений не было тяжелым.
Reynolds и соавт. [216] изучали фармакокине-
тику рапакурониума после его внутривенного и внутримышечного введения младенцам и детям, находившимся под неглубоким галотановым наркозом. При этом установлено, что клиренс препарата был самым быстрым у младенцев, несколько замедленным — у детей и еще более медленным — у взрослых. Клиренс препарата в плазме крови равнялся 5 мг/кг/мин, а его биодоступность — 56 %. Пик концентрации рапакурониума в плазме крови наступал через 4—5 мин после внутримышечного его введения. Метаболиты рапакурониума также обладают выраженным миорелаксирующим действием. Однако в связи с быстрым падением концентрации препарата в крови его метаболиты не играют заметной роли. Соответствующая проблема может возникнуть при повторном введении паракурониума или же при его продолжительном применении в отделении интенсивной терапии.
Устранение действия паракурониума возможно с помощью эндрофониума в дозе 1 мг/кг или неостигмина в дозе 0,05 мг/кг [217\, хотя пока не сообщалось о подобных исследованиях у младенцев и детей. Повторные введения паракурониума в дозах 0,5 мг/кг замедляют устранение мышечного блока.
Реверсия миорелаксации, вызванной недеполяризующими препаратами
До работ Fisher и соавт. [2Щ не было исследований, посвященных дозировкам препаратов, необходимых для реверсии миорелаксации у детей. По данным этих авторов, EDso неостигмина (Простигмина) равнялась 13,1 мкг/кг у детей, 15,5 мкг/кг у младенцев и 22,0 мкг/кг у взрослых. Время развертывания антагонистического действия в 70 % случаев оказалось одинаковым во всех трех возрастных группах (5—8 мин). Единственное различие в кинетике этого препарата состояло в более коротком времени его полувыведения (*'/гр) У младенцев и у детей по сравнению со взрослыми. Клиренс препарата был дольше у младенцев и детей, чем у взрослых. В соответствии с этими данными реверсия миорелаксации у детей и младенцев требует введения от половины до Уз дозы неостигмина, необходимой взрослым для преодоления действия кураре.
Подобное же исследование, проведенное с эд-рофониумом (Тензилон), показало, что его ED^, у младенцев и детей заметно выше, чем у взрослых (соответственно 145, 233 и 128 мкг/кг) [219\. Среднее время полного устранения нейромы-шечной блокады у младенцев оказалось вдвое выше, чем у взрослых (2,5 и 1,5 мин соответственно). В то же время продолжительность действия антагонистов оставалась одинаковой во всех возрастных группах. Введение атропина в дозе
Фармакология 43
10—20 мкг/кг за 30 с до назначения эдрофониума устраняло влияние последнего на ритм сердечных сокращений и на артериальное давление. Если же оба препарата вводились одновременно, то отмечалось снижение частоты пульса и систолического давления. Предварительное же введение атропина в дозе 20 мкг/кг увеличивало частоту пульса и повышало артериальное давление примерно в течение следующих 5 мин или более у всех пациентов. Авторы рекомендуют применять адрофониум у младенцев и детей в дозе 1 мг/кг, вводя его через 30 с после инъекции атропина в дозе 10—20 мкг/кг.
Действие эдрофониума у младенцев и детей наступает значительно быстрее (менее 1 мин), чем действие неостигмина (7—8 мин). Последняя особенность может сделать эдрофониум более предпочтительным, чем неостигмин, препаратом при устранении лекарственной миорелаксации.
Паралич, индуцированный недеполяризующими миорелаксантами, должен быть устранен к концу каждой операции (если после нее не планируется механическая вентиляция). По наблюдениям Rackow и Salanitre [220\, дыхательная недостаточность, потребовавшая проведения вспомогательной вентиляции, сохранялась у 20 % новорожденных, оперированных с использованием кураре и не подвергшихся после него реверсии нейромышечной блокады. В целом дыхательная недостаточность регистрировалась у 30 % детей в возрасте до 8 дней, подвергшихся действию кураре. Падение температуры тела ребенка ниже 35,5 "С провоцировало дыхательную недостаточность и требовало вспомогательной вентиляции у 48 % таких детей, в то время как при нормальной температуре это наблюдалось всего у 12 % пациентов. Респираторная поддержка была необходима чаще всего после продолжительных операций. Механическая вентиляция требовалась для большинства недоношенных новорожденных, оперированных с использованием миорелаксации [221]. Потребность в продленном нейромышеч-ном блоке снижалась или полностью устранялась, если имелась возможность мониторинга степени миорелаксации с помощью нейростиму-ляции и при наличии достаточного количества препаратов для поддержания блокады на желаемом уровне.
Деполяризующие миорелаксанты
Сукцинилхолин (Анекгин) является единственным из деполяризующих миорелаксантов, повседневно применяемых в настоящее время. При внутривенном (по 2 мг/кг детям до 1 года, 1 мг/кг — старше 1 года) или внутримышечном введении (2—4 мг/кг) сукцинилхолин вызывает деполяризацию постсинаптических мембран в течение 3—
44 Анестезия в педиатрии
10 мин. Неостигмин не ревертирует действие этого миорелаксанта. Новорожденные и младенцы менее чувствительны к действию сукцинилхо-лина при тестировании по дыханию и нейрости-муляции [222, 223\. Их реакция на одинаковые дозы препарата оказывается на 50 % слабее, чем у взрослых. Действие препарата обнаруживается через 20—30 с после его внутривенного и через 40—60 с после внутримышечного введения при условии нормального периферического кровотока.
Около 90 % внутривенно введенной дозы сук-цинилхолина подвергается быстрому гидролизу в плазме крови под воздействием псевдохолинэ-стеразы, и только 10 % достигает места приложения действия в мышцах. Дефицит псевдохолин-эстеразы (например, при патологии печени или в результате генетического дефекта) замедляет гидролиз препарата, в результате чего ускоряется наступление нейромышечного блока и увеличивается его продолжительность. Концентрация псев-дохолинэстеразы в плазме как доношенных, так и недоношенных новорожденных равна примерно 50 % величины соответствующего показателя у взрослых [224, 225]. Наблюдается схожая активность псевдохолинэстеразы у недоношенных и доношенных новорожденных [226\. Правда, у значительного числа недоношенных активность этого фермента оказывается аномально низкой, что тем не менее существенно не отражается на сроках наступления и на продолжительности действия сукцинилхолина. К возрасту 2 нед концентрация псевдохолинэстеразы в крови новорожденных становится такой же, как и у взрослых.
Продолжительность нейромышечной блокады возрастает у пациентов с аномальными вариантами псевдохолинэстеразы. Однако дибукаин угнетает активность даже нормального фермента значительно сильнее (на 80 % по сравнению с 20 % при аномальной псевдохолинэстеразе) [227, 228\. Этот факт используют для идентификации аномальной псевдохолинэстеразы.
Продленная реакция на сукцинилхолин при нормальном уровне псевдохолинэстеразы в крови и низкой дозе дибукаина указывает на ати-пичность фермента. В других случаях нормальная или слегка удлиненная реакция на сукцинилхолин может иметь место при низком уровне псевдохолинэстеразы и обычной дозе дибукаина (это типично для недоношенных и для больных с патологией печени) [229\. Эти примеры указывают на принадлежность всех форм псевдохолинэстеразы к вариантам нормы лишь с количественными различиями между ними. Дибукаиновый показатель отражает лишь способность фермента к гидролизу сукцинилхолина, но не указывает на количество псевдохолинэстеразы.
Фасцикуляция мышц при назначении сукци-
нилхолина в дозе 1 мг/кг отмечалась примерно у 75 % пациентов с аномалиями хотя бы одного из генов синтеза псевдохолинэстеразы (Viby-Mogensen [230\). При одном нормальном и одном аномальном гене продолжительность апноэ лишь слегка удлинялась по сравнению с гомозиготными пациентами, имеющими нормальные гены. Если же оба гена были аномальными, то время восстановления после миорелаксации удлинялось пятикратно. Остальные показатели такие же, как во время II фазы блока при аномалии обоих генов.
По данным исследований Viby-Mogensen [230\, 46 % пациентов с аномалиями одного из генов требуется от 15—20 мин для восстановления нормальной реакции мышц на нейростимуляцию. Для 11 % пациентов требуется более 20 мин. Подобное удлинение миорелаксации редко приобретает клиническое значение. Правда, при низкой активности псевдохолинэстеразы (например, у новорожденных, пациентов с патологией печени) в сочетании с аномалиями генов продолжительность блокады может возрастать весьма значительно. Если же у пациента с генетическими аномалиями восстановление функции мышц (дыхание и движения) наступает раньше срока введения повторной дозы сукцинилхолина, то это позволяет исключить вероятность продленной миорелаксации.
Продолжительность миорелаксации под воздействием сукцинилхолина у новорожденных и детей значительно ниже, чем у взрослых. Это может быть связано с различиями объемов внеклеточного пространства в разных возрастных группах.
Устойчивость к сукцинилхолину новорожденных значительно выше, чем взрослых (в расчете на массу тела). Если же ориентироваться на величину поверхности тела (четко коррелирующей с объемом внеклеточной жидкости), то различия между этими возрастными группами нивелируются. По наблюдениям Cook и Fischer [231], сукцинилхолин в дозе 0,5 мг/кг создает у новорожденных и младенцев менее выраженную нейро-мышечную блокаду, чем у взрослых. Вероятно, это обусловлено различиями в объеме экстрацел-люлярной жидкости. Восстановление функции мышц после введения указанных доз сукцинилхолина у младенцев происходит быстрее, чем у взрослых. Это можно объяснить более быстрым перераспределением и удалением препарата из зоны приложения его действия благодаря относительно большему объему сердечного выброса у младенцев.
Тахифилаксия у новорожденных может развиться при введении сукцинилхолина в дозе 3,0 ± 0,4 мг/кг [232]. Поэтому повышение дозировки для поддержания адекватной миорелакса-
Фармакология 45
ции, приводившей к фазе II блокады, потребовалось у 21 из 22 пациентов в возрасте от 1 года до 15 лет. По данным контроля нейромышечной проводимости, восстановление ее у 75 % пациентов наступило в пределах 41 мин. Однако при продолжительных инфузиях сукцинилхолина эти сроки оказались более вариабельными (3—81 мин), а само восстановление проходило в две фазы. Первая из них проходила довольно быстро и отражала инактивацию препарата холинэстеразой плазмы. Вторая фаза протекала более медленно и была обусловлена, вероятнее всего, связыванием препарата в нейромышечных соединениях или "собственно повреждением рецепторов". Во всех случаях эта вторая фаза блокады ликвидировалась спонтанно. Значительная вариабельность в длительности паралича требует корректировки доз при инфузиях сукцинилхолина, позволяющей реакции мышц восстанавливаться через 60— 90 с после его отмены. Использование метода нейростимуляции позволяет своевременно идентифицировать фазу II нейромышечной блокады и соответственно корректировать дозировку сукцинилхолина. При наркозе изофлураном фаза II блокады наступает раньше и под влиянием меньших доз сукцинилхолина, чем при наркозе закисью азота/фентанилом [233]. Новорожденные и младенцы в большей степени, чем взрослые, предрасположены к развитию II фазы миорелак-сации под влиянием деполяризующих препаратов. Эта особенность не была отмечена лишь в одном из исследований [232].
Фасцикуляция мышц редко развивается у новорожденных и младенцев после внутривенного введения им сукцинилхолина в дозе 1—2 мг/кг. Возможно, это связано с разведением препарата в относительно большем объеме внеклеточной жидкости у них, а также с малой мышечной массой. Возникшая под влиянием сукцинилхолина фасцикуляция мышц и повышение давления в желудке устраняются при назначении алфента-нила в дозе 50 мкг/кг [234].
Сукцинилхолин может оказывать побочное действие на организм ребенка. Так, Ryan и соавт. [235] отметили нарастание уровня миоглобина в плазме крови у 60 % детей препубертатного возраста после внутривенного введения им сукцинилхолина в дозе 1—2 мг/кг. Видимая фасцикуляция мышц при этом отсутствовала. Отмеченные сдвиги могли отражать повышение исходного напряжения мышц, прослеженное под влиянием галотана и сукцинилхолина в условиях эксперимента in vitro. Концентрация миоглобина в сыворотке не увеличивается в пубертатном возрасте.
Нарастание уровня креатининфосфокиназы, показателя повреждения мышечной ткани, отмечено после введения сукцинилхолина у 75 % па-
циентов вне зависимости от возраста. Боли в мышцах имели место у 46 % из них даже в отсутствие фасциляции. Саму фасциляцию мышц изредка наблюдали у детей после внутримышечного введения или при продолжительной инфузии сукцинилхолина. Внутривенное болюсное введение этого препарата могло спровоцировать бра-дикардию, а при повторном его назначении эти состояния наблюдались особенно часто. При наркозе галотаном приступы брадикардии развивались чаще, чем при наркозе изофлураном. Атропин в дозе 0,03 мг/кг предотвращал развитие брадикардии [236].
Уровень калия в сыворотке крови после внутривенного введения сукцинилхолина в норме превышает 0,5 мг-экв/л [237]. У ожоговых больных это повышение еще более выражено и может создавать предпосылки для остановки сердца [238]. Содержание калия также возрастает при назначении сукцинилхолина больным с обширными травмами мышц, столбняком и поражением верхних или нижних двигательных нейронов [239]. Подобное возрастание чувствительности к сукцинилхолину возникает через 5—15 дней после травмы, сохраняясь в течение 2—3 мес у больных с ожогами и травмами и 3—6 мес — при нейромоторных поражениях. Миорелаксацию у таких пациентов следует проводить недеполяри-зующими препаратами, а не сукцинилхолином. Назначение малых доз недеполяризующих мио-релаксантов перед введением сукцинилхолина отнюдь не гарантирует от повышения уровня калия в крови.
Сукцинилхолин у пациентов с аномалиями мышц (например, миодистрофия Дюшенна) может спровоцировать остановку сердца из-за массивного сокращения измененных мышц [240]. Концентрация креатининфосфокиназы (СРК) при этом иногда возрастает до 17 850 ЕД/л. Повышенный уровень СРК у таких пациентов может сохраняться даже при хорошем самочувствии. Lavach и соавт. [241] также отмечали, что у маленьких мальчиков, выглядящих вполне нормальными, может наступать остановка сердца после назначения ацетилхолина, если они страдали системным заболеванием мышц.
Назначение сукцинилхолина способно вызывать спазм жевательной мышцы (затрудненное открывание рта), что считалось признаком повышенной предрасположенности к злокачественной гипертермии [242, 243]. Последние исследования опровергли существование подобной зависимости. Van Der Spek и соавт. [244] показали, что спровоцированное сукцинилхолином напряжение жевательных мышц и затрудненное открывание рта не связаны с опасностью злокачественной гипертермии. Точно так же Carroll, обследовавший 1468 оперированных детей, наблюдал
46 Анестезия в педиатрии
 учащение
спазма жевательных мышц, имеющее место
при наркозе галотаном и сукцинилхоли-ном,
но не сопровождающееся повышением
частоты злокачественной гипертермии
[245\.
Спазм
жевательной мышцы отмечается у 2,8 %
детей с косоглазием
и всего у 1,02 % обычных детей. Повышение
СРК также не связано со злокачественной
гипертермией.
учащение
спазма жевательных мышц, имеющее место
при наркозе галотаном и сукцинилхоли-ном,
но не сопровождающееся повышением
частоты злокачественной гипертермии
[245\.
Спазм
жевательной мышцы отмечается у 2,8 %
детей с косоглазием
и всего у 1,02 % обычных детей. Повышение
СРК также не связано со злокачественной
гипертермией.
Наблюдения Van Der Spek и соавт. [244\ не совпадают с результатами исследований Rosenberg и Fletcher [246], отметившими у 50 % пациентов со спазмом жевательных мышц положительную реакцию на кофеиновый сократительный тест, указывающий на предрасположенность к злокачественной гипертермии. Повышение уровня СРК установлено-у всех 52 обследованных последними авторами пациентов. Однако повышенное содержание СРК имело место всего у 6 из 30 пациентов, рассматриваемых как наиболее предрасположенных к злокачественной гипертермии. Оценка значимости возможной корреляции между спазмом жевательных мышц и предрасположенностью к злокачественной гипертермии позволила считать, что спазм может иметь место у больных при развитии злокачественной гипертермии, но он редко указывает на возможность развития этого заболевания. Последние исследования Meaken и соавт. [247\ продемонстрировали необходимость использования более высоких доз сукцинилхолина у младенцев для быстрого наступления миорелаксации. Можно полагать, что спазм жевательных мышц у них был связан с неадекватной дозировкой сукцинилхолина, которая у младенцев и детей младшего возраста должна равняться 3 мг/кг, а не 2 мг/кг, как считалось ранее.
Сукцинилхолин повышает глубину наркоза у детей \248\. В то же время кураре в дозе 80 мкг/кг, назначенный за 1 мин до вводного наркоза, заметно снижает сонливость перед введением тио-пентала (у 2,8 % пациентов, получивших кураре, и у 16,8 %, не получивших его).
Барбитураты
Барбитураты обычно назначают больным детям как средство премедикации, вводного наркоза, а также для устранения судорог. Абсорбция большинства препаратов данной группы происходит быстро и в полном объеме. Выделение препаратов почками играет относительно небольшую роль по крайней мере в отношении препаратов, не подвергшихся метаболизму. Доза тиопентала при его внутривенном введении детям ранее определялась как 1—2 мг/кг. Эти рекомендации были пересмотрены после работ Cote и соавт. [249\, отметивших сохранение моргательного рефлекса (рефлекса с век) и возбуждение при на-
кладывании маски у всех детей, получивших тио-пентал в дозе не более 2 мг/кг. Лишь доза в 6 мг/кг устраняет моргательный рефлекс у всех детей в возрасте от 5 до 15 лет. При этом роговичный рефлекс подавляется лишь у 62,5 % детей. При дозе тиопентала 5 мг/кг у всех детей пропадает реакция возбуждения во время накладывания маски.
Подобные же данные были приведены Brett и Fisher [250\ в отношении детей от 1 мес до 5 лет. Таким образом, дозировки тиопентала, необходимые для устранения нежелательных реакций у детей младшего возраста, должны быть такими же, как и у взрослых [251].
Время полувыведения тиопентала у детей вдвое меньше^ чем у взрослых (6 ± 3 и 12 ± 6 ч соответственно), в то время как величины клиренса препарата из плазмы оказываются, напротив, вдвое больше, чем у взрослых (6,6 ± 2,2 и 3,1 ± 0,5 мл/кг/мин) [252]. При этом между возрастными группами не отмечено различий в показателях Vdss и в величинах объема центрального компонента. Около 13 % препарата оставалось несвязанным в обеих возрастных группах.
Дети с ожогами более 9 % поверхности тела нуждались в более высоких дозировках тиопентала для вводного наркоза, чем обычные пациенты того же возраста [24Щ. Подобное различие было связано с развитием резистентности к препарату. Даже спустя 1 год после ожогов детям в возрасте от 6 до 16 лет требовалось вводить значительно более высокие дозировки тиопентала для подавления моргательного и рого-вичного рефлексов. Лишь у 50 % таких детей наложение маски проходило спокойно после введения тиопентала в дозе 8 мг/кг, в то время как остальным пациентам было вполне достаточно дозы 6 мг/кг. Даже подобные "повышенные" дозы тиопентала не вызывали у ожоговых больных реакции со стороны сердечного ритма или артериального давления.
До сих пор не получены объяснения столь значительных различий в требующихся дозировках тиопентала у ожоговых больных, однако можно предполагать повышенную инактивацию препарата в сыворотках таких пациентов.
Тиопентал в дозе 10,3 ± 0,9 мг/кг не нарушает функцию сердца и не влияет на величину сердечного выброса [253]. Не происходит изменений частоты сердечного ритма и артериального давления. Назначение пентотала в дозе 6 мг/кг новорожденным при интубации трахеи в отделении реанимации сопровождается усилением сердечного ритма без изменения показателей артериального давления [254]. В действительности сердечный ритм и артериальное давление остаются более близкими к норме, чем это имеет место, если интубацию производят без седации.
Фармакология 47

Domek и соавт. [257\ обнаружили более высокое содержание пентобарбитала в мозге новорожденных котят по сравнению со взрослыми кошками. При этом отмечена обратная зависимость между проникновением препарата в мозг и степенью миелинизации нервов. Время полувыведения амобарбитала из плазмы новорожденных примерно в 2,5 раза длиннее, чем у взрослых, по-видимому, из-за слабой способности новорожденных к метаболизму и конъюгированию препарата. Содержание ферментов, обеспечивающих эти превращения амобарбитала, резко снижено у новорожденных, но возрастает к концу 1-го месяца жизни в 10—30 раз [258\. Под влиянием фенобарбитала или бензопирена этот процесс еще более потенцируется. Активность микросомаль-ных ферментов и печеночный метаболизм пентобарбитала весьма низкие у новорожденных крыс, но достигают уровня, характерного для взрослых, уже к концу 1-го месяца жизни [259]. Кривые величины реакции в зависимости от дозировки барбитуратов оказываются параллельными у новорожденных и взрослых, но у новорожденных они смещены влево, что указывает на более высокую чувствительность к препаратам в этом возрасте. Концентрации барбитуратов, вызывающие сон, пробуждение, атаксию и гибель, у новорожденных значительно ниже, чем у взрослых животных. Печеночный метаболизм фенобарбитала
у новорожденных составляет всего 10 % этой величины у взрослых. Различия в продолжительности сна и в количестве препарата, накапливающегося в мозге новорожденных, вероятно, объясняются более высоким содержанием воды в их мозге (89 против 78 %), а также разными соотношениями между глиальными клетками и нейронами (1:1 у новорожденных против 2:1 у взрослых животных). Если допустить равномерное распределение препарата между этими двумя типами клеток, то в нейронах взрослых животных будет накапливаться меньше барбитуратов, чем у новорожденных.
Onishi и соавт. [260] изучали содержание фенобарбитала в сыворотке и в органах погибших детей (недоношенные, доношенные новорожденные и дети) при аутопсии. Соотношение концентраций препарата в мозге и сыворотке у них было от 0,82 до 0,95, в то время как в печени, легких, почках и селезенке оно всегда было выше 1,0.
Gal и соавт. [261] отметили существенные различия в фармакокинетике фенобарбитала у младенцев с показателями по шкале Апгар 3 и менее через 1—5 мин после рождения, у младенцев при остановке сердца или при состоянии апноэ, длящемся более 1 мин и требующим вентиляционной поддержки, по сравнению с младенцами, у которых РаО2 было 30 мм рт.ст. или ниже (F,o2=l,0). При этом две выделенные группы не отличались по величине Vd, варьировавшейся от 0,66 до 1,22 л/кг. У новорожденных без асфиксии вымывалось на 60 % меньше фенобарбитала (4,1 + 1,0 против 8,7 ±3,9 мг/кг/мин). Во время гипотермии у младенцев величины Vd повышались на 30—40 % по сравнению с состоянием нормотермии [212]. Сроки полувыведения препарата увеличивались, метаболизм нарушался и экскретировалось вдвое больше неизмененного фенобарбитала. В то же время содержание метаболитов этого препарата (гидроксифенобарбита-ла, конъюгированного гидроксифенобарбитала и ЛГ-гликозида фенобарбитала) снижалось вдвое по сравнению с детьми в состоянии нормотермии. Восстановление нормальной температуры тела сопровождалось повышением концентрации препарата в сыворотке до максимального уровня. Снижение скорости экскреции фенобарбитала во время гипотермии в определенной степени было обусловлено одновременным назначением фуро-семида (Лазикса).
Пропофол (Диприван)
Пропофол представляет собой 2,6-диизопропил-фенол. Из-за плохой растворимости в воде его растворяют в смеси соевого масла, лецитина и глицерина. Величина его рН варьируется от 7,0 до 8,5. В связи с неполным анестезирующим дей-
48 Анестезия в педиатрии
ствием пропофол обычно назначают в сочетании с другими парентерально или ингаляционно вводимыми анестетиками. В распределении пропо-фола выделяют три фазы [263]. Фаза I соответствует быстрому распределению препарата и продолжается 2—3 мин. Фаза II характеризуется выраженным клиренсом препарата и длится от 34 до 56 мин. Последняя III фаза — клиренс препарата из плохо перфузируемых тканей — занимает от 184 до 480 мин. Более 70 % препарата выводится в фазах I и II и преимущественно печенью, где происходят процессы конъюгирования препарата с его глюкуронизацией и сульфонацией. Глюкуронизация может быть слабо выражена в периоде новорожденности, но это компенсируется усилением сульфонации. Дозировка пропофо-ла, необходимая для вводного наркоза, возрастает у детей младшего возраста, вероятно, в связи с увеличением объема распределения препарата. Величина Vdss достигает 0,0394 л/кг/мин, а концентрация в сыворотке ко времени пробуждения — 2,3 мкг/мл [264\.
Вводный наркоз обеспечивается у 95 % пациентов при введении пропофола в дозе 2,4 мг/кг. По мере взросления эта дозировка снижается до 1,5 мг/кг. Апноэ может развиваться преимущественно у пациентов более старшего возраста и при введении повышенных дозировок пропофола. Пропофол редуцирует минутную вентиляцию в большей степени, чем галотан [265\. Имеет место уменьшение торакального объема без изменения абдоминального объема, что позволяет объяснить снижение функционального остаточного объема дыхания [266], Поддерживающая дозировка у лиц молодого возраста колеблется от 50 до 200 мкг/кг/мин. Пробуждение от наркоза происходит быстрее у детей, анестезированных пропо-фолом в дозе 3 мг/кг, чем при наркозе тиопента-лом в дозе 5 мг/кг [267]. Подобно другим анестетикам, пропофол способствует снижению артериального давления [268]. Это снижение артериального давления происходит примерно на 30 % и наблюдается уже через 5 мин после назначения пропофола. Одновременно отмечается урежение частоты сердечных сокращений примерно на 20 %. У поросят частота сердечных сокращений и конечное диастолическое давление в левом желудочке остаются такими же, как в контроле. Максимальные и минимальные показатели dp/dt незначительно снижаются. Показатели функции правого желудочка остаются такими же, как в контрольной группе. Рвота в первые 24 ч после операции при анестезии пропофолом отмечается значительно реже, чем после наркоза ингаляционными препаратами [269]. В то же время сроки проведения трахеальной интубации, восстановление после наркоза и послеоперационные боли остаются одинаковыми при обоих методах наркоза.
Продолжительные инфузии пропофола применяют с целью седативного эффекта пациентов в отделениях интенсивной терапии. Однако при этом у отдельных пациентов могут развиваться не поддающиеся объяснению метаболический ацидоз и сердечная недостаточность, иногда приводящие к летальному исходу [270]. Не исключено развитие неврологических осложнений после продолжительных инфузий пропофола [271]. У некоторых пациентов после анестезии пропофолом возникает мышечная дрожь, наблюдающаяся также и после применения других анестетиков [272].
Наркотики
Морфин и меперидин
Наркотики часто применяются у детей для устранения боли, для седации и наркоза. Новорожденные и младенцы реагируют на введение наркотиков по-иному, чем взрослые. Так, в ЦНС молодых животных накапливается в 2—4 раза больше морфина, чем в ЦНС взрослых, хотя концентрация этого препарата в плазме крови остается одинаковой [273]. Вероятно, это связано с "дефектностью" гематоэнцефалического барьера у новорожденных.
Морфин абсорбируется из мест подкожного его введения у .молодых крыс быстрее, чем у более старых. Меперидин появляется в крови еще не родившихся ягнят уже через 2 мин после внутривенного введения этого препарата матери [274] и поэтому задерживается в мозговой ткани плода более короткое время. Равновесие концентраций препарата в организмах матери и плода наступает лишь через 20—25 мин после инъекций мепередина матери.
Новорожденные дети в течение первых 2 дней жизни экскретируют с мочой мепередин в большем количестве, чем нормепередин [275]. К 3-му дню после рождения это соотношение изменяется, что указывает на развитие способности к N-деметилированию мепередина новорожденными, происходящему не столь эффективно, как у взрослых. Кинетика морфина у оперируемых детей от 0 до 15 лет не зависит от возраста [276]. Однако соответствующие сведения были получены у детей старше 1 мес, при этом все возрастные группы анализировались совместно, что могло замаскировать существующие различия. По данным авторов, показатель Ь/р был равен 133 мин, а скорость клиренса — 6,2—6,7 мл/мин/кг. Чувство боли возникало при падении концентрации меперидина в плазме ниже 65 нг/мл.
Когеп и соавт. [277] отметили существенные различия фармакокинетики сульфата морфина у новорожденных и детей более старшего возраста
при продолжительных инфузиях препарата в дозе от 6,2 до 40 мкг/кг/ч. Концентрация препарата в крови новорожденных была в 3 раза выше, чем у детей более старшего возраста. У многих детей судороги развивались при дозировке морфина от 18,2 до 24 мкг/кг/ч. Время полувыведения морфина у новорожденных было гораздо более длительным (13,9 ± 6,4 ч), чем у более старших детей и у взрослых (около 2 ч). В некоторых случаях концентрация морфина в крови возрастала уже после прекращения его инфузии, что позволяло предполагать внутрипеченочную циркуляцию препарата. Высокая активность р-глюкуро-нидазы в кишечнике новорожденных позволяет предполагать процессы гидролиза морфинглюко-ронида с последующей реабсорбцией морфина. Подобная реабсорбция морфина и высокая концентрация его в сыворотке указывают на необходимость особо повышенного внимания при продолжительной инфузии этого препарата младенцам, находящихся на спонтанном дыхании.
Сроки полувыведения морфина из сыворотки у детей от 2 до 15 лет [278\ значительно короче, чем у новорожденных [277\. Ускорение клиренса препарата в молодом возрасте следует объяснять относительным увеличением у них размеров печени, а также повышением активности микросом печеночных клеток (Р450) [279].
Морфин и меперидин подавляют реакцию дыхательного центра на СО2 у новорожденных заметно сильнее, чем у взрослых. Эти препараты изменяют как ориентиры, так и сам ход реакции на СО2, в результате чего повышаются показатели Расо2 в покое и ослабевают вентиляционные реакции на избыточные концентрации СО2. Различия в реакции на морфин и на меперидин частично обусловлены разной растворимостью этих препаратов и соответственно разным накоплением их в ЦНС. Морфин как лучше растворимый препарат в большем количестве накапливается в тканях мозга, что объясняет и меньшую его LD50 у молодых животных. У детей более старшего возраста морфин подавляет реакцию дыхательного центра на СО2 в такой же степени, как и общая анестезия. Однако угнетающее действие морфина на дыхание бывает более продолжительным.
Морфин часто использовался для седации у младенцев, нуждающихся в механической вентиляции. Это не оказывало какого-либо неблагоприятного влияния на интеллект, двигательную функцию и на поведение детей, обследованных в возрасте 5—6 лет [280].
Бупренорфин
Бупренорфин (Бупренекс) является анальгетиком сильного и продолжительного действия, его назначают перорально или сублингвально для обез-
Фармакология 49
боливания в послеоперационном периоде [281]. Продолжительность действия вдвое больше, чем у морфина. Однако тошнота и рвота также наблюдаются в 2 раза чаще (28 против 16 %).
Метадон
Метадон относится к наркотикам продолжительного действия, его обычно используют при лечении наркомании. В последнее время его применяют и для устранения послеоперационной боли [282]. Введение метадона в дозе 0,2 мг/кг во время операции устраняет послеоперационные боли на 6—9 ч. Благодаря этому потребность в наркотиках для обезболивания оказывается ниже, чем при использовании морфина в соответствующих дозировках. Вводный наркоз при использовании метадона (0,08 мг/кг) в сочетании с тримепрази-ном (1 мг/кг) и дроперидолом (0,15 мг/кг) наступает быстрее и требует меньших количеств тио-пентала [283]. Метадон успешно используется для лечения пациентов с хронической болью [284]. Важным является то обстоятельство, что использование этого препарата снижает общее количество наркотиков, необходимых для наилучшего устранения боли. Назначение метадона в дозе 0,1 мг/кг после офтальмологических операций сопровождалось более частым развитием небольшой гиперкапнии и незначительным снижением насыщения крови кислородом [285]. Berde и соавт. [286] не наблюдали серьезных осложнений при назначении метадона в дозе 0,2 мг/кг детям в возрасте 3—7 лет, нуждающимся в обезболивании после операций.
Фентанил
Фентанил (Инновар, Сублимаз) является сильнодействующим синтетическим наркотиком, широко применяемым при анестезии у младенцев и детей. Эффективная (или MAC) доза препарата у взрослых крыс равна 52 ± 7 мкг/кг [287]. Предварительное введение фенобарбитала повышает MAC примерно на 50 %. Пониженные концентрации меперидина не производят достаточного анестезирующего эффекта [288], но в сочетании с закисью азота они устраняют тахикардию и повышение артериального давления во время операции. Метаболизм фентанила осуществляется преимущественно в печени путем реакций JV-деалкилирования и гидроксили-рования. Только 6 % препарата выводится почками.
Концентрация фентанила в сыворотке младенцев остается ниже, чем у детей и взрослых, даже после введения более высоких доз препарата [289]. Примерно у половины младенцев регистрируется второй пик повышения концентрации
50 Анестезия в педиатрии
 фентанила.
Подобные особенности фармакоки-нетики
фентанила у доношенных и недоношенных
новорожденных были установлены Koehntop
и
соавт. [290\.
Тем
не менее вариации показателей
фармакокинетики весьма значительны.
Время
полувыведения, показатели общего
клиренса, Vd,
Vdss
у детей всех возрастных групп значительно
выше, чем у взрослых. Относительное
снижение
начальной концентрации и "плато"
обусловлено более высокими
первоначальными величинами
Vd
и V^.
Последний показатель указывает на
удлинение сроков полувыведения фентанила
у новорожденных.
Повышение внутрибрюшного давления
замедляет элиминацию фентанила в 1,5—3
раза, что связано с нарушениями кровотока
в печени, снижением сердечного выброса
и ухудшением
кровоснабжения всех органов брюшной
полости, а также нижних конечностей
[291,
292].
фентанила.
Подобные особенности фармакоки-нетики
фентанила у доношенных и недоношенных
новорожденных были установлены Koehntop
и
соавт. [290\.
Тем
не менее вариации показателей
фармакокинетики весьма значительны.
Время
полувыведения, показатели общего
клиренса, Vd,
Vdss
у детей всех возрастных групп значительно
выше, чем у взрослых. Относительное
снижение
начальной концентрации и "плато"
обусловлено более высокими
первоначальными величинами
Vd
и V^.
Последний показатель указывает на
удлинение сроков полувыведения фентанила
у новорожденных.
Повышение внутрибрюшного давления
замедляет элиминацию фентанила в 1,5—3
раза, что связано с нарушениями кровотока
в печени, снижением сердечного выброса
и ухудшением
кровоснабжения всех органов брюшной
полости, а также нижних конечностей
[291,
292].
Действие фентанила изучалось у младенцев и детей с цианозом [294\ и без него [293]. У младенцев с цианозом фентанил в дозе 75 мкг/кг в сочетании с диазепамом в дозе 0,4 мг/кг несколько снижал частоту сердечных сокращений, но не изменял концентрацию катехоламинов в плазме крови. После его введения не повышалось артериальное и центральное венозное давление во время интубации или при кожном разрезе. В противоположность этому при назначении изофлюрана отмечались тахикардия и повышение концентрации эпинефрина при стабильных артериальном и центральном венозном давлении. Комбинация фентанила с диазепамом в большей степени обеспечивала стабильность сердечно-сосудистой системы, чем один фентанил (SOTS мкг/кг) [295] или фентанил (30 мкг/кг) в сочетании с 50 % закисью азота [296].
Кинетика фентанила у младенцев и детей с врожденными цианотическими пороками сердца характеризовалась рядом особенностей. Величина Vd у больных с тетрадой Фалло повышалась с возрастом [294]. Клиренс препарата был наиболее высоким у младенцев и снижался по мере взросления. Нарастание РаО2 находилось в обратной зависимости от величин Vdss, Более быстрое полувыведение фентанила у новорожденных было следствием более низких (в 2—3 раза меньших) величин Vdss у них. Клиренс фентанила у новорожденных с тетрадой Фалло был выше, чем у больных более старшего возраста. Показатели Vd на стабильной фазе, клиренс и сроки полувыведения у более старших больных с тетрадой Фалло также были выше, чем у взрослых. Инфу-зии фентанила предотвращали нарастание сопротивления в сосудах легких и увеличение артериального давления, обычно возникающие при стрессе у новорожденных в состоянии нормок-сии [297].
Время полувыведения фентанила у недоношенных новорожденных удлинено (6—32 ч, в среднем 17,7 ± 0,3 ч) по сравнению с детьми более старшего возраста (4—7 ч) [297\. Сообщалось о повышенной ригидности стенок грудной клетки у недоношенных новорожденных, матерям которых назначали фентанил.
Фентанил оказывает выраженное действие как на прессорные, так и на депрессорные бароре-цепторные реакции у новорожденных [298\, не изменяя при этом частоту сердечных сокращений и артериальное давление в состоянии покоя. Ход обеих кривых под влиянием фентанила смещается влево и несколько снижается, что отражает влияние препарата на ЦНС с сохранением исходного соотношения между тонусом симпатической и парасимпатической нервной системы. Под влиянием фентанила существенно снижается эластичность легочной ткани и грудной клетки у детей [299], однако этот эффект можно устранить при миорелаксации.
Фентанил часто применяют в виде продолжительных инфузий при лечении больных в отделениях интенсивной терапии. Устойчивость к действию этого препарата быстро возрастает, что вынуждает повышать его дозировку для достижения того же уровня седации или обезболивания [300]. Кроме того, длительное назначение фентанила приводит в последующем к развитию абстинентного синдрома [30Д.
Фентанилцитрат для перорального приема (OTFC), проникающий через слизистые оболочки, применяют для предоперационного седатив-ного эффекта у детей [302]. Выраженный седа-тивный эффект наступает через 40 или 20 мин после приема препарата в дозах 10—15 или 15— 20 мкг/кг соответственно. Пробуждение наступает в те же сроки, что и у контрольных пациентов, но у получивших фентанил пациентов чаще отмечаются рвота и зуд, затруднен прием жидкости в послеоперационном периоде. Подобные результаты были получены и в другом исследовании [303]. Кроме того, в послеоперационном периоде отмечается более выраженное подавление дыхания и снижение кислородного насыщения крови. Особое значение имеет высокая частота рвоты в пред- и послеоперационном периоде, наблюдающейся у 30—85 % пациентов при данном пути введения препарата.
Фентанил можно также назначать чрескожно. Для достижения пика концентрации препарата в плазме крови требуется 18—66 ч [304]. Клиренс и объем распределения фентанила, назначенного чрескожно одинаковы у детей и взрослых. Одной из проблем при подобном пути назначения препарата остается высокая частота рвоты (до 85 %) [305]. Помимо этого, обычным спутником являются сонливость и снижение уровня кислорода в
Фармакология 51
крови. Поэтому при чрескожном введении фен-танила младенцам и детям необходим строгий мониторинг за ними.
Суфентанил
Суфентанил (Суфента) — синтетический наркотик, обладающий активностью, в 5—10 раз большей, чем у фентанила, и применяемый для анестезии как изолированно, так и в сочетании с другими препаратами. Время полувыведения суфентанила у детей от 2 до 8 лет равно 97 ± 30 мин, а Vdss в 1,5 раза выше, чем у взрослых, в расчете на массу тела, но оказывается одинаковым в расчете на относительную величину поверхности тела. Клиренс вдвое отличается от соответствующих показателей у взрослых [307\. Показатели клиренса суфентанила, Vdss, ti/2P у новорожденных больше, чем у детей и взрослых [306]. Значительные вариации этих показателей могут быть обусловлены различиями в объеме внеклеточной жидкости. По мере взросления возрастают величины клиренса и Vdss, в то время как ti/2P снижается. По предположению, высказанному Greeley и соавт. [307], сниженная чувствительность новорожденных к суфентанилу связана с дополнительной анестезией из-за повышенного уровня препарата в сыворотке крови.
Премедикация суфентанилом, проводимая ин-траназально, эффективно устраняет состояние возбуждения у младенцев и детей [308\. Чаще всего этот метод используют при операциях на сердце [309, 310]. Если суфентанил в дозе 10— 20 мкг/кг применяют как единственное средство вводного наркоза, то во время интубации трахеи и при кожном разрезе отмечается выраженное повышение систолического и диастолического артериального давления [309]. Частота сердечных сокращений при этом возрастает у пациентов, получивших суфентанил в дозе 5—10 мкг/кг, но снижается при введении в дозе 20 мкг/кг. При назначении суфентанила в дозе 20 мкг/кг удлиняется период кардиального цикла предвыброса крови, а также соотношение между длительностью этого периода и сроком выброса крови левым желудочком. Эти сдвиги указывают на некоторое отрицательное инотропное действие суфентанила. Концентрация эпинефрина в сыворотке у детей, получивших суфентанил в дозе 20 мкг/кг, оказывается ниже, чем при дозах 5— 10 мкг/кг.
После введения суфентанила по 5—10 мкг/кг детям перед операцией на сердце отмечается небольшое снижение частоты сердечных сокращений и артериального давления во время вводного наркоза. Эти показатели вновь возрастают при интубации трахеи [310]. Незначительное увеличение артериального давления происходит во время
стернотомии. В противоположность этому при введении суфентанила в дозах 50—75 мкг/кг систолическое давление во время стернотомии возрастает на 20 %. Различия могут объясняться более быстрым полувыведением препарата (время полувыведения суфентанила у младенцев и детей равно соответственно 53±15и55±10 мин), а величина Vd у младенцев вдвое меньше, чем у других пациентов. Обе эти особенности сокращают продолжительность анестезии. Глубокая гипотермия не влияет на фармакокинетику суфентанила у новорожденных.
Суфентанил в дозах 0,5, 1,0 и 1,5 мкг/кг применяют при ортопедических операциях как дополнение к наркозу галотаном/закисью азота [311]. При каждой из трех указанных дозировок удается предотвратить тахикардию и повышение артериального давления во время интубации трахеи, а также обеспечить лучшее обезболивание в послеоперационном периоде. Однако при дозах 1,0 и 1,5 мкг/кг могут наблюдаться брадикардия и гипотензия во время вводного наркоза, а также более частая рвота после операции.
Интраназальное введение суфентанила в дозе 1,5, 3,0 и 4,5 мкг/кг применялось для премедика-ции у детей, включая младенцев [312\. При этом больные, вероятно, должны были легче расставаться с родителями, без нервного возбуждения и не кашлять во время интубации трахеи. Тем не менее у 25 % больных, получавших 4,5 мкг/кг препарата, уменьшилось изменение объема легких при колебаниях давления и наблюдалась более частая рвота в первые 24 ч после операции.
Обезболивание после эпидурального введения суфентанила в дозе 0,75 мкг/кг наступает уже через 3,0 ± 0,3 мин [310]. У 33 % таких пациентов развивается рвота через 60—120 мин после подобной инъекции. Наряду с этим суфентанил не вызывает смещений кривой реактивности на СО2 и снижение минутной вентиляции сверх тех изменений, которые возникают при наркозе изо-флураном/закисью азота. Эти сдвиги нормализуются обычно через 120 мин. Более медленная нормализация кривой реакции на СО2 и минутной вентиляции до уровня преданестезионных показателей может указывать на ростральное распространение препарата с током цереброспинальной жидкости или по ходу премедуллярных сосудистых путей [313].
Алфентанил
Алфентанил (Алфента) является весьма мощным синтетическим наркотиком, обладающим быстрым и непродолжительным действием [314]. Благодаря своему относительно небольшому Vd (1,03 + 0,71 л/кг) и более быстрому клиренсу из плазмы время его полувыведения у
3-998
52 Анестезия в педиатрии
новорожденных и младенцев примерно на 30 % меньше, чем у взрослых [315\. Величины Vd у детей и взрослых одинаковые. Краткосрочность действия алфентанила делает его особенно удобным при непродолжительных хирургических вмешательствах, а также определяет его пригодность для длительных инфузий [316\. Свободная фракция препарата остается одинаковой у детей и взрослых (0,82 ±0,30 и 1,03 ± 0,71 л/кг соответственно). До настоящего времени отсутствуют сведения об эффективности действия непрерывных инфузий алфентанила у новорожденных. Экстраполируя имеющиеся сведения относительно фентанила и суфента-нила, можно предполагать, что концентрация алфентанила в плазме крови новорожденных будет выше, а клиренс его будет проходить быстрее. У недоношенных новорожденных объем распределения препарата выше (1,0 л/кг), чем у детей и у взрослых (0,48 л/кг). Клиренс препарата у недоношенных происходит медленнее (2,2 против 5,6 мл/кг/мин), а время полувыведения соответственно выше (525 против 60 мин). Подобные же показатели получены у недоношенных новорожденных, находящихся на механической вентиляции [317\. Алфентанил в бо-люсной дозе 20 мкг/кг приводит к снижению артериального давления на 20 % и к значительному замедлению частоты сердечного ритма [318]. Если же препарат вводится длительно (более 30 мин), то не происходит изменений ни артериального давления, ни сердечного ритма [319]. Ригидность мышц развивалась у 65 % новорожденных, которым алфентанил в дозах 9— 15 мкг/кг вводился длительнее 1 мин [318\. Конвульсии, вызвавшие нарушения вентиляции и оксигенации, описаны у четырех младенцев [320\.
Ремифентанил
Ремифентанил представляет собой синтетический наркотик с очень быстро наступающим и быстро прекращающимся действием. Его влияние на новорожденных, младенцев и детей изучено недостаточно. Быстрое прекращение действия препарата делает необходимым разработку плана послеоперационного обезболивания больных после пробуждения от наркоза. Боли после операции можно устранять с помощью проводниковой анестезии, что позволяет быстро выводить пациентов из наркоза [321]. Доза ремифентанила 0,25 мкг/кг в сочетании с галотаном или сево-флураном обеспечивает адекватное обезболивание при тонзиллэктомии. Экстубация трахеи может быть проведена раньше, но дети испытывают после операции сильные боли. Поэтому не следует форсировать перевод ребенка из послеопе-
рационной палаты. По данным одного из исследований, у 10 % пациентов было необходимо назначение эфедрина для восстановления артериального давления до нормального уровня [322].
Бензодиазепины
Все бензодиазепины обладают одинаковым по качественным характеристикам действием. Оно заключается в седации, погружении в гипнотическое состояние, устранении возбуждения, судорог и в антеградной амнезии. Бензодиазепины потенцируют нейроингибицию, опосредуемую у-аминобутириковой кислотой (GABА). Выделяют два типа бензодиазепиновых рецепторов: тип I и тип II. Относительное распределение этих рецепторов изменяется по мере развития. Рецепторы типа II преобладают у плода 27 нед, а рецепторы типа I — у доношенного плода. Оба типа рецепторов представлены одинаково в глазу взрослого человека.
Диазепам
Диазепам (Валиум) обычно применяют с целью премедикации перед операцией и диагностическими вмешательствами, а также для устранения судорог. Метаболизм препарата в организме осуществляется путем гидроксилирования и димети-лирования. Оба этих процесса редуцированы у новорожденных [66], что удлиняет сроки его полувыведения. Фенобарбитал усиливает эти процессы метаболизма и соответственно сокращает сроки полувыведения препарата из организма новорожденных 31 ± 2 ч, а также детей (18 ± 3 ч). Более длительные сроки полувыведения диазепа-ма из организма новорожденных могут отразиться на уровне наркоза, даже если препарат назначали за несколько часов до начала вводного наркоза.
Аналогичная закономерность прослежена в отношении концентрации диазепама в плазме крови и мозге крыс 6- и 18-месячного возраста [323]. Однако у более старших крыс показатель ti/2P был короче и клиренс протекал быстрее.
Мидазолам
Мидазолам (Версед) относится к бензодиазепи-нам короткого действия и применяется как для премедикации, так и для вводного и поддерживающего наркоза. Подобно другим бензодиазе-пинам, мидазолам обладает успокаивающим, гипнотическим и противосудорожным действием. Он в 3—4 раза эффективнее диазепама и вызывает антероградную амнезию. Благодаря хорошей растворимости в воде препарат не оказывает местного раздражающего влияния при внутри-
мышечном или внутривенном введении. Препарат можно смешивать и вводить в одном шприце с морфином, меперидином, атропином или ско-поламином. Кроме того, столь же хорошая растворимость в липидах при физиологическом уровне рН позволяет мидазоламу быстро преодолевать гематоэнцефалический барьер и оказывать быстрое действие. Мидазолам быстро метаболи-зируется в печени, в основном путем микросо-мальной оксидации [324]. Около 97 % препарата связываются с белками плазмы; этот показатель не зависит от введенной дозы мидазолама [325].
Мидазолам (0,15 мг/кг) и диазепам (0,3 мг/кг) оказывают одинаковое по силе воздействие на артериальное давление у детей при выполнении вводного наркоза [326]. По данным большинства исследований, мидазолам, примененный для премедикации, не влиял на артериальное давление, частоту пульса и дыхание [327].
Фармакокинетика мидазолама у детей в отличие от других бензодиазепинов зависит от введенной дозы препарата [330]. Повышение его дозы усиливает клиренс и одновременно изменяет ход кривой концентрации, увеличивая площадь ниже нее. Отсутствует корреляция между фарма-кокинетикой, возрастом и массой тела пациентов. Время полувыведения препарата несколько ниже у детей (1,24—1,72 ч), чем у взрослых (1,7— 4,0 ч). После интраназального введения мидазолама в дозе 1 мг/кг его концентрация в плазме крови быстро достигает пиковых величин (72 нг/мл) [331]. Спустя 10 мин концентрация препарата в плазме равна 57 % его количества, создающегося при внутривенном введении той же дозы мидазолама.
У младенцев и детей мидазолам используют как средство премедикации. Эффект при этом зависит от введенной дозы препарата. Дремота и сонливость отмечались у всех детей после внутримышечной инъекции [328], но при дозе препарата ниже 0,06 мг/кг это состояние проходит через 15 мин и ребенок плачет. При введении препарата в дозе 0,1 мг/кг сонливость удерживается в течение 45—60 мин. Дозы от 0,06 до 0,09 мг/кг вместо дремоты и сонливости создавали настроение эйфории у детей от 0 до 10 лет, у детей более старшего возраста эйфория отсутствовала. Гладкое проведение вводного наркоза обеспечивается мидазоламом в дозе 0,08 мг/кг. Однако, по данным одного исследования, адекватный предоперационный седативный эффект достигался только при введении препарата в дозе 0,8 мг/кг. Мидазолам снимает состояние возбуждения у детей до 5 лет лучше, чем в более старшем возрасте, превосходя в этом отношении морфин. Подобный же эффект у детей более старшего возраста удается получить лишь при сочетании мидазолама с морфином. Премедикация мидазоламом
Фармакология 53
обеспечивает гладкое проведение вводного наркоза лучше, чем морфин, особенно у детей от 1 года до 5 лет.
Taylor и соавт. [329] не отметили различий в эффективности действия мидазолама (0,2 мг/кг) с атропином (0,02 мг/кг) и папаверетума (0,4 мг/кг) с гиоспином (0,008 мг/кг) при введении препаратов за 30—60 мин до операции. Подавление состояния тревоги и возбуждения перед вводным наркозом было одинаковым в обеих группах. Около 75% пациентов бодрствовали и оставались спокойными. Премедикация мидазоламом обеспечивала гладкое проведение вводного наркоза у 78 % детей, а при использовании папаверетума это достигнуто у 89 % детей. Меньший показатель эффекта от мидазолама по сравнению с папаверетумом объяснялся стремлением избежать тошноты и рвоты в послеоперационном периоде. Антероградная амнезия при обследовании через 2 ч после операции была более выражена при использовании мидазолама.
Ректальное введение мидазолама является надежным способом премедикации, обеспечивающим достаточно выраженный седативный эффект и амнезию [332, 333]. Частота сердечных сокращений и артериальное давление одинаково реагировали на ректальное введение мидазолама в дозах 0,25 и 0,45 мг/кг, однако насыщение крови кислородом при введении более высоких доз препарата было несколько ниже [334]. Отсутствие эффекта при ректальном введении препарата в дозе 0,45 мг/кг имело место у 25 % пациентов [335]. Хороший седативный эффект достигался у всех больных при ректальном введении мидазолама в дозе свыше 1 мг/кг, но при этом больных приходилось задерживать на более длительные сроки в послеоперационной палате [336].
Интраназальное введение мидазолама с целью премедикации также дает хорошие результаты. При нем 63 % детей никак не реагируют на установку ушного оксиметра, 33 % сопротивляются и 4 % детей поддаются уговорам [337]. Приходится ожидать не более 10 мин после введения препарата, прежде чем оценивать реакцию ребенка. По клиническому опыту через 15—30 мин создаются наиболее благоприятные условия для проведения дальнейших манипуляций.
Пероральное назначение мидазолама получило широкое распространение при подготовке пациентов к операции. Выраженный седативный эффект у некоторых пациентов наступает после приема 0,5—0,75 % мг/кг мидазолама [338], но чаще наблюдается оглушенное состояние больных. Отделение ребенка от родителей проходит спокойно. Частота сердечных сокращений, артериальное давление и насыщение крови кислородом не изменяются у детей, получивших перо-рально мидазолам в дозах 0,5—0,75 мг/кг [339].
3'
54 Анестезия в педиатрии
При назначении мидазолама в дозах 0,75—1,0 мг/кг у детей нарушается равновесие, они утрачивают контроль над собой и/или отмечают неясность зрительных восприятий, а также дисфорию. Возбуждение полностью устраняется у 80—90 % пациентов.
Главной проблемой при пероральном назначении мидазолама является его горький вкус, который лишь частично удается замаскировать соком, шоколадным сиропом или подобными уловками. Новая лекарственная форма для назначения мидазолама через рот значительно улучшает его восприятие детьми. В большинстве случаев они принимают его охотно.
По данным Cole [326\, внутривенное введение мидазолама в дозе 0,15—0,30 мг/кг отключает сознание пациентов, получавших премедикацию папаверетумом и гиосцином. Жизненно важные показатели при этом остаются стабильными, дыхание почти не нарушается. По мнению автора, мидазолам в подобных условиях может применяться как средство вводного наркоза. Сочетание кетамина в дозе 3 мг/кг и мидазолама в дозе 0,5 мг/кг обеспечивает более хорошую премедикацию, чем любой из этих препаратов в отдельности [340\.
Кетамин
Кетамин (Кеталар, Кетаджект), относящийся к анестетикам группы циклогексиламина, оказывает быстро наступающее и непродолжительное действие. Побочные реакции при использовании кетамина наступают реже, чем при всех других препаратах анестезирующего действия [341]. Растворы препарата имеют слабокислую реакцию и содержат как d-, так и /-изомеры кетамина [342\. Деметилирование препарата приводит к формированию его метаболита I, а процессы дегидратации — метаболита II. Оба этих метаболита образуются в Р45о микросомах печеночных клеток. Сниженная активность ферментной системы Р450 у новорожденных, а также ослабленная способность к конъюгированию препаратов у них объясняют большую продолжительность кетамино-вого наркоза в этом возрасте.
Кетамин обладает определенным сходством с морфином [343]. Оба препарата связываются с ц-рецепторами, однако это связывание у кетамина происходит при его концентрации на один порядок выше, чем у морфина.
Waterman и Livingston [344] показали, что у крыс первой недели жизни кетамин вызывает более быстрое наступление наркоза и большую его продолжительность. На протяжении следующих 6 нед жизни сроки наступления наркоза возрастают, а его продолжительность уменьшается. Подобные же наблюдения были сделаны и у детей
[345, 346]. Продолжительность сна у самок крыс оказалась больше, чем у самцов такого же возраста, что можно было объяснить особенностями процессов метаболизма [344]. Описанные различия можно было связать с особенностями процессов оксидации. Подобные же половые различия были отмечены и в отношении гексобарбита-ла [347].
Проводились исследования фармакокинетики кетамина при его пероральном введении [348]. После внутримышечных инъекций биологическая активность препарата сохранялась в 93 % случаев, а пиковая концентрация в крови наступала через 22 мин и достигала 240 нг/мл. Время полувыведения кетамина при этом равнялось 155 ± 12 мин и не отличалось от показателей при внутривенной инъекции [349]. Концентрация норкетамина в плазме через 77 + 14 мин после инъекции составила 90 ± 10 нг/мл.
После перорального приема кетамина пик концентрации препарата в плазме наступал через 30 ± 5 мин и равнялся 45 + 10 нг/мл. Биологическая активность препарата сохранялась в 16,5 % случаев. Концентрация норкетамина через 63 ± 13 мин после приема была 20 ± 44 нг/мл, что указывало на значительный метаболизм препарата при первом же его прохождении. Это является причиной того, что проблемы со стороны психики возникают реже, чем можно было бы ожидать от обычной дозировки кетамина, назначаемой через рот.
Вероятно, частично уменьшение чувствительности к боли при применении кетамина связано с норкетамином. Хороший предоперационный седативный эффект у детей [350] и взрослых [348, 349] обеспечивается при пероральном приеме кетамина в дозе 6 мг/кг.
Внутривенное введение кетамина приводит к отключению сознания уже через 30 с, а пробуждение наступает примерно через 10 мин [351]. Общая анестезия у детей старшего возраста наступает после введения кетамина в дозе 2—3 мг/кг, а у детей младшего возраста для наркоза такого же уровня необходимы более высокие дозировки, что связано скорее всего с повышенными величинами Vd у них [352].
Пути введения кетамина определяют продолжительность наркоза. После внутривенного введения препарата пробуждение наступает через 131 мин, а после внутримышечной инъекции оно происходит в среднем через 201 мин. (При наркозе галотаном для этого требуется 51 мин [353].)
Для поддержания наркоза бывает достаточно половины начальной дозы кетамина, а сроки между введением доз варьируются в зависимости от их величины, возрастая при их увеличении [333].
После инъекции кетамина пациенты начинают щуриться, взгляд становится неподвижным, возможно появление нистагма, исчезает моргатель-ный рефлекс, развивается состояние каталепсии, глаза остаются открытыми. В этом состоянии кора мозга не воспринимает афферентные импульсы из-за нарушения связей между ее сенсорной частью и ассоциативными зонами [354\. Подавление активности клеток V слоя в задних рогах спинного мозга, вероятно, объясняет аналгетиче-ское действие кетамина. Обезболивание может сохраняться после прекращения введения препарата [355\, благодаря чему в определенной степени обеспечивается послеоперационная аналгезия [352-355].
Рвотный и кашлевой рефлексы нарушаются кетамином в меньшей степени, чем это имеет место при назначении других анестетиков. Однако при этом сохраняется опасность аспирации желудочного содержимого во время наркоза [356]. Описаны летальные исходы из-за регурги-тации во время наркоза кетамином.
Воздействие кетамина на сердечно-сосудистую систему зависит от дозы препарата. Введение взрослым 0,5 мг/кг повышает частоту сердечных сокращений, показатели систолического и диа-столического давления [341]. Максимальные нарушения имеют место при дозе кетамина 1,5 мг/кг. У детей изменения сердечного ритма и артериального давления либо очень незначительны, либо вообще отсутствуют. Описанные сдвиги у них возникают лишь при внутривенном введении кетамина в дозах 1—2 мг/кг [357]. Слабовыражен-ное увеличение артериального давления отмечается после внутримышечной инъекции кетамина. Гипотензия под воздействием кетамина относится к редким осложнениям, более присущим больным в состоянии гиповолемии или с редуцированной способностью к синтезу катехолами-нов. Значительное возрастание уровня норэпи-нефрина в плазме после инъекции кетамина объясняют реакцией со стороны ЦНС [358]. Кета-мин оказывает прямое подавляющее действие на функцию миокарда, но оно кратковременно и обычно маскируется увеличением уровня кате-холаминов и стимуляцией симпатической системы. Увеличение нагрузки на миокард (тахикардия) и возрастание периферического сосудистого сопротивления повышают потребление кислорода миокардом. Поэтому относительные противопоказания к назначению кетамина имеются у больных с усиленным потреблением кислорода мышцей сердца [359].
Исследования у взрослых добровольцев подтвердили сохранность барорефлексов. Введение кетамина детям с кардиальной патологией не изменяет величин давления в правом и левом предсердиях, в легочной артерии и левом желудочке.
Фармакология 55
Частота сердечных сокращений и артериальное давление могут существенно возрастать. Небольшие дозы кетамина (1—2 мг/кг внутривенно) не влияют на давление в левом предсердии, в легочной артерии и общем круге кровообращения, не изменяют сопротивление в сосудах легких и периферической сети, а также величину сердечного выброса у ягнят [357\.
Внутривенное введение кетамина в дозе 2 мг/кг существенно снижает частоту дыхания и величину дыхательного объема, что вызывает развитие гипоксемии как у детей, так и у взрослых [359]. Максимальное возрастание РаСО2 отмечается через 10 мин после инъекции препарата, но затем этот показатель нормализуется. Указанные сдвиги газообмена могут наступать раньше и быть более тяжелыми у младенцев, так как в этом возрасте функциональная остаточная емкость легких меньше, а относительные величины сердечного выброса и потребления кислорода выше, чем у взрослых. Даже короткий период апноэ у них может вызывать тяжелую гипоксемию. Поэтому перед внутривенным или внутримышечным введением кетамина необходимо проводить гипероксидацию у ребенка. Состояние апноэ может провоцироваться кетамином [353, 360] преимущественно у недоношенных младенцев [361], а также у пациентов с уже имеющейся легочной патологией. Повышенные дозы кетамина наиболее предрасполагают к развитию апноэ. В то же время кетамин в дозе 6 мг/кг при внутримышечном введении не вызывал гипоксию у детей с врожденным пороком сердца синего типа [362]. Насыщение крови кислородом у таких пациентов возрастало с 72 до 89 % при наркозе кетамином или галотаном. У них кетамин не вызывал сдвигов артериального давления, в то время как при назначении галотана оно снижалось на 25 %. По заключению авторов, кетамин и галотан в равной степени эффективны и безопасны в качестве средств для вводного наркоза у младенцев и у детей.
По наблюдениям Corssen и соавт. [360], кетамин расширяет бронхиальные пути у взрослых. Аналогичные выводы сделали Betts и Pankin [363] при обследованиях детей. Cabanas и соавт. [364] отметили явное расслабление гладких мышц бронхов и подавление реакций высвобождения гистамина при введении кетамина морским свинкам. Однако ингаляции кетамина не предотвращали развитие бронхоспазма [365]. Кетамин в дозе 6 мг/кг при этом методе вызывал хороший седа-тивный эффект уже через 20—25 мин, не влияя на вентиляцию и на кислородную насыщенность крови. У 60 % пациентов к этому сроку исчезали отрицательные реакции на внутривенные инъекции. Не отмечено также случаев ларингоспазма и замедленного пробуждения после наркоза.
56 Анестезия в педиатрии
Кетамин можно вводить ректально в дозе 0,3 мг/кг для обеспечения предоперационного седативного эффекта [366\. Спустя 30 мин устраняется возбуждение, отмечается хороший се дативный эффект и сотрудничество со стороны ребенка. Основные показатели жизненных функций при этом не изменяются.
В отдельных случаях кетамин провоцирует кашель [346, 353], для устранения которого иногда требуется миорелаксация или назначение других анестетиков. Кетамин повышает тонус мышц и в отдельных случаях провоцирует миоклонические движения, которые могут становиться более беспокоящими, что требует специального лечения [346, 353, 367, 368\. Бесцельные движения возникают часто. Явные судороги бывают редко, но электростимуляция способна их спровоцировать [367, 369\. Несмотря на эти особенности, кетамин можно использовать у больных с первичной патологией мышечной ткани [370\ и при склонности к злокачественной гипертермии [371, 372].
Под воздействием кетамина нарастает содержание кортизола в плазме [373], сахара в крови и уровня свободных жирных кислот [374]. Эти вещества высвобождают билирубин, связанный с альбумином и увеличивают опасность развития ядерной желтухи у младенцев с гипербилируби-немией.
До настоящего времени нет никаких сведений о влиянии кетамина на функцию печени. Активность трансаминаз (аланиновой и аспарагино-вой), щелочной фосфатазы, а также концентрация билирубина в крови оставались нормальными у здоровых добровольцев, несмотря на повторный прием кетамина [375]. Точно так же не сообщалось о случаях острой или хронической почечной недостаточности.
Сонливость и галлюцинации являются основным осложнением при назначении кетамина. Они отмечаются у 30—50 % взрослых пациентов [372—378] и 5—10 % детей препубертатного возраста [352, 355, 379—382]. У детей более старшего возраста эти осложнения развиваются столь же часто, как и у взрослых.
Побочные реакции со стороны ЦНС выражаются также ощущением нехватки воздуха, повышенной возбудимостью, личностными изменениями и энурезом. Предварительная подготовка больных g помощью барбитуратов и диазепама позволяет предупредить подобные нарушения [383—386], а при их развитии внутривенное введение барбитуратов или диазепама устраняет возникшие нарушения. Иногда психические нарушения приобретают стойкий характер и создают серьезные проблемы не только для пациента, но также для родителей ребенка и других членов семьи [379].
Местные анестетики
Местные анестетики назначают новорожденным, младенцам и детям при проводниковой анестезии и для обезболивания (см. гл. 12 и 25). Они также применяются для обезболивания родов, при этом некоторые анестетики могут проникать через плаценту.
Лидокаина гидрохлорид
В крови молодых ягнят создается более высокий уровень лидокаина (Ксилокаина), а клиренс его происходит на 25 % медленнее, чем у взрослых овец [387]. Величина Vd ягнят также на 50 % выше по сравнению со взрослыми овцами. Метаболизм препарата не зависит от возраста животных, хотя у ягнят выводится на 20 % больше неизмененного лидокаина. Почечный клиренс препарата усилен у новорожденных ягнят, скорее всего из-за сниженного на 50 % его связывания с протеинами, более низких показателей рН крови и более высоких — мочи. Изменения рН всего на 0,04 удваивает почечный клиренс лидокаина. Несмотря на это, время полувыведения препарата у новорожденных остается более длительным в связи с повышенными величинами Vd.
Асфиксия способствует усиленному поглощению лидокаина организмом плода у овец [388]. Концентрация препарата в крови пупочной вены и артерии оказывается на 50 % выше, чем в крови материнского организма. Поступление лидокаина к мозгу ягнят вдвое, а накопление в его тканях в 4 раза выше, чем у взрослых животных. Подобные особенности позволяют объяснить нечастый токсический эффект лидокаина в случаях асфиксии новорожденных после спинальной, эпидуральной или промежностной анестезии у матери. Повышенное поглощение лидокаина мозгом в подобных условиях может быть связано с нарушением функции гематоэнцефалического барьера и падением концентрации в крови кислого oq-гликопротеина [389]. Тяжелые поражения печени у детей сопровождаются снижением содержания этого протеина в крови и нарастанием уровня лидокаина [390].
Цианотические пороки сердца у детей не влияют на фармакокинетику лидокаина у них, а концентрация свободного препарата в крови определяется содержанием в ней кислого агглико-протеина [391].
Сроки полувыведения, Vd и клиренс внутривенного лидокаина у младенцев и детей (0,5— 3 лет) такие же, как и у взрослых [392]. Повышенные показатели Vd после каудального введения лидокаина наблюдаются у детей в возрасте от 3 до 9 лет [393]. Период новорожденное™ также характеризуется увеличенными показателями
Фармакология 57

Vd и удлинением сроков элиминации лидокаина [394, 395]. Все три последних исследования были проведены без одновременного сопоставления с результатами аналогичных исследований у взрослых. Лишь Finholt и соавт. [392] определяли кинетику лидокаина, сопоставляя данные у новорожденных и взрослых.
Мепивакаина гидрохлорид
В печени человека мепивакаин (Карбокаин) подвергается оксидации, гидролизу и конъюгации [396]. В организме новорожденных все эти три процесса редуцированы. Поэтому печеночный клиренс препарата у них составляет '/з клиренса взрослых (16 против 48 мл/мин/кг). Соотношение между содержанием препарата в цельной крови и в плазме выше у новорожденных из-за повышенного связывания мепивакаина у них с эритроцитами. Повышение общего клиренса препарата у новорожденных обусловлено незначительным его связыванием с протеинами плазмы и повышенной рН мочи. Последний фактор препятствует реабсорбции препарата из почечных канальцев.
В табл. 3.5 приведено сопоставление кинетики мепивакаина и лидокаина.
Этидокаина гидрохлорид
Соотношение между концентрацией этидокаина (Дуранеста) в цельной крови и плазме у новорожденных выше, чем у взрослых. Это объясняется более высоким гематокритом у новорожденных и меньшим связыванием препарата с протеинами
плазмы у них [397]. Последний фактор объясняет более высокую, чем предполагалось, секрецию почками неизмененного препарата и его и-деме-тилированного метаболита. У новорожденных количество этого метаболита может быть сниженным.
Бупивакаина гидрохлорид
Бупивакаин (Маркаин) обладает длительным анестезирующим действием и часто применяется при каудальной, эпидуральной и местной анестезии у младенцев и детей. После каудальной анестезии у детей (средний возраст 7,25 + 0,75 года) максимальная концентрация препарата в плазме наступает через 29,1 + 3,1 мин [398]. Она достигает 1,25 ± 0,09 мкг/мл, время полувыведения препарата равно 277 + 34 мин. Объем распределения на стабильной стадии составляет 2,7 ± 0,2 л/кг, а клиренс — 10 ± 0,7 мл/кг/мин. Следовательно, бупивакаин быстро абсорбируется из каудального пространства. Максимальная концентрация бупивакаина у детей несколько выше [399], и клиренс такой же, как и у взрослых [400]. У новорожденных Vd почти в 3 раза больше, чем у взрослых, а время полувыведения препарата у детей продолжительнее, чем у взрослых. Мидазолам не влияет на фармакокинетику бупивакаина [401, 402].
Препараты холинергического действия
Новорожденные, младенцы и дети в большей степени, чем взрослые, реагируют на стимуляцию системы блуждающего нерва. Сукцинилхо-лин, галотан, энфлуран, манипуляции типа ларингоскопии и тракции боковых или срединных прямых мышц вызывают у младенцев и детей младшего возраста более выраженную брадикар-дию, чем у взрослых [403]. Дозы атропина, необходимые для устранения этих реакций (0,03— 0,04 мг/кт), у новорожденных в 5—10 раз выше, чем у взрослых.
Атропин
Атропин надежно блокирует действие ацетилхо-лина в тканях, иннервируемых постганглионар-ными нервами. Он подвергается частичному метаболизму (39 ± 17 %), но преимущественно экс-кретируется почками в неизмененном виде (57 %) [404]. Со стулом выводится незначительное количество атропина. Объем распределения (3,2 ±1,5 л/кг) и сроки полувыведения (6,9 + 3,3 ч) у детей почти вдвое больше, чем у взрослых [405]. Более длительные сроки полувыведения обусловлены значительно большими величинами Vd атропина.
58 Анестезия в педиатрии
Пероральный прием атропина в дозах 0,02— 0,04 мг/кг за 30—90 мин до вводного наркоза увеличивал частоту сердечных сокращений и поддерживал ее у младенцев (в возрасте 5,6 ± 3,0 мес) гораздо лучше, чем плацебо [406\, Влияние атропина на артериальное давление не зависело от возраста пациентов трех групп. В то же время атропин снижал величины диастолического давления и не предотвращал гипотензию. Внутривенное введение атропина повышало ритм сердечных сокращений и величину сердечного выброса. Увеличение этих показателей происходило вне зависимости от возраста пациентов [407\.
Внутривенное введение атропина снижало тонус нижнего пищеводного сфинктера у младенцев и детей [408\. Это в свою очередь диктует необходимость принятия соответствующих мер по предупреждению аспирации, после введения атропина, особенно при исходной слабости этого сфинктера. Пероральный прием атропина увеличивает опасность аспирации желудочного содержимого, так как при этом может сохраняться низкое рН желудочного сока (рН ниже 2,5), но возрастает объем желудочного содержимого (свыше 0,04 мл/кг). Внутривенное введение гли-копиролата таким пациентам вдвое снижает объем желудочного содержимого и соответственно повышает его рН.
Важное значение имеет место инъекции атропина. Если препарат вводится под язык, то ритм сердечных сокращений ускоряется через 3+1,1 мин. Если инъекция произведена в область дельтовидной мышцы, то подобный эффект отмечается через 4,4 +1,1 мин, а в мышцу бедра — через 6,4 + 2,4 мин [21].
Гликопирролат
Гликопирролат (Робинул) относится к четырех-замещенным аминам, плохо проникающим в ЦНС [409\. Препарат быстро абсорбируется после внутримышечного введения и оказывает выраженное антисекреторное действие. Выводится преимущественно в неизмененном виде с мочой и желчью [409\. Единственным различием параметров фармакокинетики между младенцами и детьми является более короткое время полувыведения препарата у детей в возрасте от 1 года до 3 лет [4Щ.
У детей внутривенное введение гликопиррола-та по 10 мкг/кг вызывает сухость слизистых оболочек полости рта, более выраженную, чем атропин в дозе 20 мкг/кг внутривенно при 30 мкг/кг перорально [411]. Частота сердечных сокращений после внутривенного введения этих препаратов возрастает значительно сильнее, чем после пер-орального приема атропина, причем атропин, принятый внутрь, значительно усиливает частоту
сердечных сокращений. Температура тела не и: меняется под влиянием этих препаратов. Ари1 мия во время вводного наркоза возникает у 41 ! пациентов, получивших атропин внутрь. В пр< тивоположность этому при назначении гликс пирролата или атропина внутривенно это ослоя нение наблюдается всего у 19 % больных. Бис доступность гликопирролата при его назначени через рот невелика и колеблется от 3,3 до 13,3 ! [412].
Это единственное и небольшое различие макокинетики гликопирролата у младенцев и тей не имеет клинического значения [410\.
Weiss CF, Glazko AJ, Weston JK: Chloramphenicol the newborn; a physiologic explanation of its toxicity wh< given in excessive doses. N Engl J Med 262:787, I960
Aranda JV, Portuguez-Malavasi A, Collinge JM et al: E] idemiology of adverse drug reactions in the newborn. Di Pharmacol Ther 5:173, 1982
Turner S, Nunn AJ, Fielding K, Choonaral I: Adver drug reactions to unlicensed and off-label drugs on paed atric wards: a prospective study. Acta Paediatr 88:96 1999
Aranda JV, Cohen S, Neims AH: Epidemiology of dn utilization in the newborn period. J Pediatr 89:315, 197
Aranda JV: Factors associated with adverse drug reactioi in the newborn. Pediatr Pharmacol 3:245, 1983
Weber WW, Cohen SN: Aging effects and drugs in ma p. 213. In Gillette JR, Mitchell JR (eds): Concepts in В ochemical Pharmacology. Vol. 28, Part 3. Springer-Ve lag, New York, 1975, p. 213
Ames MD: Gastric acidity in the first ten days of life the prematurely born baby. Am J Dis Child 100:123, 19<
Hyman PE, Feldman EJ, Ament ME et al: Effect of ei teral feeding on the maintenance of gastric acid secreto function. Gastroenterology 84:341, 1983
Rogers BM, Dix PM, Tolbert JL, McGuigan JE: Pastil and postprandial serum gastrin in normal human neonate J Pediatr Surg 13:13, 1978
Rooney PJ, Dow TG, Brooks PM et al: Immunoreactr gastrin and gestation. Am J Obstet Gynecol 122:834, 19'
Euler AR, Byrne WJ, Meis PJ et al: Basal and pentagastr stimulated acid secretion in newborn human infants. Ped atr Res 13:36, 1979
Hyman PE, Clarke DD, Everett SL et al: Gastric acid si cretory function in preterm infants. J Pediatr 106:46 1985
Watkins JB, Ingall D, Szczepanik P et al: Bile salt metal olism in the newborn: measurement of pool size and syi thesis by stable isotope technique. N Engl J Med 288:43 1973
Murphy GM, Singer E: Bile acid metabolism in infan and children. Gut 15:151, 1974
Gumpta M, Brans YW: Gastric retention in neonate Pediatrics 62:26, 1978
Siegel M, Lebentahl E, Krantz B: Effect of caloric densi on gastric emptying in premature infants. J Pedia 104:118, 1984
Salem MR, Wong AU, Mani M et al: Premedicant dni| and gastric juice pH and volume in pediatric patients. Ai esthesiology 44:216, 1976
Ong BY, Palahniuk RJ, Cumming M: Gastric volume an pH in outpatients. Can Anaesth Soc J 25:36, 1978
Нарушения температуры
Д ЭНИЕЛ
И.
СЕССЛЕР
(DANIEL I. SESSLER)
ЭНИЕЛ
И.
СЕССЛЕР
(DANIEL I. SESSLER)
Температура внутренней среды есть один из наиболее ревностно поддерживаемых физиологических параметров. Температура внутренней среды слегка варьируется в течение каждого дня (цир-кадианный ритм) ежемесячно у женщин и сезон-но у некоторых животных. Так или иначе, но в каждый данный момент времени температура тела находится в пределах нескольких десятых градуса ожидаемого значения. Анестезия и хирургическое вмешательство драматически нарушают столь деликатную регуляцию; понижение температуры тела пациента после операции на 1—3 "С ниже нормы типично. Клинической проблемой остается и послеоперационная гипертермия, хотя и менее типичной, чем гипотермия. В этой главе сначала будет описан синдром злокачественной гипертермии, а затем пути нарушения температурного баланса и терморегуляции вследствие анестезии и операции.
Злокачественная гипертермия есть острый гипер-метаболический синдром, который может быть спровоцирован применением сукцинилхолина и мощных ингаляционных анестетиков. Начало его может быть внезапным, а течение стремительным; симптомы, включая ригидность скелетной мускулатуры, гиперкарбию и лихорадку, могут в
68
течение 30 мин достичь преморбидного уровня, при котором рН может достигать 6,6. До недавнего времени злокачественная гипертермия находилась среди ведущих причин анестезиологической смерти с летальностью, превышавшей 65 %
[Л-
Впервые синдром был описан Denborough [2] в
1960 г. в письме редактору журнала "Ланцет". Он описал молодого человека с переломом ноги, который справедливо опасался риска предстоящей ему общей анестезии, так как 10 из 24 его родственников умерли во время нее. У этого пациента во время общей галотановой анестезии также развился этот синдром, но он выжил. Еще в 1953 г. подобный синдром был отмечен у свиней (стресс-синдром свиней [5]), но только в 1966 г. Nelson и соавт. [4\ обратили внимание на сходство между случаями. С тех пор была установлена подверженность этому синдрому собак, кошек, лошадей, коз, оленей, лосей и жирафов. Создание "свиной модели" положило начало серьезному изучению этого редкого заболевания.
Другим фактором, внесшим вклад в снижение летальности, был in vitro кофеин/галотановый тест для мышц в подозрительных случаях, описанный в 1970 г. Kalow и соавт. [5]. Этот оригинальный тест остается единственным доказанным способом диагностики синдрома. Сначала его патофизиологическая суть оставалась загадкой, хотя были предположения о дефекте регуля-
 ции
внутриклеточного кальция скелетных
мышц [6].
В настоящее время мы достигли
удовлетворительного
понимания причастных биохимических
отклонений и эпидемиологии синдрома.
Были
выявлены анестетики, не провоцирующие
развитие синдрома, что дало возможность
безопасно анестезировать и оперировать
пациентов группы
риска.
ции
внутриклеточного кальция скелетных
мышц [6].
В настоящее время мы достигли
удовлетворительного
понимания причастных биохимических
отклонений и эпидемиологии синдрома.
Были
выявлены анестетики, не провоцирующие
развитие синдрома, что дало возможность
безопасно анестезировать и оперировать
пациентов группы
риска.
Окончательным переломом было открытие в 1975 г. Harrison [7] способности ранее выпускавшегося препарата дантролена натрия ингибиро-вать запуск синдрома и эффективно его лечить. Вначале была доступна только пероральная форма, и применение дантролена ограничивалось премедикацией пациентов группы риска. Однако в 1979 г. был выпущен дантролен для внутривенного применения, что позволило использовать его и при острых кризисах.
Накопление знаний, точный диагностический тест, своевременное распознавание и адекватное лечение снизили летальность к настоящему времени до менее 1 %. Злокачественная гипертермия и ее лечение были описаны в более чем 1500 работах, включая немалое количество обзоров, опубликованных с 1986 г. [8—11].
Патофизиология
Хотя большинство исследований злокачественной гипертермии было выполнено на свиньях, большинство открытий было подтверждено на людях. Синдром характерен для свиней пород Landrace и Pietrain, что, видимо, является результатом высокой мышечной массы при малом количестве жира у этих животных. Свиная модель близко совпадает с синдромом человека, но инициируется легче и протекает еще более стремительно.
Повреждаемые ткани
Биохимические изменения при злокачественной гипертермии ограничены скелетной мускулатурой и гематологическими тканями. В нормальной мышце нервный импульс деполяризует сарколемму. Этот импульс проходит до поперечных тубул (трубочек), где сигнал передается на сарко-плазматический ретикулум связкой возбуждение — сокращение. Концентрация кальция в сарколемме повышается в 1000 раз, связывается ,тропонин, что делает возможным взаимодействие актина и миозина. Гистологические и ткане-вокультуральные характеристики предрасположенной скелетной мышцы сходны с таковыми у нормальной мышцы [ 12, 13]. Она имеет нормальные электрофоретические показатели белков [14, 15], нормальное содержание кальция и магния [16—18], нормальное функционирование нейро-
Нарушения температуры 69
мышечного сочленения [19]. Актин, миозин и тропонин предрасположенной мышцы нормальны [20, 21], равно как и активность аденилатцик-лазы [22] и моноаминоксидазы [23].
Единственными другими тканями, первично повреждаемыми синдромом злокачественной гипертермии, являются компоненты системы гемо-поэза. Повышается ломкость эритроцитов [24], однако причины этого остаются неясными, и эта ломкость не усиливается под воздействием мощных ингаляционных анестетиков [25]. Одна из групп исследователей сообщила о патологическом метаболизме АТФ-тромбоцитов, подвергшихся воздействию галотана, но получить подтверждение этому в других лабораториях не удалось [26]. Однако ультраструктурная морфология тромбоцитов предрасположенных пациентов изменена, и есть предположение, что эти клетки подвергаются каким-то образом воздействию синдрома [27, 28]. Мононуклеарный цитоплазма-тический кальций в норме, но концентрация в предрасположенных клетках значительно повышается под воздействием галотана [29, 30].
Инициация (пусковой механизм)
Инициация предрасположенной мышцы происходит во время связки возбуждение — сокращение [31]. Первоначально предполагалось, что более чувствительны мышцы I типа, чем II типа [32], но этот вопрос дискутируется [33]. Хотя средний потенциал мембран саркоплазматиче-ского ретикулума предрасположенных мышц нормален [34], сокращение происходит при —86 мВ, в то время как нормальная мышца должна деполяризироваться до —54 мВ [35]. Это существенно, так как галотан деполяризует предрасположенную (но не нормальную) мышцу с 5 до 15 мВ, что достаточно, чтобы вызвать сокращение [34]. Вероятно, другие мощные ингаляционные анестетики обладают подобным эффектом. Сукцинилхолин деполяризует как нормальную, так и предрасположенную мышцу, но инициирует только предрасположенную мышцу. Обстоятельства, при которых деполяризация и сокращения предрасположенной мышцы прогрессируют до контрактуры и клинических симптомов, неизвестны. Было высказано предположение о двухкомпонентном механизме, связке возбуждение — сокращение, при котором сукцинилхолин, галотан и дантролен воздействуют на первый компонент, кофеин — на второй [31].
Сокращение
После того как предрасположенная мышца инициирована, сокращение распространяется и поддерживается сложным комплексом биохимиче-
70 Анестезия в педиатрии
ная митохондрия становится причиной изменений в саркоплазматическом ретикулуме, которые приводят к сокращению.
Этот механизм был продемонстрирован в простых экспериментах, в которых экзогенная фос-фолипаза А2 вызывала длительное сокращение, когда нормальная мышца подвергалась воздействию сукцинилхолина и галотана. Эффект блокировался ингибиторами фосфолипазы А2 [38, 39\, индометацином и спермином. Аналогичным образом было показано, что экзогенные свободные жирные кислоты снижают захват кальция и гоь вышают его выброс нормальным саркоплазмати-ческим ретикулумом [40]. Как у человека, так и у животных инициированное галотаном сокращение смягчается ингибиторами фосфолипазы А2 [41, 42]. Обычно связующим звеном в процессе аномального активационно-контракционного взаимодействия, а также повышения активности фосфолипазы А2, вероятнее всего, являются нарушения рианодинового (контроль кальция) рецептора в саркоплазматическом ретикулуме [43, 44].
В присутствии свободных жирных кислот выброс кальция саркоплазматическим ретикулумом усиливается, а обратный захват ингибируется [18, 45, 46]. Как кальций-, так и галотан-индуциро-ванный выброс кальция усиливается в предрасположенном саркоплазматическом ретикулуме [47, 48]. В результате высокая концентрация кальция в саркоплазме делает возможным взаимодействие актина и миозина. Как и в нормальной мышце, сокращение при злокачественной гипертермии энергозависимо. Аэробный метаболизм, однако, недостаточен, возможно, вследствие того, что повышенная концентрация свободных жирных кислот ингибирует цитратсинтазу, являющуюся пейсмекером (водителем) цикла Кребса [45]. (Даже до инициации активность АТФазы предрасположенной мышцы повышена [49], а концентрации фосфокреатина, креатина и АТФ ослаблены [50—52].) В результате энергетические потребности в основном обеспечиваются за счет гликолиза [46, 53]. В поздних стадиях, когда температура мышц поднимается выше 43,5 "С, связывание актина с миозином более не является кальцийзависимым и мышечное сокращение становится необратимой контрактурой (рис. 4.1) [21, 54].
Клинические симптомы и лабораторные данные являются следствием поддерживаемого сокращения и повышенного гликолиза, необходимого для поддержания выработки АТФ в условиях нарушенного аэробного метаболизма. Повышение температуры, концентрации лактата и РСОа являются результатом мышечной патологии; большинство других органов реагирует на эти изменения пассивно [46].
Эпидемиология
В опубликованных данных количество случаев злокачественной гипертермии составляет приблизительно 1 на 14 000 у детей и 1 на 40 000 у взрослых. Это приближение базируется на числе случаев, диагностированных в Госпитале для больных детей в Торонто, Канада, разделенном на число анестезий, выполненных за этот период [55]. Однако до недавнего времени вследствие недостаточной изученности синдрома он не диагностировался, например при отсутствии температурного мониторинга или невыраженности клинических проявлений. Кроме того, даже у пациентов, чья предрасположенность была известна, обычно несколько анестезий могут пройти нормально до развития клинической картины [56]. Таким образом, реальная группа риска может быть значительнее, чем полагали ранее.
Так как предрасположенность к злокачественной гипертермии сохраняется на протяжении всей жизни, повышенная частота ее возникновения у детей является аномалией. Тем не менее инициировать синдром у взрослого труднее. Видимая устойчивость может проистекать из того факта, что введение в анестезию у взрослых чаще выполняется при помощи тиопентала натрия и недеполяризующих мышечных релаксантов, которые ингибируют инициацию синдрома [57— 59]. Напротив, анестезия у детей чаще индуцируется галотаном с последующим введением сукци-нилхолина, комбинации, являющейся особенно эффективным триггером. Дополнительным фактором является то, что инициирование и тяжесть синдрома уменьшаются при понижении температуры внутренней среды всего на 2 °С [60, 61]. Так как взрослые обычно остаются во время операции гипотермичными, в то время как детей согревают, повышенная частота возникновения синдрома в педиатрии может быть отчасти следствием более высокой температуры внутренней среды пациента.
Злокачественная гипертермия редко диагностируется в предельных возрастах, вероятно, вследствие того, что мышечная масса в это время уменьшена. Однако есть сообщения о случаях у новорожденных (после кесарева сечения под общей анестезией) [62] и у детей в возрасте 5 и 6 мес [63—66]. Нет сообщений о случаях в возрасте старше 78 лет [67]. Различия, связанные с половой принадлежностью в допубертатном периоде, отсутствуют, после полового созревания синдром более характерен для мужчин [55], что может быть следствием большей мышечной массы, облегчающей диагностику случаев с невыраженной клинической картиной. Описано несколько случаев развития синдрома во время бе-
Нарушения температуры 71
ременности без заметного повреждающего действия на плод [68, 69].
Злокачественная гипертермия является семейным заболеванием, но тип наследования остается неясным. Идентификация генетической модели затруднена вследствие того, что 1) многие члены семьи могли просто никогда не подвергнуться воздействию инициирующего препарата, 2) реакция предрасположенного пациента на инициирующий препарат может быть недостаточно документирована, 3) предрасположенность изменяется с возрастом и 4) у предрасположенных пациентов часто не развивается клинической картины даже при применении препарата, заведомо способного инициировать синдром.
Первоначально полагали, что синдром наследуется по аутосомно-доминантному типу на базе двух экстенсивных генеалогических ветвей [70, 71]. Дальнейшее изучение показало, что наследование в большинстве семей носило мультигене-тический характер с различной степенью выраженности и неполной пенетрантностью. Изучения других популяций показали, что у предрасположенных пациентов необычный тип HLA и нет строгого наследственного типа [72]. В то же время семейная тенденция была явной: родственники первой степени имели заметно более высокую предрасположенность, в то время как родственники второй степени имели и более низкий риск (который тем не менее выше, чем4 среди нормальной популяции).
У свиней был идентифицирован изолированный генный дефект, кодирующий рианодиновый рецептор (кальциевый канал саркоплазматиче-ского ретикулума) [73]. Было сообщение об обнаружении аналогичного дефекта у человека, но последующий анализ показал, что синдром человека генетически гетерогенен [74]. Предрасположенность к злокачественной гипертермии кодируется по меньшей мере 10 разными генами.
Ассоциация с миопатиями
Так как синдром злокачественной гипертермии является заболеванием скелетных мышц, неудивительны сообщения о миопатиях у предрасположенных пациентов. В одном исследовании случаи миопатии средней степени выраженности (мышечные спазмы, птоз, косоглазие, повышенный мышечный объем) были выявлены у предрасположенных пациентов в 66 % случаев, у их родственников первой степени в 36 % и в контрольной группе — в 7 % случаев [55]. Однако эти миопатии типичны для популяции в целом и большинство людей, ими страдающие, не предрасположены к злокачественной гипертермии.
Фенотип Нунан (также известный как синдром Кинга) характеризуется низким ростом, не-
72 Анестезия в педиатрии

Хотя врожденные миопатии ассоциировались со злокачественной гипертермией, данные в поддержку причинной связи в большинстве случаев недостаточны [85]. У предрасположенных пациентов был продемонстрирован синдром Эванса (истощенность проксимальных мышц, низкий рост и сколиоз). Было сообщение о врожденной миотонии у нескольких предрасположенных пациентов [75, 86, 87], хотя индуцировать злокачественную гипертермию у животных, страдающих этим заболеванием, не удалось [88]. Мышечная дистрофия Дюшенна также была описана у нескольких явно предрасположенных пациентов [89—92], однако большинство из них не были протестированы на злокачественную гипертермию, что делает любую корреляцию предположительной. Один предполагаемый эпизод злокачественной гипертермии был описан у пациента с синдромом Швартца — Джампеля.
При осмыслении этих сообщений следует помнить, что у более 10 000 человек документированы кризисы злокачественной гипертермии. Таким образом, неудивительно, что некоторые пациенты имели сопутствующие заболевания. Так как некоторые из этих заболеваний повышают вероятную необходимость хирургического
вмешательства, они повышают и вероятность того, что синдром у предрасположенных пациентов все-таки будет диагностирован.
Инициирующие (триггерные) агенты
Триггерные свойства сукцинилхолина и мощных ингаляционных анестетиков хорошо документированы для человека (табл. 4.1). Галотан инициирует синдром легче других ингаляционных анестетиков. Физическая нагрузка и кофе часто вызывают мышечные судороги у предрасположенных пациентов, но они не рассматриваются как триггеры заболевания у человека. Реакция в виде злокачественной гипертермии описана у пациентов, получавших такие препараты, как йопаное-вая кислота (Телепак), фенциклидин и кокаин. Сообщения о реакции на эти препараты в виде злокачественной гипертермии чрезвычайно редки и могут представлять собой злокачественную гипертермию, индуцированную стрессом, аллергические реакции или лекарственную лихорадку. Сами же эти препараты нельзя рассматривать как пусковые факторы злокачественной гипертермии.
Злокачественная гипертермия у свиней инициируется а- (но не Р-) адренергическими агони-стами. Фенилэфрин, как и норэпинефрин, инициируют синдром (с одновременным применением пропранолола или без него). Однако изопро-теренол не приводит к инициации [93], а резерпин и фентоламин даже предотвращают триггер-ное действие сукцинилхолина [94]. Триггерное действие допамина и добутамина не изучено. Тем не менее, если предрасположенному пациенту необходима медикаментозная поддержка артериального давления, изопротеренол будет лучшим выбором (хотя нет данных, что какой-либо из ва-зопрессоров инициирует синдром у предрасположенных людей). Есть сообщения, что тотальная эпидуральная анестезия блокирует инициацию у предрасположенных свиней [95], в то время как тотальная спинальная анестезия таким эффектом не обладает [96\, хотя есть предположения, что
сообщения в отношении эпидуральной анестезии были ошибочны. Злокачественная гипертермия не инициируется гиперкарбией, гиперкалиемией или дигоксином [97].
Злокачественная гипертермия у свиней также может быть инициирована физической нагрузкой и стрессом [97]. Ни один из этих факторов не является важным в заболевании человека, хотя есть единичные сообщения об инициировании злокачественной гипертермии только стрессом [1]. В частности, один хорошо документированный случай описывает 42-летнего пациента с позитивной биопсийной пробой, у которого стресс вызывал лихорадки, купировавшиеся назначением тантролена [98]. Другое сообщение описывает предрасположенную семью, в которой были часты необъяснимые внезапные смерти [99], и пять субъектов испытывали "стресс-синдром" [100]. В редких случаях стресс может быть причиной кризисов, наблюдаемых во время анестезий без применения инициирующих препаратов [101—103].
Гиперметаболическая лихорадка после применения психотропных лекарственных средств, таких как фенотиазины, трициклические антидепрессанты и ингибиторы моноаминоксидазы, известна как злокачественный нейролептический синдром [104, 105]. Несмотря на наличие сходных клинических проявлений, взаимоотношение этого синдрома с синдромом злокачественной гипертермии нуждается в изучении. У нескольких пациентов со злокачественным нейролептическим синдромом была получена положительная кофеин-контрактурная мышечная биопсия, что позволяет предположить сходность патофизиологических механизмов [106, 107]. Некоторое количество пациентов со злокачественным нейролептическим синдромом было успешно лечено дантроленом [108, 109].
Признаки и симптомы
Все признаки и симптомы злокачественной гипертермии являются результатом гиперметаболизма и повреждения скелетных мышц. Таким образом, хотя легочная, сердечно-сосудистая и печеночная системы вовлечены, их участие вторично и является результатом компенсаторных реакций, необходимых для поддержания генерализованной, длительной мышечной контрактуры. Вовлечение почечной системы также вторично и обусловлено выбросом миоглобина из поврежденных мышц.
Злокачественная гипертермия обычно возникает в течение первых 2 ч анестезии [67], хотя синдром проявлялся после длительной анестезии [110], во время пробуждения [102, 111, 112] и редко через много часов после возвращения пациента в отделение [ИЗ].
Нарушения температуры 73
Ригидность жевательной мускулатуры
Синдром развивается особенно быстро после применения сукцинилхолина, при этом часто первым симптомом у таких пациентов бывает спазм жевательной мышцы [55, 114\. Спазм или ригидность жевательной мускулатуры проявляется мощным тризмом нижней челюсти, наблюдаемым в течение нескольких минут после введения сукцинилхолина. Это не есть просто неадекватная релаксация, или "напряженность".
Напряженность нижней челюсти встречается почти у 1 % детей, получающих ингаляцию гало-тана с последующим внутривенным введением сукцинилхолина [115] и у 2,8 % детей с аналогичной анестезией, оперируемых по поводу косоглазия [116]. Вероятно, большинство этих напря-женностей не является ригидностью жевательной мускулатуры. В пользу этого предположения говорят исследования, показывающие, что сукци-нилхолин вначале повышает тонус нижней челюсти, затем обеспечивает релаксацию [117, 118]. Ригидность жевательной мускулатуры, по-видимому, является крайним проявлением тонуса у некоторых детей. У взрослых ригидность жевательной мускулатуры редка даже при применении сукцинилхолина.
В первых сообщениях ригидность жевательной мускулатуры описывалась как великолепно коррелирующая со злокачественной гипертермией [115]. Однако дальнейшие исследования показали (клинические и стандартный кофеин-кон-трактурный тест in vitro), что эта корреляция далеко не так очевидна, как это казалось [119]. В настоящее время считается установленным, что 50 % детей, у которых при введении в анестезию развился спазм жевательной мускулатуры, были к нему предрасположены [120, 121].
Острая злокачественная гипертермия
Первыми симптомами кризиса, появляющимися во время анестезии, являются синусовая тахикардия, гипертензия и тахипноэ. Эти широко распространенные симптомы обычно ошибочно интерпретируются как признак неадекватной глубины анестезии и "корригируются" применением более высокой концентрации ингаляционного анестетика. Далее появляется мраморность кожи с участками цианоза и ярко красными пятнами. Генерализованная ригидность скелетной мускулатуры, подобная трупному окоченению, развивается приблизительно в 70 % таких кризисов [55] и обычно ассоциируется с более стремительным течением. Припухлость и напряжение мышц после кризиса типичны. Однако ригидность и дистонические реакции на сукцинилхолин могут иметь место также и у пациентов с различными
74 Анестезия в педиатрии
миопатиями, не предрасположенных к злокачественной гипертермии [122, 123],
Центральная терморегуляция во время злокачественной гипертермии предположительно остается интактной. Температура повышается вследствие того, что длительное мышечное сокращение генерирует больше тепла, чем организм в состоянии рассеять в окружающей среде. Хотя лихорадка является относительно поздним проявлением, она может нарастать со скоростью до 1 "С в минуту, с повышением температуры тела выше 46 °С. Лихорадка может быть минимальной в вялотекущих случаях либо в случаях крайне стремительного развития кризиса, когда за 20 мин развиваются тяжелый ацидоз, шок и фибрилляция желудочков.
В последнее время проведено изучение известных признаков и симптомов (таких, как генерализованная ригидность, спазм жевательной мускулатуры, тахикардия и лихорадка) с целью определения их прогностической полезности для предрасположенности к злокачественной гипертермии [120\, Авторы установили, что генерализованная мышечная ригидность была единственным отдельно взятым симптомом, предсказывающим позитивный контрактурный тест in vitro. Хотя спазм жевательной мускулатуры после введения сукцинилхолина не был предсказательным, у 50 % пациентов, испытавших спазм жевательной мускулатуры, тест оказался положительным. Все пациенты, чьи тесты в конечном счете оказались положительными, имели по меньшей мере два симптома, что дает основания полагать, что оценка клинической картины в целом более полезна, чем попытка положиться на какой-то отдельно взятый фактор.
Высказывались предположения об отклонениях в сердечной мышце, однако в пользу первичного поражения миокарда данных недостаточно. Хотя тонкие гистопатологические изменения были обнаружены в сердечной мышце пациентов, умерших вследствие злокачественной гипертермии, скорее всего эти находки являются отражением стресса летального кризиса [12, 22, 124\. Высказывалось предположение о повышенной частоте сердечных аритмий, но эти сообщения либо анекдотичны, либо из неконтролируемых исследований [124—126\.
Лабораторные показатели
Так как лихорадка вторична гиперметаболизму скелетной мускулатуры [46], большинство отклонений в лабораторных показателях могут быть выявлены до повышения температуры (табл. 4.2) [127\. Наиболее заметным показателем является метаболическая и респираторная ацидемия (оба отклонения более выражены в венозной, чем в
артериальной крови). Иначе говоря, необъяснимая гиперкарбия является первым заметным физиологическим признаком злокачественной гипертермии [52] и может быть выявлена при мониторинге конца выдоха PCOj [128, 129].
Потребление кислорода повышается не так значительно, во всяком случае существенно меньше, чем максимально возможное повышение после энергичной физической нагрузки [127]. Скелетная мышца сама по себе является источником повышения лактата [130\, и повышение температуры только наполовину может быть объяснено повышением потребления кислорода, указывающим на значительный анаэробный метаболизм либо на неравномерное распределение тепла в организме [46, 53]. Оксигенация артериальной крови остается адекватной несмотря на заметный цианоз, тем не менее РОз смешанной венозной крови снижается, а РСОз возрастает, отражая шестикратное повышение экстракции кислорода скелетными мышцами. Эта реакция качественно сходна с таковой при тяжелой физической нагрузке.
Уровень циркулирующего норэгшнефрина в 20 раз превышает нормальный и является причиной вазоконстрикции, препятствующей нормальному периферическому кровотоку и ингибирую-щей таким образом рассеивание тепла. В ранних стадиях уровень калия плазмы достигает 6— 14 мг-экв/л [131, 132]. Через несколько часов в результате перераспределения калия и применения диуретиков может развиться гипокалиемия. Некоторое количество лактата метаболизируется в печени. Высвобождаются глюкоза и калий, вероятно, вследствие расщепления гликогена [133]. Сердечный выброс и экстракция кислорода сердцем существенно возрастают, по-видимому, в результате повышения уровней циркулирующих катехоламинов [134]. Метаболические изменения в мозге, по-видимому, пассивно отражают системные изменения при поддержании нормального мозгового кровотока [135].

Нарушения температуры 75


Несколько ранних работ описывают кардио-миопатию и вентрикулярную аритмию у бодрствующих предрасположенных пациентов, не подвергавшихся действию инициирующих агентов [125, 136\. Один из исследователей нашел, что треть предрасположенных субъектов имели отклонения на ЭКГ, чаще всего дефекты атриовен-трикулярной проводимости и ишемические изменения [126\. Однако это исследование было ретроспективным, и отмеченные изменения не были сопоставлены с аналогичными в контрольной группе. Более того, гистология предрасположенной сердечной мышцы нормальна [137, 138]. Было также высказано предположение о том, что злокачественная гипертермия является одной из причин синдрома внезапной смерти детей раннего возраста [139, 140], но данных за столь важную связь между этими синдромами недостаточно.
Прогноз и лечение
До введения в клиническую практику дантролена смертность при кризисе злокачественной гипертермии составляла приблизительно 65 % [55]. Лечение состояло из прекращения анестезии, гипервентиляции кислородом и назначения бикарбоната натрия и препаратов спорной эффективности, таких как прокаинамид, прокаин, галопе-ридол, стероиды и каетансерин (блокатор серото-ниновых рецепторов) (табл. 4.3). Пациентов интенсивно охлаждали погружением в ледяную воду, промыванием желудка, прямой кишки, плевральной и брюшной полостей ледяным физиологическим раствором и внутривенным введением охлажденных жидкостей. Один пациент со стремительно развивавшейся злокачественной гипертермией (рН 6,85; РСО2 179 мм рт.ст.) был успешно лечен частичным кардиопульмональным шунтом [141].
Тогда, как и сейчас, раннее распознавание было критически важным. Есть мало сообщений о летальных исходах менее чем через 10 мин после начала анестезии. Напротив, почти все пациенты, у которых начало лечения кризиса было за-
держано более чем на 2 ч, умерли [142]. Быстрое распознавание и адекватное лечение, включая внутривенное введение дантролена, снизили смертность почти до нуля. Энергичная работа с родственниками первой и второй ступени привела к повышению настороженности как среди врачей, так и среди пациентов и соответственно к уменьшению числа кризисов.
Лечение и мониторинг
Современный комплекс мер, рекомендуемых для лечения злокачественной гипертермии, включает прекращение введения инициирующих препаратов, гипервентиляцию с 100 % кислородом и, как можно быстрее, введение 2,5 мг/кг дантролена в/в. В течение 45 мин после введения начальной дозы дантролена все симптомы (ригидность, ацидоз, тахикардия) должны исчезнуть. В противном случае следует вводить дополнительные 2,5 мг/кг в/в каждые 30 мин (до максимума в 10 мг/кг) до исчезновения всех симптомов. Обычно также назначается бикарбонат натрия (1 или 2 мг-экв/кг внутривенно). Так как СО2, образующаяся при реакции бикарбоната с метаболическими кислотами, может аггра-вировать респираторный ацидоз, бикарбонат не следует назначать, если не налажена адекватная вентиляция, а артериальное РСО2 близко к норме. Дополнительного калия следует по возможности избегать, так как в течение 6—12 ч после кризиса возможна возвратная гиперкалиемия. Немедленную консультацию специалиста можно получить круглосуточно через Ассоциацию по злокачественной гипертермии в США. Вызов по коду 800-MH-HYPER.
Ведение облегчается частым измерением газов артериальной крови, электролитов и КФК плазмы. По меньшей мере одна проба мочи должна быть взята в послеоперационном периоде, так
76 Анестезия в педиатрии
как миоглобинурия с развитием острого тубуляр-ного некроза возможна даже при минимальной выраженности остальных симптомов. Если клинические и лабораторные данные вернулись к норме после введения дантролена, в интенсивных охлаждающих мерах нет необходимости. Внутривенное введение дантролена, вероятно, следует продолжать в дозе 2,5 мг/кг каждые 6 ч в течение приблизительно 24 ч после исчезновения симптомов. (Последние исследования методом магнитно-резонансной спектроскопии показали, что мышечный метаболизм остается аномальным в течение нескольких часов после исчезновения симптомов [143].) До введения в клиническую практику дантролена и в случаях, когда кризис проявлялся тревогой, мышечной ригидностью, гиперкалиемией и анурией, рецидивы кризиса были типичны в течение нескольких первых дней после него [113]. Такие рецидивы редки у пациентов, получавших дантролен. Тем не менее разумно наблюдать за пациентом в госпитальных условиях в течение 24 ч после возвращения к норме лабораторных тестов и исчезновения симптомов.
Ригидность жевательной мускулатуры
Спазм жевательной мускулатуры часто бывает первым клиническим симптомом злокачественной гипертермии, но такой спазм бывает и у непредрасположенных пациентов [120, 121]. Анестезиолог, столкнувшийся со спазмом жевательной мускулатуры, должен принять решение — прекращать либо продолжать анестезию, несмотря на риск кризиса злокачественной гипертермии.
Некоторые специалисты полагают разумным прекращать анестезию при выявлении спазма жевательной мускулатуры, учитывая риск развития кризиса [144]. Другие обращают внимание на то, что ригидность жевательных мышц встречается значительно чаще, чем злокачественная гипертермия. Они рекомендуют заменить анестетик на более безопасный и оценить пациента на признаки кризиса. Если газы крови нормальны и нет признаков гипертермии, они полагают возможным продолжить операцию [145].
Почти в каждом достаточно подробно описанном случае ригидность жевательной мускулатуры, сопровождавшаяся концентрацией КФК в плазме, превышающей 20 000 ME, указывали на гипертермию или другую миопатию [121]. Соответственно у каждого пациента с ригидностью жевательной мускулатуры следует исследовать КФК крови последовательно через 6, 12 и 24 ч. У пациентов с ригидностью жевательной мускулатуры также должна быть исследована моча на миоглобин, так как это может быть изолирован-
ным симптомом мышечного повреждения. Однако обычно необходимости в госпитальном лечении таких больных нет [146].
Естественным выглядело бы желание анестезиологов свести к минимуму случаи спазма жевательной мускулатуры возможным исключением использования сукцинилхолина у пациентов, вводимых в анестезию мощными ингаляционными анестетиками, так как эта комбинация представляется особенно эффективной для индуцирования спазма жевательной мускулатуры. Иногда применение сукцинилхолина у маленьких детей (обычно мальчиков) провоцирует немедленную остановку сердца. Остановка обычно является результатом гиперкалиемии у пациентов с нераспознанной мышечной дистрофией [147]. В этих случаях необходимо немедленно предпринять действия, направленные на снижение концентрации калия в плазме, которые должны включать введение бикарбоната и глюкозы/инсулина.
Дантролен
Пероральная форма дантролена (препарата, родственного дифенилгидантоину) была разработана в 1967 г. для лечения мышечного спазма при церебральном параличе и сходных заболеваниях. Первое сообщение о его эффективности при злокачественной гипертермии у свиней относится к 1975 г. [7]. В 1977 г. было доказано, что он более эффективен у людей, чем прокаинамид и другие применявшиеся в то время лекарственные средства [148, 149]. Однако попыткам растворить перо-ральные капсулы препятствовала слабая растворимость препарата, что ограничивало его применение пероральной профилактикой у пациентов, чья предрасположенность была известна. Одобренный федеральными властями США лиофилизирован-ный препарат для внутривенного введения был в конце концов выпущен в ноябре 1979 г.
Введенный внутривенно в дозе 3,5 мг/кг дантролен подавляет мышечные судороги у 95 % свиней [150]. Обе дозы — эта и 5 мг/кг представляются эффективными для ингибирования инициации злокачественной гипертермии у свиней [131], которая стремительнее, чем у людей, и может быть эффективно лечена дозой 7,5 мг/кг. Судорожные подергивания у людей ингибируются приблизительно на 73 % 2,5 мг/кг препарата [151, 152]. Обширные клинические испытания, проводившиеся в нескольких медицинских центрах, показали лечебную эффективность этой самой дозы [153]. Первоначально для профилактики и начала лечения была рекомендована одна и та же доза — 1 мг/кг дантролена внутривенно, однако в настоящее время большинство исследователей рекомендуют начинать лечение с дозы, не меньшей чем 2,5 мг/кг.
Время полувыведения дантролена в течение анестезии равно приблизительно 9 ч, и на него не оказывают существенного влияния беременность или предоперационное применение диазе-пама или фенобарбитала [68, 154\. В отличие от ранних сообщений перорально примененный дантролен хорошо абсорбируется и надежно обеспечивает адекватную концентрацию в крови [155\. Препарат метаболизируется в печени первично до 5-гидроксидантролена, который экс-кретируется с мочой. Фармакологически 5-гид-роксидантролен сходен с родительским соединением и имеет время полувыведения приблизительно 15 ч [154\. Фармакокинетика препарата у детей ничем не отличается от описанной [156]. Препарат не может быть удален в эти сроки с помощью диализа.
Хотя дантролен ингибирует связку возбуждение — сокращение [157, 158], основное и непосредственное влияние он оказывает на сарко-плазматический ретикулум. Он повышает вольтаж порога сократительной активации в предрасположенной [35] и нормальной мышце [159\ и предотвращает деполяризацию предрасположенной мышцы галотаном [34]. Дантролен также снижает концентрацию внутриклеточного кальция, приводя к минимуму концентрации при дозе более 2 мг/кг [152, 160]. Он также демонстрирует выброс кальция саркоплазматическим рети-кулумом и снижение общего выбрасываемого количества [161]. Хотя это и снижает напряжение мышечных подергиваний, дантролен в одиночку не может снять их полностью. Эффект влияния этого препарата на высоту напряжения мышечного подергивания одинаков у предрасположенной и нормальной мышцы [151]. Дантролен не имеет центрального эффекта, не влияет на ней-ромышечное сочленение [158] и не имеет прямого влияния на связывание актина с миозином [21].
Дантролен имеет также первичный антиаритмический эффект, включая повышение пред-сердного и желудочкового рефрактерных периодов [162]. Сердечная сократимость снижается, а длительность потенциала действия повышается [163]. Системное сосудистое сопротивление повышается, в то время как сердечный индекс снижается. Среднее артериальное давление не изменяется [ 164]. Эти эффекты до некоторой степени ослабляются кальцием, хотя они не похожи на изменения, вызываемые блокаторами кальциевых каналов. Тем не менее токсические свойства дильтиазема и дантролена представляются синер-гичными, вызывая гиперкалиемию и остановку сердца при их совместном применении [165]. Потенциальная токсичность сочетания верапа-мил/дантролен остается неясной [166, 167]. Напротив, комбинация нифедипина с дантроленом выглядит безопасной [ 165].
Нарушения температуры 77
У детей младшего возраста и плода побочных эффектов при применении дантролена не наблюдалось. Хотя было одно сообщение об атонии матки после применения дантролена для преме-дикации, противопоказаний для его применения во время беременности, по-видимому, нет. Уровень в крови плода составляет приблизительно половину материнского [68, 69]. Гепатотоксич-ность может иметь место при длительном перо-ральном применении (3—6 мес) [168], были также выявлены острые изменения печеночной биохимии [169—171]. Однако не было ни одного сообщения о клинических признаках гепатотоксич-ности во время лечения гипертермии. Хронический эозинофильный плевроперикардиальный выпот (очевидно, гиперчувствительность) может иметь место во время длительного лечения, но не отмечен при экстренном лечении [172]. Дантролен также повышает LD50 бупивакаина [173] и может вызвать сонливость, головокружение, головную боль и тошноту. Иногда после применения дантролена глубокая мышечная слабость требует механической вентиляции [174].
Так как лечение дантроленом внутривенно стало столь эффективным в снижении смертности, это лекарственное средство должно быть в наличии везде, где применяются мощные ингаляционные анестетики и сукцинилхолин. (Трудно выиграть судебное разбирательство случая, осложнившегося злокачественной гипертермией, когда дантролена не оказалось в наличии.) Продаваемый дантролен для внутривенного применения дорог: коробка с 36 флаконами (содержащими всего 720 мг) обходится госпиталю приблизительно в 1000 долл. США. Короткий срок хранения препарата в состоянии, позволяющем применить его немедленно, еще более удорожает его. Пероральная форма дешевле препарата для внутривенного введения приблизительно в 30 раз [175]. Был разработан водорастворимый аналог дантролена (азумолен), однако в продажу он еще не поступил [176].
Плановая анестезия у восприимчивых пациентов
Плановая анестезия не противопоказана пациентам с установленной предрасположенностью. Может быть безопасно выполнена как региональная, так и общая анестезия, хотя при обеих методиках необходимы предосторожности во избежание нежелательного стресса. Приемлем любой вид проводниковой анестезии с применением любого анестетика. Интересно, что, когда пациенту, в связи с которым был впервые описан синдром [2], потребовалась другая операция через год после едва не стоившей ему жизни гало-тановой анестезии, д-р Denborough и соавт. при-
78 Анестезия в педиатрии
Так как в течение многих лет предполагалось, что лидокаин и другие местные анестетики — амиды повышают концентрацию внутриклеточного кальция, их применения избегали. Однако применение анестетиков амидов не инициировало синдром у предрасположенных свиней [177, 178], и было только одно сообщение о случае злокачественной гипертермии у человека после (но не обязательно вследствие) применения ли-докаина. Следовательно, эти препараты могут быть безопасно применены у предрасположенных пациентов [179\.
Общая анестезия может быть безопасно выполнена по сбалансированной методике, сочетающей закись азота и наркотики, усиленные не-деполяризующими мышечными релаксантами [46, 47, 180]. К другим безопасным препаратам относятся бензодиазепины, кетамин, альтезин, пропофол и этомидат [181, 182\. Известно, что барбитураты ингибируют инициацию [57\, равно как и недеполяризующие мышечные релаксанты [58, 59]. Дроперидол, вероятно, безопасен, хотя может инициировать клинически сходный злокачественный нейролептический синдром [104, 105\. Антихолинергические препараты не являются триггерами синдрома, но могут повышать лихорадку во время кризиса, так как они ингибируют рассеивание тепла в окружающем пространстве вследствие подавления потения. Хотя есть несколько сообщений о кризисах во время анестезии "неинициирующими" препаратами [112, 183—185], все же в настоящее время очевидно, что сбалансированные анестезиологические методики могут быть безопасно применены
у предрасположенных пациентов. Тем не менее изредка (в 0,5 % случаев) реакции типа/ легкой формы злокачественной гипертермии вызывают препараты, не являющиеся триггерными [186]. Все подобные эпизоды происходят непосредственно после завершения анестезии и легко устраняются.
Вымывание анестетика из наркозного аппарата происходит быстро, даже без замены всех резиновых и пластиковых компонентов. При их замене (на новый или одноразовый контур) остаточная концентрация анестетика равна приблизительно 1/1000 MAC (< 10 частиц на миллион) с вымыванием в пределах 5 мин (рис. 4.2). Маловероятно, чтобы столь незначительные концентрации могли инициировать синдром даже у пациентов с высоким риском развития злокачественной гипертермии. Поэтому наркозный аппарат, вероятно, может быть подготовлен для безопасного применения у предрасположенного пациента с помощью простого удаления испарителя (риск утечки) и заменой легкодоступных резиновых и пластиковых компонентов; нет необходимости заменять абсорбер с поглотителем СО2.
Профилактика дантроленом
Неясно, имеет ли профилактика дантроленом перед операцией преимущество. Некоторые врачи применяют перорально или внутривенно дантро-лен перед операцией, в то время как другие не считают это необходимым. Важен исторический контекст: после того, как в 1975 г. была установлена эффективность дантролена, профилактика у предрасположенных пациентов стала стандартом,
Нарушения температуры 79
но это было до появления его внутривенной формы в 1979 г. В то время любое лечение, способное предотвратить инициирование, было разумным, так как эффективных способов лечения начавшегося кризиса не существовало и смертность оставалась высокой.
Дантролен в дозе 2,5 мг/кг достигает терапевтической концентрации будучи введен внутривенно за 30 мин до начала анестезии [151]. Альтернативно может быть использован перораль-ный путь введения в виде курса длительностью в несколько дней. Однако премедикация адекватной дозой дантролена внутривенно может вызвать значительную мышечную слабость и депрессию дыхания. У нескольких пациентов потребовалась неожиданная и длительная вентиляторная поддержка после применения дантролена [174\. Кроме того, стоимость дозы 2,5 мг/кг для пациента с массой тела 70 кг равна приблизительно 350 долл. США.
Соответственно многие исследователи имеют впечатление, что премедикация дантроленом не является необходимой по следующим причинам: 1) при применении "неинициирующих" препаратов кризисы редки; 2) тяжелый кризис может быть легко остановлен внутривенным введением дантролена; 3) премедикация может вызвать осложнения [102\. На больших группах пациентов, не получавших премедикации (так как они были подвергнуты мышечной биопсии), было показано, что кризисы злокачественной гипертермии при применении "неинициирующих" препаратов редки [102—18О\.
Диагностические тесты
В основном подозрение о злокачественной гипертермии формируется на основании кризиса или в случаях, когда кто-то из родственников пациента уже пострадал от этого синдрома.
Кофеин/галотановая контрактура
Тест кофеин/галотанового сокращения in vitro, разработанный Kalow в 1970 г. [5], остается единственным широко принятым тестом при диагностике злокачественной гипертермии. Диагноз устанавливается на основании оценки сокращения свежего интактного сегмента мышцы в ответ на галотан и кофеин, оказывающих слабое влияние на нормальную мышцу. Тест труден как для выполнения, так и для интерпретации. Поэтому он не является рутинной процедурой, и его выполнение в США возможно приблизительно в 10 медицинских центрах.
Для контрактурного теста in vitro необходимо интактный мышечный сегмент натянуть в измерительном устройстве, подвешенном в физиоло-
гическом растворе (рис. 4.3). Отмеренные концентрации галотана пропускаются через раствор, при этом измеряется изменение напряжения мышцы. Аналогично концентрация кофеина увеличивается дробно до 8 ммоль, и изменение напряжения мышцы измеряется снова. Постоянное сокращение (например, > 0,2 г при низкой концентрации кофеина) указывает на то, что мышца предрасположена к злокачественной гипертермии. С 1989 г. существует соглашение между североамериканскими центрами по стандартизации протоколов теста [187\. Европейские страны также разработали подобный протокол, имеющий незначительные отличия [188],
Некоторые лаборатории также идентифицируют промежуточный (фенотип К) ответ, при котором сокращение развивается во время воздействия галотана, только когда мышца предварительно обработана сукцинилхолином [189\.
Рис. 4.3. Биопсийная мышечная проба прикреплена к натянутой струне и помещена в буферный физиологический раствор. Контрактурный тест in vitro выполняется добавлением кофеина и галотана к буферу и измерением напряжения, генерируемого мышцей. Поддерживаемое напряжение указывает на то, что мышца предрасположена к злокачественной гипертермии. (Снимок I mad Rasooi, MD, PhD, University of California, Irvine, CA.)
 80
Анестезия в педиатрии
80
Анестезия в педиатрии
Эта реакция коррелирует с таковыми у пациентов, которые имели спазм жевательной мускулатуры, но не были диагностированы как предрасположенные к злокачественной гипертермии при помощи традиционной биопсийной методики [190\. Пациенты с фенотипом К не предрасположены к злокачественной гипертермии [191]. Здесь не наблюдается простой корреляции между результатами биопсии и ригидной злокачественной гипертермией в сопоставлении с неригидной.
Для теста сокращения in vitro требуется свежая ткань. Следовательно, для проведения биопсии мышцы пациенты должны прибыть в центр, обладающий необходимыми возможностями. Необходим приблизительно 1 г ткани, получаемый обычно из четырехглавой мышцы. Так как требуется относительно большой кусок мышцы, биопсия у детей младшего возраста обычно откладывается до достижения ими возраста в несколько лет, если она не показана по подозрению на еще какую-либо миопатию. Анестезия для биопсии обычно осуществляется путем блокады бедренного и бокового кожного бедренного нервов [792]. Приемлема также и общая анестезия без использования инициирующих препаратов. Местная блокада нежелательна, так как присутствие местного анестетика в биопсийном образце может стать причиной ложноотрицательного результата. Пациенты, у которых производится биопсия, не должны получать премедикацию дантроленом, так как он влияет на выполнение теста.
Чувствительность теста представляется высокой: документированы лишь несколько ложноот-рицательных результатов. Однако инициирующие анестетики были применены лишь у весьма ограниченного количества пациентов, имевших отрицательный результат сократительного гало-тан/кофеинового теста [193\. Кроме того, его специфичность относительно невысока, с частотой ложноположительных результатов, достигающей 50 %.
В модифицированном сократительном тесте in vitro используются мышечные волокна, лишенные оболочки [194\. Преимущество этой модификации в том, что она позволяет использовать замороженную мышцу и не требует прибытия самого пациента. Это позволяет также использовать значительно меньший мышечный сегмент, что благотворно для маленьких детей. Хотя тест хорошо коррелирует с традиционным тестом in vitro, он труден в выполнении и не является процедурой, доступной рутинно [195]. Недавно предложен вариант контрактурного теста, основанный на использовании 4-хлоро-ш-крезола вместо кофеина, который обладает более высокой чувствительностью [196\.
Креатинфосфокиназа и микроскопия
Измерение КФК перед операцией используется для облегчения постановки диагноза. Среднее значение для предрасположенных к гипертермии пациентов 152 ME, для родственников первой степени 93 ME и только 43 ME у нормальных субъектов. Значения КФК у нормальных субъектов неизменны на протяжении жизни. Однако у предрасположенных к гипертермии пациентов эта функция мощно связана с возрастом, при этом повышенная концентрация КФК наблюдается в возрасте от 10 до 50 лет [55]. Это распределение понятным образом ограничивает применение этого теста у педиатрических и гериатрических пациентов. В любом случае ни активность КФК, ни сочетание этой активности, миопатии и семейного анамнеза недостаточны для подтверждения или исключения диагноза злокачественной гипертермии в любой группе населения [13]. Исключением из этого упомянутого выше правила является то, что активность КФК, превышающая 20 000 ME, после спазма жевательной мускулатуры имеет высокую степень корреляции с положительным результатом кофеин-сократительного теста [120, 121].
Обычная и электронная микроскопия была рассмотрена и отвергнуты в качестве надежных тестов на предрасположенность к гипертермии. Результаты обоих тестов обычно нормальны у маленьких детей, а у взрослых наблюдаются только неспецифические изменения, такие как внутренние ядра, одноволоконная атрофия, волоконный некроз и регенерация, а также коре-таргетоидные волокна. Нейромышечное сочленение выглядит нормальным: нет данных за денер-вацию. Эти наблюдения подобны наблюдаемым после многих видов мышечных повреждений, и это позволяет предположить, что они являются результатом кризиса, а не признаком предрасположенности к гипертермии.
Потребление кальция
Тест с использованием потребления кальция в тонком замороженном срезе мышцы был предложен в 1978 г. и в последующем использован приблизительно у 2000 пациентов [197]. Одним преимуществом этого теста было то, что маленький кусочек мышцы мог быть заморожен и отослан в центральную лабораторию для выполнения теста. Разработчики сообщили, что у 1 % из 1460 детей, получавших для индукции наркоза галотан с последующим введением сукцинилхолина, развился спазм жевательной мускулатуры. Они выявили также почти четкую корреляцию между спазмом жевательной мускулатуры и предрасположенностью к злокачественной гипертермии [115]. Эти
Нарушения температуры 83
Температурный мониторинг
С давних времен лихорадка расценивалась как полезный клинический симптом и ассоциировалась с болезнью в древнейших медицинских книгах: хирургическом папирусе Эдвина Смита («1700 лет до н.э.) [201\. Во времена Гиппократа был точно описан характер лихорадки некоторых заболеваний (например, малярии) [202\. Эти описания особенно интересны, если принять во внимание то, что до изобретения термометров оставалось 23 столетия. Более того, первые термометры давали возможность измерения только в относительных единицах; так продолжалось до 1714 г., когда Габриель Фаренгейт разработал надежный способ клинической термометрии в абсолютных единицах [202].
В течение последующих лет температурный мониторинг все энергичнее внедрялся в медицинскую практику, став практически одним из критических "жизненных показателей". Однако только после 1970 г. настороженность в отношении синдрома злокачественной гипертермии ускорила внедрение рутинного перинаркозного температурного мониторинга. В настоящее время рекомендации Американского общества анестезиологов требуют наличия возможности измерения температуры тела во время наркоза; однако в ближайшем будущем возможно появление более специфических стандартов. С тех пор как температурный мониторинг стал рутинной практикой, выяснилось, что почти все пациенты существенно гипотермичны во время анестезии и операции и что гипотермия иногда инициирует существенные физиологические реакции.
Термометры
Традиционно для измерения температуры тела в медицине применялись ртутные термометры из стекла. В последнее время стеклянные термометры вытеснены электронными, более быстрыми, более безопасными в пользовании, обеспечивающими постоянное измерение и более точными. Таким образом, в настоящее время осталось немного показаний для клинического применения стеклянных термометров.
Наиболее распространенными электронными температурными сенсорами являются термопары
4--998
и термисторы. Они точны и достаточно дешевы, для того чтобы быть утилизированными после однократного применения. Хотя термопары и термисторы могут быть использованы для измерения температуры кожи, для этой цели существует два специфических метода: жидкокристаллический температурный сенсор и инфракрасная термография. Инфракрасные системы имеют значительно более широкий спектр измерения, они быстрее и значительно более точны, чем жидкокристаллические. Температура кожи лба отражает внутреннюю температуру тела лучше, чем это можно было бы ожидать [203\. Однако температура кожи недостаточно точно отражает клинические признаки злокачественной гипертермии (тахикардию или гиперкагашю). Кроме того, она неинформативна во время наркоза с применением потенциально триггерных анестетиков (рис. 4.4) [204\. Температура в ушном канале, определенная инфракрасным датчиком, недостаточно точна и достоверна в клиническом отношении [205—207]. Более эзотерические измерения температуры (включая магнитно-резонансную спектроскопию) остаются интригующим инструментом исследователя, но клинического применения в настоящее время не имеют.
Точки температурного мониторинга
Выбор соответствующих точек температурного мониторинга значительно более сложен, чем выбор типа термометра. Температура тела далеко не
84 Анестезия в педиатрии
однородна: внутренние, хорошо перфузируемые ткани имеют тенденцию сохранять постоянную (и относительно высокую) температуру. Это рассматривается как "внутренняя" температура и в большинстве случаев как лучший отдельно взятый показатель температуры тела. Напротив, "периферические" ткани (представляющие до половины массы тела) могут иметь существенно меньшие температуры [208]. Кроме того, периферические температуры далеки от единообразия и могут значительно варьироваться на незначительных расстояниях.
Температура как внутренних, так и периферических тканей вносит свой вклад в формирование терморегуляторных реакций (см. ниже). Однако температура внутренней среды обычно значительно более важна для терморегуляторного контроля и, следовательно, первична с точки зрения клинического интереса. Наиболее типичными точками мониторирования температуры внутренней среды являются дистальный отдел пищевода, барабанная перепонка, легочная артерия и носоглотка. Даже при быстротекущих температурных перепадах (например, во время искусственного экстракорпорального кровообращения) эти точки температурного мониторинга остаются надежными [209, 210]. При не слишком быстрых изменениях температуры внутренней среды достаточно хорошо ее отражают ректальная температура и температура мочевого пузыря [211, 212]. Температура внутренней среды может быть также оценена во рту или подмышечной ямке, но измерения в этих точках имеют тенденцию к невысокой точности [211]. С практической точки зрения дистальный отдел пищевода есть наиболее легкодостижимая и надежная точка мониторинга температуры внутренней среды во время общей анестезии. Ценность этих точек температурного мониторинга у детей и взрослых сопоставима [213].
Периферическая температура полезна для оценки чрескожного поступления тела в термо-регуляторную систему [214, 215], содержания тепла в теле (например, во время быстрого согревания после искусственного экстракорпорального кровообращения) и терморегуляторной вазокон-стрикции [216]. Чрескожное поступление в тер-морегуляторную систему обычно подсчитывается из четырех взвешенных по площади точек по формуле Раманатана (Ramanathan): 0,3(Тгрудь + + Ткисть) + 0,2(Тбедро + Тголени) [217]. Хотя применение формул с большим количеством точек обеспечивает большую точность [218], в дополнительных измерениях обычно необходимости нет.
Аналогичным образом комбинация средней температуры кожи и температуры окружающей среды может быть использована для определения средней температуры тела; из этого значения и
специфичного тепла тела людей (приблизитель» 0,83 ккал • кг"1 • "С"1 [219]) может быть рассчита на средняя температура тела. Для расчета средне) температуры тела по средней температуре кожи ] температуре внутренней среды предложено не сколько различных формул. Среди лучших пред ложенная Colin и соавт.: 0,66 • Твнутр + 0,34 • ТК(И в нейтральной среде и 0,79 *Твнутр + 0,21 *ТК0ЖИ теплой среде [208].
Важно понять, что эти формулы были вырабо таны на здоровых взрослых добровольцах при oi раниченном количестве постоянных ситуаци! До какой степени они остаются справедливыми перинаркозном периоде, неясно. Например, еле дует ли использовать "нейтральный" или " тел лый" коэффициент для анестезированного, гипс термичного пациента, находящегося чв холодно среде, да еще с вазодилатацией? Эти формуль требующие дальнейшего уточнения, должн применяться с известной осторожностью в пер* наркозном периоде, особенно в ситуациях с бь стрыми перепадами температур (например, бь строе согревание во время пробуждения при oi щей анестезии).
Необходимость интраоперационного мониторинга температуры
Для мониторинга температуры тела в перина! козном периоде существуют две основные npi чины: оценка содержания тепла в теле и подтве! ждение других клинических признаков злокач< ственной гипертермии.
Препараты, применяемые при мониториру мой общей или регионарной анестезии, не hhi циируют злокачественную гипертермию [77 220]. Тем не менее снижение температуры вну ренней среды при проведении анестезии име( место, особенно если операция сопряжена < вскрытием больших полостей тела [221], и час] манифестируется ознобом [222, 223]. Темперах ра внутренней среды должна также мониторир! ваться в процессе эпидуральной и спинальж анестезии у пациентов с вероятностью гипоте] мии.
Измерение температуры внутренней среды ц лесообразно в процессе большинства общих ан стезий как для облегчения диагностики злокач ственной гипертермии, так и для количественш оценки гипер- или гипотермии. Злокачественн; гипертермия лучше всего распознается по тая кардии и повышению концентрации РСОз в кои выдоха не соответствующим минутной вентил ции [129]. Тем не менее повышение температу£ внутренней среды помогает подтвердить диагно
В норме температура внутренней среды коле лется от 36,5 до 37,5 °С, в среднем около 37,0 °' Обычно в течение первых 30 мин после инду
 ции
она понижается на 0,5—1,5 °С. Гипотермия
является
результатом внутреннего перераспределения
тепла и ряда других факторов, важность
которых
у данного конкретного пациента
предсказать
непросто [224\.
В
итоге перепады внутренней
температуры, происходящие в первые 30
мин анестезии, нелегко интерпретировать.
Значительное
последующее снижение температуры
внутренней среды наиболее вероятно у
пациентов, подвергающихся большим
операциям, но опасность
злокачественной гипертермии сохраняется
у всех пациентов. Следовательно,
температуру
тела необходимо мониторировать у
большинства пациентов, подвергающихся
общей анестезии длительностью более
30 мин, и у всех пациентов,
чья операция длится более 1 ч. Изменения
температуры имеют тенденцию быть
особенно
быстрыми у младенцев; следовательно,
измерение температуры следует
начинать как можно скорее
после введения в анестезию.
ции
она понижается на 0,5—1,5 °С. Гипотермия
является
результатом внутреннего перераспределения
тепла и ряда других факторов, важность
которых
у данного конкретного пациента
предсказать
непросто [224\.
В
итоге перепады внутренней
температуры, происходящие в первые 30
мин анестезии, нелегко интерпретировать.
Значительное
последующее снижение температуры
внутренней среды наиболее вероятно у
пациентов, подвергающихся большим
операциям, но опасность
злокачественной гипертермии сохраняется
у всех пациентов. Следовательно,
температуру
тела необходимо мониторировать у
большинства пациентов, подвергающихся
общей анестезии длительностью более
30 мин, и у всех пациентов,
чья операция длится более 1 ч. Изменения
температуры имеют тенденцию быть
особенно
быстрыми у младенцев; следовательно,
измерение температуры следует
начинать как можно скорее
после введения в анестезию.
Нормальная терморегуляция
Существует три основных компонента системы терморегуляции: афферентное поступление, центральный контроль и эфферентный ответ. Полный контроль за температурой тела в экстремальных обстоятельствах требует эффективного функционирования каждого из этих компонентов. Почти очевидно, что терморегуляторная система развивалась не с нуля. Напротив, эволюция прогрессивно объединяла существовавшие ранее регуляторные системы, последовательно превращая их в эффективные регуляторы. Следуя этой логике, Satinoff [225] предложил каудально-ростральную иерархию регуляторного контроля. Нижние центры демонстрируют более скромную степень контроля, но обычно их вытесняют более точные регуляторные центры, расположенные в центральной нервной системе.
Афферентное поступление
Температурные ощущения передаются волокнами Ао (большинство холодных сигналов) и волокнами С (большинство теплых сигналов [226, 227\). Эти сенсоры распределены в организме, и представляется вероятным, что в различной степени в терморегуляторном контроле участвует большинство тканей. Но даже после десятилетий исследований точная роль различных тканей в температурном регулировании остается неясной. Однако термальная внутренняя среда (центральная нервная система и глубокие ткани брюшной и грудной полостей), очевидно, доминирует [228—23О\. Кожа вносит количественно меньший вклад, чем температура внутренней среды, однако, обеспечивая основной контакт с окружающей
Нарушения температуры 85
средой, она сохраняет свою значительную важность [214, 215]. Собственно, кожа обеспечивает 20 % контроля за автономными реакциями [231, 232], а также 50 % контроля за поведенческими реакциями (температурный комфорт) [233]. Важность чрескожного поступления такова, что в большинстве случаев перепады температуры внутренней среды выглядят незначительными по сравнению с широким спектром окружающей среды.
Является хорошо установленным» что темп из^ менений температуры кожи изменяет ее очевидную важность: быстрые изменения влияют на центральную регуляторную систему в 5 раз сильнее, чем сопоставимые изменения, происходящие медленно [234]. По крайней мере в пределах темпов изменений, испытываемых пациентами, не подвергающихся искусственному экстракорпоральному кровообращению, темп изменений температуры внутренней среды не выглядит существенно влияющим на амплитуду провоцируемых регуляторных реакций.
У млекопитающих гипоталамус, другие части мозга, спинной мозг и глубокие ткани грудной и брюшной полостей по отдельности отвечают приблизительно за 20 % центрального терморегу-ляторного контроля. Точные значения у людей неизвестны, не были они установлены и у педиатрических пациентов. У птиц основным термальным детектором является спинной мозг, роль которого значительно превышает таковую гипоталамуса. Степень, до которой относительно высокое соотношение поверхность кожи -*- внутренняя среда у детей усиливает чрескожное температурное поступление, остается неясной.
Центральный контроль
Satinoff предположил, что терморегуляторный контроль устроен по иерархическому принципу. Филогенетически наиболее древний и наименее точный контроль находится, вероятно, на уровне спинного мозга. Реакции этого уровня модифицируются более "новыми" и более точными ростральными центрами. Наиболее точный контроль в большинстве случаев исходит, по-видимому, из преоптической зоны гипоталамуса. Хотя эта модель была огромным шагом вперед по сравнению с предположениями об исключительно кожном или гипоталамическом контроле терморегуляции, есть данные о том, что настоящие контролирующие системы еще более сложны. Следовательно, модели следует использовать в случае, если они являются полезным инструментом обобщения экспериментальных данных. Тем не менее в большинстве случаев не следует думать, что они действительно показывают, как работает система.
4"
86 Анестезия в педиатрии
i

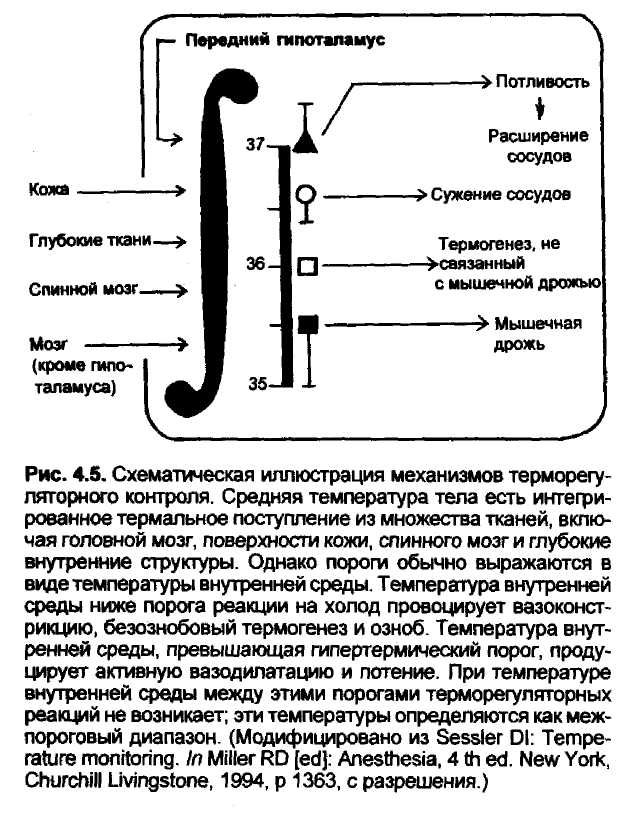
Терморегуляторная реакция содержит три аспекта: порог, прирост и максимальная интенсивность реакции. Порог есть температура тела, при которой инициируется специфическая реакция. На практике пороги обычно описываются в условиях температуры внутренней среды, с пони* манием того, что в порог вносит вклад температура кожи и других тканей. Нет необходимости, чтобы температуры тканей были сопоставимо интегрированы в каждый тип терморегуляторной реакции, но автономные реакции выглядят сходно интегрированными. В отличие от этого пове* денческие реакции могут зависеть в основном от температуры поверхности кожи (рис. 4.5) [212, 234, 239, 2Щ.
Прирост определяет скорость, с которой повышается интенсивность реакции с дальнейшими колебаниями температуры внутренней среды от инициирующего (тригтерного) порога. Практически это наклон кривой интенсивности реакции по сравнению с изменениями температуры внутренней среды. Типичен крайне высокий прирост терморегуляторных реакций. Не является необычным нарастание интенсивности терморегуляторной реакции с 10 до 90 % ее максимального значения с изменениями температуры внутрен-ней среды всего на несколько десятых градуса [241—244]. Максимальная интенсивность реакции определяется просто как наибольшая интенсивность, наблюдаемая в процессе перепадов температуры внутренней среды, значительна превышающих пороговые.
Температура, не инициирующая автономную терморегуляторную реакцию, определяется как межпороговый диапазон. Так как вазоконстрик-ция, усиливающая артериовенозное шунтирова* ние, является первой реакцией на холод, а потение является первой реакцией на тепло, температуры между этими порогами соответственно определяются как межпороговый диапазон. У людей в норме этот диапазон составляет приблизительно 0,3 °С. Лишь небольшое дальнейшее колебание температуры внутренней среды нужно для инициирования термогенеза без озноба либо озноба и активной вазодилатации. Тщательный контроль температуры внутренней среды необходим не только потому, что мал межпороговый диапазон, но и потому, что велик прирост терморегуляторных реакций. Прирост терморегуляторных реакций действительно высок: в некоторых случаях он высок настолько, что не может быть идентифицирован. Например, вазоконстрикция может определяться по принципу "есть — нет". Прирост для потения можно выявить, но он довольно высок (например, 1500 г • м2 • ч1 • ОС). Так как приросты ва-зоконстрикции и потения высоки и так как эти реакции эффективны, только очень серьезные
перепады среды инициируют озноб или активную вазодилатацию.
Взаимодействие между различными терморегу-ляторными реакциями определяется частично регуляторными предпочтительностями. Например, вазоконстрикция в норме инициируется ранее озноба. В результате реакция, требующая меньшего количества нутриентов и минимально нарушающая функцию, мобилизуется ранее другой, более ценной метаболически. Еще более сложно устроено взаимодействие между терморе-гуляторными и нетерморегуляторными реакциями. У млекопитающих поддержание температуры тела имеет высокую степень приоритета. Тем не менее в особых ситуациях терморегуляторный контроль может быть принесен в жертву ради поддержания еще более точно регулируемых параметров. Например, даже в условиях водного истощения потение у пациента с гипертермией вначале продолжается, однако прекращается, когда истощение внутрисосудистого объема достигает крайней степени. Типичным результатом, если не произойдет изменения окружающей среды или не восстановится внутрисосудистый объем, является гипертермия внутренней среды и тепловой удар.
Эфферентные реакции
Подавляющее большинство основных терморегу-ляторных реакций у человека на экстремальные воздействия внешней среды являются поведенческими. Примерами поведенческих реакций являются поиск убежища, теплой одежды, регулировка термостата, поиск позиции, минимизирующей или максимализирующей отдачу тепла в окружающую среду. Общая эффективность поведенческих реакций намного превосходит возможности автономных реакций, вместе взятых. Следовательно, существовать в условиях экстремальных проявлений внешней среды человеку позволяют именно поведенческие реакции.
Первичной реакцией на холод является вазоконстрикция с артериовенозным шунтированием. В термонейтральных условиях артериовеноз-ные шунты открыты, и периферический кожный кровоток уже является максимальным. Воздействие холодом снижает шунтирующий кровоток без существенного изменения капиллярного кровотока. Напротив, тепловой стресс драматически повышает капиллярный кровоток без ослабления шунтирующего кровотока по сравнению с его термонейтральными значениями.
Артериовенозные шунты есть сосуды 100 мкм, расположенные только в коже, покрывающей большую часть дистальных частей тела, включая пальцы рук и ног, нос [245\. Кровоток через артериовенозные шунты превышает таковой через
Нарушения температуры 87
сравнимой длины капилляры диаметром 10 мкм в 10 000 раз [246\. Хотя количество капилляров значительно превышает количество шунтов даже в пальцах рук и ног, шунтирующий кровоток достаточен для того, чтобы повысить кровоток в пальцах рук более чем в 10 раз [247\. В результате кровоток пальцев рук в тепле обычно превышает локальные трофические потребности в 100 раз.
К сожалению, потеря тепла не является линейной функцией периферического кровотока. Так, даже 10-кратное снижение кровотока пальцев рук уменьшает потери тепла в значительно меньшей степени. Эффект шунтирующей вазо-констрикции значительнее, чем можно вообразить, вследствие снижения кровотока в руке, приводящего к охлаждению проксимальных ее тканей, что само по себе снижает чрескожную потерю тепла. По всему телу терморегуляторная вазоконстрикция снижает потери тепла на 25— 50 % в зависимости от исходной температуры окружающей среды и длительности вазоконстрик-ции. Для полного снижения температуры периферических тканей и, таким образом, максимального снижения чрескожных потерь тепла требуется многочасовая вазоконстрикция.
Медиатором терморегуляторной вазоконстрик-ции являются а-адренергические нервы. Хотя доминирует центральный контроль, сосудистый тонус модулируется и местной температурой. Следовательно, центрально-инициированная вазоконстрикция более интенсивна при низкой температуре кожи, чем при высокой. В пределах типичного клинического диапазона температур кожи центральный контроль означает значительно больше, чем местный контроль кровотока кожи.
Безознобный термогенез определяется повышением метаболической теплопродукции, не сопровождающейся мышечной активностью. В основном безознобный термогенез происходит в особой ткани, называемой коричневым жиром (ткань, имеющая в основном коричневый цвет вследствие чрезвычайно высокой плотности митохондрий). Коричневая жировая ткань иннерви-руется а-адренергическими нервами через местный расщепленный протеин. Хотя активация безознобного термогенеза сопровождается двукратным повышением циркулирующего норэпи-нефрина, циркулирующие катехоламины оказывают не слишком большое влияние на активацию коричневого жира. Есть данные о том, что в безознобном термогенезе участвуют и другие ткани, включая скелетные мышцы.
Безознобный термогенез является наиболее важной терморегуляторной реакцией на холодо-вой стресс у мелких млекопитающих. Например, у крыс метаболическая теплопродукция повышается в холодной среде до возникновения озноба
88 Анестезия в педиатрии
на 300 %. Безознобный термогенез в целом более важен у молодых животных, чем у старых. Безознобный термогенез либо не возникает у взрослых людей, либо его колебания слишком малы, чтобы иметь клиническое значение [248, 249\. Напротив, у новорожденных под воздействием холода метаболическая продукция тепла может удваиваться [250, 25Ц. Подобная реакция наблюдается даже у недоношенных младенцев (например, с массой тела 1500 г) [252]. Клинически значимый безознобный термогенез наблюдается лишь в первые 2 года жизни.
Младенцы не дрожат, вероятно, вследствие незавершенности формирования скелетно-мы-шечной системы. Более того, так как младенцы имеют столь малую мышечную массу, представляется маловероятным, что озноб смог бы внести вклад в борьбу с холодом. Зависимость выраженности озноба от возраста полностью не выяснена, но эта реакция, вероятно, не имеет существенного значения до раннего детства.
Существуют две автономные реакции на тепловой стресс: потение и активная прекапилляр-ная вазодилатация. Потение осуществляется при участии постганглионарных, холинергических, симпатических нервов [255]. Эти нервы оканчиваются в потовых железах кожи, распространенных широко, но неравномерно. Пот является ультрафильтратом плазмы, из которого реабсор-бируется значительная часть электролитов. Содержание натрия, калия и лактата в поте зависит от скорости потоотделения, сосудистого тонуса и состояния мускулатуры [254]. Потение начинается с грудной клетки и распространяется к более дистальным частям кожной поверхности. Даже при максимальной скорости потоотделения в области грудной клетки она выше, чем в других зонах. Неразвитые в физическом отношении люди могут потеть со скоростью до 1 л в час, у подготовленных атлетов эта скорость может быть в 2 раза выше [255, 256]. Потение является заметной защитой от гипертермии. В сухих условиях потение может рассеивать до 10 объемов основного метаболизма. Только испаряющийся пот рассеивает тепло (в отличие от вытирания тела), но каждый грамм испарившейся воды абсорбирует 0,58 ккал. Эффективность потения была продемонстрирована одним ученым, остававшимся в атмосфере воздуха с температурой 250 °F в течение 1 ч, при этом не получив ни ожога, ни гипертермии.
Так как потение зависит от испарения, его эффективность полностью блокируется при относительной влажности окружающей среды, приближающейся к 100 %. Напротив, его эффективность возрастает при достаточной конвекции. Так как в роли медиаторов потения выступают холинергические нервы, даже малая доза атропи-
на (например, 0,5 мг) практически блокирует эту реакцию [257, 258]. Напротив, местное нанесение холинергических агонистов, например пилокарпина, вызывает энергичное потение.
Активная прекапиллярная вазодилатация способна повышать кожный кровоток до невероятной степени. Подобная реакция свойственна только человеку и не наблюдается даже у других приматов. Во время тяжелого теплового стресса кровоток верхнего миллиметра кожи может равняться объему сердечного выброса в покое. Механизм, при помощи которого тепловой стресс активирует прекапиллярную вазодилатацию, остается неясным. Однако создается впечатление, что медиатором вазодилатации является неизвестный пока трансмиттер, вырабатываемый потовыми железами [253]. Медиатор вполне может быть пептидом, так как стандартные адренерги-ческие и холинергические блокаторы не предотвращают эту реакцию. В целом активная вазодилатация инициируется после потения, хотя были отмечены явные исключения. Практически активная вазодилатация усиливает терморегулятор-ные реакции на тепловой стресс переносом тепла от внутренних тканей к поверхности кожи, где оно может быть рассеяно испарением.
Терморегуляция во время общей анестезии
Общая анестезия повышает межпороговый диапазон с нормального значения, равного приблизительно 0,3 °С, до приблизительно 4 °С (рис. 4.6 и 4.7). Существует вероятность того, что температура остается четко ощущаемой на протяжении анестезии, но температуры, не выходящие за пределы межпорогового интервала, просто не воспринимаются как требующие автономных реакций. Однако даже когда температура тела существенно сдвигается от нормальной к инициирующей, терморегуляторные реакции, поступление и максимальная интенсивность этих реакций остаются почти нормальными [241, 259].
Заметно измененные терморегуляторные пороги с относительно неплохо сохраненными приростом и максимальной интенсивностью находятся в полном контрасте с влиянием анестезии на большинство других гомеостатических систем. Например, общая анестезия "сдвигает вправо" и "уплощает" кривую реакции СО2. Эта необычная модель обусловленного анестезией терморегуля-торного ингибирования согласуется с иерархической терморегуляторной системой, в которой наиболее точный контроль (т. е. пороги) определяется гипоталамусом и другими ростральными структурами, относительно чувствительными к анестетикам [225]. В отличие от этого "механические детали" этих реакций (например, прирост и
90 Анестезия в педиатрии
Поведенческая терморегуляция обычно имеет незначительные последствия во время общей анестезии, так как пациент находится без сознания и часто парализован. Влияние общей анестезии на поведенческую регуляцию у людей еще не получило специфической оценки. Тем не менее клинические наблюдения позволяют предположить, что пациент в прохладной окружающей среде часто ощущает тепло после введения различных седативных препаратов. Аналогично этому мыши, получившие субанестезирующие концентрации закиси азота, выбирают более прохладное помещение, чем получившие только воздух [261].
Холодоеые реакции
Все анестетики, когда либо испытанные, значительно снижают терморегуляторный порог вазо-констрикции. Типичные клинические дозы гало-тана (0,86 % в конце выдоха [262]), энфлурана [263] и закиси азота/фентанила [264], десфлурана [265], севофлурана [266] и пропофола [267] снижают порог до приблизительно 34—35 "С; комбинация пропофола с закисью азота продуцирует, очевидно, еще большее угнетение [268]. Термо-регуляторная вазоконстрикция (обычно начинающаяся при температуре ниже 37 °С) не возникает под влиянием клинических доз большинства анестетиков. При обычной дозировке изо-флурана она возникает при снижении температуры примерно до 34 °С. Ингибиция, вызываемая летучими анестетиками, имеет нелинейный характер (зависит преимущественно от высокой концентрации). В противоположность этому ингибиция, провоцируемая пропофолом и опиои-дами, бывает линейной.
Изменения терморегуляторной вазоконстрик-ции во время как галотановой [269], так и изо-флурановой [270] анестезии у младенцев, детей и взрослых схожи (рис. 4.8). Однако у пожилых лиц вазоконстрикция наступает при температуре внутренней среды приблизительно на 1,5 °С ниже, чем у молодых взрослых. Супрамаксимальная болевая стимуляция во время энфлюрановой анестезии повышает порог всего лишь приблизительно на 0,5 °С по сравнению с нестимулируе-мыми анестезированными добровольцами [263]. Эти данные позволяют предположить, что термо-регуляторные реакции сходны при больших и малых хирургических вмешательствах и в случаях, когда боль от хирургического вмешательства блокируется регионарной или местной анестезией. Быстрые перепады температуры кожи проду-
цируют существенно большие терморегулятор-ные реакции, чем сопоставимые изменения, происходящие медленно [214, 234]. Тем не менее скорость температурных изменений внутренней среды (в пределах типичного клинического диапазона) не выглядит повышающей пороги вазо-констрикции.
Будучи инициирована, максимальная интенсивность вазоконстрикции во время анестезии сходна с таковой у неанестезированных пациентов [259]. Как и у неанестезированных пациентов, вазоконстрикция либо "есть", либо ее "нет". Таким образом, прирост терморегуляторной вазоконстрикции чрезвычайно высок в обоих случаях.
Безознобный термогенез не увеличивает продукцию тепла во время анестезии у взрослых [271], что вряд ли неожиданно, поскольку подобные реакции, по всей видимости, не имеют большого значения у взрослых и вне наркоза [248, 249]. Однако охлаждение и глубокая гипотермия не в состоянии усилить темпы метаболизма у младенцев во время наркоза [272]. Недостаток отсутствия озноба частично определяется тем, что летучие анестетики ингибируют соответствующие реакции на периферии [273].
У взрослых постнаркозный озноб часто осложняет пробуждение после анестезии, сопровождавшейся гипотермией [274]. Младенцы, однако, не испытывают озноба, редок озноб и у детей бо-
Нарушения температуры 91

Тепловые реакции
Изофлурановая анестезия продуцирует дозозави-симое повышение порога потения. Однако повышение порога потения значительно менее выражено, чем понижение порога вазоконстрикции. Например, 1,2 % изофлурана понижает порог вазоконстрикции приблизительно до 33 "С, но повышает порог потения только до 38,2 °С. Причины столь значительного различия этих реакций остаются невыясненными. Телеологически, однако, агрессивная реакция на гипертермию разумна, так как гипертермия значительно более опасна, чем сравнимая гипотермия.
Интересно, что хотя порог потения при изо-флурановой анестезии существенно повышается, прирост этой реакции остается нормальным при любых концентрациях изофлюрана. Аналогично максимальная интенсивность потения при эн-флурановой анестезии снижается минимально, если снижение вообще происходит (рис. 4.9) [241]. Порог потения от 0,2 до 0,5 "С выше у женщин, чем у мужчин, и это различие во время изофлюрановой анестезии сохраняется.
Дегидратация существенно уменьшает продукцию пота, особенно при сочетании ее с физической нагрузкой. Без адекватного потения тело неспособно рассеивать тепло физической нагрузки в теплой окружающей среде, что приводит к драматическому повышению температуры внутренней среды (тепловой удар).
Порог прекапиллярной артериальной вазоконстрикции во время анестезии повышается параллельно с порогом потения [241, 277\. Хотя прирост и максимальная интенсивность кожной гиперемии во время анестезии формально не были определены количественно, они выглядят вполне сохраняющимися. Так как эта вазодилатация является активным процессом, кожный кровоток у лиц, температура внутренней среды которых превышает порог вазодилатации, при местной блокаде нерва понижается [241]. Следовательно, максимальный кожный кровоток во время анестезии, что может быть желательно при микрососудистой хирургии, лучше всего продуцируется гипертермией внутренней среды, чем регионарной анестезией.
У анестезированных младенцев терморегуля-торное потение не выглядит важной реакцией, возможно, потому, что продукция и сохранение тепла для детей сложнее, чем его рассеивание. Возраст, при котором потение становится важным, все еще нуждается в уточнении.
Баланс тепла во время общей анестезии
Термостабильность определяется как равенство между потерями тепла в окружающую среду и метаболической теплопродукцией. Следовательно, если необходимо поддержание температуры тела, потери тепла должны быть равны его продукции. Показатель основного метаболизма у людей приблизительно равен 100 Вт, но при физической нагрузке он увеличивается в 5—10 раз.
Температура тела (и, следовательно, содержание тепла) неоднородна. Терморегуляция поддерживает температуру внутренней среды почти постоянной. Однако температура периферических тканей поддерживается не так хорошо, формирование при помощи тонической вазоконстрикции температурного градиента в 1—5 "С между внутренней средой и периферией типично. В силу своей анатомической массы ноги представляют собой основной периферический термальный буфер.
Теплоемкость периферического термального буферного компартмента составляет приблизительно 150 ккал (т. е. содержание тепла в организме может меняться в пределах этой величины без изменений температуры внутренней среды). Периферический термальный буфер позволяет человеку терять тепло в холодной среде или аб-
92 Анестезия в педиатрии
сорбировать в теплой без изменений температуры внутренней среде. Эта стратегия минимизирует надобность в автономных реакциях, которые могут недешево обходиться с точки зрения метаболических потребностей, использования резервов или поведенческих требований.
Перенос тепла
Тепло теряется или поступает из окружающей среды четырьмя путями; каждый термодинамический механизм полностью обратим и может приводить к чистым потерям или поступлению тепла одинаково легко. В типичной окружающей среде существенна потеря тепла с поверхности кожи посредством излучения. Однако одновременно кожа тем же путем абсорбирует из окружающей среды определенное количество тепла. И только разница между поступлением и потерями составляет чистый перенос тепла. Поступление тепла с излучением пропорционально разнице четверти энергии кожи и средней температуры излучения окружающей среды. Когда температура кожи и окружающей среды отличаются не слишком сильно, можно рассматривать перенос тепла излучением как линейную функцию разницы между этими двумя температурами без значительного ущерба для точности.
Кондуктивный перенос тепла также пропорционален разнице между температурами кожи и окружающей среды. Однако постоянство пропорциональности очень жестко связано со свойствами материала, контактирующего с кожей: хорошие проводники, такие как металл или вода, переносят тепла в 50 раз больше, чем воздух. Кондуктивный перенос в воздух может усиливаться драматически при разрушении барьера из неподвижного воздуха (великолепного теплоизо-лятора), прилежащего непосредственно к коже. Этот процесс называется конвекцией и повышает теплоток в соответствии с величиной квадратного корня из скорости воздуха [278\.
Испарение является последним механизмом чрескожного переноса тепла. Неощутимые потери с поверхности кожи (без потения) у взрослых невелики, составляя всего около 10 % потерь тепла основного метаболизма. Напротив, потери с испарением через тонкую кожу могут быть значительным фактором общих потерь тепла у младенцев, особенно у недоношенных [279—281]. Как обсуждалось выше, потение заметно повышает чрескожную потерю тепла. Потери тепла с испарением во время обработки кожи перед операцией обычно малосравнимы с другими источниками гипотермии, даже при обработке больших поверхностей [282].
Потери тепла в связи с испарением происходят также в легких, когда вдыхаемый сухой воз-
дух увлажняется в трахеобронхиальном дереве. Однако респираторные потери тепла в связи с испарением всегда остаются лишь незначительной частью метаболизма. Некоторая дополнительная потеря тепла с дыханием происходит, когда холодный вдыхаемый воздух согревается до уровня температуры тела; вследствие специфически медленного согревания воздуха вклад этого вида потерь в общий баланс тепла ничтожно мал [283].
Модели интраоперационной гипотермии
Температура тела, в норме хорошо поддерживаемая даже в холодной окружающей среде, после введения в общую анестезию снижается стремительно. Это снижение относили на счет обнаженности пациента в прохладной среде, вазодилата-ции (повышающей температуру кожи), вызванной анестетиками, испарением препаратов, применяемых для обработки кожи, потерь тепла с операционного поля и обусловленного анестезией угнетения метаболизма. Однако общая анестезия снижает теплопродукцию приблизительно всего на 20 %, и вызванная анестетиками вазоди-латация увеличивает потери тепла минимально [224, 284]. Более того, гипотермия быстро развивается после введения в анестезию даже у добровольцев, чья кожа не обрабатывалась [224] и кому операция не проводилась [285]. Эти данные указывают на то, что быстрая стартовая гипотермия является результатом внутреннего перераспределения тепла организма из центральных отделов внутренней среды к периферическим тканям, имеющим более низкую температуру [224]. В большинстве случаев для перераспределительной гипотермии необходимо приблизительно 40 мин, и наблюдается снижение температуры внутренней среды на 1—1,5 °С. Так как перераспределение полностью происходит внутри, содержание тепла в организме и средняя температура тела остаются постоянными (рис. 4.10).
За перераспределительной гипотермией наступает медленное, почти линейное снижение температуры внутренней среды, обычно продолжающееся 2—3 ч. Это линейное снижение, очевидно, является результатом превышения теплопотерь над метаболической теплопродукцией [286]. Так как во время анестезии теплопродукция остается почти постоянной, скорость развития гипотермии в этот период определяется главным образом потерями тепла. Как упоминалось выше, респираторные потери тепла составляют малую часть метаболической продукции [283]. Основными факторами, определяющими теплопотери, являются температура окружающей среды, теплоизоляция, обеспечиваемая хирургическим простыня-
После 3—4 ч анестезии и операции снижение температуры внутренней среды прекращается. Эта фаза плато может наступить при относительно высокой температуре (например, 35,5 °С) у пациента с минимальными потерями тепла в окружающую среду [289\. Но чаще температурное плато внутренней среды наступает при более низкой температуре (например, 34,5 °С) и сопровождается периферической терморегуляторной вазоконстрикцией [290\.
Совпадение наступления плато температуры внутренней среды с вазоконстрикцией первоначально дало основания полагать, что снижение кожного кровотока существенно уменьшает потерю тепла через кожу в окружающую среду. Однако последующее изучение показало, что снижение скорее всего было недостаточно существенным для того, чтобы вызвать термостабильное состояние [259\. Более того, в течение нескольких часов после наступления плато температуры внутренней среды содержание тепла в ноге продолжало снижаться [290, 291]. Эти данные указывают на то, что плато температуры внутренней среды наступает тогда, когда терморегуляторная вазоконстрикция снижает чрескожную теплопо-терю и ограничивает метаболическое тепло внутренним термальным компартментом.
Во время плато температуры внутренней среды метаболическая теплопродукция (остающаяся почти постоянной) в основном поддерживается в пределах относительно небольшого внутреннего термального компартмента. Так как метаболическое тепло теперь ограничено только приблизительно половиной массы тела, температура внутренней среды остается почти постоянной. Напротив, периферические ткани становятся гипо-термичными даже с еще более высокой скоро-
Нарушения температуры 93
стью, так как потеря тепла в окружающую среду ослабевает несущественно, а поставки тепла от внутренних тканей становятся минимальными. В результате ограничение метаболического тепла в центре внутренней среды восстанавливает нормальный температурный градиент между внутренней средой и периферией. Для клинициста важно понять, что постоянная температура внутренней среды во время фазы плато может маскировать продолжающееся снижение содержания тепла в организме.
В большинстве случаев различия между тепловым балансом взрослых и педиатрических пациентов исследованы не были. Тем не менее некоторые особенности педиатрической анатомии потенциально способны изменять характер ин-траоперационных теплопотерь. Дети, включая младенцев, имеют относительно большую округлость тела с большей массой, сосредоточенной в торсе, в отличие от взрослых. Следовательно, у младенцев перераспределение может вносить меньший вклад в интраоперационную гипотермию. Так же и голова у младенцев представляет собой значительно большую фракцию общей по-
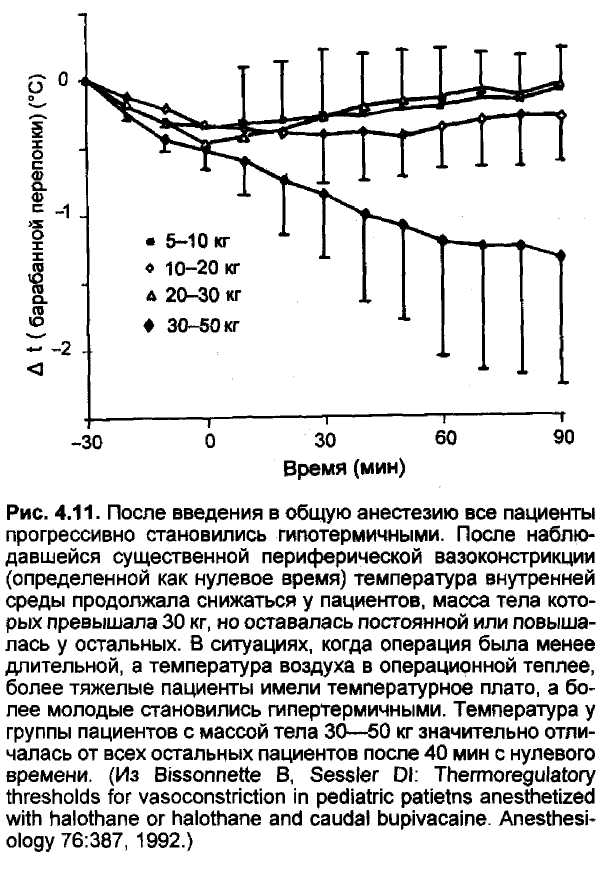
94 Анестезия в педиатрии
 верхности
тела, чем у взрослых. Чрескожные потери
тепла с головы у взрослых не больше
тех, которых
можно было бы ожидать в соответствии
с
площадью поверхности ее кожи. Однако
у младенцев
потери тепла с головы могут составлять
пропорционально большую фракцию общей
теп-лопотери, вероятно, вследствие
того, что тонкие череп
и скальп делают возможным потери тепла,
доставляемого
к головному мозгу.
верхности
тела, чем у взрослых. Чрескожные потери
тепла с головы у взрослых не больше
тех, которых
можно было бы ожидать в соответствии
с
площадью поверхности ее кожи. Однако
у младенцев
потери тепла с головы могут составлять
пропорционально большую фракцию общей
теп-лопотери, вероятно, вследствие
того, что тонкие череп
и скальп делают возможным потери тепла,
доставляемого
к головному мозгу.
Чрескожные потери тепла грубо пропорциональны поверхности кожи, в то время как метаболическая теплопродукция в значительной степени является функцией массы. Следовательно, младенцы и дети легче теряют значительное количество тепла (в сравнении с его продукцией) через поверхность кожи. Тем не менее, как упоминалось выше, терморегуляторная вазоконст-рикция хорошо поддерживается у педиатрических пациентов [270, 292]. Кроме того, безозноб-ный термогенез существенно повышает метаболическую теплопродукцию у младенцев, достигших заметной гипотермии. Вазоконстрикция и безознобный термогенез, будучи инициированы, взаимодействуют у младенцев для предотвращения дальнейшей гипотермии. Так как взрослые не обладают сопоставимым механизмом повышения метаболической теплопродукции, терморегу-ляторные реакции у детей, включая младенцев, более эффективны, чем у взрослых (рис. 4.11),
Регионарная анестезия
Гипотермия во время регионарной анестезии выражена почти так же жестко, как и во время общей [221, 293], и вызывает осложнения, включая ознобоподобный тремор (недопустимо повышающий скорость метаболических процессов у пациента) [212, 222], нарушения коагуляции [294], пролонгирование действия лекарств [295], отрицательный послеоперационный азотный баланс [296]. Похожая термальная лабильность имеет место у пациентов с полным поперечным поражением спинного мозга, становясь в некоторых случаях причиной серьезных проблем [297\. Гипотермия во время хирургической операции является отчасти результатом воздействия окружающей среды [285], в то время как гипотермия без анестезии имеет место только при критических воздействиях. Эти данные указывают на реальность вклада обусловленных анестезией тер-морегуляторных нарушений в интраоперацион-ную гипотермию.
Регионарная анестезия может взаимодействовать с одним или более компонентом терморегуляции: афферентные ощущения, центральный контроль и эфферентные реакции [237]. Эфферентные терморегуляторные реакции, включая потение, вазоконстрикцию и озноб, являются ак-
тивными нейрогенными процессами, очевидно угнетаемыми в зонах, блокированных спиналь-ной или эпидуральной анестезией [298—ЗЩ. Каждый из этих эффекторов продуцирует клинически значимую защиту от перепадов температуры [301—303]. Вызванное анестезией ингибирование этих эфферентных терморегуляторных реакций, таким образом, вносит существенный вклад в развитие гипотермии во время регионарной анестезии. Например, угнетение тонической термо-регуляторной вазоконстрикции является основной причиной гипотермии внутренней среды в течение первых часов эпидуральной анестезии [223].
Однако, даже если ограничить обсуждение реакциями, происходящими выше уровня, обусловленного анестезией симпатического и моторного блока, пороги реакций останутся патологическими. Впервые терморегуляторная недостаточность во время регионарной анестезии была выявлена Roe в 1972 г. [304]. Они обнаружили, что гипотермия от 1 до 3 "С была типична во время спи-нальной анестезии, и приводили в качестве причины то обстоятельство, что ознобный порог был на 1 °С ниже нормы. Сходная патологическая толерантность к внутренней гипотермии также имеет место при эпидуральной анестезии у пациентов [304] и добровольцев [223, 305, 306].
Представляется маловероятным прямое влияние регионарной анестезии на центральный тер-морегуляторный контроль. Может иметь место некоторое прохождение афферентных термальных сигналов на уровне поясничного отдела спинного мозга [230], но данные, полученные в исследованиях на животных, дают основание полагать, что почти вся интеграция происходит на более высоких уровнях (таких, как ствол головного мозга, средний мозг и гипоталамус) [228— 230]. Представляется маловероятным, что небольшие объемы местного анестетика, введенные интратекально во время спинальной анестезии, диффундируют рострально в количестве, достаточном для анестезии высших регуляторных центров. (Введенные спинально опиоиды диффундируют рострально, но эти препараты значительно сильнее местных анестетиков.) Нет данных о прямом влиянии местных анестетиков, введенных в субарахноидальное пространство, на другие церебральные регуляторные системы. Более того, при эпидуральной анестезии анестетики вводятся, не достигая арахноидальной и дураль-ной мембран, и проникновение достаточного их количества в цереброспинальную жидкость мало- • вероятно. Тем не менее эпидуральная анестезия нарушает терморегуляторные реакции.
Альтернативно эпидуральная анестезия может нарушать центральную терморегуляцию опосредованно, через абсорбцию местного анестетика в
Нарушения температуры 95
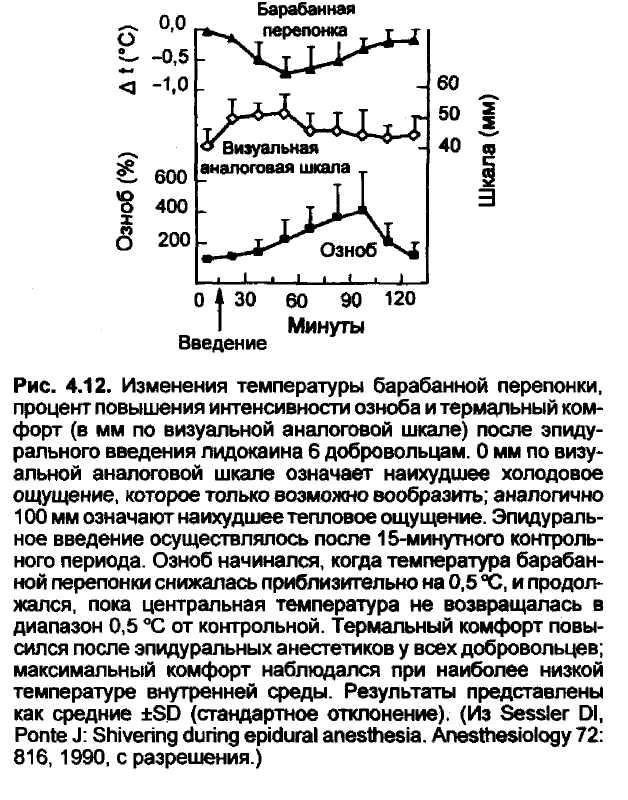
Спинальная и эпидуральная анестезия почти определенно изменяют афферентную передачу термальных сигналов. Было документировано наличие температурных рецепторов спинного мозга у всех исследованных млекопитающих [230]; вероятно, они есть и у людей. Эти рецепторы обеспечивают приблизительно 20 % общей термальной информации, поставляемой в центральную регуляторную систему [229, 308\. Эпидуральное или интратекальное введение холодного местного анестетика может оказаться тем не менее достаточным для инициации терморегуляторных реакций. Озноб, однако, не может быть инициирован у небеременных добровольцев даже эпиду-ральным введением большого количества ледяного физиологического раствора [309]. Более того, частота случаев озноба, вызванного теплым или холодным анестетиком во время эпидуральной анестезии, сопоставима у пациентов [222] и добровольцев [ЗЩ.
Температуры кожи и окружающей среды вносят вклад в терморегуляцию, при этом вклад температуры кожи составляет 10—20 % общего [214, 215, 231]. Большинство тепловых рецепторов кожи при температуре 37 °С и ниже находятся в состоянии покоя [234]. Следовательно, при типичной температуре окружающей среды преимущественно холодовые сигналы будут поступать в центральную терморегуляторную систему [234]. Регионарная анестезия блокирует всю термальную информацию от нижней части тела, в том числе нарушает и доставку большинства тонических Холодовых сигналов. Соответственно выглядит вероятным, что центральная терморегулятор-ная система интерпретирует их отсутствие как тепло. В поддержку этой гипотезы говорит термальный комфорт, наблюдаемый после индукции эпидуральной анестезии, несмотря на одновременное понижение температуры внутренней среды [222, 223]. Следовательно, регуляторные реакции на термальные перепады могут быть нарушены, так как регионарная анестезия повышает кажущуюся температуру нижней половины те-
ла в значительно большей степени, чем повышает действительную температуру тканей. Данная теория, тем не менее, требует подтверждения.
В то время как ознобоподобный тремор при пробуждении после общей анестезии содержит патологический компонент, непроизвольная мышечная активность во время регионарной анестезии является нормальным терморегуля-торным ознобом. Ей предшествует гипотермия внутренней среды и вазоконстрикция выше уровня блока, и при миографическом анализе структуры тремора не удалось обнаружить патологических клонических сигналов, иногда наблюдающихся при пробуждении после общей анестезии (рис. 4.12). Существует также не поддающийся терморегуляции компонент ознобо-подобного тремора, возникающий при эпидуральной анестезии и появляющийся в связи с болью [311].
Удивительно, но вазодилатация, обусловленная регионарной анестезией, лишь минимально повышает чрескожные потери тепла в окружающую среду. В большинстве случаев метаболическая теплопродукция после начала эпидуральной анестезии либо остается постоянной, либо повышается. В то же время в результате перераспределения тепла от внутренней среды к периферии
J
96 Анестезия в педиатрии
200
г-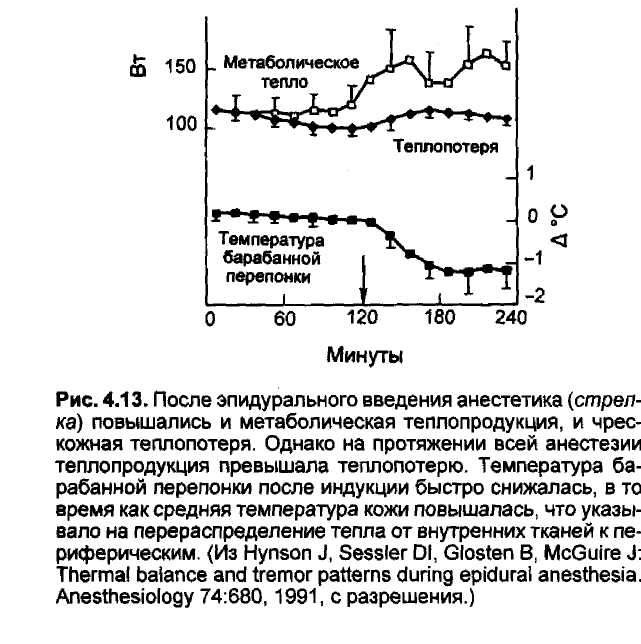
Последствия гипотермии
Перинаркозная гипотермия вызывает потенциально тяжелые осложнения, но может быть и явным преимуществом. Осуществление термального обеспечения требует, таким образом, такого же тщательного осмысления и анализа потенциальных опасностей, как и другие терапевтические решения.
Преимущества
Гипотермия обеспечивает существенную защиту от тканевой ишемии и гипоксии. Температура внутренней среды между 25 и 30 °С длительное время использовалась для церебропротекции при кардиопульмональном шунтировании. Защита, обеспечиваемая еще более низкими температурами, позволяет перенести полную остановку кровообращения. Однако в последнее десятилетие наблюдается крепнущая уверенность, что понижение температуры внутренней среды всего на 2—3 °С обеспечивает большую защиту от ишемии, чем любые фармакологические средства [314—316]. Точный механизм, при помощи которого умеренная гипотермия обеспечивает столь существенную защиту, остается невыясненным. Однако ясно, что гипотермия обеспечивает за-
щиту в значительно большей доле, чем понижает метаболическую активность.
Вследствие ее замечательного защитного эффекта умеренная гипотермия показана пациентам, подвергающимся вмешательствам, чреватым тканевой ишемией (например, нейрохирургия). Не стоит пренебрегать потенциальными преимуществами умеренной гипотермии при соответствующих вмешательствах у педиатрических пациентов.
Опасности
Люди слабо ощущают температуру внутренней среды [212], но температура кожи грубо следует за температурой внутренней среды и гипотер-мичные послеоперационные пациенты чувствуют себя менее комфортно, чем те, у кого поддерживалась нормотермия [233, 274]. Хотя комфорт не является жизнеспасающим обстоятельством, клиницистам, возможно, следует относиться к нему более серьезно, ведь так много пациентов запомнили чувство холода как наихудший момент хирургического вмешательства. Нет оснований полагать, что при гипотермии дети испытывают меньший дискомфорт, чем взрослые.
Местная гипотермия снижает функцию тромбоцитов [294]. Так как температура в ране не может превышать температуру внутренней среды, гипотермия, вероятно, способствует интраопера-ционным кровотечениям. Напротив, протромби-новое время и частичное тромбопластиновое время (ПВ и ЧТВ), очевидно, остаются нормальными при температуре выше 33 °С [317, 318], а время лизиса эутлобулинового сгустка при гипотермии удлиняется [319]. Нарушения коагуляции, сочетающиеся с легкой гипотермией (только на 1,6 °С), значительно увеличивают кровопо-терю и потребность в переливании крови при операции артропластики на тазобедренном суставе [320, 321]. Вполне вероятно, что пропорцио-т нальное нарастание кровопотери имеет место и при других процедурах у детей.
Умеренная гипотермия существенно удлиняет время действия векурониума и атракуриума [295\. Длительность действия векурониума у пациентов с температурой внутренней среды 34,5 "С более чем вдвое превышает таковую у пациентов с температурой 36,5 °С и почти равна таковой у пан-курониума в норме. Продолжительность действия атакуриума также увеличивается на фоне гипотермии [322]. Таким образом, мониторинг судорожной реакции на стимуляцию локтевого нерва особенно важен у гипотермичных пациентов.
Одно проспективное [296] и несколько ретроспективных [323] исследований позволили задокументировать факт того, что интраоперацион-
i
ная гипотермия повышает послеоперационную экскрецию азота. Хотя клиническая значимость этого наблюдения остается неясной, есть предположение, что у перенесших гипотермию пациентов возможны трудности с заживлением операционных ран. Раневая инфекция является наиболее типичным серьезным осложнением операции и анестезии, вызывая большую заболеваемость, чем все анестезиологические осложнения, вместе взятые. По некоторым данным, гипотермия нарушает иммунный ответ на раневую инфекцию: гипотермия внутренней среды в 3 °С снижает повреждающий размер и бактериальный клиренс после тестового инфицирования морских свинок Staphylococcus aureus и Escherichia coli [324, 325]. Инфекция аггравируется, по-видимому, в основном нарушением иммунной функции [326, 327], но, возможно, вносит свой вклад также и снижение кожного кровотока [328\. Легкая степень гипотермии, развивающаяся на фоне подобных нарушений, увеличивает частоту раневой инфекции в 3 раза и удлиняет сроки госпитализации на 20 % [329\.
Тремор после анестезии не является вполне обычным ознобом [ЗЗО\. Его возникновение только лишь возможно при гипотермии у добровольцев [274], но обычно наблюдается у больных с нормальной температурой и четко коррелирует с операционной болью [331, 332]. Это серьезное осложнение, повышающее потребление кислорода до 200 % [333] пропорционально интраопера-ционной теплопотере [302]. Кроме того, он аг-гравирует послеоперационную боль (за счет движений, вовлекающих разрез) и повышает интра-краниальное и интраокулярное давление [334]. Как упоминалось выше, озноб может быть купирован согреванием кожи [335] или введением ме-перидина [276]. Большинство исследований приводят к заключению, что меперидин более эффективен при лечении озноба, чем эквианальге-тические дозы других опиоидов [336]. Причина такой особой эффективности остается неясной, но, возможно, это связано с К-активностью препарата [337]. Проявлением этого служит снижение порога озноба в 2 раза, т. е. в такой же степени, что и порога вазоконстрикции [338]. Подобным действием не обладают никакие другие опиоиды, седативные препараты и анестетики.
Существует несколько теоретических причин предполагать, что гипотермия удлиняет пробуждение. Например, гипотермия нарушает восстановление сознания [339] и замедляет метаболизм некоторых лекарственных средств [295]. Некоторое количество исследований дает основания полагать, что умеренная гипотермия удлиняет пробуждение после анестезии [340, 341]. Все они имеют недостатки, к которым относятся: 1) сбор информации не слепым методом; 2) отсутствие
Нарушения температуры 97
рандомизированной оценки температурного ведения; 3) мониторинг температуры не в оптимальных точках; 4) необособленные критерии отбраковки и 5) использование температуры как критерия отбраковки. Некоторое число других исследований не подтверждает утверждения об удлинении пробуждения, но они не учитывают значительной статистической способности не выделять этого [342—344]. Формальная оценка влияния легкой гипотермии на продолжительность госпитализации недавно была произведена с помощью рандомизированного исследования. Результаты этого исследования показали, что гипотермия приводит к клинически важному и достоверному увеличению сроков выздоровления [345].
Поддержание нормотермии
Приблизительно 90 % метаболического тепла теряется через поверхность кожи. Следовательно, только поверхность кожи обеспечивает теплообмен, делая возможным эффективное согревание. Лечить интраоперационную гипотермию относительно легко, так как вызванная анестезией вазо-дилатация облегчает чрескожный перенос тепла. Напротив, послеоперационная вазоконстрикция заметно снижает перенос тепла с поверхности кожи к внутренним тканям.
Согревание и увлажнение дыхательных путей
Менее 10 % метаболического тепла типично теряется через респираторную систему. Таким образом, неудивительно, что была неоднократно доказана неэффективность согревания и увлажнения дыхательных путей у взрослых хирургических пациентов. В отличие от взрослых пациентов согревание и увлажнение дыхательных путей и тепло- и влагообменные фильтры могут быть эффективны у детей, включая младенцев [346, 347]. Существуют две очевидные причины этого различия. Во-первых, младенцы и дети имеют относительно высокую частоту дыхания и таким образом теряют относительно высокую часть метаболического тепла через респираторную систему. Во-вторых, педиатрические исследования проводились на пациентах, подвергавшихся настолько небольшим вмешательствам, что почти вся поверхность их кожи была укрыта и обернута. Это обстоятельство максимализирует отношение респираторных теплопотерь к общим, делая респираторные манипуляции более эффективными. У пациентов, поддержание температуры внутренней среды которых является особенно трудным (подвергающиеся большим операциям), увлажнение дыхательных путей значительно ме-
98 Анестезия в педиатрии
нее эффективно [286]. С учетом высокой цены и относительной неэффективности увлажнения и согревания дыхательных путей применение этой методики, по-видимому, показано редко.
Трахеальное увлажнение, вероятно, полезно во время длительных вмешательств для профилактики повреждения трахеи холодными, сухими газами [348]. Однако пассивные тепло- и влагооб-менные фильтры обеспечивают достаточное согревание и увлажнение для предотвращения повреждения трахеи, даже при поддержании высокой скорости газотока. Эти устройства значительно дешевле активных и поэтому предпочтительнее. Более того, многие из пассивных тепло-и влагообменников имеют встроенные бактериальные и вирусные фильтры, что минимизирует потенциальную перекрестную контаминацию пациентов. Различные марки искусственных носов не имеют клинически значимых различий по своим согревающим и увлажняющим свойствам [283\. Следовательно, клиницисту следует выбирать их в соответствии с минимальными ценами и лучшими фильтрующими свойствами.
Кожное согревание
Через поверхность кожи теряется до 90 % метаболического тепла. Дополнительные потери тепла происходят во время операции в виде испарения с поверхности операционного поля [285]. Потери с кожи и операционного поля являются приблизительно линейной функцией разницы между температурой тканей и температурой окружающей среды. Соответственно повышение температуры окружающей среды почти всегда предотвращает гипотермию. Обычно температура тканей на 10—15 °С выше температуры окружающей среды. Таким образом, повышение температуры окружающей среды на 1 "С снижает потери тепла приблизительно на 7 %.
Обычно температура воздуха в операционной для взрослых близка к 20 °С, и персонал (особенно одетые в халаты хирурги, работающие под операционными лампами) находит температуру, превышающую 23 °С, некомфортной. Таким образом, хотя повышенная температура воздуха является эффективным средством профилактики интраоперационной гипотермии, она в то же время является и причиной ненужного стресса персонала операционной и менее совершенна, чем методики, фокусирующиеся на аппликации тепла пациенту.
Наиболее простым путем снижения чрескож-ных теплопотерь является укрывание поверхности кожи одним из пассивных термоизоляторов, легко доступных в большинстве операционных. К ним относятся хирургические простыни, хлопчатобумажные одеяла и пластиковые пакеты.
Кроме того, несколько фирм-производителей предлагают на рынок пластик/миларовые композиты, предназначенные для существенного снижения потерь тепла при излучении. Все эти приспособления эффективны и снижают теплопоте-рю с поверхности кожи приблизительно на 30 % [287]. Однако клинически значимых различий между термоизоляторами нет, и в клинике можно использовать те из них, которые есть под рукой. Дополнительная ценность композита "космическое одеяло" не гарантирована.
Чрескожные потери тепла всего тела приблизительно пропорциональны площади его поверхности [247, 259]. Однако теплопотеря с головы может быть особенно велика у детей младшего возраста, так как голова составляет весьма значительную часть общей поверхности тела [349]. Эффективность кожной термоизоляции, таким образом, прямо пропорциональна площади укрытой кожи. Площадь укрытой части кожи значительно важнее, чем тип выбранного термоизолирующего материала [287\. Многослойность пассивного термоизолирующего материала не обеспечивает линейного снижения теплопотерь: применение трех хлопчатобумажных одеял вместо одного снижает тешюпотерю с 70 до 50 % [288].
Популярным методом интраоперационного согревания остаются матрасы с циркулирующей водой. Однако теплопотеря со спины пациента в губчатые термоизолирующие покрытия операционного стола очень невелика [259]. Более того, невозможно обогреть относительно небольшую поверхность тела, прилежащую к операционному столу, достаточно интенсивно для того, чтобы обеспечить перенос к пациенту значительного количества тепла. Неудивительно, таким образом, что была неоднократно показана неэффективность водоциркулирующих матрацев у взрослых [286]. Водоциркулирующие матрацы лучше, чем ничего, для младенцев с массой тела менее 10 кг [350], но маловероятно, чтобы эти устройства у детей младшего и среднего возраста работали сколько-нибудь лучше, чем у взрослых.
Применение водоциркулирующих матрацев у взрослых в некоторых случаях связывают с ожо-гоподобными поражениями тканей [351, 352]. Вероятным генезом этих поражений являются некрозы "давление/тепло" [353, 354]. Даже невысокие температуры способны вызвать поражение тканей, если они сочетаются с высоким давлением на ткани в течение длительного времени. Сообщения о таких ожогах у младенцев редки, вероятно, потому, что их небольшая масса тела минимизирует давление на ткани. Более того, тканевая перфузия у младенцев обычно лучше, чем у взрослых. Так или иначе, но водоциркулирующие матрасы представляются относительно неэффективными. В отличие от них водоциркули-
Нарушения температуры 99
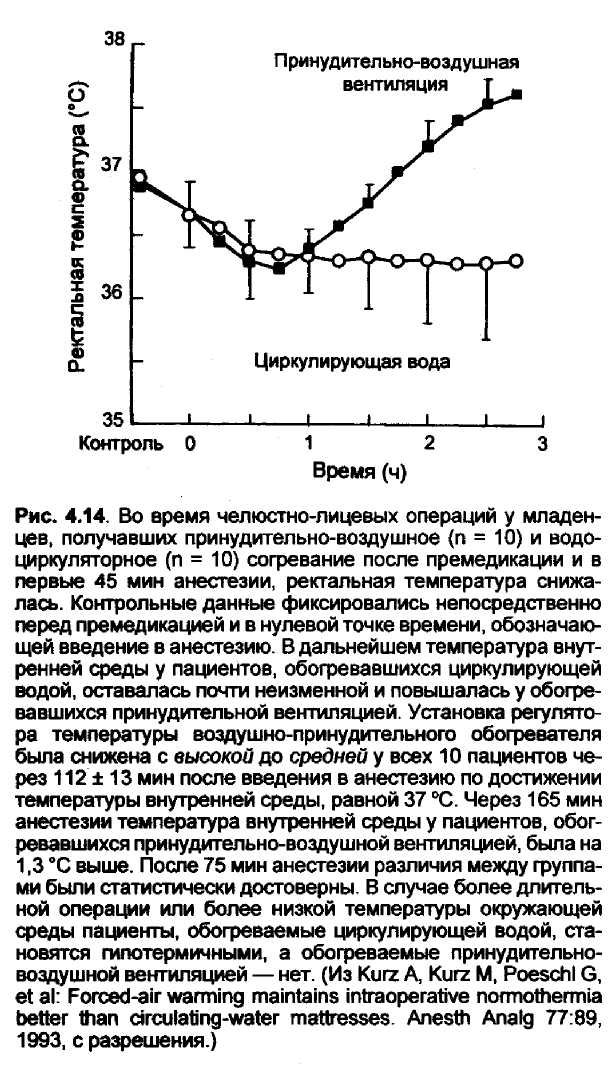
неудивительно, что принудительно-воздушные обогреватели более эффективны, чем водоцирку-лирующие матрасы или активные обогреватели и увлажнители дыхательных путей у взрослых [286, 356]. Эта методика у детей младшего возраста также более эффективна, чем циркулирующая вода (рис. 4.14) [356]. Педиатрические принудительно-воздушные покрывала имеют трубчатую конфигурацию, что обеспечивает полный доступ к пациенту и адекватный поверхностный контакт для теплообмена. Даже во время чрезвычайно расширенных операций (например, пересадка печени) принудительно-воздушное согревание обеспечивает поддержание нормотермии [357].
Внутривенные жидкости
Согреть пациента внутривенным введением подогретых жидкостей невозможно. С другой стороны, внутривенным введением жидкостей температуры окружающей среды или замороженных можно легко понизить температуру внутренней среды. У взрослых введение 1 л кристаллоидов температуры окружающей среды или одной единицы холодной крови понижает среднюю температуру тела на 0,25 "С. У младенцев и детей это снижение с поправкой на объем и массу тела сравнимо. При введении малых объемов жидкости согревание ее не является необходимым, так как снижение температуры тела в результате будет незначительным. Напротив, быстро вводимые большие объемы жидкости всегда следует подогревать. Все коммерчески доступные обогреватели жидкостей согревают ее приблизительно до 37 °С. В основном это достаточно для рутинного педиатрического применения.
Гипертермия и лихорадка
Температура внутренней среды тела, превышающая нормальные значения, определяется как гипертермия. Гипертермия, таким образом, есть родовой термин, не отражающий специфической этиологии или механизма. Напротив, лихорадка есть регулируемое повышение температуры внутренней среды, опосредуемое эндогенными пиро-генами и активно поддерживаемое терморегуля-торными реакциями.
Пассивная гипертермия
Вне операционной наиболее типичной причиной пассивной гипертермии является тепловой удар в результате столь экстремального сочетания теплопродукции и обстоятельств окружающей среды, что даже максимальные терморегу-ляторные реакции не в состоянии рассеять избыток образующегося при этом тепла. Факто-
100 Анестезия в педиатрии
 ром
окружающей среды, представляющим
наибольшую
опасность, является тепло, особенно
влажное.
До тех пор пока влажность остается
низкой,
потение достаточно эффективно и, как
правило,
в состоянии рассеять избыточное тепло.
Однако при повышении влажности
происходит
драматическое снижение теплопотери,
и при
превышении температурой окружающей
среды
температуры внутренней среды при
влажности,
достигающей 100 %,
организм
теряет способность
рассеивать даже теплопродукцию основного
метаболизма.
ром
окружающей среды, представляющим
наибольшую
опасность, является тепло, особенно
влажное.
До тех пор пока влажность остается
низкой,
потение достаточно эффективно и, как
правило,
в состоянии рассеять избыточное тепло.
Однако при повышении влажности
происходит
драматическое снижение теплопотери,
и при
превышении температурой окружающей
среды
температуры внутренней среды при
влажности,
достигающей 100 %,
организм
теряет способность
рассеивать даже теплопродукцию основного
метаболизма.
Теплопотеря нарушается при существенно сниженном внутрисосудистом объеме даже в условиях умеренной окружающей среды. Хотя поддержание температуры внутренней среды обладает высоким приоритетом, приоритет поддержания артериального давления очевидно выше. Таким образом, при истощении внутрисосудистого объема темп потения и активной вазодилатации снижается драматически; соответственно этому снижается и теплопотеря. Если метаболическая теплопродукция продолжает превышать теплопо-терю, неизбежным результатом становится гипертермия. Сочетание истощения внутрисосудистого объема и гипертермии определяет тепловой удар. Синдрому типично предшествует энергичная физическая нагрузка.
В течение перинаркозного периода гипертермия обычно является результатом избыточного согревания. Она заметно более характерна для младенцев и детей, чем для взрослых: то же самое высокое отношение поверхности тела к его массе, позволяющее педиатрическим пациентам быстро становится гипотермичными, позволяет им столь же быстро абсорбировать передаваемое через кожу тепло. Турникеты (жгуты) конечностей повышают риск случайной гипертермии, так как ограниченный периферический кровоток уменьшает перенос метаболического тепла к внутреннему термальному компартменту, таким образом повышая температуру этих тканей [358\. Следовательно, тщательный и надежный мониторинг температуры внутренней среды крайне важен при применении эффективного (т. е. чрескожного) согревания у младенцев и детей.
Как упоминалось выше, во время злокачественной гипертермии терморегуляция, вполне вероятно, остается интактной. (Хотя теплопотеря может быть нарушена вследствие высокой концентрации циркулирующих катехоламинов, вызывающих кожную вазоконстрикцию, это не является признаком недостаточности центральной регуляции). Повышенная температура внутренней среды во время этого синдрома, таким образом, есть результат избыточной теплопродукции, а не управляемой лихорадки.
Лихорадка
Эндогенные пирогены были впервые выявлены в 1940-х годах, и к известным ныне относятся ин-терлейкин-1, фактор некроза опухоли, интерфе-рон-сс и макрофагальный инфламматорный протеин-1 [555*1. Медиация циркулирующими цито-кинами находится в очевидном контрасте с нормальным контролем температуры тела, влияние на который гормонов минимально. Эндогенные пирогены вызывают координированное повышение терморегуляторных порогов как тепловых, так и Холодовых реакций. Межпороговый диапазон остается, таким образом, неизменным. Повышенная температура внутренней среды во время лихорадки поддерживается теми же самыми терморегуляторными реакциями, что и нормальный контроль за температурой тела: озноб, без-ознобный термогенез и вазоконстрикция.
"Охлаждение" типично сопутствует развитию результата лихорадки, когда эндогенные пирогены быстро повышают порог Холодовых реакций до температур, значительно превышающих реальную температуру тела. В результате нормальная температура внутренней среды становится гипотермичной относительно температуры, требуемой регуляторной системой (фебрильной). Функционально эта относительность значения не имеет, и инициируются соответствующие механизмы холодовой защиты, включая озноб. Поэтому охлаждение кожи не облегчает состояние лихорадящих больных, доставляет им много неудобств, но очень незначительно снижает температуру тела [360[.
При "переломе" лихорадки пороги быстро возвращаются к нормальным значениям, что является следствием быстрого истощения эндогенных пирогенов. Однако температура внутренней среды, неспособная меняться быстро, остается повышенной. Несоответствие между гипертермич-ной внутренней средой и теперь почти нормальными порогами инициирует активную вазодила-тацию и потение.
Лихорадка является хорошо сохраняемой регуляторной реакцией. Лихорадка в ответ на инфекцию развивается не только у всех млекопитающих и птиц, но даже рептилии и рыбы используют поведенческую регуляцию для повышения температуры внутренней среды в ответ на пиро-генную стимуляцию. Существуют серьезные признаки того, что лихорадка есть адаптивная реакция, значительно облегчающая реакцию на инфекцию [361—365\. Предоминантный эффект представляется периферической стимуляцией иммунной функции [326, 327]. Лечение млекопитающих препаратами-антипиретиками снижает резистентность к тестовым инфекциям. С этой точки зрения сегодняшняя практика интенсив-
ного лечения лихорадки может быть не вполне обоснованной.
Несмотря на то что многие хирургические больные имеют основания для лихорадки в пред-и послеоперационном периоде, во время наркоза фебрильная температура отмечается редко. Это обусловлено применением летучих анестетиков и опиоидов, ингибирующих лихорадку [366—369]. В противоположность этому эпидуральное обезболивание не влияет на лихорадку [370\.
Температурные нарушения в периоперацион-ном периоде всеохватывающи. Некоторые из них являются результатом регуляторных нарушений, другие — экстремального стрессового воздействия окружающей среды либо избыточной метаболической теплопродукции. Так или иначе, но все они потенциально вредны. Понимание этиологии этих нарушений облегчит выбор соответствующего терапевтического воздействия и сведет к минимуму вероятность серьезных осложнений.
Wingard DW: A stressful situation [Editorial]. Anesth An- alg 59:321, 1980
Denborough MA, Lovell RRH: Anaesthetic deaths in a family [letter]. Lancet 2:45, 1960
Ludvigsen J: "Muscular degeneration" in hogs (preliminary report), p. 602. 15th International Veterinary Congress, Stockholm, 1953
Nelson ТЕ, Jones EW, Henrickson RL et al: Porcine ma lignant hyperthermia: observations on the occurrence of pale, soft, exudative musculature among susceptible pigs. Am J Vet Res 35:347, 1974
Kalow W, Britt BA, Terreau ME, Haist C: Metabolic error of muscle metabolism after recovery from malignant hyperthermia. Lancet 31:895, 1970
Britt BA, Kalow W: Malignant hyperthermia: aetiology unknown. Can Anaesth Soc J 17:316, 1970
Harrison GG: Control of the malignant hyperpyrexic syn drome in MHS swine by dantrolene sodium. Br J Anaesth 47:62, 1975
Sessler DI: Malignant hyperthermia. J Pediatr 109:9, 1986
Nelson ТЕ, Flewellen EH: The malignant hyperthermia syndrome (current concepts). N Engl J Med 309:416,1983
MacLennan DH, Phillips MS: Malignant hyperthermia. Science 256:789, 1992
Rosenberg H, Fletcher JE: An update on the Malignant hypesthermia syndrome. Ann Acad Med Singapore 23:84, 1994
Ruitenbeek W, Verburg P, Janssen AJ, Stadhouders AM, Sengers RC: In vivo induced malignant hyperthermia in pigs. Metabolism of skeletal muscle mitochondria. Acta Anaesthesiol Scand 28:9, 1984
Moulds RPW, Denborough MA: Identification of suscep tibility to malignant hyperpyrexia. Br Med J 2:245, 1974
Fletcher JE, Rosenberg H, Hilf M: Electrophoresis of sol uble muscle protein from malignant hyperthermia suscep- tibles. Anesthesiology 61:A279, 1984
Нарушения температуры 101
Marjanen LA, Denborough MA: Electrophoretic analysis of proteins in malignant hyperpyrexia susceptible skeletal muscle. Int J Biochem 16:919, 1984
Bennett D, Cain PA, Ellis FR et al: Calcium and magne sium contents of malignant hyperpyrexia susceptible hu man muscle. Br J Anaesth 49:979, 1977
Nelson ТЕ, Belt MW, Kennamer DL, Winsett OE: Stud ies on the Ca+2 transport function of sarcoplasmic retic- ulum isolated from human malignant hyperthermia skel etal muscle, abstracted. Anesthesiology 65:A243, 1986
Gronert GA, Heffron JJA, Taylor SR: Skeletal muscle sar coplasmic reticulum in porcine malignant hyperthermia. Eur J Pharmacol 58:179, 1979
Moulds RFW: The site of the abnormality in MH muscle: a comparison of MH muscle and denervated muscle, p. 49. In Aldrete JA, Britt BA (eds): Malignant Hyperther mia. Grune & Stratton, New York, 1978
Lorkin PA, Lehmann H: Malignant hyperthermia in pigs: a search for abnormalities in Ca2+ binding proteins. FEBS Lett 153:81, 1983
Green A, Mitchell G, Heffron JJA: Effects of temperature, adenosine triphosphate and magnesium concentrations on the contraction of actomyosin isolated from halothane- sensitive and -insensitive German Landrace pigs. Br J Anaesth 52:319, 1980
Marjanen LA, Denborough MA: Effect of halothane on adenylate kinase in porcine malignant hyperpyrexia. Clin Chim Acta 122:225, 1982
Bardsley ME, Wheatley AM, Fowler CJ et al: Metabolism of monoamines in malignant hyperthermia-susceptible pigs. Br J Anaesth 54:1313, 1982
Harrison GG, Verburg C: Erythrocyte osmotic fragility in hyperthermia-susceptible swine. Br J Anaesth 45:131, 1973
Heffron JJA, Mitchell G: Influence of pH, temperature, halothane and its metabolites on osmotic fragility of eryth- rocytes of malignant hyperthermia-susceptible and resist ant pigs. Br J Anaesth 53:499, 1981
Gerrard JM, Duncan PG, Koshyk SA et al: Halothane stimulates the aggregation of platelets of both normal in dividuals and those susceptible to malignant hyperthermia. BrJ Anaesth 55:1249, 1983
Solomons CC, Bonneville MA, Zsigmond EK: In vitro re sponse to halothane of human platelets in malignant hyperthermia, abstracted. Anesth Analg 66:S162, 1987
Basrur PK, Frombach S, McDonell WN: Platelet mor phology and membrane bound calcium in porcine stress syndrome. Scan Electron Microsc Part 1:209, 1983
Klip A, Ramlal T, Walker D, Britt BA, Elliott ME: Se lective increase in cytoplasmic calcium by anesthetic in lymphocytes from malignant hyperthermia-susceptible pigs. Anesth Analg 66:381, 1987
Klip A, Elliott ME, Frodis W et al: Anaesthetic-induced increase in ionised calcium in blood mononuclear cells from malignant hyperthermia patients. Lancet 1:463, 1987
Nelson ТЕ, Denborough MA: Studies on normal human skeletal muscle in relation to the pathopharmacology of malignant hyperpyrexia. Clin Exp Pharmacol Physiol 4:315, 1977
Deuster PA, Bockman EL, Muldoon SM: In vitro re sponses of cat skeletal muscle to halothane and caffeine. J Appl Physiol 58:521, 1985
Heiman-Patterson T, Fletcher JE, Rosenberg H, Tah- moush AJ: No relationship between fiber type and haloth ane contracture test results in malignant hyperthermia. Anesthesiology 67:82, 1987
Gallant EM, Godt RE, Gronert GA: Role of plasma membrane defect of skeletal muscle in malignant hyper thermia. Muscle Nerve 2:491, 1979
Bryant SH, Anderson IL: Mechanical activation and elec- trophysiological properties of intercostal muscle fibers
 Жидкости,
электролиты и
питание в педиатрии
Жидкости,
электролиты и
питание в педиатрии
Д ЭНИЕЛ
САЙКЕР
(DANIEL
SIKER)
ЭНИЕЛ
САЙКЕР
(DANIEL
SIKER)
Не много предложу тебе
Лишь лотоса цветок,
Трепещущий в кувшинчике с водой [1].
Риокан
Риокан, Зен буддистский монах, жил два столетия назад. Его поэма "Один халат, одна чашка" описывает простую жизнь, возможную при удовлетворении лишь насущных потребностей. Как хорошие врачи мы должны рекомендовать, нашим пациентам не слишком много, но и не слишком мало, не слишком рано, но и не слишком поздно жидкости, электролиты и пищу, необходимые для поддержания жизни и укрепления духа. Пища и вода питают наш метаболизм. Обеспечение детей достаточным количеством жидкости, соли и калорий есть простейший путь борьбы с самыми страшными убийцами детей в мире — дегидратацией и недостаточностью питания. Образы голодающих младенцев из стран, терзаемых разрухой и войнами, напоминают нам, что нужда в пище и воде для человека императивна. Даже в индустриально развитых странах анестезиологам приходится сталкиваться с лечением детей, чьи медицинские или хирургические проблемы включают дегидратацию и недостаточность питания. Умение корректировать недоста-
110
ток жидкости, электролитов и обеспечивать нут-ритивные потребности жизненно важно как для педиатров, так и для анестезиологов.
Концепция внутрисосудистой жидкостной терапии явилась миру после фундаментального описания Вильямом Гарвеем (William Harvey) системы циркуляции крови в организме. В 1628 г. он писал: "Создаваемое сердцем суть — основа жизни, от которой зависит все сущее и из которой проистекает вся мощь и сила" [2\. Современная наука о парентеральном лечении, основывающаяся на циркуляции крови, придала новое звучание словам Гарвея, значительно превышающее то, что мог вообразить он сам. Неадекватное лечение жидкостных и электролитных нарушений остается ведущей причиной смерти детей во всем мире.
Первое широко известное использование парентеральной терапии имело место во время эпидемии холеры в 1830—1831 гг. Вызываемая холерой секреторная диарея становилась причиной острой потери воды и электролитов, приводившей к смерти в течение нескольких часов. Вот как вы-
Жидкости, электролиты и питание в педиатрии 111
глядит классическое описание, которое дает Лат-та (Latta) своему первому случаю: "... юная .., но с лицом ведьмы .., выражение ее лица имело мертвенно-бледный оттенок; ее глаза запали в глазницы на дюйм глубже естественного положения; ее пальцы были сморщены и согнуты и имели чернильный оттенок. Коротко говоря, сэр, этот вид и это лицо я не забуду никогда". Далее в течение около 10 ч Латта влил 10 л щелочного солевого раствора в ее почти бездыханное тело. Он описывает, что "ее мертвенный вид" исчез и позднее она выздоровела [3\. Однако вскоре после того как эпидемия холеры миновала, энтузиазм в отношении применения парентерального введения жидкостей упал вследствие множества сообщений о септических осложнениях.
Сегодня, делая обзор сотен исследований животных, Bickel и соавт. в непопулярном в настоящее время "Хьюстонском исследовании" [4\, относительно немедленного по сравнению с отложенным восстановлением потерянной жидкости у 600 травмированных пациентов показали, что слишком много жидкости слишком рано может увеличить смертность от геморрагического шока. Этот важный и наиболее противоречивый вопрос рассматривается в разделе "Кровотечение у ребенка" (см. ниже).
Тем не менее гипотензия, вызванная негеморрагическими причинами, такими как холера, заставила нас вновь сосредоточить внимание на пероральной регидратации. Недавние вспышки холеры в Центральной и Южной Америке стали причиной изменения нашего внимания к жидкостной терапии. Однако современным чудесным лечением стало не внутривенное, а скорее перо-ральное введение тщательно подобранных по составу регидратирующих растворов. Даже под общей анестезией кишечник способен активно абсорбировать электролиты, если к регидратирую-щему раствору в соответствующей пропорции добавлена глюкоза. Этот раствор вполне способен противостоять токсической секреторной потере электролитов, наблюдаемой при холере. Хотя прогресс медицины вооружил нас пониманием механизмов поражения и возможностью точно подбирать сочетание глюкозы и электролитов, мы все еще подвержены эпидемиям, приносимым антисанитарией, войнами и бедностью. Рекордное количество заболеваний холерой было зарегистрировано в Перу за первые 11 мес 1991 г. — 300 000 случаев. Применение перорального препарата ВОЗ—ЮНИСЕФ и лишь изредка внутривенной регидратации позволило добиться уровня выживаемости как младенцев, так и взрослых, превышающего 99 % [5\. Для сравнения — уровень смертности во время недавних эпидемий холеры превышал 30 %.
Корни современной парентеральной терапии
относятся к концу XIX столетия, когда получила признание теория антисептики Lister и сформировалось представление о жидкостном составе организма [6]. В 1879 г. Клод Бернар описал жидкостный состав нашего тела как "частичку первобытного моря в каждом из нас". Бернар выдвинул концепцию жидкостного гомеостаза организма, который он описал как тонкий баланс жидкостей, электролитов и гормонов, поддерживающий "milieu internus", или "космос", защищенный от внешнего мира, внутри которого точно поддерживаются давление кислорода и СО2, концентрации ионов водорода, жизненно важных минералов и объемы жидкостей [7, 8\.
Педиатры давно осознали, что детская диарея тяжко повреждает внутреннюю среду организма и несмотря ни на что продолжает оставаться ведущей причиной детской смертности. Диарея иллюстрирует критичность потерь жидкости и электролитов у маленьких детей и жизненную роль жидкостной заместительной терапии. В 1915 г. Holt и Courtney [9\ непосредственно проанализировали потери минералов, сопровождающих детскую диарею, что дало возможность обосновать рационарный состав перорального замещения воды и электролитов. В следующем году Howland и Marriot [10\ установили, что заметной особенностью диарейной дегидратации было тахипноэ. Они корригировали такую комбинацию гиповолемии и частично компенсированного метаболического ацидоза инфузией стерильной воды, смешанной с 4 % раствором натрия бикарбоната, продолжая это лечение до тех пор, пока темп мочеотделения не становился нормальным, а моча — щелочной. Эти и другие педиатры коллективно сформулировали концепцию, гласящую, что возмещение воды и минералов должно быть равно объему и содержанию потерь организма. Перед началом инфузионной терапии проводился сбор анамнеза и объективное исследование с последующим прямым измерением и анализом жидкостных потерь. Эти данные обеспечили основу для выработки рациональной терапии по замещению жидкости и электролитов.
Для расчета количеств воды, калорий и минералов, необходимых для продолжения роста, поддержания организма во время анестезии, замещения потерь и секторальных сдвигов жидкости, а также восстановления после хирургического стресса было предложено немало систем. Обычно эти системы взаимозаменяемы. Каждая является сочетанием клинического наблюдения и опыта, включая обращение к основам физиоло-
112 Анестезия в педиатрии
гии. Однако до настоящего времени не существует системы, универсально принятой и применимой ко всем обстоятельствам. Потребность в жидкости может быть рассчитана, например, на единицу поверхности тела (в квадратных метрах) или на килограмм массы тела или по калорическому расходу. Все эти системы в общем рассчитывают как потери жидкости, определяемые как заместительная терапия, так и последующие потребности, определяемые как поддерживающая терапия.
Хотя готовые составы применяются в начале восстановления жидкостных и электролитных потерь, в дальнейшем необходимо принять во внимание индивидуальные различия в темпе роста, метаболических потребностях и актуальной "тощей" массе тела, определяемой измерением толщины кожных складок [11, 12].
Индивидуальные реакции на травму, индивидуальные различия в течении болезней, заживлении ран и состоянии здоровья делают необходимым индивидуальный подход к каждой потребности ребенка в жидкости и электролитах. Каждый клинический вариант требует особого расчета жидкости и электролитов, необходимых для замещения потерь или длительной поддерживающей терапии. Дальнейшее улучшение жидкостной терапии может основываться только на повторных оценках реакции пациента на проводимую терапию.
Площадь поверхности тела
Измерение площади поверхности тела является одним из способов расчета потребности в воде для госпитализированных детей различных размеров. Однако данные, использованные при разработке номограмм для определения актуальной площади поверхности тела, связаны с довольно широкими отклонениями. Еще в 1913 г. Howland и Dana [13] сравнили два широко применявшихся способа измерения площади поверхности тела. При разработке первого Meeh при измерении общей поверхности тела тщательно обернул бумажными салфетками несколько хорошо упитанных младенцев. При разработке второго Lissauer использовал ряд трупов младенцев, многие из которых были тяжко истощены. Оба метода определения поверхности тела давали Среднюю ошибку в 15 %. Dubois и Dubois [14\ разработали широко копировавшуюся номограмму для определения площади тела, которая, как заметил Boyd [15], давала ошибку почти в 20 % у младенцев с массой тела менее 3 кг.
Для расчета площади поверхности тела не» ходимо знать рост и массу тела и номограмму} приблизительного расчета площади поверхнсх тела. Применение номограмм вызывает неко' рые сомнения. Так как расчеты поддерживаюн объемов, рассчитанные только на основе нон грамм площади поверхности тела, варьирую: столь широко, их применение в качестве осно для дозирования жидкостей для парентералыи введения не рекомендуется [16, 17].
Более прямой и принятый метод расчета i требности в жидкости основывается только массе тела. Обе системы (площадь поверхносп масса тела) не учитывают вариации темпа ме: болизма и различия в проценте "тощей" мае тела. Однако система, основанная на массе те; предпочтительнее, так как для исследователя i мерить надежно и точно массу тела извиваюц гося малыша значительно легче, чем площадь е тела. Точная масса тела часто оказывается наиб лее надежным отдельно взятым методом для о ределения изменений волемического стату< Введение в практику кроватей, постоянно изм ряющих массу тела, несомненно, упростит пр ведение жидкостной терапии.
Калорическое потребление
Наиболее важным аспектом в определении опп мальной потребности в калориях всегда являет идентификация детей, подверженных опасное: гипогликемии. Особое значение это имеет ] время реанимации или при остром заболевани когда клинические признаки гипогликемии mi гут быть нехарактерными [Щ. В болыпинси больниц калорический расход [19] стал станда] том для определения потребности в жидкостях калориях у младенцев. В 1911 г. Howland [2Щ и: мерил потребление энергии у детей. Его данны близко согласующиеся с принятыми в настоящ время, указывают на то, что младенцы моложе года (с массой тела 3—10 кг) метаболизирук 100 ккал/кг/день, в то время как более старшие д< та и взрослые метаболизируют 75 и 35 ккал/ы день соответственно. Howland пришел к заклк чению, что малыши имеют более высокую кале рическую потребность вследствие их быстрог роста и пропорционально большей площади по верхности тела.
В 1957 г. Holliday и Segar [21] проанализирова ли данные по потребностям основного метабо лизма и потребностям активной энергии в зави симости от массы тела. Между графиками актив ных и основных потребностей они экстраполи ровали третью кривую, устанавливающую по требности для пациента в условиях постельнол режима, обозначенную как "госпитализирован ные пациенты" (рис. 5.1). Наклон кривой бьи
 114
Анестезия
в педиатрии
114
Анестезия
в педиатрии

каждый градус стоградусной шкалы сверх эутер-мии. Снижение темпа метаболизма снижает потребность в калориях аналогичным образом [21]. Общая анестезия существенно имитирует калорическую потребность на уровне, близком к основному метаболизму. Lindahl [22], используя непрямую калориметрию, рассчитал потребности в жидкости, энергии и электролитах у 31 ребенка, включая младенцев, во время галотановой анестезии. Для этих пациентов с массой тела до 25 кг его оценка жидкостных и калорических потребностей совпала с уравнениями дифференциальной регрессии (табл. 5.1). Потребности в калориях, жидкости и электролитах рассчитываются на основании следующих уравнений [22]:
Потребность в калориях =1,5хкг + 5 = поддерживающее количество калорий в час (ккал/ч)
Потребность в жидкости = 2,5хкг+10 = поддерживающее количество жидкости в час (мл/ч)
Потребность в натрии = 0,045 х кг + 0,16 = поддерживающее количество натрия в час (мг-экв/ч)
Потребность в калии = 0,03 х кг + 0,10 = поддерживающее количество калия в час (мг-экв/ч).
Поддерживающее обеспечение глюкозой
Формула Lindahl для калорической потребности во время общей анестезии
1,5 х массу тела (кг) + 5 = ккал/кг/ч
прогнозирует значительно меньшую потребность в глюкозе, чем можно было предположить, используя формулу Holliday и Segar [21] для госпитализированных детей. Они предполагали, что жидкостные и калорические потребности одинаковы. Однако Lindahl продемонстрировал, что у анестезированных детей для метаболизма 100 ккал необходимо 166 мл жидкости. Так как интраопе-
рационная гипогликемия у детей исключител! редка даже после длительного голодания [23] операционной предпочтительны сбалансиров! ные солевые растворы, не содержащие глюкоз
Еще более важным открытием для анестез] лога является тот факт, что при ишемических стояниях мозг, сердце и кишечник страдают i применении растворов глюкозы сильнее. Сов менная тенденция избегать в операциою внутривенного введения растворов, содержав глюкозу, требует тщательного мониторинга ур ней глюкозы в крови, особенно в первые 2 j жизни [24\. В Соединенных Штатах Америк пациентов, страдающих диабетом, выполи около 2 млрд измерений уровня глюкозы в машних условиях, что делает очевидной техно гическую и экономическую возможность ане< зиологов-педиатров выполнять эти же самые i ты в условиях операционной. Это особенно в но для недоношенных младенцев с ограничен] ми запасами гликогена и для детей, получаю! центральную гипералиментацию. Я исполк простую, надежную и недорогую прикровап систему (HemoCue-B-Glucose, HemoCue-Angelholm, Швеция), позволяющую следовап вариациями уровня глюкозы в сыворотке во i мя операции или в блоке интенсивной тераг Часть капли цельной крови (5 мкл) подбирае пластиковой кюветой, содержащей азид наг{ В течение минуты ручной фотометр, использ щий реакцию дегидрогенации глюкозы, пока вает точное значение уровня глюкозы крови зависящее от внезапных сдвигов протеинов п. мы, характерных для случаев гемодилюции массивного кровотечения [25].
Исследование крови на содержание глюко; плазме имеет и некоторые собственные прЫ мы. Ланцеты, применяемые для пункции пал] руки или ноги, оставляют шрамы, а ранки м< быть болезненными в течение нескольких ча Эта процедура часто пачкающая, подвергаю анестезиолога контакту с кровью. Хотя в тече многих лет применялось скрининговое иссл< вание глюкозы в моче, ее уровень не лш уровню в сыворотке и существенно отстаег него по времени. По исследованию мочи не можно отследить низкий уровень глюкозы в i ви, так как нормальные почки не фильтр глюкозу, пока ее уровень не превысит 160 100 мл. Даже у рожениц при уровне глюко; сыворотке ниже 100 мг/100 мл глюкоза в моч определяется. Были исследованы и другие > кости организма, более близко совпадают] кровью, включая ингерстициальную, церв' спинальную, внутриглазную жидкости, лш пот и слезы. Хотя использование крови, по слез имеет явный литературный оттенок, го слезы имеют слабую линейную корреляци
глюкозой сыворотки с существенным отставанием по времени и получить их для исследования часто еще более трудно.
Поддерживающее обеспечение жидкостями
Метаболизм требует значительно больше воды, чем производит. В отличие от анестезированных бодрствующие дети не имеют чистых потерь воды в процессе метаболизма 100 ккал. Метаболизм 1 ккал продуцирует 0,2 мл и потребляет 1,2 мл воды. Таким образом, у бодрствующего ребенка потребление воды и калорий рассматривается как равное. Годовалый ребенок с массой тела 10 кг требует на кг/день 100 ккал энергии и 100 мл воды. Табл. 5.1 представляет почасовую потребность в поддержании жидкостью.
На рис. 5.2 представлены два младенца одной даты рождения за 6 мес до фотографии. Однако меньший родился на 28-й неделе беременности с массой тела 0,9 кг, в то время как второй родился через 12 нед, на 40-й неделе беременности, с массой тела 4,2 кг. Кривая роста ребенка, развившегося в срок, как по росту, так и по массе тела превысила 90-й процентиль, и содержание жира у него превышает 40 % общей массы тела. Развитие недоношенного ребенка представляется кривой, на два стандартных отклонения ниже нормальной. Содержание жира у него составляет
Жидкости, электролиты и питание в педиатрии 115
около 10 % общей массы тела. Хотя масса тела меньшего ребенка составляет всего лишь половину большего, определяемая "тощая" масса тела и потребление калорий у них сходны. Однако, согласно стандартным формулам поддержания, больший, 10-килограммовый, младенец будет нуждаться во вдвое большем количестве жидкости, минералов и калорий, чем меньший, 5-килограммовый. Оба ребенка в настоящее время имеют почти одинаковое потребление воды и калорий, приблизительно 250 мл (8 унций) состава каждые 4—6 ч. Если для расчета поддерживающих количеств жидкости используется только показатель массы тела, но не принимаются во внимание "тощая" масса тела и метаболическая активность, могут иметь место большие ошибки в получаемых результатах.
Расчет дефицита жидкости, вызванного ночным ограничением ее поступления, может привести к назначению слишком большого количества воды. Возьмем, например, полнощекого, 6-месячного младенца с массой тела 10 кг, не получавшего ничего per os в течение ночи перед плановой операцией. Замещение его ночного "дефицита" и обеспечение его стандартным поддерживающим объемом до лэнча потребует 24 унций жидкости. Здоровые дети устойчивы к большим объемам жидкости, но редкий 6-месячный младенец выпивает три бутылки жидкости за один прием для восполнения ночного дефици-
■-«
5-998
116 Анестезия в педиатрии
та. Здоровый новорожденный может проспать, к восхищению родителей, всю ночь, демонстрируя устойчивость к длительному голоданию. Таким образом, при коротких вмешательствах может не быть необходимости в парентеральном введении жидкостей. Напротив, у младенцев, подвергающихся длительным и более травматичным операциям, особенно имеющих токсические проявления, предоперационная парентеральная гидратация целесообразна ввиду значительных потерь жидкости во время операции.
Сложные хирургические вмешательства часто ассоциируются с быстрыми изменениями потребностей в жидкости, делающими необходимой частую повторную оценку и модификацию терапии. Педиатры тщательно рассчитывают ежедневные потребности в жидкостях и электролитах для каждого ребенка индивидуально. У большинства госпитализированных детей потребности в жидкости, электролитах и метаболические в течение дня относительно постоянны. В операционной потребности в жидкости могут быстро меняться в течение введения в анестезию или операции в соответствии со сдвигами температуры, метаболизма и жидкостных объемов. Травма, кровотечения и реакции тканей, сопровождающие операцию, инициируют перемещение жидкостей тела между компартментами, делая необходимым замещение жидкостей растворами, компенсирующими потери энергии, воды, крови, протеинов электролитов.
Анестезиолог обязан определить суть и масштаб этих потерь и быть бдительным как в отношении очевидных потерь жидкости в плазме и моче, так и скрытых потерь жидкости, таких как потери с испарением или в хирургические простыни, окружающие операционное поле. Прямая нормальная реакция жидкостного гомеостаза организма на анестезию часто делает необходимым назначение повышенных количеств жидкостей для поддержания адекватного циркулирующего объема крови. В отличие от педиатра, имеющего возможность тщательно планировать поддерживающее введение жидкостей в течение 24 ч, анестезиолог обязан часто модифицировать интра-операционное введение жидкостей в зависимости от наблюдаемого хода событий. Важными компонентами этого наблюдения являются частота сердечных сокращений, пульс, среднее артериальное давление, время капиллярного наполнения и объем мочеотделения. Мониторинг тенденций этих изменений, равно как и изменений гематок-рита и осмолярности мочи, очень важны для планирования эффективной заместительной терапии. Во время больших хирургических вмешательств и у детей с нестабильностью гемодинамики огромную помощь в периоперативной жидкостной терапии оказывает прямое постоянное
измерение артериального и центрального вено: ною давления (см. гл. 11).
Какая бы ни была выбрана система назначена жидкостей, весьма важно, что бы она оставалас простой. Дегидратация, связанная с повышение температуры внутренней среды организма и ра; дражимостью, и регидратация повышают устойта вость к физической нагрузке и смягчают гипер термию [26, 27\. Подсчет потребности в жидкост и электролитах должен быть понятен и практиче во избежание ошибок, которые у маленьких дете могут вести к ужасным последствиям.
В конце XIX столетия физиологи и химики вы яснили, что электролитное обеспечение диен жизненно важно. Голуби, получавшие бессоле вую диету, страдали переломами костей и умира ли. Мыши, получавшие бессолевое молоко, так же умирали раньше своих сородичей, получав ших точно такую же диету с солью [28\. Ringe [29] обнаружил, что путем добавления калия ] раствору натрия хлорида можно поддерживат] нормальный ритм изолированного препарат! сердца. Его ранние исследования натриевых со лей привели к созданию широко распространен ного теперь раствора для парентерального при менения, известного как Рингер-лактат.
В последующих исследованиях было проведеш сравнение общей минеральной массы тела у раз вивающегося младенца, рожденного в срок, * взрослого. Было установлено, что 4-месячнш плод имеет всего 1 % содержания золы, в то время как ребенок, рожденный в срок, и взрослый — 31 4,5 % соответственно. Эти данные, полученные при помощи процесса высушивания, иллюстрируют нарастание относительных запасов электролитов организма с его ростом, и они хорошо коррелируют с нашим сегодняшним представлением о постепенном снижении содержания воды в организме в процессе развития и роста, соответствующем пропорциональному повышению общего содержания минералов. Аналогичный анализ электролитного баланса был выполнен измерением содержания золы в коровьем и человеческом молоке при пероральном потреблении с определением содержания золы в моче и кале [30\.
Обычные поддерживающие потребности в воде, электролитах и глюкозе могут быть стандартизированы на основе метаболических показателей.

Это соотношение глюкозы и электролитов стало частью современных коммерческих жидкостных парентеральных препаратов. Общепринятые значения приведены в табл. 5.2.
В парентеральном жидкостном растворе, данные которого приведены в табл. 5.2, 250 г декстрозы, 1,46 г NaCl и 1,49 г КС1 в 1 л воды (25 % декстрозы в 0,15 % N физиологическом растворе плюс 20 мг-экв/л КС1). В стандартных поддерживающих жидкостях в основном используется больше NaCl и только 20—40 % расчетной потребности декстрозы; в итоге поддерживающие растворы содержат 5—10 % декстрозы и натрия хлорида, что составляет 0,2—0,9 % нормальности.
Растворы натрия хлорида 0,25, 0,33, 0,50 и 0,90 % содержат соответственно 38,5, 51,3, 77 и 154 мг-экв натрия на литр. Рингер-лактат, часто применяемый замещающий изотонический раствор, имеет концентрацию электролитов, приблизительно соответствующую таковой в сыворотке. На каждый литр воды в Рингер-лактате содержится: Na — 130 мг-экв, К — 4 мг-экв, С\ — 109 мг-экв, Са — 3 мг-экв и лактата — 28 мг-экв.
Abbott в 1999 г. выпустил в продажу заменитель стандартного раствора Рингера. Хотя стоил он вдвое дороже, но представлял собой сбалансированный солевой раствор со сниженным содержанием хлоридов и заменой их другими анионами, лактатом и 6 % гетастарчем (Гекстен-дом). Количество хлоридов при этом было не 154 мг-экв/л, как в нормальном солевом растворе, а всего 124 мг-экв/л. Преимуществом подобного состава было сочетание буферных свойств раствора Рингера, достаточного содержания солей обычного солевого раствора и дополнительного включения коллоидов.
Опыт применения этого гибридного раствора у детей пока минимален, но указанные преимущества обещают, что он найдет широкое применение при больших операциях, требующих переливания значительных количеств жидкости.
Когда вводится более 5—10 % декстрозы со
Жидкости, электролиты и питание в педиатрии 117
скоростью, соответствующей потребности в воде, повышение нагрузки на почки может привести к потерям с мочой как воды, так и глюкозы. Поддерживающая терапия 5 % раствором декстрозы, хотя и обеспечивает лишь 20 % метаболизируе-мых калорий, приводит к снижению катаболизма эндогенных протеинов и снижает почечную нагрузку. Эта концентрация декстрозы рекомендуется для кратковременной терапии, но для обеспечения полного парентерального питания требуются более высокие концентрации глюкозы. Общую калорическую потребность можно удовлетворить постепенным повышением концентрации декстрозы, что дает возможность избежать потерь глюкозы с мочой, и добавлением протеинов и липидов во внутривенные растворы.
Возрождение пероральной регидратации
В недавнем обзоре, посвященном пероральной регидратации, Avery и Snyder [31] пришли к заключению, что свидетельства в пользу применения пероральной регидратации по сравнению с внутривенной терапией неоспоримы. Они утверждают, что основным препятствием для применения в Соединенных Штатах Америки простых пероральных растворов было "контринтуитивное" сравнение их со сложными системами госпитальных технологий внутривенной терапии. Перо-ральная регидратация стала решением проблемы диарейных заболеваний во всем мире [32\. Набор ВОЗ—ЮНИСЕФ содержит глюкозу (20 г/л воды) и три основные соли: NaCl (3,5 г/л воды), КС1 (1,5 г/л воды) и либо тринатрия цитрат (2,9 г/л воды), либо натрия бикарбонат (2,5 г/л воды). Готовые растворы, доступные для семей в Соединенных Штатах Америки, приведены в табл. 5.3. Противопоказаниями для применения пероральной регидратации являются тяжелый гастро-интестинальный рефлюкс и рвота, непроходимость кишечника и шок. Раннее энергичное применение пероральных растворов может позволить избежать необходимости госпитализации большинства детей, включая младенцев, с диа-рейной дегидратацией. Путем применения про-тивоперистальтических или вяжущих препаратов снизить острые диарейные потери воды не удалось.
Колебания жидкостного гомеостаза организма, вызываемые анестезией и операцией, требуют понимания определенных терминов. Раствор, не вызывающий перемещения воды в клетку или из нее, называется изотоническим. Жидкости по обеим сторонам клеточной мембраны имеют
118 Анестезия в педиатрии
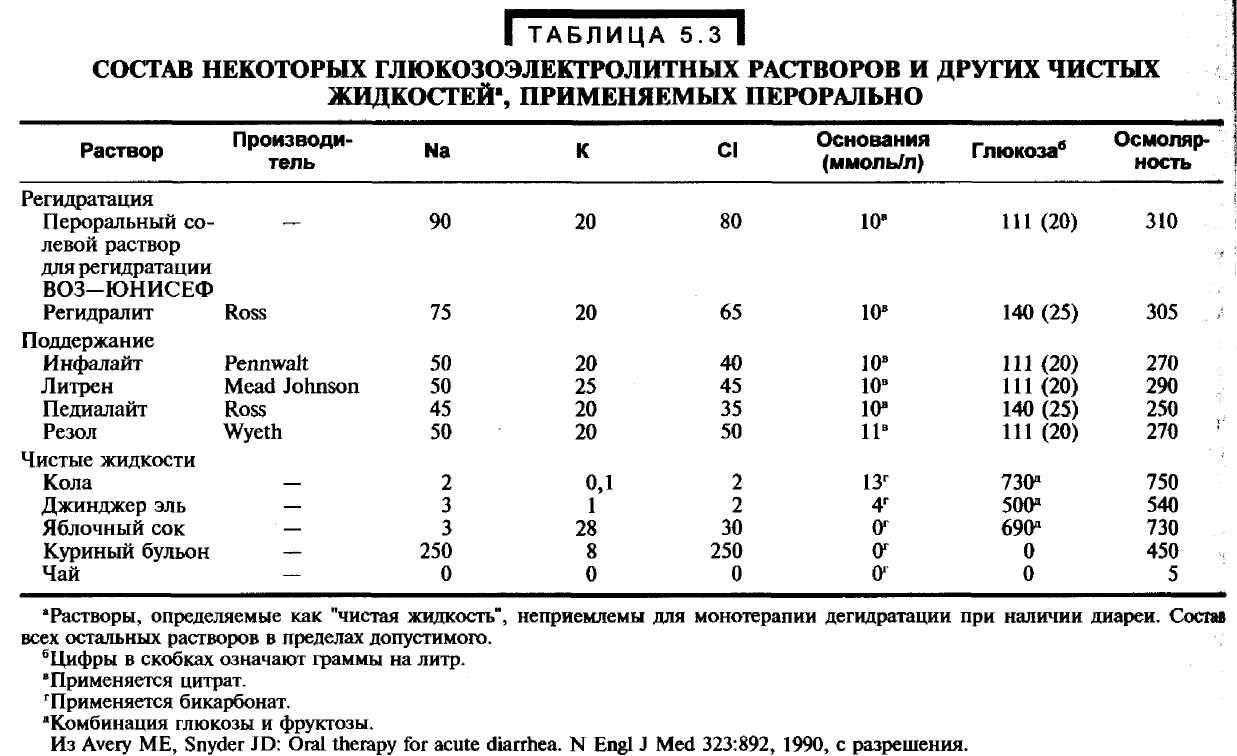
Экстрацеллюлярная жидкость поддерживает клетки и обеспечивает их питанием; они подвешены в ней. Раздел между внутриклеточным и внеклеточным пространством поддерживается электрическим и осмотическим балансом. Электрический баланс, позволяющий калию оставаться внутриклеточным катионом, а натрию — преимущественно внеклеточным анионом, контролируется калий-натриевым насосом [33]. Небольшое расстояние диффузии между экстра-, и ин-трацеллюлярным пространством позволяет легко проникать в клетку нутриентам, а отработанным продуктам — покидать ее.
Жидкостные компартменты организма меняются с возрастом. Хотя осмолярность каждого жидкостного компартмента остается постоянной в процессе развития, фракция жидкостей каждого пространства меняется. Для определения раз-
меров этих пространств были использованы инъецируемые или проглатываемые радиоактивные изотопы. Однако применение дейтерия (D2O) дало оценку общей воды тела у растущих приматов, на 14 % превышающую результаты, полученные при помощи высушивания [34]. Эта переоценка в основном есть следствие быстрого роста новоро* жденных и проникновения радиоизотопов в плотные части тела. Исследования продемонстрировали значительно более тесное соответствие между жидкостными компартментами тела и высушиванием. Используя широко применяемые в мясной промышленности методики электропроводности организма [35] и магнитного резонанса [36], исследователи могут надежно и неинвазив-но определить состав тела и отношение "тощей" его массы к жиру у детей. На 28-й неделе беременности плод с массой 1 кг на 80 % состоит из воды и лишь 1 % общей его массы приходится на жир. При рождении в срок общее содержание воды в организме снижается до 70—75 % и происходит постепенный сдвиг жидкостей из внеклеточного пространства в клетки. Доля одного относительно безводного плотного компонента, жира, постепенно повышается до 17 % общей массы тела при рождении. В возрасте 3 мес средний младенец удваивает свою массу до 6 кг, и общее содержание жира в организме повышается
Жидкости, электролиты и питание в педиатрии 119
до 30 %. Одновременно с этим повышением общее содержание воды в организме снижается до менее 65 % общей массы тела вследствие повышения общей клеточной массы, включающей и клеточный жир (рис. 5.3) [37\.
Внеклеточная жидкость
Механизмы экстрацеллюлярной жидкости описаны в последнем обзоре [38\. В ее состав входят объем внугрисосудистой крови или плазмы, а также интерстициальная жидкость. Объем ее определяется натрием и сопутствующими анионами. К внеклеточной жидкости относятся объем внугрисосудистой крови или плазмы, а также интерстициальная жидкость. Эти компоненты отделены друг от друга сосудистым эндотелием. Объем плазмы и объем интерстициальной жидкости вместе формируют функциональный внеклеточный жидкостный компартмент. Guyton и соавт. [39\ описали интерстициальное жидкостное пространство как желатинозный матрикс, в норме имеющий отрицательное давление и эластичный компонент. Последнее обстоятельство дает возможность хранения жидкости, которая быстро фильтруется из сосудистого пространства при высоком объеме плазмы. Уменьшение объема циркулирующей жидкости корректируется, когда
жидкость из интерстициального пространства перемещается в плазму. Таким образом, при низком центральном венозном давлении (например, вследствие низкого внутрисосудистого объема) для его повышения необходима инфузия большего объема. Эта ситуация представляет ненаполнение циркулирующего объема. Быстрое повышение центрального венозного давления, по-видимому, будет представлять полное насыщение циркуляторного и интерстициального компар-тментов. Перенасыщение плазмы, интерстициального и клеточного компартментов повышают объем трансцеллюлярной жидкости, что ведет к генерализованным отекам.
В пубертатный период объем интерстициального пространства составляет приблизительно 20 % массы тела. Добавление объема плазмы, 7— 10 % массы тела, к интерстициальному компар-тменту дает функциональный внеклеточный объем, составляющий 27—30 % массы тела. У младенца при рождении в срок функциональный внеклеточный объем жидкости с пропорционально большими плазменным и интерстициальным компартментами может составить 45 %, в то время как у ребенка, рожденного на 28-й неделе беременности, он может составить до 60 % его общей массы тела. Хотя между возрастными группами существуют довольно широкие различия,
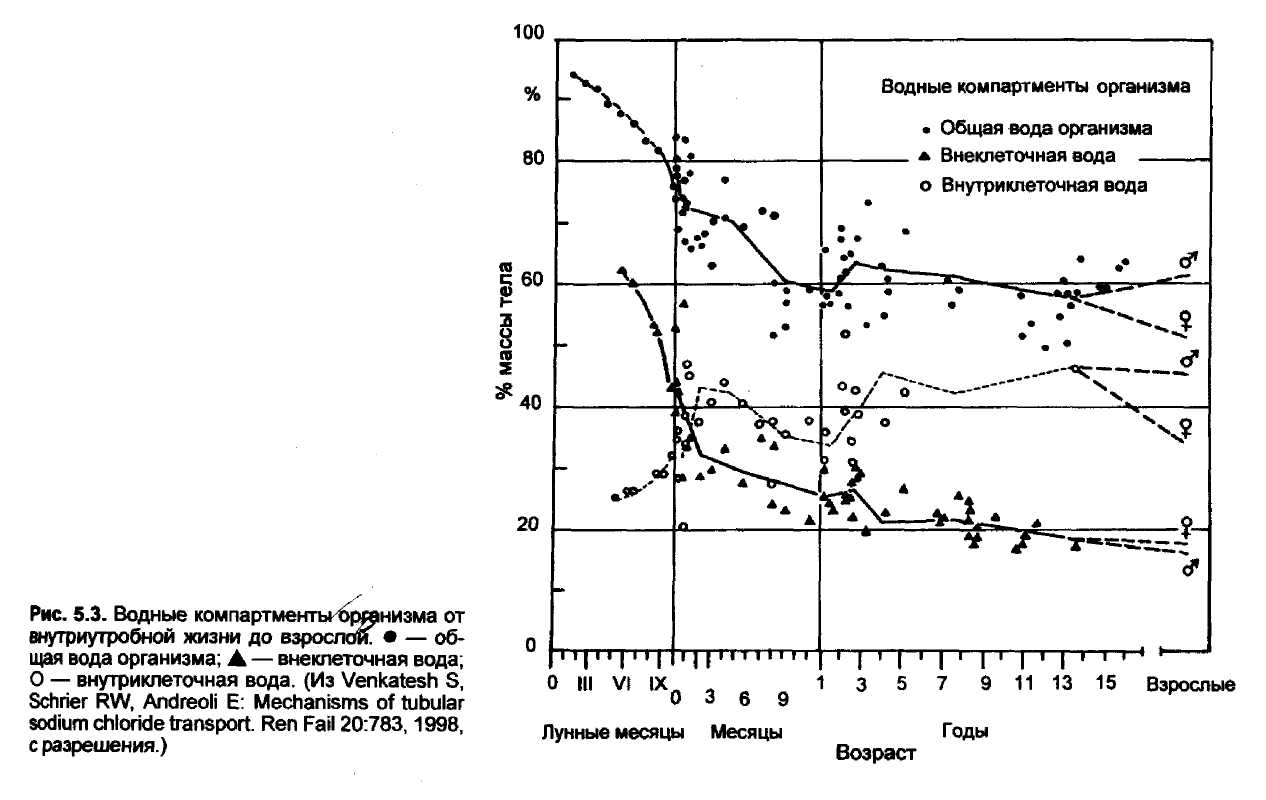
 объем
резерва функциональной внеклеточной
жидкости часто недостаточен для
компенсации периоперативных
потерь жидкости независимо от
размеров педиатрического пациента.
объем
резерва функциональной внеклеточной
жидкости часто недостаточен для
компенсации периоперативных
потерь жидкости независимо от
размеров педиатрического пациента.
Трансцеллюлярная вода является нефункциональной внеклеточной жидкостью. Она представляет собой недоступный запас воды, формируемый транспортом жидкости из клеток и внеклеточного пространства. К ней относится жидкость, содержащаяся в просвете желудочно-кишечного тракта, объем которой значительно повышается при кишечной непроходимости. Хирургические манипуляции и другие виды травмы также повышают объем трансцеллюлярной жидкости. Примерами трансцеллюлярной жидкости являются асцит, плевральный выпот, синовиальная и цереброспинальная жидкости, моча и кал. Жидкость, проникшая в трансцеллюлярное пространство, практически потеряна для функционального внеклеточного пространства. При прямых потерях плазмы в процессе операции или травмы вода, электролиты и протеины выводятся из циркуляции и интерстиция.
Расширение внеклеточного жидкостного пространства (ВЖП) и повышение сердечного выброса (СВ) наблюдаются при многих болезнях, например при асците любой этиологии. Похожие изменения высокого СВ наблюдаются при беременности, тиреотоксикозе, бери-бери и у пациентов с большими артериовенозными соустьями.
Функциональное внеклеточное пространство является резервуаром для плазмы и клеточной жидкости. Протеин, производимый клетками, до того как профильтроваться в плазменный ком-партмент, хранится в экстрацеллюлярных тканях. Добрая половина общей массы протеинов плазмы организма находится в зоне внеклеточного матрикса кожи и скелетной мускулатуры [40\. В процессе кровотечения происходит потеря протеинов внутрисосудистой плазмы. При замещении теряемой крови кристаллоидами происходит разведение как внутрисосудистых, так и внеклеточных протеинов. Для полного возвращения плазменных протеинов из внеклеточного пространства в плазму требуется несколько дней. Оно завершается сдвигом внесосудистых плазменных протеинов в лимфатическую систему для постепенного возмещения дефицита сосудистых протеинов с последующим повышением синтеза протеинов [41].
В большинстве случаев интраоперационное жидкостное замещение имеет целью обеспечение достаточного количества жидкости для восполнения потерь из плазменного и интерстициального компартментов. Внутривенное назначение свободной воды приводит к быстрой фильтрации ее в интерстиций. Такие растворы, как 5 % декстро-
за в 0,2 % солевом растворе почти на 80 % пре ставляют собой свободную воду. Так как задер; ка жидкости есть первичная защитная реакц на травму, только сбалансированные солев] растворы должны применяться для предоперац онной подготовки. Быстрая фильтрация воды внеклеточную жидкость снижает осмолярность сдвигает воду в клетки, становясь причиной ак сарки.
В начале 1960-х годов Shires и соавт. [42\ п казали, что во время больших хирургическ вмешательств значительные количества жидк стей секвестрировались в "третье пространств' Они предположили, что для замещения поте жидкости из функционального внеклеточнс пространства требовались большие объемы сС лансированных солевых растворов. Интраопе{ ционное повышение уровней вазопрессина (а тидиуретического гормона) и альдостерона и дуцирует активное удержание воды и натр почечными канальцами. Эта жидкость расщ деляется во внутрисосудистый, интерстициш ный, целлюлярный и трансцеллюлярный ко партменты.
Энтузиазм в обеспечении больших объем поддерживающих жидкостей во время операи был охлажден в последующем обнаружением : го обстоятельства, что меченый радиоактивн сульфат, использовавшийся для измерения о( ема внеклеточной жидкости, не полностью щ никает в функциональное жидкостное внек; точное пространство. Следовательно, оцеь объема внеклеточной жидкости в третьем щ странстве была завышена. В настоящее времз общем признано, что назначение избыточн количеств жидкости создает большие объемы < квестрируемой жидкости во время операции ] течение короткого периода после нее. Инфу; избыточных объемов сбалансированных солев растворов снижает концентрацию протею плазмы во всем функциональном внеклеточн компартменте. Это разведение протеинов и ] быток жидкости повышают секвестрацию тра] целлюлярной жидкости и клеточного объема счет перенасыщения внеклеточного жидкости! компартмента. Такая перегрузка жидкостью медляет диурез и поступление протеинов, на ходимых для достижения послеоперацион» восстановления жидкостного баланса. Напрот большие экстренные операции, тяжелый ш кровотечения, большие ожоги и другие травма ческие повреждения вызывают массивную по рю и перераспределение жидкостей. Во избе) ние гиповолемии они требуют больших объел поддерживающих жидкостей. Алгоритмы ди ностики и лечения некоторых электролита нарушений хорошо разработаны и вполне д тупны [43].
Были рассмотрены четыре основных компенсаторных механизма, восстанавливающих объем плазмы [44]:
нейрональный и гуморальный контроль за действием почек по снижению диуреза;
сдвиг интерстициальной жидкости от кожи, скелетных мышц и кишечника, фильтрую щего ее в сосудистое пространство для уве личения объема плазмы;
индуцированная стрессом гипогликемия снижает осмолярность плазмы, таким обра зом мобилизуя сдвиг клеточной жидкости в плазму;
важным вкладом в восполнение плазмы яв ляется массивное повышение абсорбцион ной емкости тонкого кишечника.
Внутриклеточная жидкость
Общая вода организма минус внеклеточный жидкостный объем есть объем внутриклеточной жидкости. Жидкость внутри клетки истинно изото-нична по отношению к окружающей интерстициальной жидкости, так как вода свободно перемещается через клеточные мембраны в обоих направлениях. При назначении изотонических жидкостей объем клеток остается постоянным. Однако при назначении гипотонических жидкостей он может быстро увеличиться благодаря перемещению свободной воды внутрь клетки. Большая часть воды в клетках связана с протеинами (т. е. эта вода не имеет возможности сразу принять участие в осмотических перемещениях между жидкостными компартментами).
Как подчеркивалось выше, абсорбция или экскреция воды клетками происходит через клеточные мембраны в ответ на изменения внеклеточной осмолярности. Натрий является доминирующим внеклеточным катионом, а калий — доминирующим внутриклеточным катионом. Почечная экскреция калия в обмен на натрий увеличивает внеклеточное водное пространство. Почечные канальцы консервируют как воду, так и внеклеточный натрий за счет повышения концентрации мочи и секреции калия. Для предотвращения интраоперационных потерь калия интра-операционное жидкостное замещение должно обеспечивать адекватное снабжение как натрием, так и водой.
Требуются дни для восстановления внутриклеточного калиевого истощения при введении калия внутривенно. Таким образом, жидкости, вводимые после операции, должны содержать достаточно калия для постепенного восстановления потерянного калия во время операции.
Для транспорта калия в клетку, а натрия из нее через водопроницаемую клеточную мембрану
Жидкости, электролиты и питание в педиатрии 121
для поддержания водного гомеостаза организма необходима энергия. Клетки, включая клетки мозга, набухают при назначения гипотонических и сморщиваются при назначении гипертонических растворов. Быстрые изменения осмолярности плазмы могут нарушить хрупкую цереброва-скулярную сеть, расположенную между клетками. Инфузия маннита, гипертонического солевого раствора либо любого другого гипертонического раствора может моментально повысить мозговой кровоток за счет понижения вязкости. Хотя поток к мозгу возрастает, внутримозговое давление быстро снижается, так как эти гиперос-молярные растворы извлекают воду из клеток мозга. Была замечена связь столь быстрого перемещения жидкости внутри мозга в связи с кровоизлияниями в центральной нервной системе (ЦНС) у недоношенных детей. Была отмечена также связь таких гипертонических растворов, как стандартный бикарбонат и маннит, с внутри-желудочковыми кровотечениями. Перитонеаль-ное введение гипертонических солевых растворов котятам вызывало резкое снижение содержания воды в мозге [45]. С другой стороны, введение растворов, содержащих свободную воду, детям с гипернатриемической дегидратацией вызывало кровоизлияния в ЦНС вследствие быстрого перемещения воды внутрь гипертонических клеток [46]. Лечение гипер- и гипонатриемической дегидратации обсуждается ниже.
Идеальный анестетик не должен влиять на сосудистый объем. Регионарная и общая анестезия снижают объем циркулирующей крови и вызывают перемещение жидкости, происходящее между объемом плазмы и интерстицием [47\. Взаимодействие между анестетиками и сосудистым объемом есть лишь часть многих циркуляторных нарушений, вызываемых анестезией, которые непременно следует понимать и иметь в виду при выборе анестетика и жидкостной терапии.
Гипотензивные эффекты
Ингаляционная анестезия имеет много эффектов, нарушающих гомеостатический контроль за циркуляцией [48]. У взрослых изофлуран вызывает гипотензию вследствие снижения общего периферического сопротивления [49]: галотан вызывает гипотензию за счет депрессии функции миокарда. Кетамин, галотан, изофлуран и наркотики снижают сосудистое сопротивление и вызывают гипотензию у новорожденных [50]. Нар-
122 Анестезия в педиатрии
котики, барбитураты, бензодиазепины и ингаляционные анестетики вызывают вазодилатацию, повышающую общую сосудистую емкость и притупляют рефлекс, в норме корригирующий гипо-волемическую гипотензию.
Некоторые хирурги и педиатры незнакомы с влиянием анестезии на циркулирующий объем. Сфокусировавшись только на удержании воды, сопутствующей травме, повышении вазопрессина вследствие интраоперационного сокращения внеклеточной жидкости и нескольких днях после операции, требующихся для возвращения к нормальному волемическому статусу, эти врачи упускают из виду тот факт, что для коррекции гипотензии во время анестезии, столь типичной для младенцев и детей младшего возраста, требуются повышенные объемы жидкости.
Венозная емкость
У нормальных пациентов вены содержат до 80 % системного объема крови. Остальные 20 % находятся в артериях. Изменения артериального давления или сердечного выброса вызывают конст-рикцию либо дилатацию вен. Барорецепторы ка-ротидных синусов, печени и селезенки ощущают изменения давления и через симпатическую нервную систему изменяют венозный возврат к сердцу. Стимуляция барорецепторов каротидных синусов повышает венозную емкость на 8 мл/кг до и на 11 мл/кг после ваготомии [57]. В результате рефлекторной реакции барорецепторов наступают венозная дилатация и снижение венозного возврата к сердцу. Снижение артериального давления вызывает рефлекторную венозную кон-стрикцию и повышение кровотока к сердцу. Вены селезенки, печени и скелетных мышц являются хранилищами крови, и эти вены участвуют в пассивных и активных изменениях сосудистой емкости.
Изменения венозной емкости
Пассивные изменения венозной емкости происходят в соответствии с законом Ома, согласно которому снижение давления (Р) по ходу сосудистой системы равно потоку (/)> умноженному на сопротивление (R):
АР = F х R.
Вены становятся менее эластичными и пассивно дилатируются под воздействием наркотиков и ингаляционных анестетиков. По мере секвестрации крови в дилатированных венах меньше крови возвращается к сердцу, и сердечный выброс снижается. Гиповолемия, имевшаяся у ребенка до анестезии, с ее началом значительно усугубляется за счет пассивной венозной дилатации. Таким детям для
поддержания адекватного сердечного выброса не обходимо меньше анестетика, больший внутриео судистый объем либо и то и другое.
Симпатическая нервная система является ме диатором активных изменений венозной емко ста. Галотан и изофлуран дозозависимым обра зом снижают способность барорецепторов управ лять емкостными изменениями, необходимым] для уверенного повышения возврата венозно] крови к сердцу во время состояний с понижен ной перфузией. При повышенном системном ар териальном давлении также притупляется и нор мальное рефлекторное повышение венозной ем кости, снижающее венозный возврат к сердцу Следует особо обратить внимание на тот факт что увеличение барорефлекторной емкости а время изофлурановой анестезии сохранено зна чительно лучше, чем при эквипотенциальны: концентрациях галотана [52\. Представляется что причина этого различия есть следствие мень шего угнетения симпатической нервной активно сти изофлураном в сравнении с галотаном. У жи вотных со сниженным объемом крови болыпи значения сердечного выброса и регионально!1! кровотока наблюдались при применении изофлу рана, чем энфлурана, галотана и кетамина [53\ Кетамин поддерживает циркуляцию у нормаль ных, объемкомпенсированных пациентов, но ; гиповолемичных имеет такой же эффект, как ] тиопентал. Оба снижают сердечный выброс, час тогу сердечных сокращений и сосудистое сопро тивление [54\. С точки зрения волемическоп контроля у больных с умеренной гиповолемие] более предпочтительными представляются изо флуран или севофлуран, поскольку оба этих пре парата в умеренных дозах усиливают тонус сим патической нервной системы.
Влияние температуры и вентиляции
Во время анестезии пациенты часто нуждаются ] механической вентиляции вследствие гиперкар бии. Острая гиперкарбия компенсируется выбро сом ионов HCOf и С1~ и воды из клеток в интер стиций. Эти потери сморщивают внутриклеточ ный жидкостный компартмент, одновремеюк повышая внеклеточный объем. Гипокарбия и ги потермия ассоциируются с перемещением воды HCOJ и СГ в клетки. При быстрых потерях объ ема, избежании гипотермии и поддержании уме ренной температуры острая гиперкарбия предот вращает дополнительные потери жидкости и: внеклеточного пространства во внутриклеточное что может помочь максимизации функциональ ного внеклеточного водного объема. Таким образом, во время эпизодов гштоволемии настоятель но рекомендуется согревание замещающих жидкостей и избежание гипервентиляции.
Для понимания жидкостного гомеостаза в педиатрии необходимо представлять физиологию плода человека и принимать во внимание высокую скорость роста новорожденного. У рожденного в срок младенца удвоение массы тела ожидается за период между рождением и возрастом в 3 мес. К возрасту в 1 год темп роста постепенно замедляется. К этому времени младенец утроил свой вес до 9—10 кг. Детей, чье внутриутробное развитие оказалось прерванным очень преждевременными родами либо с тяжелой задержкой развития, называют детьми с очень низкой массой тела при рождении (ОНМР).
Для решения непростых проблем жидкостного, минерального и метаболического обеспечения этих младенцев хирурги и анестезиологи могут настаивать на присутствии в операционной специалиста по неонатологии. Хотя эта практика одобрена некоторыми медицинскими центрами, обычно она ведет к коллективному ведению пациента, так как ни один из врачей не представляет себе весь комплекс потребностей новорожденного. В экстренных ситуация это может приводить к принятию запоздалых или неоптимальных решений. Точно так же, как недоношенный или новорожденный с ОНМР для максимального использования всех возможностей стать нормальным ребенком требует участия опытного специалиста перинатолога, ослабленный, малого размера, травмированный младенец перед лицом необходимости корригирующей или паллиативной операции требует заботы врача, имеющего опыт и знания относительно анестезии и травмы на новорожденного. Работая вместе в детском отделении и операционной, врачи могли бы продолжать обмениваться опытом и знаниями. Ответственность за лечение ребенка в операционной должен принять на себя один врач — анестезиолог-
Младенцы с очень низкой массой тела при рождении
Снижение заболеваемости и смертности новорожденных с ОНМР происходит в основном благодаря эффективности субспециальностей — пери-натологии и неонаталогии. Хотя частота рождения недоношенных детей и детей с ОНМР не снижается, имеет место значительное улучшение исходов их лечения. Таким образом, мы продолжаем наблюдать постоянно повышающееся число педиатрических пациентов и специалистов по работе с ними для плановых и экстренных операций, паллиативных или восстановительных по
Жидкости, электролиты и питание в педиатрии 123
поводу дефектов развития или врожденных. Для анестезиолога, работающего с этими младенцами, понимание их измененных потребностей в электролитах, жидкостях и метаболическом обеспечении жизненно важно для их благополучия. Приведенный ниже случай иллюстрирует пери-операционные обстоятельства, связанные с жидкостями, электролитами и метаболическим обеспечением младенцев с ОНМР по сравнению с обычными.
Здоровая беременная близка к тому, чтобы родить ребенка преждевременно, при сроке беременности 26—28 нед; ребенок К. Г., вероятно, будет иметь массу тела не более 1 кг. Акушер информирует вас о том, что сердечные тоны К. Г. нормальны и что по данным ультразвукового исследования амнио-тические мембраны интактны н объем амниотиче-ской жидкости нормален.
Жидкости плода
Важным моментом в оценке жидкостного баланса К. Г. будет осознание того, что амниотическая жидкость и материнская циркуляция функционируют как расширенный внеклеточный жидкостной компартмент.
Амниотическая жидкость изотонична. Она продуцируется из мочи плода и секреции его легких. Каждый день экскретируется 200—1000 мл мочи и 200—400 мл жидкости из легких плода [55], К незначительным источникам амниотиче-ской жидкости относятся саливация и назальная секреция. Так как кожа кератинизируется на 28-й неделе беременности, чрескожная абсорбция К. Г. незначительна. Следовательно, К. Г. абсорбирует амниотическую жидкость, проглатывая ее. Наблюдается проглатывание и выделение (моча и трахеальная секреция). В заключительном триместре беременности полный оборот составляет около 1 л каждый день. Моча слегка ги-потонична, так как даже в условиях стресса почки плода не могут экскретировать гипертоническую мочу. Хотя петлевые диуретики, такие как фуросемид, проникают через плаценту, они не повышают диурез умеренно дегидратированного или находящегося в условиях стресса младенца, вероятно, вследствие высокого уровня вазопрес-сина [56\. Ренальный ответ К. Г. на вазопрессин и альдостерон сходен с таковым у нормального новорожденного. Высокие уровни кортизола, однако, приводят к дву-пятикратному повышению потока мочи и экскреции ионов Na+, K+ и СГ '[52]. Калий сразу же после рождения быстро переходит из внутриклеточного во внеклеточное пространство, что приводит к относительному увеличению объема сыворотки крови. После ро-
124 Анестезия в педиатрии
ждения по мере повышения клубочковой фильтрации и налаживания постнатального диуреза, способствующего выведению калия, уровень калия в плазме крови обычно снижается [57\.
Диагностировать дегидратацию у плода невозможно, но некоторые подвергшиеся стрессу в утробе младенцы и большинство имеющих задержку внутриутробного развития при рождении относительно гипогидратированы. Новорожденные с задержкой развития имели существенно повышенную потребность в воде по сравнению с теми, кто соответствовал своему сроку развития
Острый стресс (например, кровотечение, гипоксия, гипертоничность) ассоциируется с понижением диуреза и повышением концентрации вазопрессина в плазме плода [55]. Перемещения жидкости в организме матери отражаются на состоянии плода. После введения гипертонического солевого раствора беременным овцам объем крови плода снижался на 11 % благодаря повышению осмолярности плода с перемещением жидкости от плода. Однако этот эффект был преходящим; в течение часа объем крови возвращался к исходному уровню [55]. При лишении беременных овец воды в течение 5 дней, объем крови плода повышался нормально [59]. После двухдневного материнского истощения Na+ концентрация натрия у матери и плода снижалась предположительно вследствие быстрой трансплацентарной эквилибрации раствора [60].
При беременности человека внутривенное введение содержащих свободную воду растворов в попытке предотвратить преждевременные роды повышает риск пневмоторакса и пневмоперикар-диума во время родов. У новорожденных, подвергшихся стрессу, и младенцев, рожденных вагинально, наблюдается более высокий уровень аргининового вазопрессина и более высокий диурез, чем у новорожденных, не подвергшихся стрессу, или здоровых малышей, рожденных при помощи кесарева сечения [60, 61]. Точно так же, как изменения внутри плода параллельны изменениям в амниотической жидкости, изменения материнской циркуляции могут влиять на жидкостной баланс как плода, так и амниотической жидкости. Таким образом, как амниотическая жидкость, так и материнская циркуляция для плода функционируют как внеклеточный ком-партмент.
Избыточная гидратация здорового плода может быть невозможной. Brace [55] вводил сбалансированный солевой раствор прямо в вену плода ягненка и измерял темп мочеотделения. Он повышал темп инфузии ежедневно с 4 мл/ч до максимально 256 мл/ч, но при этом отека плода не обнаружил. Даже когда темп внутривенной инфузии у плода ягненка был эквивалентен 80 мл/кг/ч,
темп мочеотделения повышался в степени, до( таточной для предотвращения изменений гемг токрита плода. Введением изотонического рас твора глюкозы Battaglia и соавт. [62] смогли прс демонстрировать параллельное снижение осмс лярности как у матери, так и у плода, что, по-вк димому, явилось прямым результатом объемно нагрузки. По мере того как женщина, получак щая инфузию, метаболизирует глюкозу, снижав! ся осмолярность и у матери, и у плода.
Теперь в связи с дистрессом плода и ягодичны предлежанием для экстренного кесарева сечени требуется анестезия. До введения необходимое матери местного анестетика для смягчения воз можных после этого циркуляторных нарушени запланирована инфузия 1,5 л сбалансированыог солевого раствора. Если плацентарная циркуляци не нарушена и материнский метаболический ста туе, электролитный и жидкостной балансы матер нормальны, жидкостной баланс К. Г. не долже нарушиться.
К. Г. родился без трудностей, активен, кожны покровы розовые. Побывав короткое мгновение руках матери, передан медсестре.
Жидкостный баланс при рождении
Как уже обсуждалось выше, К. Г. продуцирова амниотическую жидкость при помощи мочи ] легочной секреции. Последняя имеет высоку» концентрацию хлоридов и почти не содержи протеинов. До рождения легкие наполнены жид костью (от 20—30 мл изотонической жидкости к килограмм). Существенное снижение содержа ния вневаскулярной воды в легких происходи1 на поздних сроках беременности и во время ро дов [63]. С первым дыханием новорожденной поток жидкости в терминальные отделения рее пираторного тракта оборачивается вспять. Легоч ное интерстициальное пространство быстро аб сорбирует практически не содержащую протеи нов жидкость, делая возможным газообмен. Эт< жидкость перемещается в легочную микроциркуляцию, фильтруясь из интерстиция в направле-ние более высокого осмолярного давления плаз-мы. Таким образом, с первым своим дыхание\ К. Г. получил болюс изотонической жидкости Кроме этого, он абсорбировал небольшой объе* жидкости в легочные лимфатические сосуды Последующее дыхание снизило водяное давленш в микроциркуляции, улучшая нарастающий кровоток и абсорбцию интерстициальной жидкости. У рожденных преждевременно младенцев он-котическое давление плазмы существенно ниже К. Г. и другие 26—28-недельные новорожденные имеют среднюю концентрацию альбумина 19 г/л, в то время как 40-недельный, рожденный в срок
новорожденный — 31 г/л [64\. Подкожный отек часто встречается у недоношенных младенцев, и чем более недоношен малыш, тем выраженнее отек. Эта степень отека связана со сроком беременности и используется в системе очков Dubowitz для клинического определения срока беременности при рождении [65].
Тяжесть отека не коррелирует с концентрацией альбумина в плазме, и внутривенная инфузия человеческого альбумина не реверсирует этот отек [64\. В действительности вводимый человеческий альбумин может повысить отек двумя путями. Во-первых, дополнительная солевая нагрузка человеческого альбумина (изотонический солевой раствор) может повысить отек тканей. Во-вторых, проникновение альбумина через капилляры в интерстиций повышает онкотическое давление в интерстициальном пространстве. При введении 0,5 мг/кг человеческого альбумина недоношенным новорожденным при одновремен-
Жидкости, электролиты и питание в педиатрии 125
ном измерении трансэпидермальных водных потерь было обнаружено значительное обратное соотношение [66\. Однако в течение 2 ч и водные потери, и внутрисосудистая концентрация альбумина возвращались к уровням, имевшимся до введения. Преходящий характер этого эффекта может быть следствием более быстрого перераспределения и большего объема распределения альбумина у новорожденных по сравнению со взрослыми. При синдроме капиллярной утечки, как это бывает у новорожденных младенцев на экстракорпоральной мембранной оксигенации, экзогенный альбумин не может измеримо увеличить внутрисосудистую концентрацию.
Неощутимые потери воды
У здоровых детей и подростков испарение составляет приблизительно 40 % общих постоянных потерь воды. Однако у недоношенных ново-
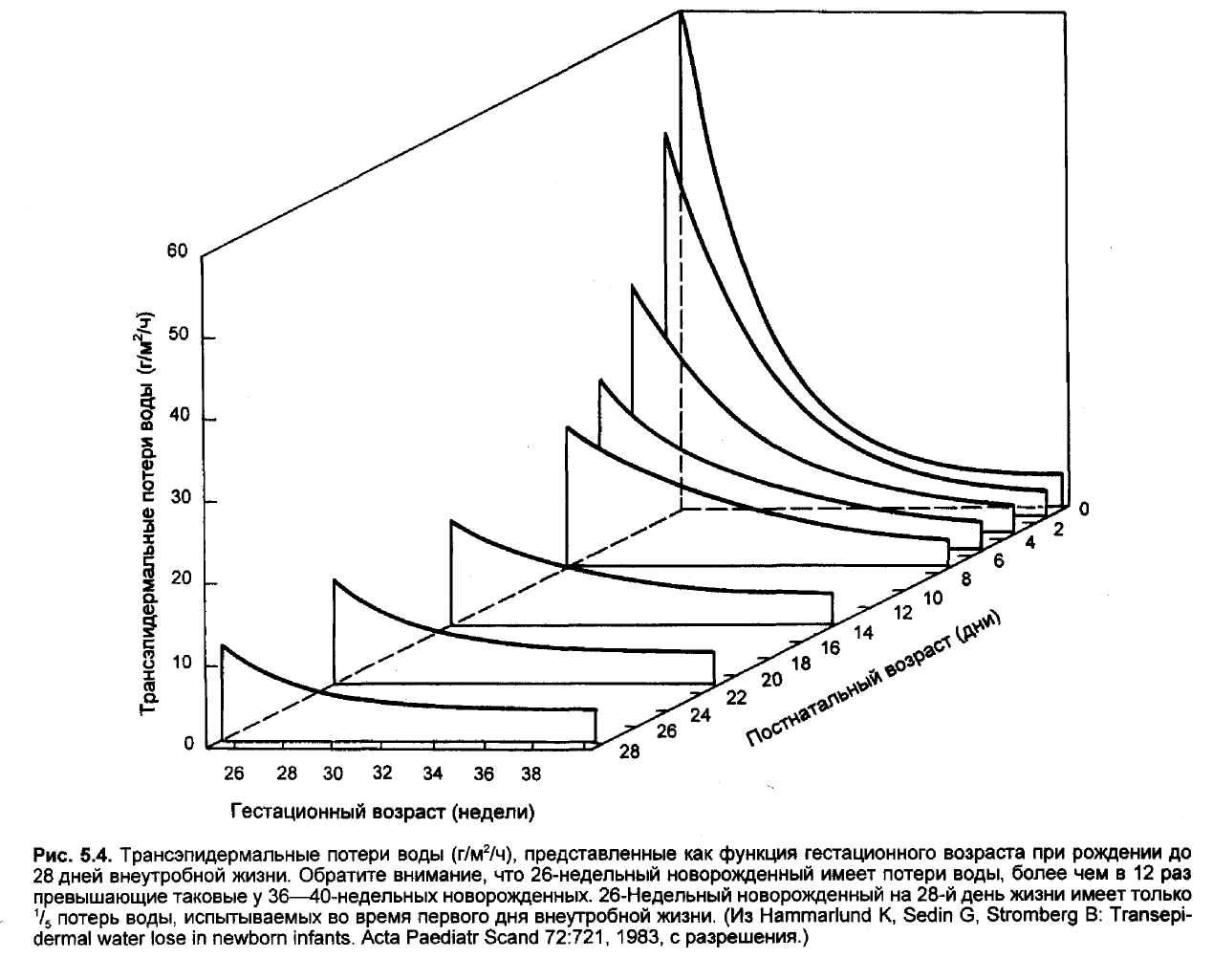
рожденных неощутимые потери воды в несколько раз выше вследствие потери воды еще и трансэпидермально. Обнаженные (неодетые) недоношенные младенцы теряют с испарением в 15 раз больше [67\, чем обнаженные новорожденные, рожденные в срок, в течение нескольких первых дней после рождения. Следовательно, обнаженный малыш с ОНМР может потерять этим путем до 10 % массы тела в течение первого дня жизни. Сопоставление потерь испарением, срока беременности и площади поверхности приведены на рис. 5.4. Полагают, что повышение потерь есть следствие разницы проницаемости кожи и содержания воды в коже, которые обратно пропорциональны гестационному возрасту у преждевременно рожденных младенцев.
Другие неощутимые потери воды у недоношенных новорожденных связаны с повышенным респираторным обменом. Недоношенные младенцы поддерживают более высокую частоту дыхания и минутную вентиляцию. Нормальная частота дыханий К. Г. составляет 80 в минуту. Недостаточность механики грудной стенки недоношенного младенца также повышает работу дыхания, что дает основания некоторым авторам выступать в пользу интубации и проведения механической вентиляции всем младенцам с ОНМР для обеспечения увлажнения и сбережения калорий, необходимых для роста, но повсеместной поддержки это предложение не получило.
Неонатологи и анестезиологи могут минимизировать неощутимые потери заворачиванием младенцев в пластик и обеспечивая сохранение атмосферного тепла (эутермичность) и влаги. Доступные в настоящее время инкубаторы предлагают широкий спектр контролируемого климата внутренней среды [68\. Увлажнение атмосферы и согревание малыша в двойном термоизоляторе эффективно при уходе за ним и транспортировке, но практически неприменимо во время операции. Младенцы, за которыми ухаживают в открытой кроватке с излучающим обогревателем над ней, теряют значительно больше и воды, и энергии. Несмотря на это, хирургам следовало бы рассмотреть модификацию открытых кроваток для ухода за тяжелобольными новорожденными. Неясно, следует ли применять инфракрасный обогреватель в случаях вскрытой брюшной полости, так как тепло может повреждать кишечник.
При изучении малышей с ОНМР, за которыми ухаживали в открытых кроватках, потребление кислорода было постоянным и нормальным при температуре кожи 36,5 °С и выше. Когда температура кожи снижалась на 1 "С, потребление ими кислорода значительно возрастало [69\. Как только температура в инкубаторе установлена в соответствии с температурой кожи малыша, не-

обходимо тщательно мониторироватъ производительность излучающего обогревателя во избежание как повышения температуры (что приведет к росту неощутимых потерь воды), так и ее понижения (что приведет к повышению метаболических расходов). Факторы, повышающие неощутимые потери воды, приведены в табл. 5.4.
Даже в термонейтральном кювезе К. Г. потеряет с испарением в течение первого дня внеут-робной жизни 60 мл; после 3 нед жизни его потери с испарением за счет изменений кожи снизятся до уровня, наблюдаемого у доношенных детей (10 мл/кг/сут) [70\. В теплой операционной даже с температурой воздуха 34—35 "С температура обнаженной кожи К. Г. может быстро упасть до 30 °С вследствие потерь тепла с испарением. Заворачивание его конечностей и других неопери-руемых зон в пластик, согревание всех растворов (исключая готовые) и применение увлажненных, согретых газов минимизируют ненужное потребление энергии, связанное с повышением потерь тепла с испарением.
Вода и электролиты у новорожденных
Так как натрий составляет более 90 % катионов и более 90 % осмотического давления внеклеточного жидкостного компартмента, концентрация натрия определяет размер внеклеточного пространства. Почки К. Г. в меньшей степени, чем почки доношенных младенцев, способны сохранять натрий, и поэтому ему необходимо получать больше, чем 2—3 мг-экв/кг/день натрия, необходимых для последних. Ранние исследования показали, что почки новорожденных незрелы, так как нагрузка водой и растворами не вызывает реакции, наблю-
даемой у взрослых, или по крайней мере вызывает не в такой степени. Эти исследования не учитывали, что рождение инициирует секрецию гормонов, отчасти ответственных за эти различия. При рождении почки, имевшие относительно пассивную реакцию на стресс внутриутробно, вынуждены приспосабливаться к быстрым перемещениям жидкостей, происходящим после прекращения контакта с амниотической жидкостью и материнской циркуляции. Центральные осморецепторы и периферические объемные рецепторы младенцев должны регулировать баланс воды и натрия. Недостаточная реактивность почек на нагрузку водой или растворами может быть ответом на избыточную секрецию эффекторов по обе стороны системы контроля объема и натрия. При рождении перемещение жидкостей, необходимое для открытия легких и поддержания циркуляции, происходит одновременно с массивным подъемом систем ренина, альдостерона и ангиотензина. Недоношенные и доношенные младенцы также имеют повышение атриального натрийуретического пептида (ANP) [71], недавно открытого гормона, в изобилии присутствующего в тканях предсердий, который индуцирует натрийурез и экскрецию как воды, так и натрия. Повышение объема плазмы растягивает предсердия, которые выбрасывают ANP и другие вазоактивные факторы и таким образом повышают сосудистую емкость. Недоношенные младенцы с респираторными заболеватиляции, имеют более высокие концентрации ANP. У этих пациентов концентрация ANP остается повышенной, несмотря на отрицательный баланс воды и натрия [72\.
Неудивительно, что почки новорожденных реагируют не так, как у взрослых: они получают конфликтную информацию. Высокие уровни альдостерона требуют задержки воды посредством ка-нальцевой реабсорбции натрия, но в то же самое время вазопрессоры сужают сосуды для поддержания артериального давления. Ангиотензин II сигнализирует о необходимости больше реабсорбиро-вать натрий в почках, а высокий фон натрийуре-тических пептидов сигнализирует о необходимости экскретировать натрий. Простагландины, присутствующие и активные в неонатальном периоде, имеют различное влияние на почки. В своем обзоре их действие описывают Brenner и Stein [73\. В это время неясно, являются ли почки новорожденного нечувствительными к гормональному контролю либо просто дезорганизованными.
Функция почек новорожденного
Почки рожденного в срок младенца созревают быстро. Гломерулярная и проксимальная каналь-цевая функции удваиваются у него к возрасту
Жидкости, электролиты и питание в педиатрии 127
1 мес [74\, в то время как у недоношенных, таких как К. Г., созревание происходит постепенно на протяжении нескольких первых недель. Химические мессенджеры, которых в избытке при рождении, постепенно снижаются, и для регенерации их запасов в организме необходимо некоторое время.
Скорость гломерулярной фильтрации у недоношенных ниже, чем у рожденных в срок. После 34 нед беременности и завершения нефрогенеза скорость гломерулярной фильтрации у человека растет экспоненциально. Однако в отличие от взрослых у хорошо гидратированного доношенного новорожденного инфузия до двух объемов поддерживающих жидкостей в течение первых нескольких дней после рождения не повышает скорости гломерулярной фильтрации. В одном из исследований за повышением жидкостной нагрузки следовало оживление диуреза, вероятно, в результате понижения почечной канальцевой реабсорбции воды [75\. Другие исследования доношенных и недоношенных младенцев в первые дни внеутробной жизни иногда показывали быстрые изменения гломерулярной фильтрации, связанные с состоянием гидратации. Это несовпадение результатов является еще одним свидетельством того, что реактивность почечного сосудистого русла повышается в перинатальном периоде. Следовательно, предсказать водный и электролитный баланс в этот период непросто.
Водный и электролитный баланс контролируется почечными структурами, расположенными дистальнее гломерул. Созревание функции почечных канальцев существенно отстает от созревания функции гломерул. Таким образом, новорожденный способен продуцировать разведенную мочу, но концентрировать мочу способен вдвое меньше, чем взрослый, вследствие пониженного тонуса медуллярного интерстиция [76\. Созревание функции клеток почечных канальцев происходит в неонатальном периоде. Двухмесячный младенец способен экскретировать мочу с осмолярностью, в 4 раза превышающей осмоляр-ность плазмы, доношенный новорожденный — только вдвое.
При рентгенографии брюшной полости у 3-дневного К. Г. выявлен свободный воздух, в связи с чем планируется экстренное вмешательство. Основным в клинической картине младенца являются признаки интоксикации. Витальные показатели таковы: масса 1 кг (на 50 г больше, чем накануне); частота сердечных сокращений 180 уд/мин (было 160 уд/мин); артериальное давление 45/30 мм рт. ст. (было 55/40 мм рт.ст.); частота дыхательных движений 30 в 1 мни при вентиляции с положительным давлением, установленным как 18/4 см вод. ст.; температура 36,5 °С.
128 Анестезия в педиатрии
У К. Г. запавший лобный родничок, кожа бледная, тургор ее снижен, с его руки при помощи пульсоксиметра считываются перемежающаяся волновая кривая и сатурация. Время капиллярного наполнения удлинено у него до более 5 с. Несмотря на поддерживающее внутривенное введение сбалансированных солевых растворов (150 мл/день) плюс липиды, протеин и несколько переливаний крови, К. Г. не выделяет мочу в течение последних 8 ч. Он "сухой". Дегидратация и любой электролитный дисбаланс, анемия и гипергликемия у него должны быть корригированы до операции. Жизненно важен тщательно разработанный план предоперационного ведения, скоординированный неонатологом и медицинской сестрой, ухаживающей за младенцами у его кроватки. После установления центрального венозного катетера может быть осуществлено обоснованное болюсное введение сбалансированных солевых растворов, и ре-гидратация может быть завершена в течение часа. Для транспортировки К. Г. должен быть тщательно завернут в целлофан и согревающее одеяло. Операционная также должна быть согрета к его прибытию.
Натрий и гидратация
Как подчеркивалось в приведенном выше случае, первые дни К. Г. после рождения в норме предполагают значительные перемещения жидкостей. Благодаря расширению объема циркулирующей жидкости, вызванному перемещению интерсти-циальной жидкости легких, сопутствующей рождению, его начальные потребности в жидкости на первые 2 дня жизни составляют около 90 и 75 мл/кг соответственно.
Содержание натрия в плазме у недоношенных младенцев варьируется и, следовательно, может быть относительно слабым показателем их гидратации. У недоношенных младенцев высоки почечные и интестинальные потери натрия, что требует в первые 2 нед жизни [ 77] дополнительного его введения или перорально, или внутривенно. Усиленный рост, имеющий место в течение дополнительного обеспечения натрием, продолжающегося после этого начального 2-недель-ного периода лечения, дает основания предположить, что положительный натриевый баланс стимулирует рост [78\. Интересно заметить, что молоко матерей, родивших младенцев до срока, содержит в 2—3 раза больше натрия, чем молоко родивших в срок [79\.
Гипонатриемия может быть также следствием
задержки воды. Применение вентиляции с положительным давлением и постоянного положительного давления дыхательных путей (СРАР) независимо от наличия или отсутствия респираторного дистресса, сопровождается натрийуре-зом, повышенной задержкой воды и выбросом вазопрессина [80].
Острый дисбаланс водного гомеостаза новорожденных ассоциируется также с внутримозговы-ми кровоизлияниями и пневмотораксом [81, 82\. Была замечена связь инфузии воды, глюкозы и гипертонических растворов натрия с внутримоз-говыми кровоизлияниями у недоношенных младенцев. Причиной считают быстрые перемещения церебральной жидкости вследствие введения гипер- или гипотонических растворов [82]. Выраженные изменения системного артериального давления также ассоциируются с внутримозговы-ми кровоизлияниями. Длительная инфузия сбалансированных солевых растворов, предотвращая быстрые изменения артериального давления и осмолярности помогает поддерживать циркулирующий объем в течение операции и анестезии.
Избыточная гидратация может стать причиной отека легких [83], незаращения артериального протока [84\ и застойной сердечной недостаточности. Терапия, уменьшающая риск этих состояний, включает раннее умеренное ограничение натрия и жидкостей для снижения преднагрузки: диуретики (фуросемид) для повышения концентрации протеинов плазмы; осторожную вспомогательную вентиляцию с положительным давлением в конце выдоха (PEEP) для снижения дополнительных потребностей в кислороде; адекватное нутритивное обеспечение синтеза протеинов и роста; избежание факторов, повышающих легочный кровоток, включая гипоксию, эмоциональное напряжение и боль [63].
Опасаясь гипергидратации, многие неонатоло-ги ошибочно гипогидратируют младенцев с ОНМР. Присоединение наркозных и периопера-тивных потерь жидкости к этому состоянию ги-погидратации может вести к полному сердечнососудистому коллапсу и смерти. Как подчеркивалось ранее, потребности в натрии у младенцев с ОНМР повышены. Младенцам, рожденным на сроке беременности до 30 нед, требуется натрия до 5 мг-экв/кг в сутки в отличие от рожденных на сроке 30—35 нед, которым требуется 4 мг-экв/кг в сутки в течение первых 2 нед после рождения [77,85\.
Калий
Так как более 98 % запасов калия являются внутриклеточными, концентрация калия в плазме дает лишь грубое представление об общем количестве калия в организме. Недавно был сделан об-
 Жидкости,
электролиты и питание в педиатрии 129
Жидкости,
электролиты и питание в педиатрии 129
зор нарушений калиевого гомеостаза у детей [86\. Многие препараты, применяемые в неонаталь-ном периоде, индуцируют экскрецию калия почками либо прямо, либо через изменение рН. К таким препаратам относятся диуретики (фуросе-мид), стероиды, антибиотики (аминогликозиды) и метилксантины (теофиллин). Респираторный или метаболический ацидоз сигнализирует почкам о необходимости задерживать ионы водорода ценой потерь ионов калия. Экстраренальные потери калия (например, гастральные и интести-нальные потери жидкости) могут вызвать значительную гипокалиемию. Чрескожные потери с перспирацией составляют дополнительную, хотя и незначительную часть потерь.
Глюкоза, инсулин, кальций и бикарбонат понижают содержание калия в плазме, способствуя перемещению калия в клетки. Следовательно, они клинически целесообразны при ведении случаев острой гиперкалиемии. р-Адренергические соединения, особенно альбутерол, перемещают калий в клетки в обмен на натрий. Это может объяснить, почему тревожные состояния сопровождают снижение калия в плазме [87].
Гиперкалиемия является состоянием более тревожным, чем гипокалиемия. В табл. 5.5 приведены препараты, применение которых ассоциируется с повышением концентрации калия в плазме. Калий в плазме повышается при ацидозе и понижается при алкалозе без острого изменения общих запасов калия в организме (табл. 5.6). Гиперчувствительность клеточных мембран к суксаметонию после повторного его применения может вызвать массивный выброс калия из клеток. Это особенно очевидно на 10—70-й день после ожогов, при массивной травме, столбняке, мышечных дистрофиях [88], уремии и при параплегии на 14—28-й день после ее возникновения [87].


Так как на концентрацию калия в плазме влияют многие факторы, жизненно важно не лечить "количество", а искать основную причину патологии концентрации калия, корригировать ее и затем осторожно добавлять или исключать калий из вводимых внутривенно растворов. В младенческом периоде поддерживающая доза калия составляет 2—3 мг-экв/кг в сутки. Так как быстрая инфузия калия может стать причиной флебитов и тяжелых сердечных аритмий, следует избегать одномоментного введения, за исключением крайних обстоятельств. Потребляемое пе-рорально и внутривенно количество калия должно отвечать основным потребностям и быть достаточным для компенсации его потерь. При оли-гурии, анурии, шоке, ацидозе или почечной недостаточности калий должен быть исключен из всех вводимых внутривенно растворов. Даже Рингер-лактат, содержащий 3—4 мг-экв/л, должен быть заменен изотоническим солевым раствором во избежание гиперкалиемии, ассоциирующейся с почечной недостаточностью.
Калий и консервированная кровь
Очень свежая цельная кровь содержит меньше свободного калия и предпочтительнее более старой цельной крови или концентрированных ее продуктов. Мать младенца является превосходным источником свежей крови (если ее кровь совместима с кровью малыша), даже если она выглядит слегка анемичной. Так как переливание крови новорожденному в большинстве случаев требуется вследствие частого забора проб крови для исследований, небольшой объем крови, необходимый для повышения эритроцитарного объема может быть получен от одного имеющегося донора. Наш банк крови неплохо помогает нам в заготовке небольших, концентрированных и замороженных порций материнской крови для замещения: большие, свежие объемы могут быть приготовлены для использования в операционной. Эта процедура требует минимальных донорских затрат и снижает содержание калия в сыворотке хранимой крови.
130 Анестезия в педиатрии

 Кальций
Кальций
Для недоношенных младенцев нормальным является уровень кальция 6,5—8 мг/100 мл, так как они имеют более низкую концентрацию протеинов в плазме и больше несвязанного кальция, чем более старшие пациенты. Таким образом, большее количество кальция доступно для клеток. Однако запасы кальция в организме недоношенного младенца очень невелики по сравнению с организмом рожденного в срок, и гипокальцие-мия возникает почти у 90 % недоношенных детей [89\.
Ежедневная поддерживающая потребность младенца с ОНМР в глюконате кальция может превышать 500 мг/кг/сут. Алкалоз (вследствие энергичного лечения бикарбонатом или гипервентиляции), так же как и инфузия альбумина или препаратов крови, содержащих цитрат, понижает концентрацию ионизированного кальция. Гипокальциемия у недоношенного младенца ассоциируется с понижением функции миокарда [Щ. В операционной для обеспечения кальция после гемотрансфузии или замещения его дефицита может быть предпринята медленная инфузия 20 мг/кг (0,2 мл/кг) 10 % кальция хлорида либо эквивалентная доза 10 % кальция глюконата 60 мг/кг (0,6 мл/кг). В этих концентрациях хлоридная и глюконатная формы кальциевых солей одинаково эффективны для повышения концентраций ионизированного кальция у детей [91]. Следует помнить о том, что препараты могут легко преципитировать на стенках инфузионных систем малого объема для внутривенного введения вследствие относительно низкой скорости потока и применения малых объемов растворов для их промывания. При смешивании кальция и бикарбоната образуется преципитат, что может привести к обструкции инфузи-онной системы и небольших вен.
Несмотря на то что острая гиперкалыдиемия у детей редка, ее лечение требует немедленной гидратации изотоническим солевым раствором. При острой или хронической терапии с целью снижения кальция в сыворотке применяются петлевые диуретики, бисфосфонаты, пликами-цин, кальцитонин, галлия нитрат, стероиды, фосфаты и простагландины. В случае ошибок обеспечения содержания кальция в составах для полного парентерального питания, врожденных причин, молочно-щелочном синдроме, раке или эндокринных расстройствах лечение диктуется симптоматологией. К гастроинтестинальным симптомам гиперкальциемии относятся анорексия, тошнота, рвота и запор. При гиперкальциемии могут также наблюдаться гипертензия, усиление токсичности дигоксина, почечные расстройства и поражения ЦНС вплоть до комы [92\.
Магний
У новорожденных дефицит магния редок. У мл денцев более старшего возраста он ассоциирует! с длительным применением гипералиментацио] ных растворов, не содержащих магния. Это и пично для детей в критическом состоянии, Tj как в плазме находится всего лишь 1 % магни внутриклеточное содержание Mg2+ было измери но методом ядерно-магнитного резонанса. СК щую гипомагниемию организма имели 65 % па циентов в критическом состоянии [93\. Гипомш ниемией сопровождаются также альдостерониз! кишечные свищи, голодание, панкреатиты, алк( голизм, применение катехоламинов и Э-агош стов. Недостаточность кальция часто сопровоз дает недостаточность магния (уровень магни ниже 1,5 мг-экв/л). Недостаток любого из эти двух ионов понижает функцию миокарда. Гипс магниемия вызывает мышечную слабость, сер дечные аритмии и гипокалиемию.
Высокий уровень магния часто наблюдается новорожденных, чьи матери получали соли маг ния для лечения токсикозов беременности. Эп соли магния вызывают седацию и могут усилит действие мышечных релаксантов у роженицы ] новорожденного. Эти эффекты солей магния мо гут быть преодолены введением кальция.
Анионы
Как рожденные в срок, так и недоношенны) младенцы способны экскретировать с мочо! больше бикарбонатов, чем хлоридов. И наоборот их почки способны реабсорбировать больше хло ридов, чем бикарбонатов, даже в условиях ациде-мии. Чем более недоношен младенец, тем выпи потери бикарбонатов. Метаболический ацидо! (рН менее 7,20) следует лечить растворами, содержащими НСО7 или ацетат в качестве анионного компонента. При применении натрия I виде NaCl рожденный в срок младенец способен перенести введение всего 12 мг-экв/кг в сутки. Однако, если половина натрия вводится в виде бикарбоната, младенец способен перенести 15 мг-экв/кг в сутки [94\. Так как растворы для внутривенного применения содержат в первую очередь NaCl, эти "взрослые" препараты могут быть противопоказаны при лечении недоношенных младенцев. Например, К. Г. может потребоваться дополнительно разведенный ацетат или HCOJ вследствие почечных потерь НСОз и ацидоза. Так как и физиологический раствор, и Рин-гер-лактат содержат на 50 % хлорида больше, чем плазма в норме, замещающие растворы для новорожденных могут быть составлены из половинного содержания соли плюс 65 мг-экв натрия бикарбоната на литр, с тем чтобы отвечать требова-
 Жидкости,
электролиты и питание в педиатрии
131
Жидкости,
электролиты и питание в педиатрии
131
ниям сбалансированного солевого раствора натрия с пониженной концентрацией хлорида. Этот раствор следует оставить для младенцев с сохраняющимся метаболическим ацидозом. Также были недавно описаны и предложены в клиническую практику и другие буферы, такие как ТНАМ, карбикарбонат и DCA [95\.
Хлоридное истощение происходит у новорожденных при длительном применении диуретиков, но оно редко связано с периоперативным замещением жидкости. Хронический дефицит хлоридов, однако, сопровождается тяжелой задержкой развития [96\. Более того, метаболический ацидоз невозможно скорригировать без коррекции сопутствующей гипохлоремии.
Концентрация фосфатов в плазме может снижаться во время операции вследствие внутриклеточного перемещения этого иона. Гастроинте-стиналъные потери вследствие рвоты или назога-стрального дренирования также вносят вклад в периоперативную гипофосфатемию. Гипофосфа-темия ассоциируется с нарушениями доставки кислорода к тканям, депрессией миокарда и респираторной недостаточностью [97]. Редкое врожденное заболевание гипофосфатазия сопровождается пониженной минерализацией костей и зубов. Перинатальные формы фатальны, для них характерны судороги и переломы. Младенческие формы могут сопровождаться умеренно выраженным респираторным дистрессом, задержкой развития, гипотонией, лихорадкой, запором и заметными скелетными деформациями [Щ. Детские формы заболевания средневыраженны, основными проявлениями являются дефекты скелета и лептосклерия.
Глюкоза
Запасы энергетических субстратов в организме К. Г. понижены. Не имея жира и с очень небольшими запасами гликогена, он нуждается в постоянном внутривенном введении источника энергии, до тех пор пока болен. Кроме низких запасов глюкозы в организме, младенцы имеют значительно более высокий темп метаболизма и потребления глюкозы, чем дети более старших возрастов. Здоровые младенцы обычно ничего не получают через рот за 3—6 ч до операции для снижения риска аспирации желудочного содержимого. Гипогликемия новорожденных, особенно при операциях на сердце и сосудах, индуцирует тяжелую гипогликемию, угрожающую жизни. В таких ситуациях умеренное введение глюкозы (2,5 мг/кг/мин) не угрожает развитием клинически выраженной гипергликемии [99]. Во время операции потреблении глюкозы мышцами ослабевает [100\. Кроме того, во время операции в ответ на операцию, боль и стимуляцию уровень
глюкозы повышается. Так как во время операции глюкоза утилизируется не очень хорошо, в дополнительном введении глюкозы в этот период у более старших младенцев часто нет необходимости. В одном из исследований было отмечено, что дети моложе 5 лет оставались нормоглике-мичными несмотря на голодание в среднем в течение 15 ч [94\. Здоровые младенцы и дети голодают в течение их обычного ночного сна без появления признаков гипогликемии.
У К. Г. по сравнению с младенцами, рожденными в срок, понижены как запасы глюкозы, так и почечный порог фильтрации глюкозы. Инфу-зия 10 % раствора декстрозы (100 мг глюкозы/мл) со скоростью 6 мл/кг/ч обеспечит его глюкозой 10 мг/кг/мин. Введение глюкозы в дозе, превышающей 7—10 мг/кг/мин, может превысить его почечный порог для глюкозы. В связи с операционным или травматическим стрессом уровень глюкозы в сыворотке, возможно, повысится у него еще больше, что может привести к дальнейшему тяжелому истощению его запасов гликогена. Кроме того, повышают концентрацию глюкозы в его плазме и другие источники сахара, включая декстрозу консервированной крови. Во избежание интраоперационной глюкозурии и осмотического диуреза следует тщательно монито-рировать эффект инфузии декстрозы, определяя ее концентрацию в крови и моче с помощью тестирующих наборов типа Dextrostix, Chem Strips или коммерчески доступных ручных устройств типа One Touch или HemoCue.
Гипергликемия во время анестезии может усиливаться вследствие снижения эффективности инсулина [10Д. По мере снижения устойчивости к вводимой глюкозе и повышения эндогенной продукции глюкозы растворы, содержащие 1 % декстрозы, могут оказаться предпочтительнее растворов 5 % декстрозосбалансированных солевых растворов для жидкостного замещения. Для получения такой концентрации декстрозы, вводимые для поддержания жидкости могут быть даны в виде 5 % декстрозосбалансированного солевого раствора, а дефицит жидкости и сопутствующие потери замещены простым сбалансированным солевым раствором. Сбалансированный солевой раствор для недоношенного младенца с тяжелыми нарушениями в целях периоперацион-ного замещения объема может быть приготовлен извлечением 100 мл раствора из поллитрового пакета 0,5 % изотонического солевого раствора и добавлением к нему 40 мг-экв бикарбоната натрия (2 мг-экв/мл = 20/мл) и 80 мл 5 % раствора декстрозы в воде. В итоге хорошо перемешанный раствор содержит около 0,08 % декстрозы в сбалансированном растворе натрия хлорида и натрия бикарбоната. Как подчеркивалось выше, во время любых больших операций необходимо мо-
132 Анестезия в педиатрии
ниторировать уровень глюкозы в сыворотке крови.
Накапливаются данные о том, что растворы, удлиняющие анаэробный метаболизм в ишеми-зированных тканях [например, фруктоза-1,6-бис-фосфат (FBP)], вполне возможно, улучшают клинические исходы ишемических ситуаций. Улучшение выживаемости, продемонстрированное у животных после миокардиальной, кишечной и церебральной ишемии при применении этих растворов, дает основания полагать, что исключительное применение глюкозосодержащих растворов у педиатрических пациентов должно быть пересмотрено [102—104\.
Жидкостная терапия в отдельных случаях в педиатрии
Пилорический стеноз
Для устранения кишечной непроходимости в первый год жизни часто требуется операция. Типичным для таких ситуаций является пациент с пилорическим стенозом.
Рожденный в срок ребенок в возрасте 2 нед госпитализирован в связи с рвотой и дегидратацией. Этот младенец, П. С, имеет клинические проявления интоксикации и время капиллярного наполнения более б с. Его кожные покровы на ощупь холодны и бледны, при щипке для расправления складок в исходное положение требуется несколько секунд. В течение 16—24 ч у него нет мочи и стула, масса его тела на 10 % ниже массы его тела при рождении. На 3 см ниже правого реберного угла пальпируется объемное образование размером с оливу. После кормления видны волны желудочной перистальтики. Младенец был госпитализирован для коррекции дегидратации и последующей пиломиотомии.
Пилорический стеноз относится к экстренным ситуациям. Для коррекции сокращения объема внутрисосудистой жидкости необходима регидра-тация. Хотя операция может быть отнесена к небольшим, эффективная предоперационная ре-гидратация чрезвычайно важна. Восстановление внутрисосудистого объема должно предшествовать попыткам хирургической коррекции стеноза даже в случае голодания ребенка. После восстановления объемного и электролитного баланса оперативная коррекция может быть выполнена более безопасно. Обычно для этого может потребоваться регидратационная терапия в течение 1— 3 дней.
Пилорический стеноз вызывается гипертрофией мышц пилорического сфинктера. Нарастание
симптоматики после первой или второй недели внеутробной жизни позволяет предположить, что возникает он уже постнатально. В то время как опорожнение желудка у новорожденных происходит в течение 2 ч с момента последнего кормления, младенцы с пилорическим стенозом имеют жидкость в желудке и через 6 ч после последнего кормления. При поступлении исследование электролитов П. С. показало глубокий метаболический ацидоз с умеренной гипернатриемией.
Младенцы с пилорическим стенозом при поступлении в основном имеют гипохлоремию, ги-покалиемию и метаболический алкалоз. Гипока-лиемия обусловлена потерей калия из желудка и обменом ионов водорода на ионы натрия в почечных канальцах, что ведет к системному алкалозу и парадоксально кислой моче. Истощение объема у младенца П. С. до госпитализации стало следствием рвоты и ограничения потребления жидкости, и симптомы гипернатриемической дегидратации и шока маскируют сокращение алкалоза, вызванного дегидратацией и гастральными потерями натрия, калия и ионов водорода.
По клинической оценке, базирующейся на запавших глазах и родничках, холодной коже, анурии, тахикардии и тахипноэ, гипотензии и отсутствию реакции на стимуляцию П. С. дегидратирован на 15—20 %. В начале лечения необходима быстрая инфузия 20 мл/кг физиологического раствора для коррекции шока. Если внутривенную канюлю не удается ввести такому младенцу, то нормальный солевой раствор (20 мл/кг) можно вводить внутрикостно, предварительно тщательно определив место инъекции и подобрав тип иглы [105, 106\. После восстановления мочеотделения и повторного исследования электролитов можно постепенно вводить калий. Тяжелое калиевое истощение является следствием рвоты, неадекватного потребления калия и почечных потерь этого иона и для восстановления может потребовать нескольких дней.
Серповидно-клеточная анемия
Коррекция симптоматики серповидно-клеточной анемии сводится к минимизации процентного содержания HbS, снижению его ниже 40 % путем трансфузии, простой или обменной (см. гл. 6). У детей с серповидно-клеточной анемией повышение фетального гемоглобина (HbF) также является признаком нормального восстановления после операции [107, 108\. Предшествовавшие эпизоды этого заболевания в паренхиме почек могут ком- 1 прометировать почечную функцию. Следует из- ] бегать гипергидратации. Во избежание формиро- i вания серповидно-измененных эритроцитов следует избегать гипоксемии [108\, поддерживать нормотермию и адекватную гидратацию. Новым
 Жидкости,
электролиты и питание в педиатрии
133
Жидкости,
электролиты и питание в педиатрии
133
средством снижения концентрации HbS является внутривенная инфузия бутирата, натурального вещества, применяющегося в качестве пищевой вкусовой добавки. У пациентов как с HbS, так и с талассемией драматически повышен фетальный гемоглобин (HbF). Основой этого представляется механизм стимуляции генной экспрессии [109, 110]. В большинстве штатов введено обязательное универсальное тестирование всех новорожденных для идентификации HbS методом электрофореза, что дало возможность выявить детей, еще не имеющих признаков HbS, но относящихся к группе риска. В каждом детском лечебном учреждении должен быть известен номер телефона лаборатории штата, по которому можно получить информацию о результатах скринингового исследования новорожденного на врожденные заболевания.
Обожженный ребенок
Хирурги просят назначить время операции для первичной хирургической обработки и пересадки поверхностного слоя кожи 5-месячной девочке, С. К., опрокинувшей на себя чайник с кипятком, стоявший на плите. С. К. получила ожоги поверхностных слоев кожи щек, шеи и грудной клетки. При помощи номограммы определена площадь поверхности ожогов, составляющая 35 %. После ожога прошло 8 ч, и с момента поступления в госпиталь девочка достаточно гидратирована растворами кристаллоидов.
Жидкостная терапия С. К. и других детей с распространенными ожогами требует понимания механизма повреждения тканей теплом. В то время как при воздействии воды температуры 150 °С полная глубина ожога достигается в течение 0,5 с, при взрыве бензина ожог может наступить быстрее и быть интенсивнее. Ориентация на величину внутриторакального объема крови в качестве основного показателя может оказаться более точной в проведении реанимации, чем учет только "механической" ожоговой формулы [111].
Ожоги полной глубины имеют зону, лишенную циркуляции вследствие спазма сосудов, практически не содержащих крови. К этим тканям прилежит зона стаза, зона частичного ожога [112]. В этой зоне имеет место интенсивная воспалительная реакция и чрескапиллярное пропо-тевание жидкости и протеинов вследствие микрососудистой дилатации и повреждения клеток, которое ведет к повышению проницаемости и массивным потерям воды и протеинов, как из интерстициального, так и из плазменного ком-партментов. Вследствие гемоконцентрации и относительной полицитемии гематокрит может
вначале повыситься, усиливая вязкость крови и соответственно шунтирование в системе микроциркуляции. Так как в большинстве случаев ожоги частичной глубины способны к восстановлению и заживлению, интерес сфокусирован на максимализации микроциркуляции в этой зоне. Целью терапии является предотвращение про-грессирования частичного повреждения этой зоны до потери кожи на всю глубину.
Основные потери жидкости и протеинов происходят в первые несколько часов после повреждения благодаря выбросу гистамина с последующей потерей протеинов, создающих условия для дальнейшего нарастания клеточной проницаемости [113]. Количество потерянной жидкости устанавливается при помощи подсчета площади поверхности ожога, оценки его глубины с учетом возраста жертвы. Ожоги дыхательных путей вызывают заметные потери жидкости вследствие массивного трансцеллюлярного ее перемещения. Младшие дети теряют жидкости больше, чем старшие жертвы ожогов, даже при одинаковой площади поверхности ожога. Это различие есть следствие более высокого функционального объема внеклеточной жидкости и содержания воды в коже у младших детей. Были разработаны раздельные номограммы для жидкостного восстановления у детей. Потери жидкости можно установить умножением процента ожога на относительный размер объема внеклеточной жидкости пациента. Может быть показан инвазивный мониторинг, включающий внутрисосудистую сатурацию и контроль давления в легочной артерии [114].
В настоящее время в лечении ожогов дискуссионным является вопрос: что лучше — гипертонические или изотонические солевые растворы — и когда в качестве дополнительной замещающей жидкости следует применять коллоиды. Общепринятая формула предполагает применение только растворов типа Рингер-лактат от 2 до 4 мл/кг/% (поверхности) ожога в течение первых 24 ч с момента его причинения [115]. Некоторые центры опираются на данные, указывающие на то, что более высокие уровни протеина можно поддерживать коллоидами уже с 6-го часа с момента получения ожога. Все центры обеспечивают достаточно дополнительных жидкостей для поддержания адекватного диуреза. Большинство центров обеспечивают терапию коллоидами и начинают дополнительное парентеральное питание в период с 24 до 48 ч с момента ожога. Остановка сердца далеко не редкое явление. Даже в ведущих ожоговых центрах отмечен показатель выживания, равный 50 % [116].
Сторонники применения гипертонических растворов утверждают, что при этом на восстановление объема требуется меньше жидкости и,
134 Анестезия в педиатрии
таким образом, возникает меньше отеков. Они полагают, что это обстоятельство ведет к меньшему стазу в зоне обратимого повреждения. Сторонники раннего и свободного применения коллоидов полагают, что коллоиды улучшают перфузию нутриентов, включая кислород, в зону стаза. Однако ни одна из этих теорий не подтверждена контролируемыми исследованиями [117\.
Масса тела С. К. нарастала вслед за свободным введением жидкости. Она также удерживала жидкости в качестве реакции на травму. Отек, респираторные проблемы (включая отек легких), замедление опорожнения желудка или парез кишечника, а также признаки отека мозга характерны для ранних стадий ведения ожогов. В настоящее время полагают, что применение гипертонических и протеинсодержащих жидкостей замедляет формирование отеков. Коллоиды, назначаемые более чем через 8 ч после ожога, снижают отек тканей, сопровождающий гипопротеинемию [116]. Считается, что снижение отека повышает оксигенацию в зоне стаза за счет улучшения микроциркуляции [113, 118\. Последние исследования подтвердили преимущества введения больших доз (66 мг/кг/ч) витамина С. При этом снижается потребность в жидкости, ослабевают нарушения дыхания и уменьшается формирование отеков [1Щ.
У пациентов с ожогами понижены концентрации ионизированного кальция в плазме [120], что делает необходимой постоянную инфузию кальция. Инфузия альбумина и содержащих цитрат продуктов крови еще больше снижает концентрацию ионизированного кальция. Другие электролитные нарушения при ожогах могут быть связаны с применяемыми повязками. Например, при применении повязок с нитратом серебра увеличиваются потери натрия и калия в ожоговый струп [121].
Если бы С. К. перенесла ингаляцию дыма, могла бьшотребоваться диагностическая бронхоскопия. После ингаляции дыма отек гортани проявляется в течение нескольких часов; поражения паренхимы манифестируют на 2—4-й день. Стридорозное дыхание, отторжение некротизи-рованных участков слизистой оболочки и отек легких вносят свой вклад в повышение микро-циркуляторной проницаемости [122]. Некоторые исследователи выступают в пользу ограничения жидкости, чтобы избежать этих осложнений. Однако в эксперименте у овец с обожженными легкими особи, получавшие только поддерживающие жидкости, погибали в течение 48 ч, тогда как в группе, получавшей объем, вдвое превышающий поддерживающий, выжили 70 % [123].
Адекватность жидкостного замещения помогает определить измерение центрального венозного давления. Пациенты, нуждавшиеся в большем количестве жидкости для поддержания централь-
ных давлений наполнения, имеют заметно более низкую выживаемость [124]. Травма, боль, гипо-волемия и тревога стимулируют секрецию вазо-прессина, что ведет к задержке воды, повышению концентрации мочи и олигурии у детей с нормальной функцией почек. Использование для определения адекватности гидратации только объема мочи и ее специфической плотности часто приводит к развитию избыточной гидратации.
Предоперационное ведение младенцев и детей с геморрагическим шоком требует знания результатов последних исследований, обнаруживших увеличение смертности при раннем и энергичном замещении потерянной жидкости [125]. Однако, если кровотечение остановлено, для выведения ребенка из шока необходимо массивное и быстрое восстановление потери жидкости (свыше 40 мл/ кг/ч) [126, 127]. У детей шок обычно ассоциируется с тяжелой гиповолемией, с сепсисом или без него. Острое кровотечение при травме, тяжелая диарея, перитонит и ожоги ведут к потере функционального объема, которая, не будучи своевременно корригирована, ведет к гиповолемии. Во время анестезии рефлекторная компенсация в ответ на гиповолемию и хирургическую травму снижена. Так как внеклеточный функциональный объем потерян, венозный возврат ослаблен и сердечный выброс снижается. Реакция барорепепто-ров стимулирует выброс катехоламинов и повышает сосудистое сопротивление, сердечную сократимость и частоту сердечных сокращений. Она также снижает венозную емкость (за счет сокращения вен) и повышает преднагрузку. Ренин-ан-гиотензин-альдостероновая система включается с целью консервации объема. Эта система взаимодействует с другими вазопрессорами для поддержания высокого сосудистого сопротивления. Ги-поволемия вызывает компенсаторные реакции, включая интенсивную вазоконстрикцию кожи, скелетных мышц и желудочно-кишечного тракта. Олигурия, индуцированная сокращением циркулирующего объема, может перевести глубоко сниженную почечную перфузию в острую почечную недостаточность. Клеточные побочные продукты анаэробного метаболизма повышают местную тканевую ишемию, вызывая метаболический ацидоз. Пониженная энергетика клеток снижает активность калий-натриевого насоса, позволяющего воде и натрию проникать в клетки. Эта ситуация еще более снижает функциональный внеклеточный объем. Ориентируясь на величины кровопо-тери, необходимо тщательно планировать терапию, чтобы не допустить нарастания кровяного давления, как артериального, так и венозного, а
также избежать назначения наркотиков, притупляющих симпатические реакции. Это, действительно, могло повышать смертность по материалам "Хьюстонского исследования" [4\.
Кровь является очевидным выбором при жидкостном замещении геморрагического шока. Однако тяжелый шок также сопровождает экстенсивные потери интерстициальной жидкости, так как жидкость перемещается в сосудистое пространство через транскапиллярные коллатерали и внутрь клеток. Изменение клеточной проницаемости позволяет натрию и воде проникнуть в клетки, вызывая повышение внутриклеточного объема и отека клеток. Введенный внутривенно альбумин может просачиваться в интерстиций, вызывая еще большую аккумуляцию жидкости в отеке. Кристаллоиды повышают выживаемость и предотвращают почечную недостаточность; они также предотвращают сердечно-сосудистый коллапс, будучи применены в качестве дополнения к специфическим компонентам крови.
Лечение тяжелой дегидратации часто необходимо начать до получения данных лабораторных исследований, позволяющих установить у ребенка наличие гипонатриемической, изонатриемиче-ской или гипернатриемической дегидратации. Должно быть сделано четыре соответствующих измерения [128\.
Измерьте осмолярность сыворотки по на трию плазмы.
Проверьте кислотно-основное состояние, рН сыворотки и дефицит оснований.
Проверьте калий сыворотки, сопоставьте его с рН.
Проверьте темп мочеотделения. Исключите острый некроз канальцев.
Начальный этап жидкостного восстановления обычно завершается болюсным в течение 10— 20 мин введением физиологического раствора для улучшения циркуляции и восстановления почечной перфузии. Последующая терапия продолжается после получения информации о концентрации электролитов плазмы.
Снижение объема крови даже на 1 % сопровождается повышением ректальной температуры на 0,3 °С [129\. Механизм фебрильной реакции на сокращение объема возможно объясняется снижением кровотока кожи, что препятствует чре-скожному рассеиванию тепла. Гиперосмоляр-ность также повышает порог потения. В каждом случае обеспечение кровотока сердца и мозга поддерживается за счет перераспределения крови от других органов.
Жидкости, электролиты и питание в педиатрии 135
Для лечения пациентов с диагностированным контрактильньш алкалозом (как, например, у малыша с пиломиотомией, описанного выше) разумным первым выбором жидкостной терапии будет 5 % декстроза и 0,9 % физиологический раствор. Этот раствор содержит 154 мг-экв натрия и хлорида на литр. Для малышей с диагностированным метаболическим ацидозом больше подойдет раствор, полученный удалением 250 мл 0,9 % физиологического раствора из 1-литровой емкости и введением туда взамен 28 мл 7,5 % раствора натрия бикарбоната и 232 мл 5 % декстрозы в воде. Получается раствор, содержащий приблизительно 1,2 % декстрозы, 140 мг-экв натрия, 115 мг-экв хлорида и 25 мг-экв бикарбоната. Назначаемые сильно дегидратированным младенцам растворы, содержащие ацетат или лактат, на самом деле могут усилить их ацидоз, если эти прекурсоры (предшественники) бикарбоната не смогут быть метаболизированы до бикарбоната в печени вследствие циркуляторных нарушений. Альтернативой описанной болюсной терапии может быть гекстенд или другой гибрид сбалансированных солевых растворов.
Трое описанных ниже детей умеренно дегидратированы. Каждый имеет точно документированную информацию о массе тела, измеренной во время недавнего профилактического осмотра.
Изотоническая дегидратация
В течение 3 дней у младенца И. Д. рвота и непроходимость кишечника. В настоящее время масса его тела составляет 9 кг, что, по результатам клинического исследования, соответствует потере 10 %. Электролиты сыворотки И. Д. относительно нормальны: Na 130 мг-экв/л; К 4 мг-экв/л; О 98 мг-экв/л. Его потери жидкости составляют по Na+ от 20—80 мг-экв/л и по К+ 5—20 мг-экв/л с изменяющимися количествами теряемых ионов водорода. Так как его электролиты относительно нормальны, для возмещения потерь жидкости с рвотой и восстановления сокращенного внеклеточного компартмента показано применение сбалансированного солевого раствора. Дефицит жидкости этого пациента рассчитывается на основании простой формулы, принимающей в расчет изменения массы тела и данные клинического обследования. Результат вычитания из показателя обычной массы тела пациента его массы в настоящее время, деленный на обычную массу тела, равен проценту дефицита жидкости:
[10
кг - 9 кг]
=
Цкг] ={0%
дефИцИТ
объема.
10
кг 10
кг
Коррекция этого дефицита может быть начата с двух инфузий 20 мл/кг сбалансированного со-
136 Анестезия в педиатрии
левого раствора в течение 10—20 мин на каждую инфузию с последующим повторными клиническим и лабораторным исследованиями электролитного баланса. Потребности в жидкостном обеспечении у пациента составляют 4 мл/кг/ч, что при его 10-килограммовой массе тела составляет 40 мл/ч. При прекращении потерь жидкости этому малышу в течение 24 ч потребуется дополнительный литр жидкости для коррекции рассчитанного дефицита. После того как признаки шока купированы, почасовой темп введения жидкостей пациенту должен быть отрегулирован с учетом количества жидкости, необходимого для продолжения коррекции расчетного дефицита, что предпочтительнее продолжения болюсных введений жидкостей. Этот шаг требует, чтобы младенец получал жидкости в 1,5—2 раза больше, чем необходимо для ее поддержания, плюс достаточное количество жидкости для замещения продолжающихся потерь. Таким образом, инфу-зионная терапия в первый день включает два болюсных введения, равных 2 % массы тела, с последующей постоянной инфузией двойного поддерживающего объема плюс замещение продолжающихся потерь. Хотя потери калия могут быть равны потерям натрия, калий можно добавить к вводимым внутривенно жидкостям только после восстановления почечной перфузии и коррекции ацидоза. Вследствие опасности аритмий и тромбозов вен, сопровождающих парентеральное введение высоких концентраций калия, не следует вводить внутривенно растворы, содержащие более чем 20—40 мг-экв калия хлорида или калия фосфата в литре.
Гипонатриемическая дегидратация
Внутривенное введение жидкости способно убить любого ребенка. Тот факт, что госпитали до сих пор сохраняют расширенные показания к применению D5W и других парентерально вводимых растворов в операционных, палатах скорой помощи и в других отделениях, продолжает угрожать развитием судорог и смертью детям, которым перелито избыточное количество жидкости [131].
X. Д. 1 год, масса его тела составляет 10 кг, и тяжелая диарея продолжается у него несколько дней. Натрий сыворотки составляет 110 мг-экв/л. Потери натрия в результате диареи составляют 10—140 мг-экв/л, а потери калия 10—80 мг-экв/л. Если потери солей в результате диареи превышают их потребление, развивается серьезная гипотоническая дегидратация.
При гипотонической дегидратации потери солей превышают потери воды. Таким образом,
происходит разведение и сокращение внеклеточного компартмента, что становится причиной перемещения внеклеточной жидкости по градиенту осмотической концентрации во внутриклеточное пространство. Следовательно, гипотоническая дегидратация, обусловленная комбинацией общих потерь жидкости организмом и относительного повышения объема клеточной жидкости, ведет к ранним признакам гиповолемии. Процент потерь массы тела может быть несущественным по сравнению с выраженностью признаков и симптомов дегидратации.
Хотя гипокалиемия редко вызывает симптоматику у в остальном здоровых детей, концентрации натрия ниже 120 мг-экв/л часто сопровождаются судорогами. Для быстрой коррекции симптоматической гипонатриемии 3 % раствор NaCl, содержащий 0,5 мг-экв натрия в 1 мл, может быть быстро введен для повышения концентрации натрия в плазме до 125 мг-экв/л [130\. Формула для расчета количеств натрия, необходимых для повышения его концентрации в сыворотке до данного уровня, выглядит следующим образом. Внеклеточную жидкость (ВКЖ) умножают на разницу между желаемым и реальным уровнем натрия в сыворотке. ВКЖ (30 % у этого дегидратированного на 5—10 % 10-килограммового младенца составят приблизительно 3 л) умножить на [125 (желаемый уровень натрия в сыворотке) — 110 (реальная концентрация натрия в сыворотке)] = 45, т. е. для повышения уровня натрия от 110 до 125 мг-экв/л необходимо ввести 45 мг-экв натрия. Лечение следует начинать с медленной инфузии 1—2 мл/мин; 90 мл 3 % раствора NaCl повысят внеклеточную концентрацию натрия у этого младенца до желаемого уровня. В качестве альтернативы возможно использование 0,9 % физиологического раствора, введение которого в дозе 30 мл/кг (300 мл для этого 10-килограммового младенца) также обеспечит 45 мг-экв натрия. Увеличение количества натрия во внеклеточном пространстве приведет к дальнейшему расширению этого пространства, так как внутриклеточная вода будет перемещаться во внеклеточное пространство.
Гипернатрием и ческая дегидратация
Малыш X. Н. Д. непреднамеренно накормлен концентрированным препаратом, что привело к тяжелой гипертонической дегидратации, наиболее тревожной форме дегидратации.
Как подчеркивалось выше, быстрые изменения осмолярности могут привести к судорогам и повреждению мозга, даже если снижение натрия в сыворотке составляет менее 0,5 мг-экв/л/ч. По
Жидкости, электролиты и питание в педиатрии 137
этой причине детям не следует назначать растворы, полностью содержащие свободную воду. Свободная вода проникает в клетки быстрее, чем почки могут экскретировать натрий или воду. Если из-за быстрой регидратации развились судороги, они могут быть корригированы болюс-ным введением 3 % раствора натрия хлорида в дозе 2—4 мл/кг. Другими последствиями лечения гипернатриемии могут быть отек легких, застойная сердечная недостаточность, гипокалиемия и избыточные потери воды вследствие высокой изостенурии. Лечение этих осложнений требует применения соответственно петлевых диуретиков, дигиталиса, кальция и модификации на-трийсодержащих жидкостей.
Прекращение гидратации
Как врачи, мы обучены диагностировать, поддерживать и пытаться лечить умирающих детей. Мы стараемся раздвинуть границы науки в надежде, что наши открытия позволят этим и многим другим детям выжить. Мы спасаем более маленьких и тяжелобольных младенцев, мы продлеваем жизнь и открываем способы лечения терминально больных детей. Но тем труднее в некоторых случаях осознать тщетность продолжения медицинской поддержки. Трудной проблемой является выбор: начать вместе с близкими младенца планировать прекращение этой поддержки или продолжать ее из сострадания к ним?
Следует ли продолжать питание и гидратацию терминальных пациентов, таких "как дети с пер-систирующим вегетативным состоянием? Следует ли продолжать постоянное применение синтетических гормонов, таких как DDAVP, у детей с тяжелым повреждением головного мозга и diabetes insipidus? Последний может быть признаком тяжелого необратимого повреждения головного мозга после травмы вследствие неадекватной ги-пофизарной функции. Такие дети для поддержания водного баланса нуждаются в синтетическом гормоне аргинин-вазопрессине. Без парентерального введения жидкостей и/или DDAVP они быстро умирают. Хотя мы располагаем технологическими возможностями, позволяющими нам поддерживать функционирование легких и сердца, подобных возможностей для восстановления функции ЦНС у нас недостаточно. Должны ли мы поддерживать малышей, чье терминальное состояние не дает надежды на сколько-нибудь существенное восстановление?
Основным аргументом, предлагаемым работниками хосписов в пользу продолжения гидратации, является то, что она позволяет избежать дискомфорта, связанного с жаждой, и, таким образом, внутривенное или назогастральное введе-
ние жидкостей никогда не должно быть прекращено у умирающего ребенка. Второй аргумент — пища и кормление в нашей культуре являются символами заботы. И наконец, спорным является то, что лишение ребенка жидкости и таким образом приближение смерти являются обесцениванием существования ребенка. Предотвращение дискомфорта, продление лечения и соответственно жизни императивно предполагают продолжение гидратации во всех случаях. Карма обеспечения комфорта перманентно коматозным детям должна превалировать над догмой "не вреди". Всегда ли мы обязаны гидратировать умирающих детей? Всегда ли мы обязаны применять DDAVP?
В ответ на аргументы в поддержку искусственного продолжения гидратации следует тщательнее рассмотреть комфорт, уход и умирание. В раздельных исследованиях Oliver [132] заметил, что взрослые пациенты, в терминальном состоянии лишенные жидкостей, на самом деле выглядели более комфортно, чем пациенты, получающие жидкостную поддержку. Было предложено два механизма, объясняющих это вполне отчетливое седативное состояние. Во-первых, во время дегидратации и голодания наблюдается анестезирующее действие кетонов и продуктов их естественного распада [133]. Во-вторых, длительное голодание и дегидратация повышают продукцию эндогенных опиоидов [ 134]. Хотя пациенты в терминальном состоянии с ограничением жидкости могут жаловаться на жажду, это можно смягчить частыми глотками холодной воды или кусочками льда. Относясь с уважением к аргументу о том, что гидратация есть символ заботы, мы в то же время можем проявить большую заботу об умирающих пациентах, обеспечивая им адекватный седативный эффект и аналгезию, вместо затягивания их умирания, искусственно обеспечивая нутритив-ные потребности и поддерживая внутрисосуди-стый объем. И наконец, мы можем дать терминально больному ребенку умереть, тем самым оказав ему большее уважение, прекратив гидратацию. У терминально больного пациента "хорошая" смерть может оказаться недостижимой, но "лучшая" посредством прекращения искусственно затягиваемых страданий возможна [135]. Исследования по данной актуальной теме расширяются, к сожалению, сопутствуемые махинациями патологов из Мичигана, идущими вслед за другим сочувствующим медицинским персоналом. Необходимость срочных исследований несомненна. По меньшей мере журнал Американской медицинской ассоциации (JAMA) готов поддерживать исследования этого наиболее нуждающегося в рассмотрении аспекта жизни [136].
138 Анестезия в педиатрии
Жидкостное обеспечение
при неврологических повреждениях
Неврологические повреждения как вследствие травмы, так и хирургического вмешательства должны с осторожностью корригироваться анестезиологом. Задачей нейрохирургической анестезии является защита мозга поддержанием ок-сигенации, нутритивным обеспечением и удалением отработанных продуктов метаболизма. Догма о необходимости ограничения жидкости, долгое время рассматривавшаяся как обязательная, должна быть смягчена ввиду очевидной необходимости поддерживать адекватную циркуляцию в мозге. Однако понижение метаболизма ингаляционными анестетиками, например изофлураном или барбитуратами, может быть еще эффективнее.
Гематоэнцефалический барьер
Через интактный гематоэнцефалический барьер (ГЭБ) жидкости могут проникать, только если размер их составляющих меньше 0,7—0,9 нм. Для сравнения эффективный эндотелиальный размер периферического сосудистого русла равен 4— 5 нм [137\. Тесное соединение капиллярных клеток формирует "зону окклюзии", препятствующую проникновению в интерстиций ЦНС даже электролитов. Кроме того, ЦНС не имеет активной лимфатической системы, способствующей абсорбции электролитов и альбумина. Таким образом, любые быстрые изменения осмолярности вызывают быстрые перемещения воды в направлении гиперосмолярных зон. При интактном ГЭБ маннитол реально повышает мозговой кровоток (МК) за счет повышения объема крови, и если она инфузируется при комнатной температуре, преходящее охлаждение крови может вызвать вазодилатацию периферической микроциркуляции. Снижение вязкости крови (в единицах пуаз) не выглядит влияющим на МК. Однако воздействие маннитола на ЦНС в течение многих минут снижает содержание воды в клетках ЦНС, таким образом понижая давление в ЦНС. Введение гиперосмотических растворов оказывает слабое влияние в зонах с нарушенным ГЭБ. Повреждение ГЭБ открывает поры в эндотелии, позволяющие электролитам и мелким белковым частичкам легко проникать в интерстиций ЦНС. Гиперосмотическая терапия при тяжелых повреждениях мозга, вероятно, обеспечивая незначительные преимущества, на самом деле может повысить давление в клетках поврежденного мозга и снизить перфузию за счет утечки растворов из внутрисосудистого пространства. Адекватное перфузионное давление, понижение метаболических потребностей мозга с помощью разумного использования анестезии и применения, где это
допустимо, осмотической терапии могут способствовать оксигенации, питанию и очищению мозга.
Мозговой кровоток
Мозговой кровоток (МК) у детей колеблется от 45 до 60 мл/100 г вещества мозга/мин. В целом приемлемое потребление кислорода должно быть в пределах 3—3,8 мл/Ог/ЮО г вещества мозга/ мин. (CMRO2). Хотя ингаляционные анестетики обычно снижают сердечный выброс, все они в разной степени повышают МК (см. гл. 16). Общая анестезия также снижает темп метаболизма, что изменяет потребности в снабжении. Методика управляемой интраоперационной гипотензии может хорошо переноситься за счет повышения МК и снижения метаболических потребностей мозга. Гемодилюция, понижающая внутрисосу-дистое онкотическое давление, мало влияет на МК и давление в ЦНС.
Существуют определенные доказательства того, что переливание гипертонического раствора новорожденным во время тяжелого геморрагического шока лучше восстанавливает церебральную оксигенацию, чем переливание л актированного раствора Рингера [138\.
Субарахноидальное кровоизлияние
Состояния, сопровождающие гипонатриемию у детей с субарахноидальным кровоизлиянием (СК), не изменились, но значительно изменилось наше понимание как патофизиологии, так и лечения этого заболевания. В прошлом гипонат-риемия после СК рассматривалась как часть синдрома неудовлетворительной секреции аргинин-вазопрессина (SIADH) и дилютирующей задержки воды. Однако в настоящее время известно, что у этих детей происходит тяжелое истощение внутрисосудистого объема, и ограничение воды и солей совершенно противоположно тому, в чем они на самом деле нуждаются. С современной точки зрения СК чаще всего связано с натрийу-резом вследствие центрально обусловленных растрат солей [139\. Ключевым в ведении гипонат-риемии после СК является распознавание в первую очередь, имеет ли место у ребенка дилюци-онная гипонатриемия, SIADH или настоящее внутрисосудистое жидкостное истощение вследствие церебрального натрийуреза [140\.
В последних сообщениях, касающихся измерения натрия и регуляции объема после СК, для предотвращения вазоспазма и сокращения объема применялись большие болюсные введения жидкости. Как ожидалось, предсердный натрийу-ретический фактор (ANF) был повышен, но не всегда сопровождал или предотвращал гипонат-
риемию. Реальный натриевый баланс не коррелировал с AVP, ANF, альдостероном или ренином, а жидкостный баланс положительно коррелировал только с AVP [141].
Пациенты с СК экскретируют дигоксинопо-добный фактор [142\ в дополнение к имеющемуся повышению катехоламинов. При поддержании адекватного волемического статуса происходит супрессия как альдостерона, так и активности ренина плазмы. Назначение количеств жидкости и натрия, превышающие минимально поддерживающие, должно минимизировать пертуба-ции гуморальных факторов, осложняющих ведение пациентов с СК [138\.
Хроническая почечная недостаточность у детей изначально может манифестировать замедлением нормального развития. Наиболее типичной причиной является почечная дисплазия. Младенцы с дисплазией или обструкцией почек in utero часто имеют некоторое количество нормальных нефро-нов. С другой стороны, у взрослых с хронической почечной недостаточностью потеря нефро-нальной функции происходит более единообразно. Это различие объясняет большие возможности компенсаторных реакций у детей [143]. Хотя острая почечная недостаточность строго предполагает темп мочеотделения менее 1 мл^кг/ч, оли-гурия также может иметь место при избытке ва-зопрессина, дегидратации, острой кровопотере или других обстоятельствах, вызывающих гипо-тензию. Олигурия с повышением осмолярности мочи не является следствием почечной недостаточности. Для дифференциации между снижением внеклеточной жидкости и острой почечной недостаточностью в качестве причин олигурии заслуживает внимания инфузия 10—20 мл/кг сбалансированного солевого раствора. Наблюдающейся иногда при почечной недостаточности избыточной солевой нагрузки можно избежать применением только сбалансированных солевых растворов [144]. Жидкостные и нутритивные потребности у детей с почечной недостаточностью явились объектом широких исследований [145].
Развитие почечных заболеваний до их конечной стадии характеризуется изостенурией, неспособностью повысить осмолярность мочи выше уровня осмолярности плазмы. В конечной стадии почечных заболеваний изостенурия является прямым результатом дисфункции почечных канальцев и медуллярной микроциркуляции, предохраняющей интерстиций от выработки гипе-росмолярной мочи. По мере прогрессирования заболевания почечные канальцы становятся устойчивыми к вазопрессину, вызывая осмодиурез
Жидкости, электролиты и питание в педиатрии 139
в остающихся нефронах. В итоге ребенок с заболеванием почек имеет пониженную способность продуцировать разведенную мочу и неспособен повысить диурез в случае водной нагрузки. Кроме того, снижается экскреция растворов и почки не способны концентрировать мочу [146].
У детей с почечной недостаточностью в результате сниженной экскреции мочи может развиться гиперфосфатемия; гипокальциемия также сопровождается повышенным накоплением солей фосфата кальция в тканях. Следует ограничить растворы и клизмы, содержащие фосфаты. Гидроксид магния или алюминия понижает фосфаты сыворотки, но при почечной недостаточности может быть токсичным. Карбонат кальция корригирует гиперфосфатемию и повышает кальций сыворотки, но при патологическом уровне магния в сыворотке наблюдается слабая реакция
[14Я
Содовые напитки с обычным для них избыточным содержанием фосфатов ревертируют соотношение кальций/фосфат и в 5 раз повышают вероятность переломов костей, это установлено при сравнении групп девочек, потребляющих и не потребляющих содовые напитки [146а].
Пациенты с почечной недостаточностью должны получать только достаточное возмещение неощутимых потерь и основную часть потерь жидкости с мочой. Метаболизм и катаболизм протеинов у хирургических и травматологических пациентов повышены, в результате чего повышается продукция воды и соответственно понижается потребность в жидкости. У таких пациентов необходимо контролировать центральное венозное давление и поддерживать его на уровне нижней границы нормы.
Возможна непреднамеренная гипернатриемия при избыточном удалении воды во время диализа. Гипонатриемия случается при задержке воды и потере натрия вследствие применения диуретиков. Если концентрация натрия падает ниже 120 мг-экв/л, следует применить 3 % раствор NaCl для восстановления концентрации натрия до желаемого уровня.
Наиболее тревожной электролитной проблемой при почечной недостаточности является ги-перкалиемия. Потери калия в кишечнике и с перспирацией обычно сравнимы с потерями почками в норме. Пациенты с хронической почечной недостаточностью могут компенсировать потери калия, экскретируемого почками, повышением его экскреции через кишечник, однако этот механизм обычно недостаточен для предотвращения гиперкалиемии при острой почечной недостаточности. Рабдомиолиз и другие состояния, при которых происходит разрушение клеток (например, ожоги, травма, операция, повышенный катаболизм, гемолиз и ацидоз), сопровождаются
1
140 Анестезия в педиатрии
повышением концентрации калия в сыворотке крови. Препараты, повышающие калий в сыворотке, перечислены в табл. 5.5.
Применение полного парентерального питания (ППП) у детей стало наиболее существенным достижением инфузионной терапии с 1960-х годов. Dudrick и соавт. [147\ популяризировали ППП, демонстрируя нормальный рост и развитие щенков, получающих только глюкозу и протеин внутримышечно. Вследствие столь частого его использования многие дети, поступающие в операционную, получают растворы для парентерального питания из-за неадекватного функционирования желудочно-кишечного тракта. ППП сочетает глюкозу высокой концентрации, протеины, основные жиры и микроэлементы. Добавление к ППП триацетина и триглицеридов, помимо поддержания потребностей сердца и ЦНС, ускоряет заживление кишечника [148]. Повышая темп метаболизма, ППП реально улучшает рост клеток у ослабленных новорожденных [149]. Даже у детей со злокачественными новообразованиями было продемонстрировано улучшение выживаемости при применении ППП [150]. Развитие ППП включает расширение спектра добавляемых микроэлементов, особенно меди и селена у некоторых новорожденных с очень низкой массой тела при рождении [151].
Голодание, травма и сепсис увеличивают внеклеточный объем за счет повышения проницаемости капилляров для жидкостей и альбумина. Однако дополнительное назначение альбумина не повышает безопасность и не уменьшает затраты по сравнению с другими средствами [152]. В результате концентрация альбумина повышается в интерстиции и понижается в сосудистом русле. Последнее ведет к значительному повышению общего внеклеточного объема [153]. Внеклеточный компартмент продолжает расширяться до тех пор, пока не произойдет восстановления микроциркуляции, позволяющее повысить коллоидно -онкотическое давление. Это обстоятельство важно иметь в виду при планировании ин-траоперационной инфузионной терапии [154]. Темп синтеза протеина у пациентов, нуждающихся в экстренной операции, и с другими формами травмы, угнетен, что может приводить к гипоал ьбуминемии.
Гипоальбуминемия является маркером повышения летальности и инвалидизации госпитализированных пациентов. Она замедляет заживление ран, удлиняет время свертывания крови и угнетает функцию почек и желудочно-кишечного тракта [155]. Обеспечение ППП с дозой глюкозы
не менее 4 мг/кг/мин приводит к ускорению синтеза протеина [156]. Последние данные указывают на то, что добавление фибронектина внутривенно быстро повышает коллоидно-онко-тическое давление [157\. Тем не менее даже при достижении положительного азотистого баланса внеклеточный объем может оставаться расширенным до нормализации запасов протеина и проницаемости капилляров. Применение человеческого гормона роста уменьшает потери массы тела, поддерживает общий азот организма, концентрации калия и фосфора, а также повышает продукцию инсулина у пациентов, получающих только 50 % их расчетных энергетических потребностей [158].
Пациентам часто требуется механическая вентиляторная поддержка. В одном из исследований было показано, что ППП и связанное с этим повышение протеинов сыворотки позволяет скорее прекратить механическую вентиляторную поддержку, в то время как пациенты с сохраняющейся пониженной концентрацией протеина продолжают в ней нуждаться [159].
Интраоперационное жидкостное обеспечение обычно требует снижения темпа введения растворов для парентерального питания. Однако высококонцентрированные растворы декстрозы не следует отменять остро, так как это может вызвать гипогликемию. Введение дооперационнных объемов полного парентерального питания во время операции может индуцировать осмотический диурез. Во избежание гипер- и гипогликемии во время операции необходимо часто измерять концентрации глюкозы.
Согласно результатам обзора 36 учебников по педиатрии и опросу 178 педиатров, гипогликемия определяется как концентрация глюкозы менее 36 мг/100 мл у доношенных детей и 20 мг/100 мл недоношенных [160]. Многие полагают, что эти цифры слишком низки. Более безопасно принять за нижний уровень нормы 40 мг/100 мл для всех детей. Гипергликемия представлена глюкозурией или показателями глюкозы в сыворотке выше 200 мг/100 мл.
Характерными осложнениями ППП являются: сепсис и бактериемия. Эти проблемы особенно \ характерны, когда внутривенный катетер, через ■ который вводятся концентрированные растворы декстрозы, используется также для введения лекарств и поддерживающих жидкостей. Для минимизации риска контаминации катетера для ППП, лекарства и другие растворы следует по возможности вводить через отдельный внутривенный катетер. Все манипуляции с использованием центральных катетеров дополняют введением ванкомицина, чтобы свести к минимуму инфекцию со стороны катетеров.
Дисбаланс калия, натрия и воды является наи-
более характерной жидкостной и электролитной проблемой у пациентов, получающих ППП. При неадекватном содержании этих веществ во вводимых растворах могут понижаться концентрации кальция, магния и фосфатов. Не должны быть упущены неожиданные гастроинтестиналь-ные и почечные потери этих веществ. Как подчеркивалось выше, магний и кальций могут ассоциироваться со слабостью, тетанией, судорогами и сердечными аритмиями и могут изменять реакцию пациента на мышечные релаксанты. Дефицит фосфатов может стать причиной мышечной слабости или судорог, снижения сердечной сократимости и нарушения транспорта кислорода. Ошибочные расчеты требующихся количеств электролитов и неточное измерение этих электролитов в крови часто ведут к интраоперацион-ному дисбалансу этих веществ. Неадекватное обеспечение калориями и протеином детей с пониженным питанием в интраоперационном периоде ведет к замедлению заживления ран, отрицательному азотистому балансу и значительному понижению массы тела и концентраций калия, магния и фосфора [161].
Когда ППП является единственным источником калорий для младенцев с концентрационной способностью почек, меньшей, чем у более старших детей, повышенная почечная нагрузка, обусловленная внутривенным введением жидкостей, может стать причиной осмотического диуреза и гипертонической дегидратации. Для того чтобы сделать возможной экскрецию этой нагрузки, может потребоваться дополнительная вода. Возмещение текущих потерь жидкости должно производиться жидкостями сходного состава, что предпочтительнее увеличения количества гипера-лиментационных растворов. При применении для этой цели гипералиментационных жидкостей может развиться тяжелая гипергликемия и повреждение мозга. Никогда не следует применять гипералиментационные растворы для замещения потерь жидкости во время операции, так как это может привести к тяжелой гипергликемии.
Несмотря на то что относительно необходимости интраоперационного применения коллоидов существуют противоречивые мнения и каждая из сторон имеет серьезные доводы за и против, большинство согласны с тем, что парентеральное введение жидкостей должно начинаться с растворов кристаллоидов [162]. Компоненты крови следует назначать только в случае их абсолютной необходимости, и каждая трансфузия должна
Жидкости, электролиты и питание в педиатрии 141
быть по возможности от одного и того же донора для снижения общего количества доноров для одного пациента.
Некоторые врачи предпочитают для поддержания нормального внутрисосудистого осмотического давления человеческий альбумин или синтетические коллоиды (гетастарч, декстран, флюо-рокарбоны) [163, 164]. Так как альбумин широко применяется в педиатрической операционной для увеличения циркулирующего объема, ниже следует короткое обсуждение его полезности.
Альбумин
Nacelle в первом томе "Ланцета" (1839) описывает альбумин: "Он найден не только в крови, но и в лимфе, испарениях с поверхностей, в жидкости клеточных тканей, в жидкости глазного яблока..." Он описал свойства, функции и полезность альбумина [165]. Расширялось изучение структуры альбумина. Первичная структура является пептидной цепочкой из 580—585 аминокислотных групп. Вторичная структура состоит из двойных петель, поддерживаемых дисульфидными мостиками. Человеческий альбумин имеет три "домена", каждый из которых состоит из трех петель. Структура и последовательность аминокислот указывают на его общее происхождение с миог-лобином.
Человеческий альбумин и белки плазмы были впервые выделены Cohn и соавт. в 1946 г. [166]. Так как альбумин противодействовал геморрагическому шоку, правительство США потребовало от фармацевтических фирм производить коммерческий "готовый к употреблению" раствор человеческого альбумина для использования на поле боя. Большинство основных индустриальных наций продолжают использовать метод Cohn этано-лового фракционирования, который до некоторой степени денатурирует протеин. Различные методы применялись для производства других протеиновых факторов, таких как фактор VIII, иммуноглобулины, фибриноген/фибронектин, протромбиновый комплекс (II, VII, IX, X), активированный протромбиновый комплекс и антитромбин III. Однако по соображениям стоимости применяется метод Cohn этанолового фракционирования. Этот метод позволяет получить относительно чистый и безопасный экстракт плазмы.
У людей синтез альбумина происходит в печени. Альбумин секретируется гепатоцитами в течение 20 мин. При низком онкотическом давлении, адекватном питании и наличии доступных гепатоцитов происходит стимуляция синтеза альбумина. Рибосомы, прикрепленные к саркоплаз-матическому ретикулуму, продуцируют проальбу-мин, являющийся первичным внутриклеточным

 142
Анестезия в педиатрии
142
Анестезия в педиатрии
образцом альбумина. Хотя альбумин быстро синтезируется и экскретируется и имеет период полужизни 3 нед, его избыток наблюдается редко. Синтез стимулируется кортизолом, гормоном роста и гормонами щитовидной железы. С повышением продукции альбумина ассоциируется также применение метадона. Пониженные концентрации альбумина наиболее часто наблюдаются при нарушениях питания, хронических заболеваниях и у недоношенных детей. Синтез понижается при инфузии декстрана или других коллоидов. После инфузии экзогенного альбумина следует заметное повышение деградации альбумина и снижение продукции. Таким образом, инфузия альбумина для повышения его уровня в сыворотке редко оказывается эффективной. Это особенно очевидно у детей с синдромом повышенной проницаемости капилляров, который препятствует сохранению вводимого человеческого альбумина во внутрисосудистом пространстве. Нефротический синдром, сепсис, заболевания желудочно-кишечного тракта [167] (особенно синдром мальабсорбции), лимфангиэктазия кишечника, полипоз и паразитарные инвазии сопровождаются тяжелой гипоальбуминемией и редко поддаются лечению экзогенным введением альбумина. Тем не менее последние публикации сообщают об улучшении функции почек и снижении смертности у взрослых, страдающих бактериальным перитонитом в сочетании с асцитом [ЛЯ].
Очевидный клинический императив инфузии альбумина для лечения гипоальбуминемии подвергался острой критике: внутривенно альбумин и диуретики применялись для лечения тяжелых отеков, сопровождавших нефротический синдром и недоношенность [169]. Рост онкотическо-го давления, мобилизующего клеточную и интер-стициальную жидкость в сосудистое русло и парализующего дистальные почечные канальцы, теоретически должен был снимать отек, сопровождающий нефротический синдром. Однако синдром повышенной проницаемости капилляров позволяет вводимому альбумину просачиваться в гломерулярные эпителиальные клетки. Протеиновая нефропатия лечится ограничением протеинов и системным применением стероидов, повышающих гломерулярную фильтрацию и снижающих протеинурию. В группе детей, леченных альбумином внутривенно, дегенеративные изменения персистировали дольше, реакция на стероиды была подавленной и по сравнению с контрольной группой чаще возникали рецидивы [170\.
Наиболее целесообразно применение альбумина во время больших операций для поддержания внутрисосудистого объема. Острая потеря больших количеств протеина при ожогах или
процедурах, сопровождающихся массивным разрушением тканей, может приводить к моментальному понижению концентраций протеина во внутрисосудистом пространстве. В условиях эксперимента, если показатели гематок-рита в четвертом разведении снижаются до 5 %, то введение альбумина, пенталина или гекстен-да оказывает одинаковое влияние на поражения печени [777]. Тем не менее при хронической гипоальбуминемии применение экзогенного альбумина на самом деле понижает продукцию и секрецию альбумина. Так как здоровая, "накормленная" печень быстро продуцирует большие количества альбумина, даже моментальное повышение онкотического давления плазмы посредством инфузии альбумина на самом деле снижает его продукцию [17Д.
Стресс также сопровождается потерями альбумина. Изменяют синтез протеина и инфекции, травма, операции, нарушения питания и облучение. Так как от трети до половины резервуара обмениваемого альбумина содержится в коже, у детей с ожогами 50 % поверхности тела сразу может быть потеряно до трети всего альбумина организма. Другими факторами, понижающими синтез альбумина, являются стойкая гипертермия и старение.
Функция альбумина двояка. Он поддерживает осмотическое и онкотическое давление, а также связывает различные вещества. Имея высокий отрицательный заряд, молекула альбумина аккумулирует молекулы Na+ во внутренних структурах, билирубин, жирные кислоты, металлы и ионы, гормоны и медикаменты (табл. 5.7). Связанные с альбумином фракции медикаментов остаются во внутрисосудистом пространстве. Однако некоторые препараты, такие как сульфизоксазол

Жидкости, электролиты и питание в педиатрии 143

Многие ситуации, случающиеся в неонаталь-ном периоде, сопровождаются высокими концентрациями непрямого билирубина. Сочетание недоношенности и непроходимости кишечника часто имеет место перед экстренными операциями. Препараты альбумина экстрагируются из крови доноров или человеческой плаценты [174\. У 51 ослабленного недоношенного новорожденного наблюдался повышенный связывающий потенциал билирубина. Анализ связывания билирубина с альбумином in vitro показал, что стабилизаторы и алкогольное фракционирование, применяемые при производстве альбумина, снижают связывание билирубина с альбумином. Несмотря на снижение в ассоциации постоянного альбумина с билирубином, человеческий альбумин сохраняет высокий потенциал связывания с билирубином in vivo [175].
Экспериментальные данные, полученные на препарате изолированной нижней конечности [176], показали, что плазма, кровь и изопротере-нол снижают проницаемость капилляров, в то время как растворы, содержащие альбумин, на самом деле повышают проницаемость капилляров. Как утверждалось ранее, перераспределение альбумина у новорожденных происходит быстрее, и инфузией альбумина не удается уменьшить отек у детей, страдающих гипоальбуминемией. Если альбумин проникает из сосудистого русла в интерстиций или на самом деле повышает проницаемость капилляров, его применение еще более уменьшает объем плазмы. Теоретически такое повышение интерстициальной жидкости должно увеличивать время, необходимое для мобилизации интерстициального альбумина и возврата его в сосудистое русло.
К пагубным эффектам альбумина относятся гипотензия, вызываемая вазодепрессантами-ки-нинами, или аллергические реакции на загрязнения или полимеры, образующиеся в процессе хранения. Очень редко реакция гиперчувствительности может быть вызвана инертными веществами, такими как гаптены, после их связывания с альбумином [177]. Кроме того, альбумин может временно понижать концентрацию ионизированного кальция, что напрямую снижает инотропную активность сердца. Восстановление объема с помощью инфузии гиперон-котических растворов может вести к утечке из капилляров протеинов и воды. Это может пони-
жать почечную экскрецию воды и натрия, таким образом компрометируя функцию канальцев. С точки зрения рутинного применения аль-буминсодержащих растворов не следует забывать и о его цене.
К коллоидам относятся белковая фракция плазмы, 5 % и 25 % альбумин, крахмалы (6 % ге-тастарч и 10 % пентастарч), декстран 40, 70, желатины, кровезаменители, кровь и продукты крови.
К сбалансированным солевым растворам относятся 0,9 % физиологический раствор, Рингер-лактат и плазмалит А. Их электролитный состав и осмолярность представлены в табл. 5.8.
Сбалансированные солевые растворы перераспределяются во все активные компартменты в течение 2 ч инфузии. Таким образом, чтобы достичь исходного объема циркулирующей крови при кровотечении, необходим в 3—4 раза больший объем по сравнению с замещением цельной кровью [154].
Гетастарч (гидроксиэтил, HES) представляет класс растворов, сходных с гликогеном. Гидро-ксилирование с амилопектином снижает его разрушение сывороточной амилазой. Реальный размер молекул широко варьируется, клиническое расширение объема превышает 3 ч, а некоторые частицы остаются в сосудистом русле недели. Гетастарч, добавленный к физиологическому раствору, имеет осмолярность 310 мосмоль/л. Реальная доза может варьироваться, но производители предлагают применять не более 20 мл/кг/сут. Во многих исследованиях эти рекомендации значительно превышаются без каких-либо упоминаний о нежелательном влиянии на легочную, печеночную или почечную функции [47]. К осложнениям применения гетастарча относятся изменения коагуляции, анафилаксия и повышение амилазы в сыворотке крови. Пентастарч быстрее разрушается амилазой и быстрее экскретируется. 10 % раствор эффективно повышает внутрисосуди-
144 Анестезия в педиатрии
и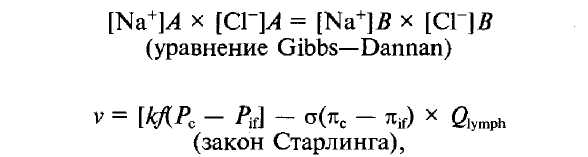
Онкотическое давление
За онкотическое давление отвечает натрий — основной катион внутрисосудистого пространства. Альбумин — основной протеин внутрисосудистого пространства, тоже отвечает за онкотическое давление. "Протекающие мембраны", создаваемые выбросом гистамина, комплемента или других воспалительных медиаторов, должны быть отделены от других причин потерь циркулирующего объема, таких как кровотечение, тяжелые ожоги, протеиновые потери при энте-ропатии, нефропатия и недостаточность питания.
Коллоидное осмотическое давление
Коллоидное осмотическое давление (КОД) определяется главным образом циркулирующим альбумином. Хотя только 40 % общего альбумина организма находится во внутрисосудистом пространстве, малый размер альбумина по сравнению с другими циркулирующими протеинами делает его концентрацию, равной КОД. Пациенты с высокой продукцией глобулинов, как, например, при циррозе или рассеянной миеломе, могут иметь гипоальбуминемию при нормальном общем белке.
Протеины являются высокозаряженными анионами, захватывающими молекулы натрия и удерживающими их в своих внутренних структурах. Этот процесс описывается следующими уравнениями:
где (Рс — Plf) — гидростатическое давление в интерстициальном жидкостном пространстве (рис. 5.5). Нормальное давление равно 15—20 мм рт.ст. о — размер пор капилляра — в различных органах и тканях он различен. Потери лимфы приводят к существенным подкожным отекам, особенно у детей, получающих мышечные релаксанты, либо после длительного периода постельного режима. Таких отеков не бывает в активно движущихся тканях, таких как ткани сердца и легких, и в тканях, не имеющих лимфатических сосудов, таких как мозг. Однако даже при плотной капиллярной стенке и физической нагрузке легкие будут отечны с угрожающе низким онко-тическим давлением, что было продемонстрировано в экспериментах с плазмаферезом.
kf фильтрационный коэффициент, который может различаться в зависимости от количества альбумина в интерстиции. (яс — 7iif) — концентрация протеина в системе циркуляции и интерстиции. Как упоминалось выше, почти 60 % общего альбумина организма находится в интерстиции. Наличие в клетках проальбумина и быстрый его транспорт по лимфатическим сосудам позволяют быстро восполнить существенные потери КОД. При снижении интерстициального альбумина, как это бывает при хронических потерях циркулирующего протеина, возрастает поток жидкости в интерстиции. В настоящее время развитие технологий, позволяющих канюлиро* вать лимфатические сосуды человека, позволит; улучшить наше понимание значения лимфатиче-1 ской системы [180\.
Низкое КОД
Различие в проницаемости тканей с можно наблюдать интраоперационно на склере ребенка. Низкое КОД может формировать розовые губча-то-желатинозные массы в нижележащих частях склеры (химоз) с острым понижением общего протеина до 5 г/100 мл. Применение в этих ситуациях только кристаллоидов вызывает дальнейшее разведение протеина, что ускоряет поток жидкости в интерстиции. В последних обзорах [179] сообщается, что повышенная отечность ии-терстиция предрасполагает детей к пролежням, отечности кишечника и ослабляет способность швов скреплять ткани. Попытки уменьшить отеки назначением диуретиков могут привести к снижению объема крови и повреждению функции почек, не уменьшив при этом отек легких.
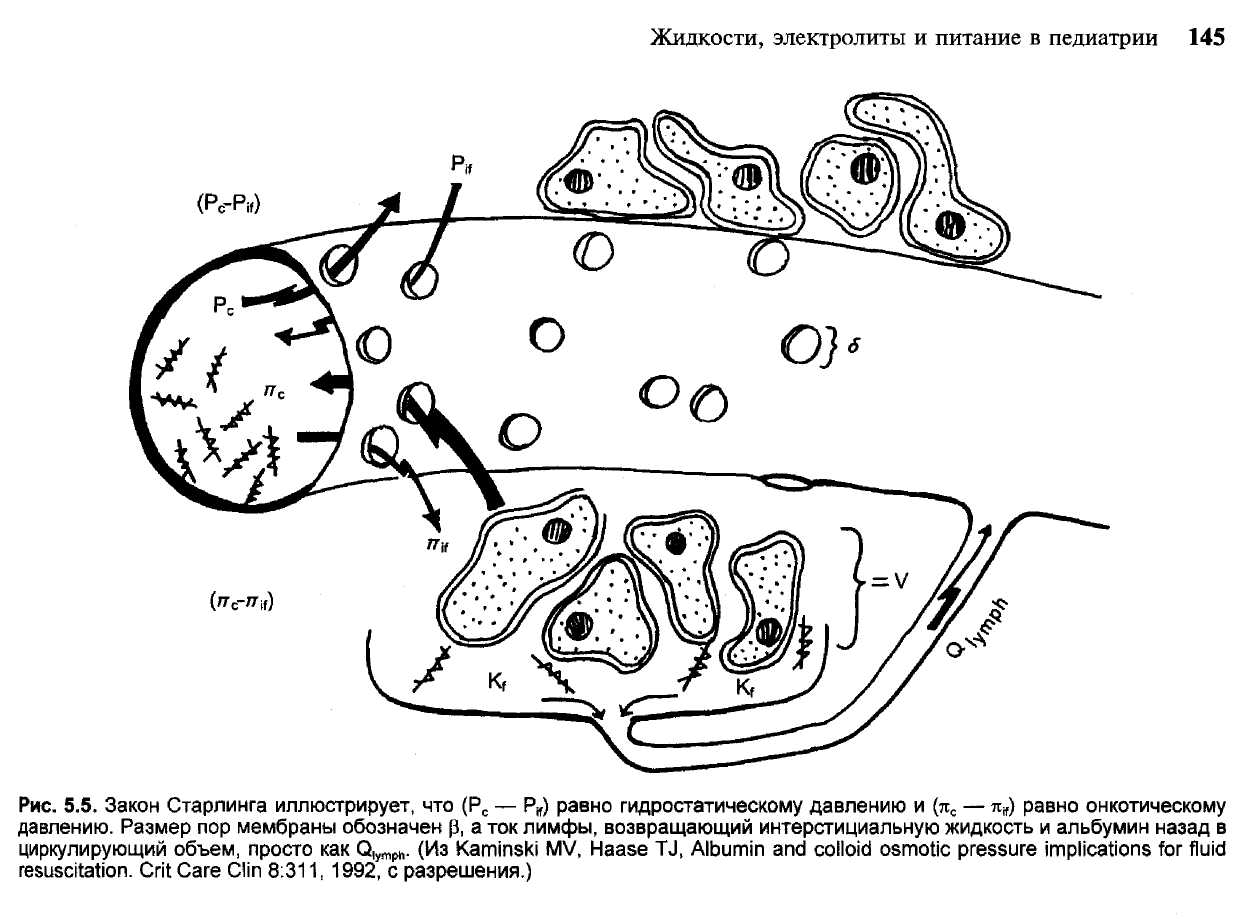
Большие операции у детей являются причиной метаболических потерь, а также потерь минералов, электролитов и воды. Во время и после операции в плазме происходит повышение концентрации катехоламинов, глюкокортикоидов и антидиуретического и натрийуретического гормонов. Анестезиологу необходимо понимание этих оперативных потерь, взаимодействия тормональ-ных реакций и того, как они могут противодействовать быстрому пробуждению и заживлению ран педиатрических пациентов.
Предоперационные пероральные жидкости
Состояние предоперационного голодания
Для того чтобы гарантировать минимальное количество жидкости в желудке к моменту начала анестезии, пациентам, готовящимся к плановым операциям, рекомендуется голодание, часто в течение многих часов. Mendelson [181] проанализировал 44 016 беременностей за период с 1932 по 1945 г. и нашел, что легочная аспирация желудочного содержимого имела место у 66 рожениц. В этих случаях, составивших 0,15 % от общего количества, были представлены в основном нетяжелые аспирации и только 6 рожениц погибли от "удушения", что составило 0,014 %. Мендельсон завершил это сообщение демонстрацией, при которой инъекция кислых рвотных масс кролику вызывала смерть последнего, но, если рвотные массы перед введением нейтрализовались, существенного повреждения легких не происходило. Частота синдрома Мендельсона у детей составляет приблизительно 1:10 000, у младенцев немного выше [182]. Плотная пища остается в желудке
146 Анестезия в педиатрии
длительное время, и большинство детей, готовящихся к плановой операции, голодают в течение ночи накануне операции [183\. Длительные периоды голодания предрасполагают маленьких детей к раздражительности и жажде, которые могут вызвать повышение объема желудочного содержимого и понизить его рН. Эта реакция повышает вероятность аспирации желудочного содержимого.
Было проведено сравнение влияния 5 унций воды, данных пациентам перорально за 2—3 ч перед началом индукции в анестезию с голоданием в течение ночи длительностью до 17 ч. Объем желудочного содержимого и его рН оценивались после индукции в анестезию. Пациенты, получавшие воду, имели меньше жидкости и больший ее рН, чем не получавшие перед операцией ничего [184\. Глоток чистой жидкости стимулирует перистальтику, но не стимулирует секрецию желудочной кислоты, если жидкость не содержит протеинов. Чистая жидкость разводит желудочную кислоту и получающийся раствор попадает в двенадцатиперстную кишку обычно в течение нескольких минут. Большие объемы солевых растворов [185] и даже чая с тостами [186\ не обнаруживались в желудке взрослых уже через 2 ч после их приема. Дети, получавшие чистые жидкости (например, воду, яблочный сок или кристаллоидные растворы) за 2 ч до индукции в анестезию имели меньшую жажду и голод, меньший объем желудочного содержимого по сравнению с контрольной группой детей, голодавших в течение ночи [187, 188\. Кислотность желудочного содержимого в обеих группах не отличалась. Это неудивительно, так как опорожнение желудка после приема жидкостей происходит в течение минут, но не часов. Максимальное время опорожнения желудка после приема плотной пищи, по-видимому, коррелирует с временем наступления голода и жажды. Наиболее рациональным способом измерения времени опорожнения желудка и перорального калорического истощения является обычное время между кормлениями малыша.
Угроза аспирационной пневмонии существенно повышается у детей, имеющих проблемы с кормлением, глотанием, гастроинтестинальным рефлюксом, судорогами или другими поражениями ЦНС (такими, как синдром Гийена — Барре или myasthenia gravis) [189\.
Предоперационная дегидратация является следствием избыточных потерь жидкости, ограничением перорального ее потребления и недостаточной поддерживающей жидкостной терапии. Хотя во время малых операций, возможно, не будет необходимости в парентеральном введении жидкостей, предоперационная регидратация может существенно смягчить осложнения при боль-
ших и экстренных операциях. Коррекция жидкостного и электролитного дисбалансов до индукН ции в анестезию минимизирует рефлекторные сигналы, имеющие место во время анестезии и операции и предрасполагающие к задержке жидкости. Таким образом, поддержание нормального; или даже слегка расширенного функционального внеклеточного жидкостного компартмента может] предотвратить нежелательные интраоперацион-; ные задержки жидкости.
Другим преимуществом увеличения внеклеточного объема жидкости перед операцией является уменьшение потерь эритроцитов во время операции за счет дополнительного разведения крови кристаллоидами. Например, ребенок с ген матокритом 40 % теряет 40 мл эритроцитов в ю ждых 100 мл потерянной крови. Однако, если этот же ребенок, чей объем крови составляет I мл/кг, получил перед операцией быстрое вливание сбалансированного солевого раствора (20; мл/кг в течение 10—20 мин), его гематокрит будет разбавлен до 30 %. Так как большинство дополнительных кристаллоидных растворов внача-i ле остаются во внутрисосудистом пространстве, процентное содержание эритроцитов в плазме снижается почти до 30 %. Потеря тех же 100 мл! крови теперь приведет к потере только 30 мЯ| эритроцитов.
Ребенок может быть подвергнут плановой ге-модилюции перед операцией извлечением у него гомологичной крови и замещением этого раство--ра кристаллоидами или, если запланировано за? ранее, пероральным потреблением объема, в 2—| раза превышающего объем извлеченной крови. Также было предложено использование челове-' ческого рекомбинантного эритропоэтина у детей| состояние которых позволяет извлекать у т$ кровь за недели до операции с предполагаемо! большой кровопотерей [190]. Представляется; что кислородным сенсором, стимулирующий продукцию эритропоэтина в печени и почках, является протеин гем [191].
Гомологичная кровь может быть возвращена пациенту в конце операции или в любое вреш когда окажется необходимым дополнительно количество крови. Хотя умеренная кровопотер может быть возмещена сбалансированными со-! левыми растворами, тяжелая и быстрая кровоту-i теря должна возмещаться цельной кровью. За* местительная терапия может быть начата еще того, как установлены количество потерянно!! крови, клиническая вариабельность и предпола^ гаемые кровопотери.
Определение волемического статуса требует анализа изменений частоты сердечных сокращен ний, среднего артериального давления, времени капиллярной перфузии, соотношения температуры внутренней среды и температуры конечно*


Во избежание предоперационной дегидратации у младенцев следует применять более короткие периоды голодания и менее жесткие ограничения в жидкости. У младенцев дегидратация развивается быстрее, чем у более старших пациентов, так как их метаболические и водные потери вдвое превышают таковые у более старших. Кроме того, младенцы ранних сроков жизни и некоторые дети с почечной недостаточностью не могут продуцировать концентрированную мочу, что ведет к дальнейшим облигатным потерям воды. Потери жидкости и объемы жидкости, необходимые для адекватного их замещения, могут быть определены по упрощенной схеме, приведенной в табл. 5.9.
Возмещение дефицита жидкости должно всегда начинаться со сбалансированных солевых растворов для повышения объема циркулирующей крови. Гидратация и повышение циркулирующего объема повышают почечный кровоток и наполняют функциональный внесосудистый объем. Повторное определение электролитов и специфической плотности мочи помогают избежать избыточной солевой и водной нагрузки. Для
6-998
Жидкости, электролиты и питание в педиатрии 147
оценки эффективности возмещения жидкостей не следует применять какой-либо отдельно взятый клинический или лабораторный параметр. Напротив, анализ комплекса лабораторных данных, клинических исследований, повторных взвешиваний и оценка тенденций жизненно важных функций должны лежать в основе эффективной оценки предоперационной гидратации.
Интраоперационная жидкостная терапия
Во время операции необходима поддерживающая жидкостная терапия (см. табл. 5.1). Дыхание не-увлажненными газами повышает потребность в жидкости, которая увеличивается с повышением объема минутной вентиляции. Вдыхание согретых, увлажненных газов обеспечивает прирост как тепла, так и воды. Дополнительные потери воды происходят с открытых частей тела (например, брюшная полость или грудная клетка). Потери в процессе челюстно-лицевых операций пропорционально выше у младенцев раннего срока жизни по сравнению с более старшими младенцами, так как голова представляет большую часть их общей поверхности тела. Ретроспективные исследования, определяющие необходимое количество крови для заместительной гемотрансфузии, должны проводиться в периопе-рационном периоде.
Как подчеркивалось выше, растворы, содержащие свободную воду, быстро фильтруются из сосудистого компартмента, разводя и расширяя объем интерстициального и клеточного компар-тментов, усиливая послеоперационный отек. Замещение жидкостных потерь сбалансированными солевыми растворами приводит к меньшей задержке жидкости и индуцирует натрийуретиче-ский эффект. Три фактора играют активную роль в восстановлении жидкостного гомеостаза.
Жидкостный баланс контролируется объе мом и осморецепторами. Инфузия сбалан сированных солевых растворов, содержащих относительный избыток натрия, замещает воду, одновременно повышая общее содер жание натрия в организме.
Этот относительный избыток натрия помо гает поддерживать циркуляцию и восстанав ливать сниженный функциональный вне клеточный объем. Повышение системной сосудистой емкости растягивает предсердия сердца и повышают почечный кровоток. Натрийуретический гормон еще более по вышает внутрисосудистый объем крови.
За счет повышения почечного кровотока и стимуляции секреции натрия жидкостный гомеостаз организма реэквилибрируется [че рез диуретический (водосбрасывающий) и
148 Анестезия в педиатрии
натрийуретический (натрийсекретирую-щий) эффект], что ведет к снижению ин-траоперационной задержки жидкости.
Избыток воды ведет к разведению внесосуди-стого компартмента, а изотонический сдвиг жидкости и электролитов вызывает абсорбцию клетками воды. Результирующий клеточный отек компрометирует поступление в клетки нутриен-тов и выброс из них продуктов их жизнедеятельности. Снижение поступления нутриентов ослабляет функционирование клеток и замедляет заживление ран и рост. Снижение выброса отработанных продуктов вызывает постепенное отравление. Эти токсичные продукты в совокупности с недостатком энергетического субстрата понижают активность АТФ-зависимого калий-натриевого насоса, который обеспечивает поддержание нормального электролитного градиента между внутриклеточным и внеклеточным компартмен-тами.
Послеоперационная жидкостная терапия
После операции ткани удерживают избыточную воду в ответ на повышенную секрецию вазопрес-сина [192, 193]. Активно дебатировалось применение жидкостей после малых операций [194— 196]. После ускоренного возобновления перо-рального потребления у педиатрических амбулаторных пациентов бывают учащены случаи тошноты и рвоты [197], в частности при недостаточной парентеральной инфузии жидкостей. У некоторых пациентов сокращение объема крови и употребление гипотонических жидкостей приводит к повышению объема внеклеточной жидкости на несколько литров. Повышение концентрации внутриклеточного натрия сопровождается понижением концентрации натрия в сыворотке крови. При применении растворов, содержащих свободную воду, для возмещения интраопераци-онных жидкостных потерь концентрация натрия падала со 138 до 108 мг-экв/л в группе в прошлом здоровых молодых женщин [198]. Это понижение сопровождалось судорогами, остановкой дыхания и перманентным повреждением мозга или смертью у 15 женщин, возможно, вследствие демиелинизирующего синдрома. Быстрая коррекция гипонатриемии является императивом [199], хотя некоторые исследователи заявляют, что повышение понтинной демиелини-зации может возникать при слишком быстрой коррекции гипонатриемии [200]. Соблазнительно обеспечить детей свободной водой, но эти наблюдения у взрослых являются резким напоминанием о том, что введение пациентам растворов, содержащих свободную воду, может резко понизить у них концентрацию натрия в сыворот-
ке. Это выглядит особенно существенным в послеоперационном периоде, когда повышен уровень вазопрессина. Десмопрессин, ацетат, водный вазопрессин и фенотиазины могут также усиливать задержку воды.
При адекватном мочеотделении (более 0,8 мл/ кг/ч) нет необходимости увеличивать введение жидкости. Олигурия (мочеотделение менее 0,8 мл/кг/ч) может быть следствием дегидратации или почечной недостаточности. Эти два состояния часто можно различить измерением соотношения азота мочевины к креатинину в сыворотке. Снижение внутрисосудистого объема или почечной перфузии снижает экскрецию натрия с мочой до менее 10 мг-экв/л и повышает соотношение азота мочевины к креатинину в сыворотке | до более чем 20:1. Соотношения этого диапазона являются следствием "преренальных" факторов. На острую почечную недостаточность, с другой стороны, указывает повышение почечной концентрации натрия (до более чем 50 мг-экв/л) я | повышение как азота мочевины в сыворотке, так и креатинина при сохранении неизменным уровней их соотношения. В обоих случаях следует обеспечить достаточное количество жидкости для поддержания почечной и циркуляторной функций [201]. Оценка степени дефицита жидкости часто становится причиной задержки начала терапии. Это имеет особое значение при необходимости ликвидировать гиповолемию у ребенка не* медленно для поддержания циркуляторного объ-1 ема и функции почек [202].
Цвет мочи
Количество выделяемой мочи легко поддается измерению в отличие от трактовки ее цвета, зависящего от кругооборота билирубина и урохро* ма. Однако цвет мочи тесно связан с ее удельным ■, весом, мы все наблюдали соломенную окраску) мочи, свободно стекающей из катетера, и кощ| центрированный золотой цвет мочи, медленнё| наполняющей приемную емкость [203].
Опасности для работников здравоохранения при парентеральной терапии
Дети редко могут дать информированное сошь сие и взаимодействовать при установке внутри-? венного катетера. Одним из свидетельств про-*! фессионализма педиатрического анестезиолог^ является его способность начать внутривенную] терапию и надежно и безопасно ограничить поЩ вижность неконтактирующего младенца и тен| самым предотвратить нанесение вреда работнян| кам здравоохранения. Хотя риск ранения конт&] минированной иглой представляется более высей!
ким, когда шприц вскрыт повторно, риск серьезной инокуляции значительно серьезнее во время процедур внутривенной пункции, таких как начало внутривенной терапии или выполнение артериальной пункции. Трудно определить реальную опасность для педиатрического анестезиолога, так как большинство врачей не докладывают о случаях нанесения повреждений иглой. Кроме того, при сравнении частоты повреждений иглой у установленных носителей ВИЧ и ВИЧ-негативных пациентов эта частота на самом деле остается одинаковой [204\.
Stevens J: One Robe, One Bowl; The Zen Poetry of Ry- okan. Weatherhill, New York, 1977
Gladstone E: The lure of medical history. Calif West Med 38:432, 1933
Latta T: Letter to the Secretary of the Central Board of Health London, affording a view of the rationale and the results of his practice in the treatment of cholera by aque ous and saline injections. Lancet 2:274, 1830—1832
Bickel WH, Wall MJ, Pepe PE, et al.: Immediate versus delayed fluid resuscitation for hypotensive patients with penetrating torso injuries. N Engl J Med 331:1105, 1994
Carpenter CC: The treatment of cholera: clinical science at the bedside. J Infect Dis 166:2, 1992
Lister JA: A contribution to the germ theory of putrefac tion and other fermative changes, and the natural history of torulae and bacteria. Trans R Soc Edinburgh 27:T-2, 1875
Jenkins MT: History of sequestered edema in surgery and trauma, p. 2. In Brown BR (ed): Fluid and Blood Therapy in Anesthesia. FA Davis, Philadelphia, 1983, p, 2
Pitts RF: Physiology of the Kidney and Body Fluids. Year Book Medical Publishers, Chicago, 1963
Holt E, Courtney A: The chemical composition of di- arrheal as compared with normal stools in infants. Am J Dis Child 9:213, 1915
Howland J, Marriot WM: Acidosis occurring with di arrhea. Am J Dis Child 1916:309, 1916
Brook CG: Determination of body composition of chil dren from skin fold measurements. Arch Dis Child 46:182, 1971
Butte N, Heinz C, Hopkinson J, et al: Fat mass in infants and toddlers: comparability of total body water, total body potassium, total body electrical conductivity and dual-en ergy X-ray absorptiometry J Pediatr Gastroenterol Nutr 29:184, 1999
Howland J, Dana RT: A formula for the determination of the surface area of infants. Am J Dis Child 6:33, 1913
Dubois D, Dubois FF: Clinical calorimetry: formula to es timate approximate surface area if height and weight be known. Arch Intern Med 17:863, 1916
Boyd E: Growth of Surface Area of the Human Body. In stitute of Child Welfare, Monograph Series 10. University of Minnesota Press, Minneapolis, 1935
Berry FA (ed): Anesthetic Management of Difficult and Routine Pediatric Patients. Churchill Livingstone, New York, 1986
Oliver WJ, Graham BD, Wilson JL: Lack of scientific va lidity of body surface as a basis for parenteral fluid dosage. JAMA 167:1211, 1958
Losek JD: Rapid assessment of glucose needed in chil dren requiring resuscitation. Ann Emerg Med 35:43, 2000
Talbot FB, Crawford JD, Butler AM: Medical progress; homeostatic limits to safe parenteral fluid therapy. N Engl J Med 248:1100, 1953
Howland J: The fundamental requirements of an infant's nutrition. Am J Dis Child 2:49, 1911
Holliday MA, Segar WE: Maintenance need for water in parenteral fluid therapy. Pediatrics 19:823, 1957
Lindahl SG: Energy expenditure and fluid and electrolyte requirements in anesthetized infants and children. An- esthesiology 69:377, 1988
Welborn LG, Hannallah RS, McGill WA et al: Glucose concentrations for routine intravenous infusion in pediat ric output surgery. Anesthesiology 67:427, 1987
Larsson LE, Nilsson K, Niklasson A et al: Influence of flu id regimens on perioperative blood-glucose concentrations in neonates. Br J Anaesth 64:419, 1990
Karcher R, Ingram R, Kiechle F et al: Evaluation of he- moCue В-glucose photometer for intensive care applica tions. Clin Chem 38:6, 1992
Coyle EF, Montain SJ: Carbohydrate and fluid ingestion during exercise: are there trade-offs? Med Sci Sports Exerc 24:671, 1992
Sawka MN, Greenleaf JE: Current concepts concerning thirst, dehydration, and fluid replacement: overview. Med Sci Sports Exerc 24:643, 1992
Hoobler BR: The role of mineral salts in the metabolism of infants. Am J Dis Child 2:107, 1911
Ringer S: Concerning the influence exercised by each of the constituents of the blood on the contraction of the ven tricle. J Physiol (Lond) 3:380, 1880-1882
Winters RW: Principles of Pediatric Fluid Therapy. Abbott Laboratories, North Chicago, 1970
Avery ME, Snyder JD: Oral therapy for acute diarrhea. N Engl J Med 323:892, 1990
Alam NH, Majumder RN, Fuchs GJ: Efficacy and safety of oral rehydration solution with reduced osmolarity in adults with cholera: a randomized double-blind clinical trial. CHOICE study group. Lancet, 354:296, 1999
Glynn IM, Karlish SJD: The sodium and potassium pump. Annu Rev Physiol 37:895, 1967
Sheng HP, Huggins RA: A review of body composition studies with emphasis on total body water and fat. Am J Clin Nutr 32:630, 1979
Cochran WJ, Klish WJ, Wong WW et al: Total body elec trical conductivity used to determine body composition in infants. Pediatr Res 20:561, 1986
Lewis DS, Rollwitz WL, Bertrand HA et al: Use of NMR for measurement of total body water and estimation of body fat. J Appl Physiol 60:836, 1986
Friis-Hansen B: Water distribution in the foetus and new born infant. Acta Paediatr Scand (suppl) 305:7, 1983
Venkatesh S, Schrier RW, Andreoli E: Mechanisms of tu bular sodium chloride transport. Ren Fail 20:783, 1998
GuytonAC, Scheel K, Murphree D: Interstitial fluid pres sure: its effect on resistance to tissue fluid mobility. Circ Res 19:419, 1966
Mullins RJ, Powers MR, Bell DR: Albumin and IgG in skin and skeletal muscle after plasmapheresis with saline loading. Am J Physiol 252:H71, 1987
Oratz M, Rothchild MA, Schreiber SS: Albumin-osmotic function, p. 275. In Rosenoer VW, Oratz M, Rothchild MA (eds): Albumin Structure, Function and Uses. Perga- mon Press, New York, 1977, p. 275
Shires T, Williams J, Brown F: Acute changes in extracel lular fluids associated with major surgical procedures. Ann Surg 154:803, 1961
Fulop M: Algorithms for diagnosing and treating some electrolyte disorders. Am J Emerg Med 16:76, 1998
Redfors S: Small intestinal fluid absorption in the rat dur ing haemorrhage and its importance for plasma refill. Acta Physiol Scand 131:429, 1987
Turbeville DF, Bowen FW, Killiam AP: Intracranial he-
6*
Переливание крови и ее компонентов
Л ИНДА
СТЕЛИНГ
(LINDA
STEHLING)
ИНДА
СТЕЛИНГ
(LINDA
STEHLING)
Многие достижения детской хирургии были бы невозможны без соответствующего прогресса в области трансфузионной терапии. Термин "банк крови" начали использовать после создания первых подобных учреждений в 1930-х годах, когда в госпиталях была выделена трансфузионная служба, взявшая на себя ответственность за создание запасов крови и ее поставку. Современная служба переливания крови вместе с ее региональными центрами все больше вовлекается в непосредственное обслуживание больных. Изобретение пластиковых трубок и мешков в 1950-х годах способствовало появлению компонентной терапии, бурно развивавшейся уже в 1960-е годы.
Последующие достижения в области технологии и иммуногематологии привели к тому, что в распоряжении современной гемотрансфузиоло-гии имеется более двух дюжин различных компонентов крови, способных удовлетворить самые разные потребности каждого пациента. Анестезиолог, решающий вопрос о применении тех или иных компонентов, должен хорошо ориентироваться в их типах и особенностях, в показаниях к их использованию и в возможном побочном действии.
154
Ежегодно в США заготавливается примерно 13 млн единиц крови. Более 90 % этого количества сосредоточено в гематологических центрах. Красный крест Америки располагает примерно половиной этих запасов, а большая часть оставшейся половины рассредоточена в гематологических центрах Америки. Менее 10 % донорской крови предоставлено службе переливания крови в госпиталях.
Сведения по гемотрансфузиям только в педиатрии отсутствуют, но можно привести обобщенные данные о переливании компонентов крови. Ежегодно переливают около 11 млн единиц эрит-роцитной массы, 2,6 млн единиц свежезамороженной плазмы и 0,7 млн единиц криопреципи-тата. Калькуляция числа трансфузий тромбоцитной массы проводится с учетом двух источников ее получения: концентрата тромбоцитов, полученных из цельной крови, и тромбоцитов от единственного донора, полученных при аферезе. Общее число переливаний тромбоцитной массы обычно сообщается в терминах тромбоцитного концентрата, предполагая, что одна донорская единица эквивалентна примерно шести тромбо-

Переливания крови становятся безопаснее благодаря улучшению отбора и обследования доноров (табл. 6.1).
Первоочередным методом профилактики подобных заболеваний является отбор доноров и исключение тех из них, кто по социальным или медицинским критериям подвержен риску заболевания, передающегося с кровью. Каждая единица собранной крови должна исследоваться на антитела к ВИЧ-1 и -2, к вирусу гепатита С (ан-ти-HCV), к ядерному антигену гепатита В (анти-НВс), к человеческому Т-лимфотропному вирусу (анти-HTLV I/II).
Кровь также тестируется на поверхностный антиген гепатита В (HBsAg), HIV-1 р24-антиген и на сифилис. В большинстве случаев донорская кровь тестируется на уровень аланиновой ами-нотрансферазы (АЛТ). Наибольшей проблемой остается безопасность донорской крови, полученной в период так называемого "инфекционного окна", когда пациент остается серонегатив-ным и инфекция не может быть установлена с помощью обычных лабораторных тестов. Основная цель тестирования методом амплификации нуклеиновых кислот (NAT), начатого в 1999 г.,
Переливание крови и ее компонентов 155
состоит именно в сокращении продолжительности инфекционного окна гепатита С и ВИЧ-инфекции.
Вирус иммунодефицита человека
Первый случай развития синдрома приобретенного иммунодефицита (СПИД), связанный с ге-мотрансфузией, был диагностирован и опубликован в 1982 [2\. К 1998 г. в Центры по профилактике болезней и борьбе с ними было сообщено о 8000 случаев СПИДа у детей моложе 13 лет; менее 400 детей заразились при переливании крови [3\. Большинство случаев заражения приходится на 1982—1984 гг., до введения тестирования на ВИЧ.
Тестирование на антитела к ВИЧ-1 было введено в 1985 г., а на антитела к ВИЧ-2 — в 1992 г. Тест на ВИЧ-1 р24-антиген сокращает продолжительность инфекционного окна почти на 6 дней, доведя его примерно до 16 дней. Этот тест повышает ежегодно на 25 % (с 18 до 27) число выявленных инфекционных доноров, которых не удавалось идентифицировать обычными тестами. Однако при первоначальном проведении этого теста с 6 млн проб крови были выявлены всего лишь два донора с положительными реакциями на антиген р24 и отрицательными — на антитела к ВИЧ [4\. В настоящее время установленный риск переноса ВИЧ-инфекции при гемотрансфу-зии колеблется от 1 случая на 200 000 до 1 случая на 2 000 000 переливаний.
Посттрансфузионный гепатит
В конце 1960-х годов посттрансфузионный гепатит (ПТГ) развивался более чем у трети всех пациентов, получавших повторные переливания крови. В 1970-х годах частота этого заболевания существенно снизилась благодаря соответствующему отбору доноров. Введение в 1972 г. скри-нингового теста на гепатит В по поверхностному антигену (HBsAg) снизило заболеваемость гепатитом примерно на 25 %, поскольку большинство случаев этой инфекции вызывали вирусы гепатита ни А- ни В-групп (НАНВГ). Из-за отсутствия специфических тестов на этот вирус с 1986 г. пользуются косвенным тестом. Подтвердилось высказанное ранее предположение, что исключение крови от доноров с повышенным уровнем аланинаминотрансферазы снизит заболеваемость НАНВГ на 30-50 % [5\.
Новая эпоха в изучении этиологии, в выявлении и профилактике НАНВГ наступила, когда был клонирован геном этого заболевания, названный вирусом гепатита С (ВГС), и был разработан рекомбинантный метод выявления антител к нему. Тестирование на ВГС было начато в
156 Анестезия в педиатрии
1990 г., а с помощью усовершенствованного теста—в 1992 г.
Риск заражения гепатитом С в результате ге-мотрансфузии в настоящее время, по оценкам, колеблется в пределах 1 случая на 30 000 — 150 000 переливаний (в среднем 1 случай на 103 000 переливаний [4]. Острая инфекция гепатитом С у большинства пациентов остается бессимптомной. Однако в 75—85 % случаев она переходит в хроническую форму, сопровождаясь постоянным или периодическим повышением уровня АЛТ. Цирроз печени развивается у 10—20 % таких пациентов на протяжении 20—30 лет наблюдения, а гепатоцеллюлярная карцинома—у 1—5 % [б]. Вполне вероятно, что гепатит С, приобретенный в раннем детстве, ассоциируется с подобной же вероятностью развития хронической инфекции. Затянувшееся течение заболевания имеет особенно важное значение у детей, инфицированных в раннем возрасте в связи с большой продолжительностью предстоящей жизни. Предварительные результаты лечения альфа-интерфероном у взрослых показали, что всего лишь у 15—25 % пациентов наступают блат-гоприятные сдвиги, выражающиеся нормализацией уровня АЛТ и исчезновением РНК вируса гепатита С из крови. Дополнительное лечение рибавирином способно повысить эти результаты вдвое [б].
Гепатит А, при котором не наблюдается но-сительства, развивается в 1 случае из 1 000 000 трансфузий. Гепатит В в настоящее время составляет не более 10 % всех случаев посттранс -фузионных гепатитов. Риск его развития колеблется в пределах 1 случая на 30 000 — 250 000 переливаний. Суммарный риск развития гепатита В и С, составляющего 88 % всех заражений вирусными инфекциями при трансфузиях, равен 1 случаю на 34 000 переливаний [7]. Примерно 10—15 % больных, заразившихся гепатитом парентерально, квалифицируются как больные ни А- и ни Е-гепатитом [8\. Изучение недавно идентифицированного вируса G (HGV), вызывающего гепатит GB, подтвердило возможность заражения им при гемотрансфузиях, но отвергло его этиологическую роль при заболевании гепатитом ни А и ни Е [9]. Другой вновь открытый вирус, первоначально названный ТТ-вирусом по инициалам пациента, от которого он был выделен, в настоящее время обозначается как TTV, или трансфузионно переносимый вирус. Обнаруживается этот вирус довольно часто, однако его связь с развитием посттранс -фузионного гепатита не доказана [10\. В настоящее время большинство случаев ни А- и ни Е-гепатита, вероятнее всего, вызывается еще не открытыми возбудителями гепатита или же имеет не вирусную этиологию [9].
Другие заболевания, передаваемые при трансфузиях
\ Человеческий Т-лимфотропный вирус I/JI
(HTLV I/II) может передаваться при переливании клеточных компонентов крови. Вероятный риск подобного заражения равен 1 случаю на 250 000 — 2 000 000 переливаний и связан с продолжительностью хранения материала до перелиъ вания. Материал, хранимый более 14 дней, рассматривается как неинфекционный [4\. Наличие инфекции HTLV I/II доказать значительно труднее, чем заражение другими вирусами, на которые тестируется донорская кровь. Инфекция HTLV I может привести к развитию хронического дегенеративного заболевания нервной системы — миелопатии, связанной с HTLV I (НАМ) или к тропическому спастическому парапарезу (TSP), который характеризуется прогрессированием спастических и сенсорных нарушений, слабостью нижних конечностей и недержанием мочи. Наряду с этим у взрослых может развиваться Т-клеточная лейкемия/лимфома. Вероятность развития неопластических или явных неврологических поражений на протяжении жизни не превышает 4 % [Щ. Инфекция HTLV II также может привести к развитию HAM/TSP, но подобная ассоциация менее достоверна, чем в случае HTLV I.
Перенос парвовируса В19 вероятен в 1 случае на 10 000 трансфузий и обычно не сопровождается клинической симптоматикой. Однако у беременных женщин возможно развитие водянки плода. Инфекция цитомегаловирусом (CMV) способна вызывать опасное для жизни поражение многих систем организма у больных с подавленным иммунитетом, у младенцев с низкой массой тела при рождении, а также у реципиентов после трансплантации костного мозга и паренхиматозных органов. Таким пациентам рекомендовано переливать CMV-отрицательную кровь и обедненные лейкоцитами ее компоненты. К другим, вероятно, переносимым при гемотрансфузиях вирусам, относятся вирус Эпштей-на—Барр, вирусы человеческого герпеса 4 и 6 (HHV4; HHV6) [721.
Возбудитель сифилиса Treponema pallidum не переносит длительного хранения при температуре 1—6 °С, при которой хранятся кровь и ее компоненты. Выживание ее в тромбоцитной массе более вероятно, поскольку она хранится при комнатной температуре (22—24 °С). Тем не менее за последние 30 лет в англоязычной литературе было опубликовано всего 2 случая подобного заражения сифилисом [13]. Перенос паразитарных заболеваний (малярия, токсоплазмоз, болезнь Шагаса, бабесиоз) исключительно редок в США. Однако недавно появилось сообщение о зараже-
 нии
двух новорожденных при гемотрансфузии
от донора
с бессимптомной инфекцией Babesia
mi-croti
[14\. Двое
других новорожденных и один ребенок
более старшего возраста, получившие те
же
компоненты крови от того же донора, не
инфицировались.
нии
двух новорожденных при гемотрансфузии
от донора
с бессимптомной инфекцией Babesia
mi-croti
[14\. Двое
других новорожденных и один ребенок
более старшего возраста, получившие те
же
компоненты крови от того же донора, не
инфицировались.
Значительное внимание было уделено вопросу о возможности переноса болезни Крейтцфель-да—Якоба (БКЯ), во всех случаях фатального нейродегенеративного заболевания. В настоящее время отсутствуют доказательства подобного пути заражения БКЯ. Отсутствуют также доказательства повышенной частоты БКЯ у пациентов с высоким риском гемотрансфузионных заболеваний (например, у больных коагулопатией из-за дефицита факторов свертываемости крови по типу гемофилии). Первые эпидемиологические исследования, касающиеся почти 200 реципиентов, получавших кровь от доноров, у которых в последующем развилась БКЯ, не подтвердили опасности заражения [15]. Тем не менее это заболевание может быть перенесено при трансплантации твердой мозговой оболочки, роговицы, при повторном проведении поверхностных электроэнцефалограмм с использованием электродов, ранее вводившихся инфицированным пациентам, или при инъекции человеческого питу-итринпроизводного гормона роста. По этой причине отвергаются вероятные доноры, ранее подвергавшиеся трансплантации тканей или подозрительные на возможность распространения БКЯ, а также с указаниями на подобное заболевание в семейном анамнезе.
1
\ Бактериальная контаминация
Бактериальное загрязнение следует всегда иметь в виду при дифференциальной диагностике причин лихорадки, развивающейся вскоре после переливания компонентов крови. Подобное бактериальное загрязнение может возникать в результате незаподозренной бессимптомной бактериемии у донора в момент взятия крови, инфицирования места введения иглы или недостаточной стерилизации емкости для сбора крови. Наибольшие возможности для бактериального роста создаются в тромбоцитной массе, поскольку она хранится при комнатной температуре. Пациенты, которым введена инфицированная тромбоцитная масса, могут реагировать появлением лишь незначительной лихорадки, но возможно и развитие молниеносного сепсиса, часто приводящего к смерти. Вероятность развития подобного сепсиса равна 1 случаю на 12 000 переливаний и чаще всего наблюдается у пациентов, которым введен сборный тромбоцитный концентрат [4\.
Несколько летальных случаев было описано после трансфузии эритроцитной массы, конта-
Переливание крови и ее компонентов 157
минированной Yersinia enterocolitica. По данным Центра по борьбе с заболеваниями, из 20 больных, которым загрязненная иерсиниями эритро-цитная масса была перелита в период 1987— 1996 гг., умерли 12. Симптомы заражения обычно появлялись уже во время трансфузии, а смерть наступала в среднем через 25 ч.
Истинная частота бактериального загрязнения эритроцитной массы остается неизвестной, но ее ориентировочно оценивают равной 1 случаю на 500 000 переливаний [4\.
Хотя пациенты и родители больных детей концентрируют основное внимание на опасности заболеваний, переносимых при трансфузиях, анестезиолог должен направлять свое особое внимание на переливаемую кровь только при соответствующих показаниях и при необходимости идентифицировать реципиентов, подверженных серьезным гемолитическим посттрансфузионным реакциям (ГТР). Частота фатальных ГТР такая же, как и частота ВИЧ-инфицирования при ге-мотрансфузиях в современных условиях. Однако не вызывает сомнений значительный недоучет подобных осложнений. Значительно более частыми являются нефатальные исходы при ошибочном назначении крови непоказанным больным. По оценкам, переливание крови ошибочному пациенту может иметь место в одном случае на 12 000 единиц [16\. Большинство ошибок имеет канцелярский характер и вполне может быть предотвращено.
Гемолитические трансфузионные реакции
Гемолитические трансфузионные реакции включают гемолиз эритроцитов. Они могут быть вызваны иммунологической несовместимостью эритроцитов донора и реципиента либо неиммунными механизмами. Вероятность иммуноло-гически опосредованных ГТР у детей выше, чем у взрослых. Это может быть связано с тем, что идентификационные бирки, прикрепляемые к ручке или ножке ребенка, часто удаляются при поиске места для внутрисосудистого введения катетера. Нередко конечность с идентификационной информацией приходится закрывать повязкой. Анестезиолог должен при любой процедуре, где может потребоваться гемотрансфузия, еще до введения в наркоз верифицировать госпитальный номер ребенка и доступность совместимой крови.
158 Анестезия в педиатрии
Признаки и симптомы ГТР обычно становятся очевидными уже вскоре после начала переливания. Во время наркоза у ребенка единственными признаками могут быть неожиданные микровас-кулярные геморрагии, гипотензия и гемоглобину-рия. Тяжесть реакции обычно пропорциональна количеству перелитой крови, возникает она вслед за введением 10—20 мл несовместимой эритро-цитной массы. При подозрении на ГТР переливание должно быть немедленно прекращено и сразу же извещена служба переливания крови. Если произошла канцелярская ошибка, то подобная же опасность может угрожать и другому пациенту. Лечение ребенка, перенесшего ГТР, предусматривает поддержание диуреза в пределах 1—2 мл/кг/ч с помощью внутривенного введения жидкости, назначения фуросемида и/или дофамина в малых дозах. Необходимо ориентироваться на исходные показатели гемокоагуляции, и в соответствии с ее изменениями проводить необходимое лечение.
Первая реакция анестезиолога, неожиданно обнаружившего выделение мочи красного цвета во время наркоза у ребенка, состоит в прекращении гемотрансфузии и в проверке идентификационной информации. Наряду с этим необходимо иметь в виду возможность и других причин для гемолиза. Неиммунный гемолиз может возникать при экспозиции эритроцитов с гипертоническим раствором (например, 50 % раствором декстрозы) или с гипотоническим раствором (например, 0,45 % раствором хлористого натрия). Причинами гемодиализа могут быть термические повреждения эритроцитов во время хранения или обработки крови, неадекватная деглицероли-зация замороженных эритроцитов, неправильное их согревание во время введения либо же механические повреждения в процессе выполнения кардиопульмонального шунтирования, а также при использовании аппарата, возвращающего кровь, потерянную во время операции.
В противоположность острым гемолитическим реакциям отсроченные ТГР обычно не угрожают жизни пациента. В большинстве случаев они возникают у больных, ранее уже получавших гемотрансфузии. Предотвратить такие реакции не удается. Соответствующие антитела в крови у таких пациентов отсутствуют к моменту гемотрансфузии и появляются лишь в ответ на нее. Единственным признаком таких реакций может быть отсутствие улучшения, ожидаемого от переливания. Диагноз должен быть заподозрен у ребенка с необъяснимым падением гемоглобина или ге-матокрита в течение 2 нед после трансфузии, особенно если у него появилась желтушность в результате быстрого разрушения перелитых эритроцитов. Никакой особой терапии не показано, но может потребоваться дополнительное переливание эритроцитов.
Острые поражения легких, связанные с трансфузией
Острые поражения легких, связанные с трансфузией (ОПЛСТ), представляют собой угрожающие жизни пациента состояния, проявляющиеся тяжелым отеком обоих легких, гипоксемией, лихорадкой, тахикардией и гипотензией. Обычно они развиваются спустя 1—6 ч после трансфузии компонентов крови, содержащих плазму. Это могут быть цельная кровь, эритроцитная масса, свежезамороженная плазма, тромбоциты, грануло-циты и криопреципитат. Истинная частота подобного осложнения остается неизвестной, но предположительно оно возникает в 1 случае на 5000 трансфузий [4\. В большинстве случаев страдают взрослые, но описано его возникновение у новорожденных и детей более старшего возраста. Несмотря на молниеносное развитие симптоматики, большинство пациентов выздоравливают через 48—72 ч при условии адекватной вентиляционной и гемодинамической поддержки. Точный механизм ОПЛСТ остается неясным, но считается, что при этом происходят реакции между плазмой донора и лейкоцитами реципиента. Диагноз устанавливают методом исключения. При подозрении на ОПЛСТ следует информировать службу переливания крови для проведения ею дополнительного обследования донора. Предосторожностей не требуется, если пациент нуждается в дополнительной трансфузии.
Лихорадочные реакции
Повышение температуры у ребенка во время наркоза может быть вызвано многими причинами, среди которых не следует забывать и о возможности реакции на переливание. Повышение температуры может быть первым признаком развивающейся ГТР, введения компонентов крови с бактериальной контаминацией или же проявлением лихорадочной негемолитической трансфу-зионной реакции (ЛНГТР). Важным диагностическим критерием становится тип введенного компонента крови и время возникновения реакции. При трансфузии эритроцитной массы следует предполагать ГТР. Бактериальное загрязнение наиболее вероятно при переливании тромбоцитов. Лихорадка при ГТР и при бактериальном загрязнении обычно появляется после переливания небольших количеств крови и редко бывает единственным симптомом. Диагноз ЛНГТР обычно ставят методом исключения. Это осложнение чаще всего возникает у больных, нуждающихся в повторных трансфузиях, особенно в переливании тромбоцитной массы. Снизить его частоту и тяжесть удается при назначении компонентов крови, обедненных лейкоцитами.
Уртикарии
Появление уртикарных высыпаний относится к наиболее обычным и наименее серьезным осложнениям гемотрансфузии. Они отражают реакцию пациента на инородные белки в переливаемой крови. Если другие признаки анафилаксии отсутствуют, то гемотрансузию не прекращают. Введение дифенгидрамина (0,5—1,0 мг/кг) позволяет устранить уртикарии.
Аллергические и анафилактические реакции
Аллергические и анафилактические реакции представляют собой результаты взаимодействия аллергенов. Обычно это протеины переливаемой плазмы, к которым реципиент был предварительно сенсибилизирован, а также антитела к иммуноглобулину Е (IgE) тучных клеток и базофилов реципиента. Реакция антиген—антитело происходит на поверхности других клеток и сопровождается выделением различных анафилаксинов. Симптоматика варьируется от появления небольших уртикарий до отека гортани, бронхоспазма, гипотензии и смерти. Общим принципом является то, что чем короче промежуток времени между началом трансфузии и появлением симптомов анафилаксии, тем тяжелее реакция. Анафилактические реакции весьма редки, но при подозрении на их развитие трансфузия должна быть прекращена и назначена необходимая терапия. Лечение предусматривает введение эгшнефрина, кортико-стероидов и дифенилгидрамина в сочетании с соответствующим обеспечением проходимости дыхательных путей и введением жидкости. Служба переливания крови также должна быть извещена. Могут возникнуть показания для тестирования на анти-IgA. При его обнаружении в перелитой крови следует считать, что у пациента имеется дефицит по этому иммуноглобулину и в последующем ему можно вводить только компоненты крови с обедненным содержанием IgA (например, отмытые эритроциты и тромбоциты или плазму от доноров с дефицитом IgA).
Болезнь "трансплантат против хозяина", связанная с трансфузией
Болезнь, получившая название "трансплантат против хозяина, ассоциированная с трансфузией" (БТПХАТ), возникает в тех случаях, когда лимфоциты иммунокомпетентного донора переливают реципиенту, несовместимому по человеческому лейкоцитарному антигену (HLA) и иммунологиче-ски неспособному устранить донорские клетки. Среди педиатрических контингентов в группу риска по БТПХАТ входят недоношенные младенцы,
Переливание крови и ее компонентов 159
новорожденные с эритробластозом плода, с врожденным иммунодефицитом, больные лимфогранулематозом, а также реципиенты после трансплантации костного мозга, пересадки стволовых клеток или введения крови от биологических родственников. Клиническая симптоматика, включающая лихорадку, макулопапулезные высыпания, тяжелую диарею, панцитопению и нарушения функции печени, развивается в течение 7—10 дней после трансфузии. Лечение обычно не дает эффекта, смертность высокая. Облучение компонентов крови во всех случаях устраняет опасность БТПХАТ. Поэтому анестезиолог должен быть знаком с соответствующим типом пациентов, подверженных риску БТПХАТ, и соответственно использовать только предварительно облученную кровь.
Иммуномодуляция
Иммуномодуляционный эффект трансфузии может быть благоприятным или вредоносным. Это распознается в течение двух или более декад после трансфузии по приживлению пересаженной почки и по улучшению ее функции. Механизм протективного действия аллогенной трансфузии остается неясным. Ассоциация трансфузии в пе~ риоперационном периоде со снижением срока выживания раковых больных остается спорной. Большое число исследований, выполненных у взрослых, по всей видимости, подтверждают существование подобной ассоциации, однако причинные взаимосвязи не были доказаны [17, Щ. Более убедительным является нарастание частоты послеоперационной инфекции у больных, которым в периоперационном периоде проводились трансфузии. По данным одного исследования, у больных, оперированных на позвоночнике (некоторые из них были детьми), послеоперационная инфекция развивалась в 5 раз чаще у пациентов, которым была проведена гемотрансфу-зия, по сравнению с не получавшими ее или же теми, кому была перелита аутогенная кровь [Щ. Согласно неподтвержденной гипотезе, лейкоциты донора вовлекаются в процессы иммуномоду-ляции и обеднение переливаемой крови лейкоцитами может принести пользу.
Практика трансфузий у детей во многом отличается от принятой у взрослых. У детей более важное, часто критическое, значение имеет количество переливаемой крови. У взрослых гемотерапия рассчитывается в единицах, а у детей — по массе тела. Методы назначения и введения малых объектов отдельных компонентов крови должны быть точно приспособлены к потребно-
160 Анестезия в педиатрии
стям ребенка. Особое внимание при повторных переливаниях малых количеств крови и ее компонентов следует уделять ограничению числа доноров. Анестезиолог должен быть знаком с клиническими показаниями для специальной обработки компонентных препаратов, в том числе с их облучением и снижением числа лейкоцитов.
Ограничение донорского воздействия
Новорожденные, нуждающиеся в трансфузии, часто получают кровь от многих доноров. Одним из эффективных методов ограничения их числа является специальная маркировка единицы крови, использованной при первом переливании и использовании той же или точно такой же при последующих трансфузиях. Подобная система дает особенно благоприятные результаты у младенцев с очень низкой массой тела при рождении (ОНМР), которым часто необходимы многократные переливания по 10—15 мл эритроцитной массы. Данные прошлых исследований показали, что при обработке крови цитратом фосфата декстрозы аденина (ЦФДА-1) кровь можно хранить и использовать до 35 дней. Благодаря этому число доноров более чем у 90 % детей можно свести к одному [2О\. Последующие работы подтвердили эффективность подобного метода у новорожденных и безопасность использования крови, хранившейся до 42 дней [27].
Неонатологи часто спорят о возможности развития гиперкалиемии и ацидоза при использовании крови, хранившейся в течение нескольких дней и недель. Уровень калия в плазме крови, хранившейся до 42 дней, может достигать 50 мг-экв/л, но истинное количество биодоступного калия при этом ничтожно мало. Например, новорожденный с массой тела 1 кг, получивший 10 мл эритроцитной массы, приобрел при этом 2 мл плазмы, если гематокрит введенной массы был равен 80 %. Количество введенного калия в ней не превышало 0,1 мг-экв/л [22]. Клинический опыт показал, что гиперкалиемия не составляет проблемы при небольших по объему трансфузиях. Британский Комитет стандартизации в гематологии и службе переливания крови опубликовал Инструкции по назначению продуктов крови: Трансфузии у младенцев и новорожденных [23], где недвусмысленно указал, что возраст крови не имеет значения при малых объемах трансфузии крови, которую можно использовать на всем протяжении ее жизни.
Высказываются также соображения по поводу низкого уровня 2,3-дифосфоглицериновой кислоты (2,3-ДФГ) в переливаемой крови, из-за чего снижается ее кислородная емкость. У взрослых 2,3-ДФГ быстро восстанавливается и Р50 перелитых эритроцитов нормализуется уже через
24 ч после трансфузии. Несмотря на отсутствие доказательств, нет никаких оснований считать, что новорожденные не в состоянии регенерировать 2,3-ДФГ в такой же степени, как и взрослые. Кроме того, Р50 более старых переливаемых эритроцитов равен нормальному Р50 крови здоровых недоношенных младенцев [24\. Таким образом, Р50 более старых эритроцитов не хуже, чем эндогенные эритроциты с высоким содержанием F-гемоглобина. Разведение приводит к еще большему снижению 2,3-ДФГ, содержащегося в малом количестве перелитого компонента крови.
Среды, используемые для сохранения эритроцитов на протяжении 42 дней, содержат повышенные количества декстрозы и аденина, поддерживающие клеточный метаболизм эритроцитов, а также маннит, предупреждающий их лизис. Неизвестны какие-либо противопоказания для введения небольших количеств крови с указанными добавками даже недоношенным детям. Некоторые службы переливания крови перед ге-мотрансфузией отмывают эритроциты для удаления примесей и затем ресуспендируют их в солевом или в альбуминовом растворе. В этом нет необходимости, если малые количества компонентов крови переливаются медленно. Не было проведено аналогичных исследований, позволивших подтвердить безопасность подобного подхода при массивных трансфузиях. Математические модели позволяют предполагать возможность токсических реакций при этом. Поэтому эритроциты, хранившиеся в специальных растворах, желательно предварительно отмывать, если планируется переливание значительных их объемов при больших вмешательствах [25].
Другим методом ограничения числа доноров является сбор крови от преданных лиц, обычно от родственников. По опыту клиники Мейо, подытожившей наблюдения за 50 оперированными детьми, благодаря этому подходу число доноров было сокращено на 57 % (на 12—93 %) [26\. Именно близкие обеспечили 48 % всей перелитой эритроцитной массы, 64 % тромбоцитной массы и 14 % свежезамороженной плазмы. Другое исследование, охватившее 73 детей, оперированных по разным поводам, также подтвердило возможность ограничиться одним донором из числа близких родственников для обеспечения ребенка кровью [27\. Из 73 отобранных доноров 79 % смогли удовлетворить все потребности в эритроцитной массе. Из 46 детей у 38 (83 %) эритроцитная масса вводилась только от одного-единственного донора.
Техника дисперсирования
Отмывание крови, предназначенной детям, сво- ;, дится к минимуму при разделении ее на многие | небольшие порции в специальные упаковки для |
Переливание крови и ее компонентов 161
детей, вмещающие 50—70 мл эритроцитной массы. Эти порции можно переливать разным новорожденным или повторно вводить одному и тому же ребенку. В некоторых учреждениях предварительно отфильтрованная кровь подвергается дисперсии в шприцах и затем вводится новорожденным [28\. В отделениях интенсивной терапии новорожденных используются механические шприцы. Приспособления для механической трансфузии обычно не требуются в операционных, где кровь вводится для замещения кровопотери при операции.
Фильтрация крови
Компоненты крови перед их введением должны быть профильтрованы. Помимо разделительных фильтров и наполнения шприцев, используемых трансфузионной службой, необходимо использовать трансфузионные наборы. Трансфузионный набор для педиатрической службы включает объемные приспособления типа бюреток для определения объема переливаемой крови. Отсутствуют документированные преимущества использования микроагрегатных фильтров 20 или 40 мкм даже при трансфузии больших объемов крови. Микроагрегатные фильтры не должны использоваться при трансфузии тромбоцитов или грану-лоцитов. Стандартные наборы для трансфузий включают фильтры 170—200 мкм.
Продолжаются дебаты по поводу показаний для применения фильтров, снижающих количество лейкоцитов, хотя хорошо известно, что лейкоциты и продукты их метаболизма — цито-кины ассоциируются с побочными реакциями у ряда реципиентов. Разработанные в настоящее время лейкоцитарные фильтры в состоянии удалить 99,99 % всех лейкоцитов, присутствующих в эритроцитной или в тромбоцитной массе. Фильтрование крови может быть проведено вскоре после ее сбора в лаборатории в процессе хранения или непосредственно перед трансфузией. Тромбоциты, собранные при аферезе, также могут быть освобождены от лейкоцитов в процессе их получения. В большинстве ситуаций препараты крови, предназначенные для использования в педиатрии, предварительно освобождаются от лейкоцитов самой службой переливания крови. Тем не менее важно, чтобы анестезиолог использовал фильтры и способы их применения, рекомендованные изготовителем. Доступны разные варианты лейкоцитарных фильтров. Некоторые из них предназначены для эритроцитной массы, другие — для тромбоцитов. Они не могут быть взаимозаменяемыми. Техника заправки и скорость потока при них также различны. Если снижение количества лейкоцитов в эритроцитной и тромбоцитной
массе считается необходимым, то это следует проводить во всех случаях переливания этих компонентов крови.
Аппараты для переливания крови
При инфузии компонентов крови иногда применяют электромеханические насосы. Шприцы, насосы перистальтического типа и поршни изучались в качестве вспомогательных приспособлений при введении эритроцитной массы (ЭрМ) и тромбоцитов [29]. Большинство насосов вполне пригодны для этой цели, но некоторые из них усиливают гемолиз концентрированной ЭрМ. Перед использованием любого из насосов необходимо тщательно изучить инструкцию по его применению.
Подогревание крови можно проводить до или во время инфузии. Наиболее распространены методы подогревания в системе для переливания, основанные на использовании водяной бани или электрических согревающих пластин, контактирующих с системой для переливания. Производятся также системы быстрого подогревания крови, основанные на противотоке циркулирующей нагретой воды. Многие нагреватели крови не приспособлены для использования у новорожденных и детей младшего возраста, поскольку рассчитаны на большие объемы. Нетерпеливые детские анестезиологи применяют самые разнообразные способы подогревания небольших объемов крови перед ее трансфузией. Это согревание под краном или в тазике е теплой водой, помещение шприца, заполненного кровью, в перчатку, а затем в согревающую среду или между двумя приспособлениями для согревания систем переливания ("сандвич"). Все эти способы недопустимы, так как в лучшем случае они не срабатывают, а в худшем — вызывают гемолиз. Согре-ватели крови должны быть снабжены хорошо просматриваемым термометром, приспособлениями, предупреждающими перегрев, и сигнальными звуковыми системами.
Различные компоненты крови, собранные от специально отобранных доноров и подвергшиеся после этого особой обработке, могут быть предназначены для детей со специфическими потребностями в отношении трансфузии. Политика службы переливания крови варьируется в отношении показаний к использованию подобных компонентов. Некоторые применяются в корот-
162 Анестезия в педиатрии
кие сроки, другие требуют дополнительного времени и оборудования для их использования. Будучи приготовленными, компоненты могут иметь ограниченный срок годности. В большинстве госпиталей подобные компоненты обычно отсутствуют, если не возникает специальных показаний к их применению. Консультация между лечащим врачом и членом бригады переливания крови бывает необходимой в случаях нестандартных ситуаций с пациентами, отклоняющимися от стандартных критериев.
Компоненты со сниженным риском переноса цитомегаловируснои инфекции
Пациенты, никогда ранее не контактировавшие с цитомегаловирусом (ЦМВ), могут заразиться при переливании им крови от донора, инфицированного этим вирусом. Кроме того, клинически выраженное заболевание может проявиться в результате реактивации латентной инфекции или же из-за реинфекции другим штаммом вируса. Инфекция у человека с хорошим иммунным статусом обычно не вызывает заболевания, но у пациентов с иммунодефицитом, особенно у детей, она приводит к тяжелым, нередко смертельным заболеваниям, которые проявляются пневмониями, гепатитом, менингоэнцефалитом, гастроэнтеритом, ретинитом, миокардитом. У таких больных развиваются лейкопения, тромбоцитопения и анемия. Внутриутробная инфекция способна привести к гибели плода, к тяжелой желтухе новорожденных, гепатоспленомегалии, микроцефалии, нейросенсорной глухоте и к тромбоцитопе-нии. Неврологические отклонения отмечаются и у внешне здоровых инфицированных новорожденных. Наиболее тяжелые поражения развиваются у младенцев с низкой массой тела при рождении.
Стратегия предупреждения переноса ЦМВ у больных, подверженных риску этой инфекции, предусматривает использование крови от ЦМВ-отрицательных доноров, а также обеднение лейкоцитами ЭрМ и тромбоцитной массы. Основное возражение против использования ЦМВ-отрицательной крови состоит в частоте обнаружения антител к этому вирусу в крови здоровых доноров, которая варьируется от 40 до 100 % в зависимости от географической локализации. По неясной пока причине не более 10 % серопози-тивных доноров являются переносчиками этой инфекции. Компоненты крови, обедненные лейкоцитами, в настоящее время признаются приемлемой альтернативой для замены ЦМВ-отрицательной крови [30\.
Современные инструкции по профилактике ЦМВ-инфекции рекомендуют ее проведение у недоношенных с массой тела до 1200 г, родив-
шихся от серонегативных к этому вирусу матерей. К этой же категории относятся реципиенты после пересадки аллогенного костного мозга и паренхиматозных органов от серонегативных доноров, пациенты с отрицательными реакциями на ЦМВ, страдающие злокачественными гематологическими заболеваниями и являющиеся кандидатами на пересадку костного мозга, больные, планируемые на трансплантацию органов, а также ЦМВ-серонегативные лица, инфицированные ВИЧ [ЗО\. Соответствующую профилактику рею> мендовано также проводить ЦМВ-отрицатель-ным больным, получающим иммуносупрессив-ную терапию, страдающих лимфогранулематозом, и лицам с врожденным или приобретенным иммунодефицитом.
Компоненты крови, обедненные лейкоцитами
Клеточные компоненты крови содержат различные количества "просочившихся" лейкоцитов, способных провоцировать лихорадочные реакции, HLA-аллоиммунизацию, приводящую к рефрактерности по отношению к переливанию тромбоцитов, ОПЛСТ БТПХАТ, а также к переносу инфекционных заболеваний (например, ЦМВ). Редукция числа лейкоцитов не является общепризнанным способом предупреждения ОПЛСТ или БТПХАТ, но служит вполне приемлемой альтернативой ЦМВ-отрицательной крови при профилактике ЦМВ-инфекции [30\.
Предупреждение повторных ЛНГТР при многократных трансфузиях служит обычным показанием для лейкоцитарной редукции. Назначение обедненной лейкоцитами ЭрМ действительно устраняет эти реакции, но менее эффективно в предотвращении ЛНГТР, ассоциирующихся с переливанием тромбоцитов. Эти различия обусловлены в первую очередь хранением этих компонентов при разной температуре. Лейкоциты, содержащиеся в тромбоцитной массе, которая сохраняется при комнатной температуре, выделяют цитокины, в основном определяющие возникновение ЛНГТР. Предварительное удаление лейкоцитов, еще до начала хранения тромбоцитной массы, значительно снижает частоту этой побочной реакции. Цитокины не накапливаются в ЭрМ, хранящейся при низкой температуре, которая ингибирует функцию и жизнеспособность лейкоцитов.
Аллоиммунизация приводит к рефрактерности по отношению к тромбоцитам, т. е. не происходит ожидаемого возрастания количества тромбоцитов у реципиента. Исследования, проведенные с целью оценить эффективность редукции числа лейкоцитов в профилактике аллоиммунизации пациентов, нуждающихся в повторных перелива-
ниях тромбоцитов, дали противоречивые результаты [31], Тем не менее многие учреждения переливают больным со злокачественными гематологическими заболеваниями только обедненные лейкоцитами ЭрМ и тромбоцитную массу.
Некоторые страны Европы во всех случаях переливают только обедненные лейкоцитами компоненты крови с целью уменьшить теоретический риск развития болезни Крейтцфельда— Якоба. То же самое, очевидно, предстоит применить и в США.
Облученная кровь
Облучение компонентов крови проводится с целью профилактики БТПХАТ у восприимчивых пациентов. Патофизиология этой реакции включает внедрение донорских лимфоцитов в организм чувствительного хозяина, их мультипликацию и усиление иммунных реакций против реципиента. Чаще всего облучение выполняется в центрах крови или в учреждениях службы переливания крови с использованием коммерческих облучателей, предназначенных именно для данной цели. Учреждения, не имеющие доступа к облучателям крови, могут осуществить эту процедуру в отделениях рентгенотерапии. В последнем случае можно столкнуться с запаздыванием в получении облученных компонентов крови.
Цельная кровь, ЭрМ, тромбоциты, гранулоци-ты и свежая плазма должны подвергаться облучению. Эта обработка не обязательна в отношении свежезамороженной плазмы и криопреципитата. Применение облученной крови рекомендовано при внутриутробном и неонатальном обменном переливании, а также во время экстракорпоральной мембранной оксигенации (ЭКМО). Облученную кровь должны получать, кроме того, следующие категории пациентов: реципиенты после трансплантации костного мозга или паренхиматозных органов, больные лимфогранулематозом, врожденным клеточным иммунодефицитом, реципиенты после прямого переливания крови от близких родственников или от доноров с HLA. Относительные показания имеются у новорожденных с низкой массой тела при рождении, у получающих иммуносупрессивную терапию, в том числе у онкологических больных, у больных СПИДом с развившейся оппортунистической инфекцией [32].
Анестезиолог должен быть хорошо знаком с рекомендациями по облучению всех компонентов крови по ряду причин. Во-первых, детям важно переливать облученную кровь при прямых показаниях к этому. Во-вторых, необходимость облучения запрошенного материала в радиологических центрах может задержать поступление его в операционную. Наконец, кровь не должна об-
Переливание крови и ее компонентов 163
лучаться, если предполагается возможность отсрочки в гемотрансфузии. Лимфоциты являются пусковыми клетками в радиационном процессе, но действие облучения на них не вполне понятно. Срок жизни облученных эритроцитов снижается до 28 дней. В связи с этим редуцируется 24-часовой период восстановления и возрастает уровень калия в крови и гемоглобина плазмы. Биохимические изменения на протяжении 28 дней жизни таких эритроцитов в большинстве случаев незначительны, однако они могут представлять опасность у новорожденных и пациентов, чувствительных к гиперкалиемии.
По первому впечатлению переливание цельной крови может показаться наиболее привлекательным, но в действительности оно связано с весьма серьезными проблемами. Очень небольшое число контролируемых исследований было посвящено критической оценке использования свежей крови. Кроме того, само понятие "свежести" остается неопределенным, что затрудняет сопоставление немногих проделанных изысканий. Некоторые авторы считали кровь "свежей" лишь в течение первых 6 ч после ее взятия у донора, а многие другие причисляли к "свежей" также кровь, полученную в течение 48 ч. Неонатологи традиционно считали свежей кровь, полученную не более 7 дней тому назад.
Так называемая "цельная" кровь не изменяет своего состава при получении ее от донора, но ее собирают в пластиковые пакеты, содержащие антикоагулянты, и хранят при температуре от 1 до 6 °С. Метаболические изменения начинаются почти сразу же после взятия крови и продолжаются на протяжении всего периода ее хранения. Наиболее выражены ранние изменения функции тромбоцитов. Тромбоцитную массу обычно сохраняют при комнатной температуре, поскольку охлаждение до 1—6 °С уже через несколько часов нарушает ее гемостатическую способность. Поэтому охлажденная кровь, морфологически оставаясь интактной, в функциональном отношении не может считаться "цельной".
Величина кровопотери после операции на открытом сердце была изучена у 161 ребенка и сопоставлена в зависимости от сроков хранения перелитой им крови [33]. Детям переливали либо цельную кровь, хранившуюся при комнатной температуре не дольше 6 ч, охлажденную кровь, взятую от 24 до 48 ч до операции, или кровь, реконструированную от ЭрМ, давностью не более 5 дней, тромбоцитов и СЗП. Величина кровопотери в выделенных группах была одинаковой. Время хранения перелитой крови не оказывало
164 Анестезия в педиатрии
влияния на величину кровопотери у детей в возрасте старше 2 лет после операций незначительной или умеренной сложности. Однако величина кровопотери оказалась достоверно ниже у детей в возрасте до 2 лет после тяжелых операций, если им переливали свежую цельную, а не реконструированную кровь. Почти такие же небольшие показатели кровопотери, как и при использовании крови, взятой менее 6 ч до операции, отмечены после переливания крови, хранившейся от 24 до 48 ч. По мнению авторов, более благоприятные результаты при переливании свежей цельной крови в значительной степени объяснялись сохранением функции тромбоцитов. Однако это объяснение представляется неполным, поскольку кровь 24—48-часового хранения существенно охлаждалась. Кроме того, преимущество проявлялось только у группы из 70 детей в возрасте до 2 лет, подвергавшихся тяжелым операциям. Необходимы дальнейшие исследования для выяснения вопроса, почему "свежая цельная" кровь улучшает гемостаз и у каких пациентов может проявиться это преимущество.
Цельная кровь может быть весьма полезной у некоторых групп детей, однако тысячи операций на сердце, выполняемых ежегодно без использования свежей крови, не сопровождаются признаками коагулопатии. Назначение свежей крови во всех случаях или хотя бы детям было бы технически невозможным как в отношении ее сбора, так и затрат времени на ее тестирование.
Педиатры и анестезиологи настроены против переливания ЭрМ скорее в-силу предубеждения, а не на основании опыта. Это неверно. Неонатоло-ги обычно стараются удерживать величины гема-токрита при тяжелом респираторном дистресс-синдроме или при симптоматической кардиаль-ной патологии у новорожденных на уровне выше 13 г/100 мл [23,24\, хотя научные обоснования подобной практики весьма слабы. Столь же сомнительны показания для трансфузии ЭрМ при лечении тахипноэ, диспноэ, апноэ, нарушениях питания или при замедленном наборе массы тела [35\.
Последние инструкции, посвященные специально трансфузиям у новорожденных [23], подобно аналогичным документам в отношении пациентов более старших возрастов [36,37\, подчеркивают важность учета общего состояния больного, а не только уровня гемоглобина. Тем не менее именно этот показатель остается первостепенным критерием при решении вопроса о гемо-трансфузии ЭрМ. Помимо абсолютной концентрации гемоглобина, необходимо учитывать его
возрастные колебания, степень оксигенации тканей, компенсаторные механизмы, активирующиеся в ответ на острую или хроническую анемию, а также возможные физиологические реакции на переливание ЭрМ.
Физиологическая анемия
Уровень гемоглобина снижается в течение первых недель жизни. У доношенного ребенка низший уровень (около 11 г/100 мл) достигается в период 8—12 нед жизни. Скорость и степень падения уровня гемоглобина находятся в обратной зависимости от гестационного возраста. У недоношенных это падение происходит быстрее и глубже. Так, у родившихся с массой тела менее 1 кг уже на 6—8 нед уровень гемоглобина падает до 7 г/100 мл.
Причины так называемой физиологической анемии у младенцев многочисленны. Наиболее важным фактором из них является ослабление эритропоэза. Вскоре после рождения он почти останавливается. Имеет значение также и фактор разведения из-за увеличения объема плазмы. Кроме того, сроки жизни эритроцитов у новорожденных короче, чем у детей более старшего возраста. Все эти факторы наиболее сильно выражены у недоношенных младенцев, возможно, в силу ослабленной продукции эритропоэтина на фоне анемии.
Трансфузия эритроцитов больным в критическом состоянии
По имеющимся сведениям, ежегодно в США примерно 38 000 недоношенных младенцев с массой тела при рождении менее 1500 г получают более 300 000 трансфузий ЭрМ [24,38]. При этом взятие крови для лабораторных исследований достигает примерно 90 % от всех случаев переливания крови недоношенным младенцам в отделениях интенсивной терапии.
Практика трансфузий существенно варьируется в различных учреждениях. Это подтвердили предварительные результаты анализа частоты трансфузий младенцам, родившимся с массой тела менее 1500 г в шести лечебных учреждениях [39]. Хотя число трансфузий и объемы переливаемой крови значительно отличались, характер клинической патологии (частота внутрижелудоч-ковых кровоизлияний, некротического энтероколита, бронхопульмональной дисплазии, рост и продолжительность госпитализации младенцев) оказался одинаковым. Авторы обсуждают вопрос о том, что флеботомия и введение центральных катетеров позволяют снизить число трансфузий, частоту осложнений и уменьшить затраты. Действительно, подобная методика, адаптированная


 в
отношении недоношенных младенцев с
массой тела
при рождении менее 1250 г и гестационным
возрастом
менее 32 нед, сокращала число трансфузий
в расчете на одного ребенка за первые
2
нед жизни с 4,7 до 2,7 [40\.
в
отношении недоношенных младенцев с
массой тела
при рождении менее 1250 г и гестационным
возрастом
менее 32 нед, сокращала число трансфузий
в расчете на одного ребенка за первые
2
нед жизни с 4,7 до 2,7 [40\.
Многие клиницисты ставили вопрос об уровне гемоглобина, оптимальном для переливания у недоношенных в критическом состоянии, но лишь некоторые из них изучали эту проблему. Одна группа исследователей оценивала эффект профилактической трансфузии небольших объемов ЭрМ у 56 недоношенных младенцев по сравнению с контрольной группой младенцев, отобранной методом рандомизации. В основной группе поддерживали уровень гемоглобина выше 10 г/100 мл, а в контрольной ЭрМ вводили только при симптомах анемии [41]. Статистические различия отмечены только в уровне гемоглобина к моменту выписки (9,1 ± 1,6 и 11,7 ± 1,7 г/100 мл соответственно), но продолжительность госпитализации и степень тяжести остальных клинических проблем оставались одинаковыми в обеих группах.
Влияние анемии и трансфузии ЭрМ на недоношенных младенцев было оценено с помощью эхокардиографии по Допплеру [42]. Показатели функции миокарда, метаболизм и динамика нарастания массы тела оставались нормальными до и после трансфузии у младенцев со средними показателями гемоглобина от 7,5 ± 0,4 до 15 ± 1,6 г/100 мл. По заключению исследователей, кар-диопульмональные осложнения не возникают у недоношенных младенцев при уровне гемоглобина выше 6,5 г/100 мл. Тем не менее они предостерегают от экстраполяции данного вывода на все случаи анемии у недоношенных. Аналогичные исследования были проведены у недоношенных младенцев с анемией (уровень гемоглобина 6,5—8,8 г/100 мл), страдавших бронхолегочной дисплазией и нуждавшихся в оксигенации, но без механической вентиляции [43\. Трансфузия ЭрМ повысила уровень гемоглобина в среднем до 12,5 ±1,6 г/100 мл и снизила величину сердечного выброса, но потребление кислорода осталось прежним. Авторы пришли к выводу, что младенцы с бронхолегочной дисплазией хорошо переносят снижение гемоглобина до 7 г/100 мл, и высказали сомнение в необходимости поддерживать этот показатель на уровне выше 10 г/100 мл с помощью трансфузий.
Ряд исследований был посвящен влиянию трансфузии ЭрМ на детей старшего возраста и взрослых, находящихся в критическом состоянии. Исследование одной из групп детей выполнено в период после реанимации по поводу септического шока в период относительной гемоди-намической стабильности [44]. Средний уровень гемоглобина до трансфузии ЭрМ в количестве
Переливание крови и ее компонентов 165
8—10 мл/кг был 10,2 ± 0,8 г/100 мл, а после переливания достигал 13,2 ± 1,4 г/100 мл. Обеспечение кислородом возрастало, но его потребление оставалось прежним. Показатель экстракции кислорода снизился с 28 до 22 %. Одна единица ЭрМ, перелитая взрослым больным, находящимся в тяжелом состоянии после операции, повышала уровень гемоглобина в среднем с 9,4 до 10,4 г/100 мл. Это сопровождалось улучшением в обеспеченности кислородом, но не повышением его потребления, а показатель его экстракции снижался с 31 до 28 %.
Недавно опубликованы результаты обширных контрольных и рандомизированных исследований, выполненных во многих лечебных центрах и посвященных потребности тяжелых больных в гемотрансфузиях [45]. Все наблюдавшиеся 838 пациентов со средним уровнем гемоглобина ниже 9 г/100 мл на протяжении 72 ч лечения в отделении интенсивной терапии были распределены на две группы в зависимости от часто проводимых гемотрансфузий и очень ограниченного их применения. В последней из этих групп переливание проводили лишь при падении уровня гемоглобина ниже 7 г/100 мл и поднимали его не выше 9 г/100 мл. В первой же группе ЭрМ вводили при падении гемоглобина ниже 10 г/100 мл и поддерживали его на уровне 10—12 г/100 мл. Обобщенные показатели смертности в течение 30 дней наблюдения были одинаковыми в обеих группах, но оказались достоверно ниже среди менее тяжелых больных в группе с ограничениями гемотрансфузий. Точно так же и смертность за весь период госпитализации была ниже в группе больных с редкими переливаниями крови. Согласно выводам авторов, ограничение числа переливаний у больных в критическом состоянии так же, а возможно, и более эффективно, чем расширение числа трансфузий.
Альтернативы трансфузии эритроцитов
Удерживание гемоглобина у больных на сниженном уровне является наиболее простым способом избежать гемотрансфузий. Другая возможность состоит в назначении рекомбинантного человеческого эритропоэтина (РЧЭП). Препарат широко назначался взрослым больным анемией самой различной этиологии, а также хирургическим больным перед и после операции. Ряд исследований продемонстрировал улучшение эритропоэза у недоношенных при назначении им РЧЭП и железа. В отношении детей опыт весьма ограничен. Умеренная клиническая эффективность РЧЭП и снижение потребности в трансфузиях ЭрМ подтверждены статистически. Исследование, проведенное во многих лечебных центрах Европы и охватившее 240 младенцев, родивших-
166 Анестезия в педиатрии
ся с низкой массой тела, подтвердило, что подкожное введение РЧЭП 3 раза в неделю в период с 3-го до 42-го дня жизни снижает потребность в трансфузиях в среднем с 1,25 до 0,87 [4<5]. Аналогичное исследование с назначением либо РЧЭП, либо плацебо более чем 150 недоношенным младенцам с низкой массой тела было проведено и в США [38]. Результаты наблюдений на протяжении 6 нед подтвердили выводы, сделанные в Европе. Среднее число переливаний ЭрМ в группе детей, получавших РЧЭП было 1,1, а у получавших плацебо — 1,6. Согласно выводам, сделанным авторами, применение РЧЭП является дополнительным методом их лечения, поскольку снижает потребность в трансфузиях у недоношенных младенцев с малой массой тела и устраняет необходимость в венесекции.
Физиологические реакции на кровопотерю
Информация о физиологических сдвигах при острой и хронической анемии у детей весьма скудная. Однако известно, что новорожденные в меньшей степени, чем более старшие дети и взрослые, способны компенсировать анемию из-за высокого сердечного выброса и потребления кислорода в состоянии покоя. Исследования на животных обнаружили возрастную зависимость в характере реакций на гипоксию. Однако осталось неизвестным, почему молодые особи хуже, чем взрослые, компенсируют эти нарушения.
Физиологические реакции на острую анемию зависят от скорости потери эритроцитов, от степени анемии, способностей пациента к компенсации и от потребностей тканей в кислороде. Компенсаторные механизмы, активируемые при острой кровопотере, включают стимуляцию ад-ренергической нервной системы, высвобождение сосудисто-активных гормонов, гипервентиляцию, резорбцию жидкости из интерстиция в просвет сосудов, перемещение жидкости из клеток во внеклеточное пространство, а также задержку почками выделения воды и электролитов. Если кровопотеря не выходит за пределы компенсаторных способностей пациента, все перечисленные механизмы восстанавливают или приближают к норме показатели сердечного выброса в течение нескольких минут. Перемещение жидкости из интерстиция в просвет сосудов способно компенсировать более 50 % внутрисосудистого объема [47]. Более медленным, но не менее важным является процесс перемещения жидкости из клеток в межклеточное пространство.
Гиповолемия является более важным компонентом острой кровопотери, чем снижение кислородной емкости крови. Поэтому назначение
кровезамещающих жидкостей является методом первоочередной терапии. Переливаемые растворы наряду с жидкостью, мобилизованной из внеклеточного пространства, могут вызвать значительную гемодилюцию. Клиницист должен учитывать общее физическое состояние ребенка и вероятную дополнительную кровопотерю и на основании всей этой оценки решить вопрос о степени анемии, которую пациент способен перенести без серьезных нарушений оксигенации тканей. Подобное решение бывает нелегким.
Исследования на животных и богатый клинический опыт позволяют считать вполне безопасным уровень гемоглобина, равный 10 г/100 мл. Значительное увеличение смертности отмечается при падении гемоглобина до 3 г/100 мл и ниже. Экстраполяция результатов изучения острой нор-моволемической гемодилюции позволяет считать допустимым и даже безопасным для большинства пациентов уровень гемоглобина от 6 до 7 г/100 мл [48\. Ограниченный опыт в отношении крайней гемодилюции у подростков позволяет считать относительно безопасным падение гемоглобина до 5 г/100 мл при условии тщательного мониторинга и отсутствия другой системной патологии [49\. Очень небольшое по объему исследование с использованием инвазивного мониторинга у здоровых детей и подростков, подвергавшихся операциям на позвоночнике и гемодилюции до уровня гемоглобина 3 ± 0,8 г/100 мл, показало, что общее потребление кислорода может поддерживаться на таком уровне на протяжении всего времени операции [50\. Авторы оговаривают, что им осталось неизвестным влияние подобной гемодилюции на обеспечение кислородом отдельных органов и на их функцию. Неблагоприятных последствий у детей не наблюдалось, тем не менее авторы не уверены, что очень низкий гемоглобин можно принять в качестве поро* га при трансфузиях.
Определение объема трансфузии
Помимо расчета дозировок медикаментов для анестезиологического обеспечения операции у детей, необходимы также калькуляция предполагаемого объема крови (ПОК) и допустимой кровопотери (ДКП). Величина ПОК у недоношенных равна 90—100 мл/кг, а у родившихся в срок — 80—90 мл/кг. У детей в возрасте до 1 года ПОК составляет 75—80 мл/кг. У детей более старшего возраста этот показатель варьируется от 70 до 75 мл/кг. Для калькуляции ДКП учитывают массу тела ребенка, исходные показатели гематокри-та (Гти), вычисленную величину массы эритроцитов (ВЭрМ) и минимально допустимое падение гематокрита при операции (Гто). Например, для ребенка с массой тела 20 кг при исходном уровне
Переливание крови и ее компонентов 167
гематокрита (Гти) 40 % и Нто 25 % безопасным уровнем ДКП будет:
ПОК — 20 кг х 70 мл/кг = 1400 мл ВЭрМ« - 1400 мл х 0,40 = 560 мл ВЭрМ25 — 1400 мл х 0,25 = 350 мл
ДПЭрМ (допустимая потеря эритроцитной массы) — 560—350 мл = 210 мл.
Если принять средние величины Гт за 30 %, то ДКП составит примерно 660 мл. Подобные же величины ДКП определяют на основании Гти, Гт0 и среднего значения этих величин (Гтср):
ДКП
= ПОК х (Гти
~ Гто)
Гт,
1ср
25)
=
я
650
ДКП = 1400 х
Подсчет кровопотери крайне важен, но весьма неточен. Емкости, используемые для сбора отсасываемой крови, подбирают объемом 50—250 мл в зависимости от размеров ребенка. Величина мертвого пространства в трубках на пути от операционного поля до этой емкости должна быть минимальной. Взвешивание салфеток, не смоченных раствором солей, следует проводить с большой точностью. Взвешивание смоченных растворами салфеток не имеет смысла. Как правило, салфетка размером 4x4 дюйма впитывает 10—15 мл крови. Лапаротомический тампон может удерживать 100—150 мл крови.
Повышение Гт при трансфузии ЭрМ рассчитывается в мл/кг переливаемой крови. Так, используя приведенный выше пример, если ребенку с массой тела 20 кг и Гт 20 % перельют 100 мл ЭрМ, то это повысит его Гт до 25 %. Однако в связи с потенциальным риском гемотрансфузии для ребенка часто бывает предпочтительным вводить несколько большие, чем рассчитанные, количества крови, чтобы предусмотреть компенсацию дополнительной кровопотери при операции, при флеботомии и при проведении лабораторных тестов. У детей более старшего возраста может быть рациональным введение полной единицы крови, если нет опасности перегрузки жидкостью.
Имеющаяся информация о времени трансфузии должна быть документирована в наркозной карте. При этом указываются как минимум измеренная кровопотеря и клинические показатели. Большинство операционных оборудованы приборами для определения уровней гемоглобина и гематокрита, что позволяет получить ответы быстрее, чем из отдаленной лаборатории. Должны фиксироваться все получаемые сведения. Показания для трансфузии компонентов крови должны документироваться точно так же, как и пока-
зания к назначению фармакологических препаратов типа антиаритмических средств. Кровь иногда переливают и в тех случаях, когда при ретроспективной оценке выясняется, что состояние ребенка оставалось бы хорошим и без трансфузии. Величина предстоящей кровопотери может оказаться завышенной, а гемостаз может быть проведен быстрее, чем предполагалось. Подобные ситуации неизбежны точно так же, как и недооценка произошедшей кровопотери в некоторых случаях.
Тщательная документация поступающей информации является лучшей возможностью осмысливания процессов, определяющих необходимость трансфузии.
Отсутствие показаний для переливания эритроцитной массы
Неонатологи и анестезиологи отнюдь не единственные виновники необоснованного переливания ЭрМ. К их числу относятся также и хирурги. Заживление раны, "хорошее самочувствие", благоприятное течение послеоперационного периода приводят в качестве оправдания трансфузии ЭрМ.
Исследования на животных, подтвержденные послеоперационными наблюдениями у взрослых людей, показали, что нормоволемическая анемия не оказывает отрицательного влияния на процесс заживления раны. Отложение коллагена в краях операционного разреза прямо пропорционально напряжению кислорода и перфузии. Коэффициент экстракции кислорода заживающими тканями равен примерно 3 %, а поступление кислорода уже только с плазмой начинает удовлетворять эту потребность при РаО2 около 300 мм рт.ст. Критический уровень Гт, при котором анемия препятствует заживлению ран у физиологически нормальных пациентов, равен примерно 15 %
[51].
Исследования переносимости сердечной нагрузки и продолжительности госпитализации, проведенные у взрослых больных после операций на сердце [52\ и у ортопедических больных [53], не смогли подтвердить каких-либо преимуществ у пациентов, подвергнутых гемотрансфузии, по сравнению с не получившими ее. Тем не менее, если подобные преимущества отсутствуют у пожилых больных с поражениями сердечно-сосудистой и других систем, то это еще не означает, что переливание ЭрМ после операции здоровым в остальных отношениях детям не окажет благоприятного действия.
Анестезиолог не ошибется, если в своем стремлении избежать возможных посттрансфузи-онных осложнений предпочтет не столь необходимый риск поставить ребенка в условия неадек-
168 Анестезия в педиатрии
ватного обеспечения кислородом. Не стоит забывать постановление Американской коллегии врачей [54\ о непоказанности трансфузий в условиях отсутствия соответствующих опасностей, даже вне зависимости от уровня гемоглобина у ребенка во время наркоза. Жизненно важные показатели являются одними из параметров для принятия решений, но наряду с ними необходимо учитывать вызываемые наркозом и операцией стрессовые реакции, а также действие фармакологических средств, существенно изменяющих нормальные физиологические реакции на острую кровопотерю. Кроме того, не последнюю роль играет оптимальное анестезиологическое обеспечение, служащее основой лечебных мероприятий по предупреждению физиологической декомпенсации. Невозможно точно предвидеть развитие острого кровотечения во время операции, падения сердечного выброса или же аномалий вентиляции, способных нарушить обеспечение кислородом. Поэтому существуют определенные границы безопасности. Рекомендации, приведенные в Инструкциях по практике лечения компонентами крови Американского общества анестезиологов [36\, хотя и не адресованы специально для педиатров, но могут служить полезным ориентиром. Согласно им, трансфузии редко показаны при концентрации гемоглобина выше 10 г/100 мл и почти всегда необходимы, если она ниже 6 г/ 100 мл, особенно в случаях острого развития анемии.
Кровотечение прекращается благодаря серии взаимосвязанных процессов, в том числе задей-ствующих сосуды, тромбоциты и систему коагуляции. Фибринолиз, или рассасывание фибрино-вого сгустка, также инициируется с самого начала коагуляции. Баланс этих двух систем и определяет тот порядок, при котором нарушение целости сосуда приводит к формированию сгустка, а его растворение через некоторый период времени восстанавливает кровоток в закупоренном сосуде.
Первая фаза гемостаза заключается в спазме сосуда вслед за его повреждением, прилипанием тромбоцитов к участкам пострадавшего эндотелия и формирования из них своеобразной пробки. На второй фазе гемостаза включаются коагу-ляционные протеины. Последовательность событий, ведущих к образованию тромбина и формированию фибринового сгустка, включает каскад биохимических процессов двоякого характера (внутреннего и внешнего), объединяющихся затем" в едином (общем) пути. Подобная схема помогает понять формирование сгустка in vitro и в
лабораторном тестировании, но в жизни процессы свертывания представляются гораздо более сложными.
Сосудистый компонент гемостаза
Сосуды представляют собой не только инертный проводник кровяного потока. Спазм сосудов и отклонение потока крови от поврежденного сосуда являются немедленной реакцией на повреждение. Одновременно с этим протекают и многие иные физико-химические реакции. Разрушение ^-эндотелия обнажает коллаген и базальные мембраны сосудов^ "что активирует тромбоциты и факторы свертывания в плазме, вызывающие прилипание тромбоцитов и формирование тромба. Внешний путь коагуляции также активируется при высвобождении тромбопластина. Адено-зиндифосфат (АДФ), высвобождаемый эндотелием, вызывает агрегацию тромбоцитов. Эта сосудистая стадия гемостаза длится около минуты. Одновременно инициируются и процессы фиб-ринолиза благодаря высвобождению активаторов тканевого плазминогена из сосудистой стенки.
Роль тромбоцитов в гемостазе
Тромбоциты являются сложным морфологическим и функциональным образованием. Их мембрана представляет собой субстрат, взаимодействующий с протеинами плазмы, участвующими в процессе коагуляции. Она также запрограммирована в механизмах, определяющих адгезию и агрегацию тромбоцитов. Стимулирование тромбоцитов приводит к сокращению микротубулярных структур их клеточного скелета, к изменению их внутренней структуры и формированию периферических псевдоподий. Внутренние структуры обеспечивают активацию метаболизма тромбоцитов. Большинство органелл внутренней зоны тромбоцитов представляет собой плотные тельца и альфа-гранулы. Содержимое этих гранул высвобождается в процессе действия тромбоцитов. Тубулярная система, также относящаяся к орга-неллам, служит местом синтеза простагландина и выделения кальция.
Тромбоциты выполняют несколько различных функций в ответ на повреждение сосуда. Они обеспечивают первичный контроль кровотечения путем формирования тромбоцитарного сгустка. Этапами подобного формирования являются прилипание, агрегация и высвобождение активных веществ. Прилипание предусматривает взаимодействие поверхностных гликопротеинов тромбоцита с субэндотелиальной соединительной тканью и зависит от присутствия фактора Виллебранда (VIII: ФВ). Точная последовательность этих реакций остается неясной. Однако
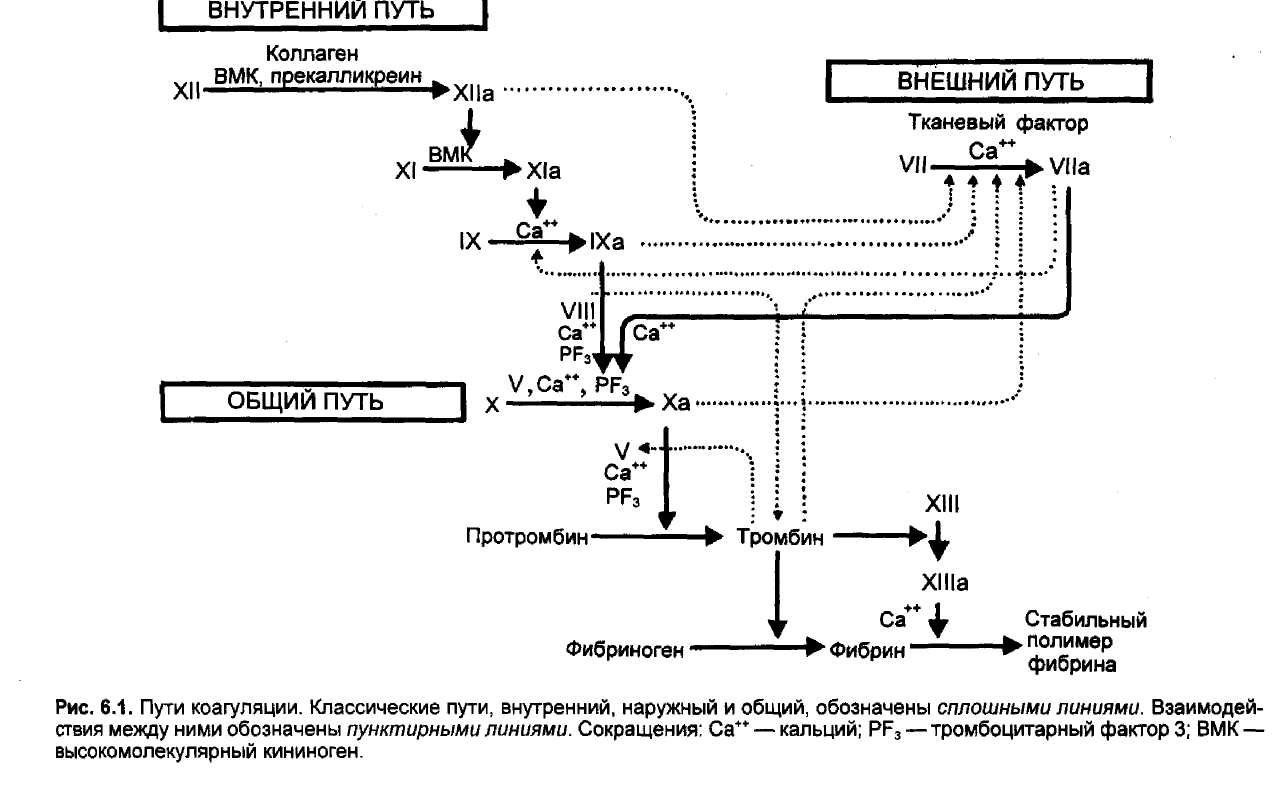
тромбоциты изменяют свою форму, высвобождают содержимое гранул и взаимодействуют между собой, образуя агрегаты.
Агрегация тромбоцитов усиливается под воздействием ряда субстанций, высвобождаемых как самими тромбоцитами, так и сосудистым эндотелием. Мощный стимулятор агрегации АДФ выделяется обеими этими структурами. Связывание АДФ с мембраной тромбоцитов является пусковым механизмом серии реакций, ведущих к образованию тромбоксана А2. Это соединение, помимо стимулирования агрегации тромбоцитов, способствует высвобождению ими активных веществ и вазоконстрикции. Агрегация тромбоцитов усиливается также под влиянием тромбина, генерируемого системой свертывания.
Финальная стадия формирования тромбоци-тарного сгустка заключается в высвобождении или экструзии субстанций, хранящихся в гранулах тромбоцитов. Подобные активированные тромбоциты изменяют свое окружение, создавая так называемое место встречи для формирования фибрина. Конверсия фибриногена в фибрин, проходящая с участием тромбина, приводит к формированию стабильного гемостатического сгустка из активированных склеившихся тромбоцитов, вкрапленных в пряди фибрина.
Переливание крови и ее компонентов 169
Коагуляционная фаза гемостаза
Вторая фаза гемостаза осуществляется факторами коагуляции, обычно присутствующими в крови в неактивной форме. Все они, возможно, за исключением фактора VIII, синтезируются в печени. Номенклатура, используемая для обозначения этих факторов, весьма путаная, поскольку номера им давали в порядке их открытия, а не места в коагуляционном каскаде. Активированные факторы обозначаются буквой "а" после римского номера, присвоенного данному фактору. Факторы коагуляции разделяют на субстраты, кофакторы и энзимы в зависимости от их гемо-статической функции. Фибриноген относят к субстратам, поскольку целью процессов коагуляции является конверсия фибриногена в фибрин. Факторы III, V, VIII и фактор Фитцжеральда, или высокомолекулярный кининоген (ВМК), являются кофакторами. Их роль заключается в ускорении энзиматических реакций коагуляции. Остальные факторы относятся к энзимам.
Коагуляция включает в себя серии взаимосвязанных биохимических реакций, которые разделяют на три пути или категории: внешние, внутренние и общие (рис. 6.1). Каскадная теория ради удобства очень примитивизирует и сводит к
170 Анестезия в педиатрии
 минимуму
многокомпонентность реакций при
каждом
из путей коагуляции.
минимуму
многокомпонентность реакций при
каждом
из путей коагуляции.
Внешний путь коагуляции инициируется при проникновении тканевого тромбопластина (фактор III) в сосудистую систему. Термин "внешний" (extrinsic) используется в связи с тем, что процессы, инициируемые данными субстанциями, в нормальных условиях не имеют места. Фактор
VII активируется в Vila в присутствии тканевого тромбопластина и кальция. Фактор Vila в свою очередь активирует фактор X в Ха. При этом весьма быстром процессе продуцируется неболь шое количество тромбина, способствующего конверсии фибриногена в фибрин. Тромбин, ге нерируемый при внешнем пути, может ускорять внутренний путь, стимулируя активность факто ра V и VIII. Величину протромбинового времени (ПВ) используют при мониторинге внешнего пу ти коагуляции.
Внутренний (intrinsic) путь получил свое наименование потому, что все участвующие в нем факторы являются нормальными компонентами крови. Фактор XII активируется в ХНа при контакте с субэндотелиальным коллагеном. Фактор ХИа в свою очередь активирует фактор XI в Х1а. Эти реакции усиливаются ВМК и фактором Флетчера (прекалликреин). В присутствии кальция фактор Х1а активирует фактор IX в 1Ха. Для последующей активации необходим не только кальций, но и взаимодействие с мембранами тромбоцитов. Тромбоцитарный фактор 3 (ТФ3), фосфолипопротеин, продуцируемый на мембране тромбоцитов, способствует активации фактора X в Ха. Необходимо также присутствие фактора
VIII и кальция. Фактор VIII является наиболее крупноразмерным из протеинов, вовлекаемых в коагуляционный каскад. Однако небольшая его составная часть, VIII:C, определяет его коагуляци- онную активность. Активированное парциальное тромбопластиновое время (аПТВ) определяет сте пень активности внутреннего пути коагуляции.
Общий путь коагуляции начинается с активирования фактора X в Ха. В присутствии фактора V, действующего как кофактор, кальция и ТФ3, Ха конвертирует протромбин (фактор II) в активный энзимный тромбин. Последний в свою очередь конвертирует фибриноген в фибрин. Тромбин также активирует фактор XIII в ХШа, усиливает активность факторов V и VIII и способствует агрегации тромбоцитов.
Фибриноген компануется из трех пар полипептидных цепочек. Тромбин разлагает фибриноген на фибропептиды А и В и на мономер фибрина. Последний быстро полимеризуется, формируя собственно фибрин. Фактор ХШа формирует ковалентное звено между мономерами фибрина, конвертируя хрупкий сгусток фибрина в более плотный и стабильный. Как ПВ,
так и аПТВ удлиняются, когда нарушается функционирование общего пути коагуляции.
Необходимо еще раз подчеркнуть, что процесс коагуляции — это не просто результат двух различных путей, протекающих одновременно и формирующих общий путь свертывания. Имеются убедительные доказательства тесной связи между этими путями. Например, фактор Vila (внутренний путь) и фактор VII могут активироваться факторами ХПа, 1Ха, Ха и тромбином.
Ингибирование коагуляции
Параллельно протекающая серия реакций, направленная на ограничение формирования тромба, начинается одновременно с инициацией тромбообразования. Тромбопластическая система опосредована в первую очередь ферментом пластином, лизирующим фибриновые сгустки. Плазминоген, представляющий собой неактивный проэнзим, циркулирует в крови. Его активация в плазмин происходит двояким путем. Фактор ХПа инициирует внутрисосудистую активацию. Тканевый плазминогенный активатор (ТПА), высвобождающийся из сосудистого эндотелия и из других поврежденных тканей, инициирует внесосудистую активацию. Активация плазминогена осуществляется также тромбином, калликреином и экзогенными субстанциями типа урокиназы, стрептокиназы и стафилокиназы.
Протеолитическая активность плазмина не ограничивается деградацией фибрина. Плазмин также расщепляет фибриноген подобно факторам V и VII и некоторым компонентам системы комплемента. Начальное расщепление фибриногена приводит к образованию Х-мономеров, которые в последующем разделяются на фрагменты Y и D. Те же Х-мономеры способны конвертироваться в D и Е фрагменты. Сами мономеры X, фрагменты Y, D и Е ограничивают образование продуктов расщепления фибрина (ПРФ) или продуктов деградации фибрина (ПДФ). В нормальных условиях ПДФ удаляются клетками ре-тикулоэндотелиальной системы. Если же этого не происходит, то они начинают препятствовать формированию сгустка, ингибируя взаимодействие мономеров фибрина, нарушая функцию тромбоцитов и усиливая сосудистую проницаемость. Для обнаружения ПДФ применяют тест быстрой латексной агглютинации.
Антитромбин III (AT-III), естественный ингибитор коагуляции, синтезируется в печени. Он относится к кофакторам гепарина и к факторам ингибитора Ха. АТ-Ш инактивирует тромбин, факторы Ха, ХПа, XIa, IXa, Villa, калликреин и плазмин. Хотя АТ-Ш является медленным ингибитором коагуляции, в присутствии гепарина он действует почти мгновенно. В действительности
Переливание крови и ее компонентов 171
эффект действия гепарина зависит от уровня АТ-III. У пациентов с недостаточностью ингибитора гепарин не оказывает должного действия. Врожденный дефицит АТ-Ш сопровождается наклонностью к тромбозам.
Протеин С, зависящий от витамина К, инак-тивирует факторы V и VIII, ингибирует Ха и способствует фибринолизу, стимулируя высвобождение активатора тканевого плазминогена из эндо-телиальных клеток. Другой зависящий от витамина К кофактор—протеин S, по-видимому, необходим для нормального функционирования протеина С. У пациентов с дефицитом протеинов S и С отмечается склонность к тромбозам.
Кинин и система комплемента
Системы коагуляции и фибринолиза тесно взаимодействуют с кинином и системой комплемента. Система кинина наряду с центральной ролью в развитии процессов воспаления, принимает участие также и в динамике коагуляции и фибринолиза. Энзимы прекалликреин и калликреин вместе с кофактором ВМК являются обязательными компонентами коагуляции. Кроме того, ВМК также включается в систему фибринолиза.
Система комплемента, имеющая важное значение в аллергических и иммунных реакциях, принимает участие как в процессах коагуляции, так и фибринолиза. Агрегация тромбоцитов усиливается в присутствии С5а. Активность тромбина и плазми-на угнетается С1-эстеразным ингибитором. С другой стороны, плазмин относится к важным активаторам комплемента. Как кинин, так и комплемент подвергаются существенным изменениям при пост-трансфузионных гемолитических реакциях.
Анестезиолог может столкнуться с четырьмя типами клинических ситуаций, связанных с гемостазом: 1) ребенок с кровотечениями в анамнезе или с кровоточивостью у родственников; 2) нарушение лабораторных показателей перед операцией у ребенка без отклонений в анамнезе; 3) нарушение лабораторных показателей у ребенка без кровотечения во время операции; 4) активное кровотечение у ребенка. Диагностика и тактика ведения должны быть индивидуализированы в зависимости от анамнеза, клинической симптоматики и трактовки лабораторных показателей.
Анамнез и физикальное обследование
Анестезиолог, оценивающий анамнестические сведения о кровоточивости у ребенка, должен обратить внимание на следующие три компонен-
та системы гемостаза: сосуды, тромбоциты и коа-гуляционную систему. Патология сосудов и тромбоцитов обычно проявляется петехиями, кровоточивостью слизистых оболочек и нередко экхимозами. Кровотечения, возникающие сразу же после повреждения, характерны для нарушения функции тромбоцитов, а появляющиеся спустя некоторое время — для аномалий со стороны факторов свертывания крови. Дефицит факторов свертывания крови проявляется большими экхимозами, кровотечением в глубокие ткани (в мышцы или в суставы), а также умеренными или тяжелыми кровотечениями из слизистых оболочек.
В зависимости от этиологии кровоточивость можно разделить на врожденную и приобретенную. Врожденные нарушения обычно сводятся к патологии одного из гемостатических компонентов, обычно одного из коагуляционных протеинов. Более часто встречающиеся приобретенные нарушения обычно касаются нескольких гемостатических факторов, они труднее диагностируются и хуже поддаются терапии.
Анестезиолог при оценке анамнеза ребенка должен выяснить, имело ли место кровотечение при рождении, в частности, из пупочного канатика. Бывает полезным распрос родителей об ушибах и кровотечениях при этом не только у данного ребенка, но и у остальных детей. Особенно важна информация о перенесенных операциях, в частности малых, типа циркумцизии, удаления зубов, тонзиллэктомии. Требовалось ли при этом переливание крови? Возникали ли подобные кровотечения у родственников, особенно у близких?
При сборе анамнеза следует уточнить вопрос о приеме широко распространенных лекарственных средств. Аспирин угнетает фермент цикло-оксигеназу, блокирует высвобождение простаг-ландинов тромбоцитами и нарушает их агрегацию. Это влияние аспирина на тромбоциты не устраняется в течение всего периода циркуляции их в организме, т. е. на протяжении 9 дней после прекращения приема препарата. Эффект ослабевает при поступлении в циркуляцию новых тромбоцитов, не подвергшихся действию аспирина. Однако при регулярном приеме аспирина требуется 7—10 дней для продукции достаточного количества тромбоцитов и нормализации времени кровотечения. Нестероидные противовоспалительные препараты, например индометацин и ибупрофен, также могут нарушить функции тромбоцитов. Однако это нарушение обратимо и сохраняется только в период присутствия препарата в системе гемоциркуляции.
Обследование пациента помогает установить заболевания, сопровождающиеся коагулопатией. Например, нарушения функции тромбоцитов
172 Анестезия в педиатрии

Важным компонентом физикального исследования является осмотр кожи на предмет петехий, экхимозов, пурпуры. Места введения внутрисо-судистых катетеров должны осматриваться на предмет необычно больших гематом. Следует обращать внимание на сосудистые аномалии типа телеангиэктазий на коже и слизистых оболочках. На основании анамнеза и физикального обследования анестезиолог может целенаправленно затребовать те или иные лабораторные исследования, помогающие в оценке гемостаза.
Оценка лабораторных данных
Оценка гемостаза у детей с анамнестическими или лабораторными указаниями на аномалии системы свертывания крови должна проводиться в определенной последовательности врачом, хорошо знакомым с пределами возможностей гемо-статических тестов. Консультация с педиатром-гематологом особенно необходима в отношении детей с врожденными коагулопатиями. Наиболее противоречива и сложна оценка гемостаза у детей, не отнесенных к группе риска при развитии у них кровотечения во время операции или после нее.
Необходимая предоперационная оценка возможностей гемостаза у детей без учета риска избыточного кровотечения во время операции и после нее может оказаться противоречивой. Некоторые хирурги настаивают на исследовании коагуляции перед операцией у всех детей, даже
без анамнестических указаний на кровоточи^ вость. Сторонники рутинного тестирования считают, что многие родители сообщают неверные анамнестические сведения. По мнению других, тестирование служит страховкой для врача в случаях неполного анамнеза. Рациональным моментом является получение исходных сведений, используемых для сравнения при развитии кровотечения во время операции. По утверждениям сторонников этой позиции, любые лабораторные данные, полученные во время кровотечения, трудно интерпретировать, поскольку введение компонентов крови, потребление или разведение факторов свертывания могут способствовать развитию коагулопатии. Однако именно лабораторные сведения, полученные во время кровотечения, а не исходные показатели служат ориентиром при решении вопроса о переливании крови или ее компонентов.
Помимо своей значительной стоимости, рутинное предоперационное тестирование может привести к недооценке анамнестических сведений и к замене клинического обследования необязательными лабораторными тестами вместо действительно необходимых. При этом редкость клинически не выявленных коагулопатии будет заменена более частыми ложноположительными результатами лабораторных анализов. Переливание компонентов крови может быть вовсе необязательным для устранения клинически не проявляющих себя отклонений.
Оценка состояния гемостаза оправдана у детей перед операциями на сердце. По сведениям, полученным в прошлые годы, у многих детей с так называемой синей болезнью имеются количественные и качественные нарушения тромбоцитов и снижение уровня факторов свертывания крови. Развитие подобных аномалий, по-видимому, коррелирует со степенью полицитемии и находится в обратном соотношении с возрастом ребенка. Ранее существовавшие аномалии гемостаза могут обостряться из-за разрушающего воздействия на функцию тромбоцитов кардиопуль-монального шунтирования или из-за дилюцион-ной коагулопатии, спровоцированной заправкой насоса.
Проблемы возникновения коагулопатии можно предвидеть, но в реальных условиях невозможно предсказать, у какого именно ребенка они разовьются. Исследование, выполненное на 30 новорожденных в возрасте от 1 до 30 дней, показало невозможность предвидеть дефекты коагуляции на основе первоначального диагноза, возраста, уровня простагландина Е! или необходимости инотропной терапии в предоперационном периоде [53]. У более половины этих детей факторы свертывания крови были существенно ниже нормы, принятой для данного возраста. Послед-
Переливание крови и ее компонентов 173
нее наблюдение, охватывающее сравнительно небольшое число младенцев в возрасте до 2 мес, а также для детей старше 12 мес, оперированных с использованием кардиопульмонального шунтирования, выявило меньшую степень реактивности тромбоцитов у младенцев по сравнению с тромбоцитами детей более старшего возраста. Это различие выражалось меньшим повреждением из-за шунтирования адгезивных рецепторов мембраны тромбоцитов у младенцев. Кроме того, у младенцев отсутствовало индуцированное шунтированием нарастание р-селектина и в меньшей степени было выражено падение гликопротеина Ib [56].
Проспективное исследование, охватившее более 400 детей, оперированных на открытом сердце, также подтвердило существование зависимости между возрастом больных, величиной крово-потери и необходимостью в гемотрансфузии [57\. Возраст 38 % оперированных детей был менее 1 года. Аномальные показатели гемокоагуляции в предоперационном периоде чаще всего отмечались у новорожденных. Обратная пропорциональная зависимость прослеживалась между величинами потери крови после операции и количеством перелитой крови, с одной стороны, и возрастом оперированных — с другой. Новорожденные кровоточили в большей степени и нуждались в большем количестве перелитой крови по сравнению с другими возрастными группами при расчете на массу тела.
Принципы тестирования гемостаза
Важное значение имеет правильный сбор крови для определения параметров коагуляции. Достаточное количество крови должно быть помещено в соответствующую пробирку и срочно отправлено в лабораторию. Обычно соотношение антикоагулянта и крови равно 1:9. Пробирка должна быть соответствующим образом маркирована и иметь указатель уровня, до которого она может наполняться. Кровь собирают в раствор цитрата (голубая пробка у пробирки) для определения ПВ, аПТВ и тромбинового времени. Пробирки с лавандового цвета пробкой, содержащие ЭДТА, применяют при сборе крови для производства мазков, определения количества тромбоцитов, гемоглобина и гематокрита. Пробирки с красной пробкой предназначены для определения факторов свертывания крови, установления групп крови, совместимости, свободного гемоглобина и ПДФ.
В операционных и палатах интенсивной терапии кровь часто получают из катетеров, введенных в просвет сосудов и промытых гепарином. Подходящие порции крови можно собирать для анализа после того, как из системы будет выпу-
щено количество крови, вдвое превышающее объем мертвого пространства системы, чтобы смыть из нее все посторонние растворы [58\. Необходимо предусмотреть соответствующие емкости, позволяющие реинфузировать выпущенную при этом кровь, не допуская ее контаминации. При катетерах как в артерии, так и в центральной вене предпочтительнее брать кровь из последнего, имеющего больший калибр, что облегчает получение крови и меньше повреждает ее клеточные элементы. Кроме того, при этом меньше выражено влияние гепарина, содержащегося в катетере и распределяющегося в крупном венозном сосуде быстрее, чем в небольшой периферической артерии.
Анестезиологи и хирурги по установившейся традиции полагаются на результаты коагуляци-онных тестов, выполненных в лабораториях. Однако опубликовано большое число сообщений о преимуществах проведения подобного тестирования непосредственно в операционной. Алгоритм трансфузий, основанный на определении ПВ, аПТВ, количества тромбоцитов [59] и показателей тромбоэластограммы [60], на месте может оказаться более эффективным в отношении снижения переливаний, особенно у больных во время операций кардиопульмонального шунтирования. Недавно в операционных начали проводить тромбоцитарноакгивирующий свертывающий тест (PACT). С его помощью оценивают ускорение времени активированного свертывания (ВАС) под действием тромбоцитарноактивирую-щего фактора PAF). Противоречивые результаты этого теста были получены при его проведении во время операций на сердце у взрослых [61—63]. У детей о подобных исследованиях не сообщалось.
Уже несколько лет используют приборы для определения вязкости цельной крови, позволяющие изучать весь процесс коагуляции от момента начала взаимодействия тромбоциты—фибрин через процессы агрегации тромбоцитов, уплотнения сгустка просачивания фибрина вплоть до лизиса сгустка. Наибольшее применение эти исследования получили при операциях на сердце и при трансплантации печени. Недавно опубликованы данные о тромбоэластографии, полученные подобным методом более чем у 200 детей в возрасте до 2 лет [64]. Клиницисты, поддерживающие использование данной методики, сообщают о ее преимуществах при идентификации и лечении коагулопатий в периоперационном периоде.
Характеристика тромбоцитов
Применение метода электронных частиц ускоряет и облегчает подсчет количества тромбоцитов. В норме их количество варьирует от 150 до
174 Анестезия в педиатрии
450 х Ю9/л. При аномально низком показателе необходимо исследование мазка крови для проверки: не вызвана ли тромбоцитопения неправильным взятием материала для исследования. Крайне малое количество тромбоцитов может быть связано с образованием сгустка в пробирке из-за отсутствия действия антикоагулянта. Сгусток при этом виден в пробирке или же агрегация тромбоцитов обнаруживается в мазках крови.
Функцию тромбоцитов оценить труднее, чем их количество. Способность их к агрегации определяется в специализированных лабораториях и не может быть немедленно учтена для коррекции лечения у хирургических больных. К суспензии тромбоцитов в плазме добавляют различные вещества (эпинефрин, ADP, коллаген) и с помощью спектрофотометра определяют прохождение света. Усиление агрегации тромбоцитов под влиянием добавленных реагентов увеличивает светопроводность суспензии. Каждый из реагентов выявляет разные нарушения функции тромбоцитов. Высказано предположение о том, что PACT может быть полезным при идентификации пациентов с повышенным риском избыточной кровопотери после операции кардиопульмональ-ного шунтирования, у которых трансфузия тромбоцитов или введение десмопрессина могут оказать благоприятное действие [61\, Значение приведенной информации для педиатрической практики требует подтверждения.
Время кровотечения (ВК) — это тест на продолжительность выделения крови из стандартной ранки на коже, он характеризует как функцию тромбоцитов, так и сосудистый компонент гемостаза. Это весьма приблизительный клинический тест, малоспецифичный и во многом зависящий от техники его выполнения. Предложено несколько способов выполнения теста на ВК, но наиболее распространенным остается приспособление для стандартного прокола кожи. Обычно этот прокол проводят на передней поверхности предплечья. Иногда — и на ноге [65\. На конечность накладывает манжетку, поддерживая в ней давление 40 мм рт.ст. Кожу прокалывают, а выступающую кровь промокают фильтровальной бумагой через каждые 30 с. В норме кровь выделяется не более 10 мин (если применяют симплат II). Если кровотечение продолжается более 15 мин, то манжетку снимают, а ранку придавливают.
Удлинение времени кровотечения происходит при падении числа тромбоцитов ниже 100 х 109/л. Обычно ВК возрастает пропорционально снижению числа тромбоцитов. Удлинение ВК имеет место под влиянием аспирина и содержащих его медикаментов, при многих врожденных и приобретенных изменениях функции тромбоцитов.
Тест на ВК, несмотря на широкое его использование в предоперационном скрининге, не может быть отнесен к информативным [66,67]. Не удалось продемонстрировать корреляции между величиной ВК и кровоточивостью при операции, так же как и соответствия кровоточивости из кожного прокола и разреза в других участках тела. Препараты, статистически достоверно увеличивающие ВК, часто не оказывают клинически выраженного действия. Напротив, ВК не может быть использовано как надежный тест при идентификации больных, недавно принявших аспирин или нестероидные противовоспалительные препараты, а также больных с изменениями функции тромбоцитов, вызванными подобными препаратами. Программная статья, опубликованная Коллегией патологов Америки и Американским обществом клинической патологии и озаглавленная: "Недостаточные клинические преимущества предоперационного теста на время кровотечения" утверждает, что время кровотечения не может служить скрининговым тестом и поэтому проведение его не может быть показанным при рутинном обследовании перед операцией [68\.
Оценка путей коагуляции
Коагуляционная фаза гемостаза оценивается по показателям ПВ, аПТВ, ТВ и уровню фибриногена. Показателем отклонения является удлинение времени свертывания сверх нормы, определяемой при исследовании крови здоровых лиц. Величина ПВ характеризует внешний путь коагуляции (факторы I, II, V, VII и X). Их исследование особенно информативно в отношении ранней детекции дефицита витамина К, так как фактор VII, зависящий от данного витамина, является самым короткоживущим из факторов свертывания. Этот фактор единственный, ограничивающий внешний путь коагуляции, все остальные являются составными компонентами общего ее пути. Вариации в методике проведения тестов, принятые в разных лабораториях, могут обусловить существенные различия показателей коагуляции, несмотря на видимую сопоставимость ПВ. Введение международного нормализующего соотношения (МНС) позволяет стандартизировать показатели ПВ, полученные в разных лабораториях мира. МНС полезно при наблюдении за больными, лечащимися варфари-ном, но не обследованными методами, характеризующими коагулопатию.
Показатели аПТВ характеризуют факторы внутреннего пути коагуляции (I, II, V, VIII, IX, X, XI, XII, Флетчера и Фитцжеральда). Факторы VIII, IX, XI, XII, Флетчера и Фитцжеральда регулируют внутренний путь коагуляции. Как ПВ, так
Переливание крови и ее компонентов 175
 и
аПТВ удлиняются при аномалии факторов
общего
пути свертывания (факторы I,
II,
V
и X).
Дефицит этих факторов возникает при
уменьшении или
качественном изменении их синтеза, при
обширных деструкциях тканей или
инактивации в результате
нарушения циркуляции. Ингибиторами их
являются гепарин, антикоагулянты
волчаноч-ного
типа, продукты разрушения фибрина и
антитела
к определенным факторам коагуляции.
и
аПТВ удлиняются при аномалии факторов
общего
пути свертывания (факторы I,
II,
V
и X).
Дефицит этих факторов возникает при
уменьшении или
качественном изменении их синтеза, при
обширных деструкциях тканей или
инактивации в результате
нарушения циркуляции. Ингибиторами их
являются гепарин, антикоагулянты
волчаноч-ного
типа, продукты разрушения фибрина и
антитела
к определенным факторам коагуляции.
Связь удлинения ПВ или аПТВ с дефицитом факторов свертывания или же с действием ингибиторов устанавливают, смешивая разведенную плазму пациента с равным объемом нормальной плазмы и проводя повторное исследование смеси. Если при этом показатели коагуляции оказываются нормальными, то можно говорить о дефиците факторов свертывания, так как нормальная плазма устранила имевшиеся нарушения. Если же ПВ- и аПТВ-смеси остались нарушенными, то это указывает на действие ингибиторов коагуляции, нейтрализующих действие также и факторов нормальной плазмы.
Величины ТВ определяются по способности тромбина конвертировать фибриноген в фибрин при добавлении очищенного тромбина в плазму крови. Этот показатель не характеризует дефекты внешнего или внутреннего путей коагуляции, поскольку данный ее этап обычно уже завершается к моменту выполнения теста. Удлинение ТВ происходит при следующих трех обстоятельствах: 1) дефицит или структурные аномалии фибриногена; 2) присутствие гепарина; 3) присутствие продуктов деградации фибрина (ПДФ). Диффе-ренцировка аномалий фибриногена от присутствия ингибиторов проводится путем смешивания разведенной плазмы пациента с нормальной плазмой и повторным тестированием смеси. Нормальные показатели теста говорят о дефиците или структурной аномалии фибриногена. Если же величины ТВ остались прежними, то это указывает на присутствие в крови ингибитора (обычно гепарина или ПДФ). В норме ТВ равно примерно 15 с. Некоторые лаборатории определяют рептилазное время для уточнения этиологии удлиненного ТВ. Этот показатель не меняется в присутствии гепарина и лишь незначительно возрастает под влиянием ПДФ. Следует проводить также исследования уровня фибриногена и тест на ПДФ.
Уровень фибриногена обычно вычисляют по изменениям ТВ-при разведении плазмы. В норме этот показатель колеблется от 200 до 400 мг/100 мл. Более низкие величины отмечаются у детей с врожденной гипофибриногенемией. Приобретенный дефицит возникает при заболеваниях печени, при ДВС-синдроме и при фибринолизе. Фибриноген относится к острофазным реагентам, поэтому увеличение его концентрации име-
ет место при острых инфекциях, опухолях и кол-лагенозах.
Уровень ПДФ определяют простым полуколичественным методом латексной агглютинации. Этот тест высокочувствителен, но часто дает ложноположительные ответы. Более специфичный D-даймерный тест может характеризовать как продукцию тромбина, так и фибринолиз. Рост показателей этого теста характерен для ДВС-синдрома. К другим признакам ДВС относятся снижение числа тромбоцитов, удлинение ПВ, аПТВ и ТВ, а также снижение уровня фибриногена.
Лабораторные исследования выявили количественный дефицит системы коагуляции у здоровых детей на протяжении не менее 6 первых месяцев жизни. Однако подобный дефицит не сопровождался повышенной кровоточивостью [64\. Как у доношенных, так и у недоношенных новорожденных концентрация факторов XII, XI, пре-каликреина, кининогена высокой молекулярной массы (КВММ), витамин К-зависимых факторов (II, VII, IX И X), а также ряда ингибиторов коагуляции (протеинов С и S, АТ-Ш и кофактора гепарина II) была ниже, чем у взрослых. Тем не менее показатели ПВ и ТВ у здоровых детей не отличались от аналогичных показателей у взрослых. Величины аПТВ при рождении несколько увеличены, но в период 3—6 мес жизни они становятся такими же, как и у взрослых.
Анестезиолог должен принимать во внимание, что, помимо возрастных колебаний показателей, могут иметь место и отличия результатов лабора- ' торных тестов, выдаваемых разными лабораториями. Недавнее исследование по сравнению нескольких результатов определения ПВ и аПТВ у пациентов, перенесших значительную кровопо-терю во время обширных операций на позвоночнике, обнаружили значительные вариации этих показателей [69\. Различия показателей тестов были наиболее значительными при повышении ПВ и аПТВ в 1,5—2 раза по сравнению с нормой. Согласно инструкциям, подобные отклонения могли служить показанием для переливания свежезамороженной плазмы. Важное значение имеет критическая оценка лабораторных показателей и их сопоставление с клиническими данными. Это позволяет определить, имеется ли коагулопа-тия и показано ли вмешательство.
Установление диагноза
Необходимо учитывать анамнез ребенка, результаты клинического и лабораторного обследования. Анестезиолог должен хорошо знать все данные лабораторных исследований и их изменения при разных типах кровоточивости, однако лечить следует именно конкретного пациента, а не разнооб-
176 Анестезия в педиатрии

Практика работы в операционной показывает, что наступает время, когда откладывание гемо-трансфузии может существенно ухудшить состояние ребенка. В подобных обстоятельствах необходимо исследовать кровь на состояние коагуляции и начать лечение, не ожидая получения ответа. Анестезиолог должен документировать все параметры анестезии, а также клинические показатели и результаты лабораторных исследований.
Тромбоциты получают с помощью двух методов: центрифугированием цельной крови и при афе-резе. Поддержание их максимальной жизнеспо-
собности требует их хранения при комнатной (20—24 °С) температуре и особом внимании. Пребывание в холодильнике уже через несколько часов изменяет свойства тромбоцитов и нарушает их жизнеспособность. Тромбоциты сохраняют жизнеспособность в условиях хранения при комнатной температуре на протяжении 7 дней, но срок их использования ограничен 5 днями из-за опасности бактериального роста при случайном загрязнении.
Тестирования групповой совместимости (АВО) не требуется. Правда, если подобное тестирование проводится и соблюдается, то сроки жизни перелитых тромбоцитов более длительные. В тромбоцитной массе содержится очень немного эритроцитов. Однако при введении резус-положительных тромбоцитов резус-отрицательной женщине детородного возраста следует помнить и о резус-иммунном глобулине. Трансфузируе-мые тромбоциты должны фильтроваться.
Тромбоциты, полученные из цельной крови, обозначаются как тромбоцитный концентрат, тромбоцитная масса или тромбоциты от "случайного донора". Каждая единица такого концентрата должна содержать не менее 5,5 х 1010 тромбоцитов в 50—70 мл плазмы. Обычная доза для младенцев равна 10 мл/кг и для детей более старшего возраста — 1 единица/10 кг массы тела. Требуемое количество единиц служба переливания крови может объединить в одной емкости. Сроки использования подобного объединенного продукта не превышают 4 ч. Поэтому анестезиолог не должен заранее требовать его доставки, если он не вполне уверен в вероятности его введения.
Тромбоциты от одного-единственного донора получают при аферезе. Каждая единица содержит 3 х Ю11 тромбоцитов и равна примерно 6 единицам от случайного донора. Существуют разные приспособления для афереза, некоторые из них
позволяют получать конечный продукт с уже сниженным количеством лейкоцитов. Ограничение контакта является основным преимуществом введения тромбоцитов от единственного донора. В противном случае пациенту приходится переливать большее количество тромбоцитных единиц, полученных от нескольких доноров.
Показания к трансфузии тромбоцитов
Переливание тромбоцитов может проводиться с профилактической или лечебной целью. Решение вопроса о назначении тромбоцитной массы ребенку зависит от степени опасности кровотечения из-за тромбоцитопении или из-за нарушения функции тромбоцитов с учетом всех конкретных условий, а также реакции на предыдущие трансфузии тромбоцитов. Анестезиолог должен хорошо знать действующие инструкции по трансфузии тромбоцитов недоношенным младенцам, онкологическим больным и пациентам, рефрактерным к переливаниям тромбоцитов.
Возможность внутричерепной геморрагии должна быть предметом особого внимания при тромбоцитопении у недоношенных младенцев. Диагноз тромбоцитопении обычно ставят при количестве тромбоцитов ниже 150 х Ю9/л, однако остается неясным, при каком уровне тромбоцитопении возникают показания к переливанию тромбоцитов. Определенные ориентиры в этом отношении дали контролируемые и рандомизированные исследования, проведенные в нескольких лечебных центрах и посвященные недоношенным младенцам с содержанием тромбоцитов ниже 150 х 109/л в течение первых 72 ч жизни [70\. Предметом исследований служил вопрос, снижаются или повышаются частота и тяжесть внутричерепных геморрагии при введении тромбоцитной массы в дозе 10 мл/кг. Переливание тромбоцитов повысило количество этих клеток в крови и сократило время кровотечения, но ни частота, ни тяжесть внутричерепных кровоизлияний при этом не уменьшились. Согласно сделанным выводам, профилактическая трансфузия тромбоцитов недоношенным новорожденным не показана, если у них нет признаков кровотечения и количество тромбоцитов в крови не ниже 60 х Ю9/л.
Многочисленные рекомендации по профилактической трансфузии тромбоцитов основаны на исследованиях, проведенных у больных острыми лейкозами. На первых этапах наблюдали больных, нередко принимавших аспирин, поскольку в тот период еще не знали о влиянии этого препарата на функцию тромбоцитов. На протяжении многих лет показанием для профилактического переливания тромбоцитов служило снижение их количества ниже 20 х Ю9/л [71]. В настоящее
Переливание крови и ее компонентов 177
время приемлемым порогом считается величина 10 х 109/л, по крайней мере у подростков и взрослых, получающих химиотерапию по поводу острого лейкоза [ 72,73]. Подобные рекомендации не распространяются на оперируемых больных.
Серьезные трудности возникают при ведении больных, рефрактерных к переливанию тромбоцитов. Определение рефрактерности варьируется, поэтому введен показатель "корректируемого нарастания количества" (КНК), согласно которому нарастание числа тромбоцитов рассчитывается с учетом перелитого их количества в отношении к поверхности тела пациента. Если через 1 ч после трансфузии тромбоцитов их количество не превышает 7,5 х 109/л, то говорят о тромбоцитной недостаточности и о рефрактерности. Ведение таких пациентов в различных лечебных центрах может в чем-то варьироваться, но в первую очередь оно предусматривает введение совместимых по группе крови (АВО) и "свежих" тромбоцитов, а в последующем трансфузию совместимых по человеческому лейкоцитарному антигену тромбоцитов у пациентов при установленной ал-лоиммунизации [74]. Необходима идентификация других факторов, помимо аллоиммунизации, вызывающих рефрактерность. Лихорадка, инфекция, сепсис, ДВС-синдром, спленомегалия и многочисленная медикаментозная нагрузка — все это нарушает восстановление функции тромбоцитов и их выживаемость. Ликвидация инфекционного процесса и отмена излишних медикаментов могут оказаться единственными необходимыми компонентами лечения.
Гематотрансфузия обозначается как массивная, если в течение нескольких часов пациенту переливают один или более объемов крови. Ведение таких больных варьируется в зависимости от обязательного введения тромбоцитов по принятой формуле и в соответствии с количеством перелитой ЭрМ до трансфузии тромбоцитов только при клинических признаках коагулопатии. Нельзя забывать о профилактическом переливании тромбоцитов по принятой формуле. Нельзя ожидать развития клинических признаков коагулопатии в случаях предсказуемой, нарастающей и значительной кровопотери. Служба переливания крови Должна быть заранее извещена об ожидаемой потребности в тромбоцитных средствах, особенно если их часто приходится сохранять.
Немногочисленные исследования у детей показали, что динамика изменений количества тромбоцитов при массивной гемотрансфузии у них такая же, как и у взрослых, при расчете с учетом объемов перелитой крови. В исследовании, охватившем 26 детей, потерявших не менее одного объема крови, было подтверждено, что количество тромбоцитов перед операцией служит надежным прогностическим критерием потреб-
178 Анестезия в педиатрии
ности в трансфузии тромбоцитов [75\. По заключению авторов, при количестве тромбоцитов до операции более 150 х 109/л их переливание показано уже при замене одного объема крови, а при более высоком исходном уровне тромбоцитов трансфузия становится необходимой лишь после замены двух объемов крови и более. Точно так же, как и у взрослых, количество тромбоцитов у таких детей оказывалось выше предполагаемого, поскольку селезенка в нормальных условиях компенсирует потерю примерно третьей части этих клеток.
Потребность в трансфузии тромбоцитов определяется не только по их количеству. Она зависит от типа и тяжести операции, от скорости и величины кровотечения, от возможности его остановки хирургом, а также от ряда дополнительных факторов, неблагоприятно влияющих на функцию тромбоцитов (кардиопульмональное шунтирование, уремия, препараты антитромбо-тического действия) [36\. Согласно общему правилу, дети с исходным уровнем тромбоцитов 100 х 109/л и выше редко нуждаются в переливании тромбоцитов, если отсутствуют факторы, нарушающие функцию этих клеток. Благоприятное влияние трансфузии тромбоцитов проявляется даже у детей с нормальной их функцией и количеством перед операцией ниже 50 х 109/л. Если же необычная кровоточивость наблюдается при количестве тромбоцитов выше 50 х 109/л, то следует искать другие ее причины, в том числе ДВС-синдром или недостаточный хирургический гемостаз.
Значение профилактической трансфузии тромбоцитной массы не изучалось при операциях на сердце у детей. Правда, соответствующее исследование у взрослых не обнаружило каких-либо преимуществ подобной трансфузии [76]. Как было продемонстрировано, величина крово-потери находится в обратно пропорциональной зависимости от возраста ребенка. Поэтому следует ожидать, что при операциях на сердце у новорожденных трансфузия тромбоцитов может потребоваться чаще, чем у детей более старшего возраста.
Реакция на введение тромбоцитов должна контролироваться как при профилактическом, так и терапевтическом их введении. Если это невозможно сделать непосредственно в операционной, то материал для исследования следует направить в лабораторию. Результаты подсчета количества тромбоцитов обычно получают раньше определения всего коагуляционного профиля. Анестезиологи могут настаивать на их сообщении по телефону в операционную немедленно после получения. Лучше всего определять количество тромбоцитов в промежутке от 15 мин до 1 ч после- их переливания. Если отсутствует кро-
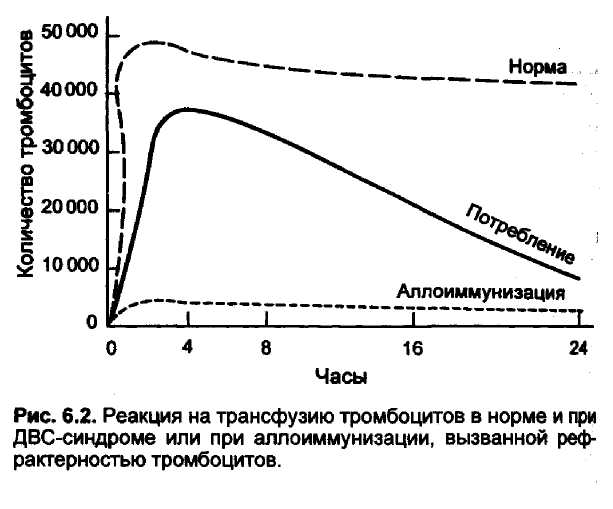
вотечение, то аномальная реакция на трансфузию помогает диагностировать рефрактерность или же развитие ДВС-синдрома (рис. 6.2). При рефрактерности не происходит ожидаемого подъема количества тромбоцитов, а при ДВС-синдроме число тромбоцитов вначале повышается, но затем падает.
Свежезамороженную плазму (СЗП) чаще всего получают из цельной крови путем отделения плазмы и ее замораживания не позднее 8 ч после флеботомии. Одна единица СЗП равна примерно 220 мл. Некоторые учреждения выпускают партии плазмы с содержанием 600 мл в одной единице. Оба типа продуктов сохраняют при температуре — 18 "С и используют не позже 1 года после получения. Перед назначением плазму оттаивают на водяной бане с температурой 30—37 °С или в специально приспособленной для этой цели микроволновой печи. В оттаявшем состоянии плазма может храниться при температуре 1—6 °С не более 24 ч.
Недавно лицензированный продукт, так называемая объединенная плазма, обработанная растворителем/детергентом (S/D = Р), приготавливается путем инкубации свыше 2500 единиц плазмы одинаковой группы крови с органическим растворителем и неионным детергентом. После отмывания растворителя и детергента плазма отфильтровывается в стерильных условиях и замораживается в стандартных емкостях по 200 мл. Этот процесс надежно инактивирует вирусы, обладающие липидными оболочками, в том числе ВИЧ, вирусы гепатита С и В [77J. Дан-
ная обработка тем не менее не способна устранить вирусы без липидной оболочки, например вирус гепатита А и парвовирус В19. Несмотря на явные успехи в устранении вирусов с липидными оболочками, остаются серьезные опасения в связи с повышенной опасностью переноса других вирусов, поскольку в каждую порцию объединенной плазмы входит много единиц плазмы от разных доноров.
Альтернативой S/D = Р, производимой некоторыми центрами переливания крови, может служить свежезамороженная повторно тестированная плазма (СЗП-ПТ). Подобную плазму получают обычным способом от одного-единствен-ного донора и затем выдерживают не менее 112 дней, когда будет получена следующая порция крови от того же донора. Тестирование крови повторяется при каждом ее заборе.
Учреждения могут поставлять все три вида плазмы (СЗП, S/D = Р и СЗП = ПТ) или некоторые из них. Термин "свежезамороженная плазма" может быть применен к каждому из этих продуктов, поскольку показания для их применения (но не возможные осложнения) остаются одинаковыми.
Показания для применения свежезамороженной плазмы
Ежегодно в США переливают более 2 млн единиц СЗП. В значительном проценте случаев это делается без достаточных обоснований. В хирургических клиниках СЗП чаще всего назначают пациентам при массивных гемотрансфузиях, при операциях на сердце, а также при серьезных поражениях печени, в том числе при ее трансплантации. В терапевтических клиниках большие количества СЗП вводят при лечебных плазмообме-нах. У отдельных больных, принимающих варфа-рин и нуждающихся в неотложных операциях, введение СЗП может быть показано для быстрой реверсии действия этого препарата.
Ранее установленная практика введения плазмы в четком соотношении с переливанием ЭрМ в настоящее время признана несовершенной. Дилюционная коагулопатия может развиваться даже при введении большого количества ЭрМ, но в то же время свертываемость крови может оставаться нормальной даже при концентрации факторов коагуляции, равной 20—30 % от нормы. Замещение одного циркулирующего объема крови оставляет у пациента примерно треть от исходной концентрации факторов свертывания.
Клинический анализ должен сочетаться с оценкой результатов лабораторных исследований. Лабораторные показатели ПВ и аПТВ могут отклоняться от нормы, но клинические проявления дилюционной коагулопатии обычно не раз-
7-998
Переливание крови и ее компонентов 179
виваются, если они не отличаются от нормы в 1,5 раза и более. Подобная корреляция между повышенной кровоточивостью при операциях и отклонением лабораторных показателей была подтверждена при наблюдениях за 32 детьми (средний возраст 15,6 + 2,3 года), потерявшими более 50 % объема циркулирующей крови во время операций на позвоночнике [78\. Пациенты с повышенной кровоточивостью имели более высокие показатели ПВ и аПТВ (в 1,5 раза и более выше нормы), чем больные с обычной кровоточивостью. Как и следовало ожидать, первая из этих групп больных испытывала более высокую кровопотерю, чем вторая (1,14 ± 0,28 и 0,87 ± 0,22 циркулирующего объема крови соответственно). Введение СЗП по 10 мл/кг позволило преодолеть усиленную кровоточивость у 14 из 17 детей. По утверждению авторов, их пациенты перенесли именно дилюционную коагулопатию, а не ДВС-синдром, более характерный для больных, оперированных по экстренным показаниям. Дети, наблюдавшиеся в данном исследовании, не переносили ни шока, ни ацидоза, обычно ассоциирующихся с развитием ДВС-синдрома.
На основании приведенных выше и других наблюдений можно полагать, что назначение СЗП показано при величинах ПВ и аПТВ, превышающих норму в 1,5 раза и более. Возможны существенные колебания результатов определения ПВ и аПТВ в разных лабораториях, особенно при повышении этих показателей в 1,5—2 раза [69\. Поэтому данные локальные особенности следует учитывать при составлении инструкций.
Профилактическое введение СЗП нередко практикуется у недоношенных новорожденных, подверженных повышенному риску внутричерепной геморрагии. Оценка подобной практики недавно была проведена при большом рандомизированном исследовании, охватившем более 700 детей гестационного возраста менее 32 нед [79\. В течение первых 2 ч после рождения дети были распределены на две группы, первой из которых вводили СЗП (20 мл/кг вначале и 10 мл/кг дополнительно через 24 ч), а вторая группа служила контролем. Число умерших детей и частота выживших с тяжелыми дефектами оказались одинаковыми в обеих группах. Средний коэффициент развития выживших детей при обследовании в 2-летнем возрасте также был одинаковым. Было сделано заключение об отсутствии оснований для рутинного введения СЗП с целью профилактики внутрижелудочковых геморрагии у недоношенных младенцев.
Другое исследование по профилактическому применению СЗП было проведено у 75 детей при операциях на открытом сердце. Было установлено, что назначение СЗП не давало преимуществ при коррекции коагулопатии, развивавшейся по-
180 Анестезия в педиатрии
еле операций кардиопульмонального шунтирования [80\. Ухудшение параметров коагулопатии четко коррелировало с продолжающейся кровоточивостью, количеством отделяемого из дренажа и не реагировало на введение тромбоцитов или СЗП.
Переливание СЗП должно проводиться при соответствующих показаниях в дозах, калькулируемых на достижение не менее 30 % уровня концентрации факторов коагуляции плазмы. Это обычно удается при дозировке 10 мл/кг. Плазма должна быть профильтрована в процессе переливания и относиться к той же группе крови, что и у больного. Следует помнить, что пациенты, которым переливают тромбоциты, а также больные с тромбоцитопенией при массивных трансфузиях одновременно должны получать плазму. Одна единица СЗП содержится в 4—5 порциях тромбо-цитного концентрата или в одной единице тром-боцитной массы, полученной методом афереза от одного донора.
Криопреципитат представляет собой концентрированный источник определенных белков плазмы (факторы VIILvWF, VIILC, XIII и фибриногена), полученных при оттаивании СЗП при 4 "С. Белый осадок, формирующийся при оттаивании, и является криопреципитатом. Супернатант плазмы удаляют, оставляя преципитированные протеины в 10—15 мл плазмы, которую повторно замораживают до —18 "С. Перед использованием криопреципитат оттаивают при 30—37 °С.
Криопреципитат используют с несколькими целями. Раньше он являлся одним из методов выбора при лечении пациентов с гемофилией А и болезнью Виллебранда, но был заменен более безопасными средствами терапии. Недавно была выдана лицензия на приготавливаемый фибрин, или "клей", вытеснивший аллогенный или ауто-логичный криопреципитат.
Показания к использованию криопреципитата могут возникать при массивных трансфузиях, кровоточивости и при уровне фибриногена ниже 80—100 мг/100 мл [36\. Доза равна примерно 1 единице на 7 кг массы тела. Предпочтительно назначать преципитат той же группы крови, что и у больного, фильтрование при трансфузии обязательно.
Дети часто бывают подходящим контингентом для предоперационной заготовки крови, острой нормоволемической гемодилюции, сбора и со-
хранения крови во время операции и после нее. Этот метод вовсе не исключает аллогенную гемо-трансфузию, но его применение позволяет уменьшить переливание аллогенной крови, а иногда и обойтись без нее.
Сбор крови перед операцией
Концепция сбора крови перед операцией была выдвинута в конце 1930-х годов. Однако дети были включены в данные программы совсем недавно. Факторами, ограничивающими сбор аутоло-гичной крови перед хирургическими вмешательствами у детей, были трудности налаживания сотрудничества со стороны ребенка, взаимоотношений между хирургами, родителями и службой переливания крови, а также ограниченный доступ к сосудам. Количество крови, удаляемой при каждом взятии, зависит от массы тела ребенка. Условная "единица" — это допустимое количество крови, удаляемой у ребенка с массой тела 50 кг или более. У детей с меньшей массой перед операцией допустимо удаление в один прием не более 15 % вычисленного объема крови. Показатели гематокрита при этом должны быть не ниже 33 %. Сбор крови может проводиться не чаще 1 раза в неделю и последний — не менее чем за 72 ч до операции. Этот срок необходим для восстановления внутрисосудистого объема, а также для транспортировки и тестирования взятой крови. Заготовка крови противопоказана, если ребенок лечится или перенес бактериемию либо страдает бактериальной инфекцией, которая может сопровождаться бактериемией.
Программа предоперационной заготовки крови у детей, готовящихся к ортопедическим операциям, была принята в 1967 г. (Alfred I. Du Pont Institute), и результаты ее проведения проанализированы в 1974 г. [81]. Всего были проведены 203 процедуры у пациентов в возрасте от 7 лет до 21 года (средний возраст 14 лет). Полные сведения собраны в отношении 147 пациентов, перенесших 155 процедур заготовки и ретрансфузии крови. В 2/3 всех операций можно было ограничиться только аутологичной кровью. Единственным серьезным осложнением был перелом носа у ребенка, упавшего в обморок во время взятия крови.
Программа предварительного заготовления крови на базе гематологического центра была выполнена на 180 детях в возрасте 8—18 лет и опубликована в 1987 г. [82\. Полная обеспеченность собственной кровью достигнута у 88 % детей. При этом у детей с массой тела не более 27 кг собирали заранее 1—5 пропорциональных единиц. Безопасность и эффективность предварительной заготовки аутологичной крови у детей старшего возраста и подростков отражены в мно-
гочисленных сообщениях. Действительно, подобная тактика стала настолько рутинной при операциях по поводу сколиоза, что клиницисты перестали публиковать соответствующие материалы.
Недавно проведено исследование о заготовке крови у детей младшего возраста. Кровь получали во время катетеризации полостей сердца и затем хранили для использования во время операции на сердце [83]. Всего наблюдали 27 детей, у которых примерно за 2 нед до операции под тио-пенталовым наркозом собирали кровь (10 мл/кг). Возраст детей колебался от 6 мес до 6 лет (в среднем 1,9 + 2,1 года), а масса тела — от 5,8 до 20,2 кг (в среднем 9,7 ± 5,5 кг). В день взятия крови и спустя 7 дней детям без признаков цианоза внутривенно вводили r-HuEPO. При наличии цианоза r-HuEPO не применяли, но во всех случаях назначали сульфат железа ежедневно внутрь. Предварительно собранная кровь использовалась для заправки насоса, вводилась во время операции кардиопульмонального шунтирования либо после нее. Переливания аллогенной крови во время операции не потребовалось у 19 (76 %) детей. Другое исследование было выполнено у 80 детей в возрасте около 3 лет (средний возраст 8,6 ± 3,9 года) с массой тела 12,3 кг (в среднем 29,2 ± 14,5 кг). Заготавливали в среднем 735 ± 388 мл крови, полученной при 3,1 + 1,5 венесекции [84\. Переливания аллогенной крови во время операций на сердце не потребовалось у 75 (94 %) детей. Следовало особо отметить, что в обоих исследованиях применялась методика консервирования крови, из-за этого не представлялось возможным дать количественную оценку роли заготовленной предварительно крови.
Предварительно собранную кровь использовали также и при других операциях у детей младшего возраста, в том числе при вмешательствах по поводу болезни Гиршпрунга [85] и при кра-ниосиностозе [86,87]. В последнем из этих исследований кровь получали под анестезией из катетера, введенного в артерию. Наблюдались дети начиная с возраста 6 мес. При соответствующих показаниях применяли острую нормоволемиче-скую гемодилюцию, использовали собранную при операции кровь и назначали r-HuEPO. На фоне всех этих мероприятий у 11 из 13 детей не пришлось прибегнуть к переливанию аллогенной крови.
Если преимущества предварительного накопления крови при операциях по поводу сколиоза у подростков не вызывают вопросов, то польза от этого метода у детей младшего возраста представляется не столь явной. Количество проведенных наблюдений весьма невелико, чтобы можно было судить о том, в какой степени предварительный сбор крови позволяет исключить пере-
Переливание крови и ее компонентов 181
ливание аллогенной крови, особенно при использовании разных методов консервирования собственной крови ребенка. Назначение r-HuE-РО позволяет заготавливать большее количество крови, однако данный метод дорог и требует проведения нескольких инъекций. Некоторые дети болезненно реагируют на процедуры заготовки крови, развивающиеся у них вагусные сосудистые реакции в большинстве случаев не требуют лечения. Наконец, переливание заготовленной крови не позволяет полностью исключить возможность опасности.
Наибольшая из этих опасностей состоит в переливании заготовленной крови не тому реципиенту. Подобные ошибки происходят. Анализ трансфузий собственной крови у 175 детей, лечившихся в ортопедических клиниках, выявил ошибки в 13 случаях [88]. Трое детей получили аллогенную кровь, хотя имелась заготовленная аутологичная кровь. В нескольких случаях заготовленная кровь испортилась из-за проблем с ее хранением, что сделало необходимым переливание аллогенной крови. Одному пациенту перелили заготовленную кровь другой группы. Степень настороженности анестезиолога в отношении трансфузионных реакций может быть низкой, когда считается, что пациенту ввели аутологич-ную кровь. Это уменьшает возможность раннего диагноза и своевременного вмешательства. Помимо гемолиза, вызванного переливанием несовместимых эритроцитов, повышается возможность введения контаминированной крови. Так, 2 из 10 случаев сепсиса, вызванного Yersinia ente-rocolitica, зарегистрированных в США за период с 1991 по 1996 г., были отмечены у больных, кото*-рым переливали аутологичную кровь [89\. Сообщалось также об одном случае острого внутрисо-судистого гемолиза, вызванного трансфузией предварительно собранных, но неправильно обработанных и предварительно замороженных эритроцитов [90].
Остается спорным вопрос о необходимости ре-инфузии всей предварительно собранной крови вне зависимости от потери ее при операции или от показателей гематокрита. У взрослых нередко остается не перелитой около 50 % предварительно заготовленной крови. Соответствующие сведения в отношении детей не опубликованы, но отходы у них могут оказаться гораздо меньше благодаря более тщательному подходу к заготовке крови и отбору доноров. Предварительный сбор крови не должен проводиться у детей, операция которых редко требует переливания крови. Кроме того, лучше отказаться от переливания излишней дозы заготовленной крови, чем вводить ее без достаточных показаний. Представляется рациональным пользоваться более либеральными критериями для переливания аутологичной кро-
т
182 Анестезия в педиатрии
ви, а не аллогенных эритроцитов, особенно в тех ситуациях, где показания к их трансфузии равнозначны. Американское общество анестезиологов в своей Практической инструкции по терапии компонентами крови [36\ отметило, что показания для трансфузии аутологичной ЭрМ могут быть более свободными благодаря меньшему (но все же существенному) риску, связанному с аутологичной кровью. С другой стороны, в Инструкциях по переливанию эритроцитов и плазмы у взрослых и детей [37\, опубликованных Медицинской ассоциацией Канады, указывается на необходимость одинаковых показаний для переливания аутологичной и аллогенной крови.
Острая нормоволемическая гемодилюция
Острой нормоволемической гемодилюцией (ОНГ) называется забор крови у пациента непосредственно перед или после вводного наркоза с ее заменой бесклеточной жидкостью [48\. Термин "ограниченная", или "умеренная", гемодилюция применяют в случаях снижения гематокрита примерно до 28 %. О крайней гемодилюции говорят при снижении гематокрита ниже 20 %. Термин "расширенная острая нормоволемическая гемодилюция" (РОНГ) предложен автором для обозначения использования наряду с другими жидкостями временного кислородного носителя, заменяющего эритроциты.
Основное преимущество ОНГ состоит в снижении потери эритроцитов во время операции. Например, ребенок с предоперационным показателем гематокрита 45 % при кровопотере 500 мл теряет около 225 мл эритроцитной массы. Если же исходный гематокрит 25 %, то утратится всего 125 мл ЭрМ. Кроме того, ОНГ обеспечивает запас цельной свежей аутологичной крови. На проведение ОНГ своим детям соглашаются даже некоторые родители из членов Общества свидетелей Иеговы.
Количество крови, которое можно удалить у ребенка (V), зависит от вычисленного предполагаемого объема крови (ПОК), исходного уровня гематокрита (Гт0), минимально допустимого финального уровня гематокрита (Гтф) и от среднего значения последних двух показателей (Гтср). Например, у ребенка весом 30 кг, ПОК 2,1 л, Гт0 45 % и Гтф 27 % согласно формуле:
V = ПОК х [(Гто~Гтф)] t 1 тср
допустимо удалить около 1 л крови для последующей ее реинфузии:
у = 2Дх (0,45-0,27) =1,05 л. 0,36
Удаленная кровь заменяется растворами коллоидов, кристаллоидов или теми и другими. При ин-фузии кристаллоидов их объем должен быть в 3 раза больше объема взятой крови, так как 2/з их количества выходят из просвета сосудов в межклеточные пространства. Растворы альбумина и других коллоидов, хорошо удерживающиеся в кровотоке, вводят в количествах, равных объему удаленной крови. Основным преимуществом кристаллоидов, помимо меньшей их стоимости, является быстрое выведение избыточной жидкости в последующем под действием диуретиков типа фуросемида (0,5—1 мг/кг), назначаемых перед реинфузией крови.
Кровь можно получать из центральной либо из локтевой вены или из лучевой артерии. Использование вен, расположенных периферийнее локтевой, нерационально из-за слабого потока крови, часто вызывающего свертывание. Кровь собирают в емкости (мешки), содержащие антикоагулянт, обычно цитрат-фосфат-декстрозу (ЦФД). Гемодилюционный набор включает мешки с антикоагулянтом, коннектор Y-типа с адаптером с запором Люэра и идентификационную бирку с обозначением крови реципиента (Autologous Blood Collection Kit 4R5012, Fenwal Division, Baxter Healthcare, Deerfield, IL). Необходимо следить за соответствием между количеством собранной крови и содержанием антикоагулянта в мешке. Использование автоматизированных сборщиков крови и смешивающих приспособлений (так называемых "шейкеров крови") обеспечивает непрерывный контроль за объемом собранной крови и предупреждает ее коагуляцию (Blood Shaker/ Flow and Weigth Monitor Model 1040, Sebra, Tucson, AZ). Каждая собранная единица маркируется с указанием имени ребенка, госпитального номера и времени взятия крови. Хранят кровь в операционной вблизи пациента при температуре, способствующей сохранению функции тромбоцитов. Если предполагаемая реинфузия планируется спустя 8 ч и более после откачивания крови, то ее помещают в смесь льда с водой или в специальный мониторинговый холодильник для крови. Реинфузию проводят лишь после прекращения основной кровопотери или немедленно в зависимости от необходимости. Учет кровопотери и определение динамики уровня гематокрита служат ориентиром для назначения трансфузии.
Минимально допустимый уровень гематокрита зависит от способности ребенка компенсировать снижение содержания кислорода в артериальной крови. Большинство больных хорошо переносят снижение гематокрита до 20 %. Несколько исследований было посвящено определению крайней степени допустимой ОНГ у детей и подростков. Дети сохраняли способность поддерживать обеспечение кислородом при уровне гемоглоби-
на 3 ± 0,8 г/100 мл [50]. При этом показатель извлечения кислорода возрастал с 17 до 44 %, а насыщение кислородом смешанной венозной крови падало с 90,8 + 5,4 до 72,3 ± 7,7 %. У детей из семей членов религиозной секты "Общество свидетелей Иеговы" при снижении уровня гемоглобина до 16 % экстракция кислорода возрастала с 22 до 33 %, а насыщение смешанной венозной крови кислородом снижалось с 80 до 70 % [91]. Безопасность крайней ОНГ была продемонстрирована при операциях фиксации позвоночника. При этом уровень гематокрита достигал 12—14 % и одновременно проводилась легкая гипотермия с контролируемой гипотензией (среднее артериальное давление 40—50 мм рт.ст.) [92\. Если глобальная оксигенация сохраняется даже при очень низком уровне гематокрита у здоровых тщательно отобранных и жестко контролируемых пациентов, то остается неизвестной возможность отрицательного влияния ОНГ на поступление кислорода к отдельным органам и ее воздействие на их функцию.
К ОНГ чаще всего прибегают у больных подросткового возраста, но она была применена и у детей в возрасте до 1 года. В период с 1974 по 1983 г. ОНГ была проведена более чем у 300 детей, оперированных в педиатрическом госпитале [93,94\. При выполнении ОНГ у детей младшего возраста необходимо особо внимательно контролировать процесс взятия крови, следить за количеством удаляемой крови и соответствием этого объема с содержанием антикоагулянта в мешке. Служба переливания крови обеспечивает информацию о количестве антикоагулянта, необходимого для соответствующего объема собираемой крови.
Возвращение крови, теряемой во время операции и после нее
Отсасывание крови из операционного поля можно проводить двухпросветной трубкой, обеспечивающей дозируемое поступление цитрата или гепарина. Кровь с антикоагулянтами собирается в специальной плотной емкости, подвергается центрифугированию в сосудах на 125 мл, приспособленных для педиатрической практики. Отделенные эритроциты отмываются, взвешиваются в изотоническом растворе и перекачиваются в емкость для реинфузии. Оставшийся суперна-тант, содержащий детрит из операционного поля, лейкоциты, тромбоциты, активированные факторы свертывания крови, свободный гемоглобин и антикоагулянты, собирают в отдельную емкость для отходов.
Показатели гематокрита собранной крови обычно колеблются в пределах 50—60 %. Способность сохраненных эритроцитов к переносу
Переливание крови и ее компонентов 183
кислорода и сроки их выживания остаются такими же, а уровень 2,3-DPG — даже выше, чем у эритроцитов консервированной крови [95—97]. Цитрат, использованный в качестве антикоагулянта, подвергается метаболизму в печени. Гепарин, использованный в качестве антикоагулянта, не задерживается эритроцитами в клинически значимых концентрациях [98\. Собранная кровь содержит меньшее количество коагуляционных белков и функционально полноценных тромбоцитов.
Операции на позвоночнике, на сердце и оро-топная трансплантация печени у детей чаще всего проводятся с применением методов сохранения теряемой крови. Применение метода считается противопоказанным при загрязнении раны кишечным содержимым. Присутствие в операционном поле опухолевых клеток традиционно расценивалось как относительное противопоказание к использованию собранной при операции крови. Однако имеются доказательства того, что обеднение лейкоцитами или облучение такой крови перед трансфузией освобождают ее и от клеток опухоли [99,100]. Кровь не следует отсасывать во время наложения на рану локальных гемостатических средств типа тромбина или при орошении раны антибиотиками, не предназначенными для парентерального применения.
Литература переполнена сообщениями по использованию этой методики у взрослых, а в части случаев — и у детей. В одном из подобных исследований из 218 наблюдавшихся пациентов было 139 детей, средний возраст которых составлял 14,5 года [96]. Удалось сохранить и затем реинфузировать 54 % эритроцитов из крови, потерянной при операции у детей, и 68 % — у взрослых. При операциях на позвоночнике у детей удается сохранить и затем реинфузировать от 50 до 80 % эритроцитов теряемой крови [101,102].
Кровь можно собирать и затем реинфузировать также и в послеоперационном периоде. Кардиохирурги уже длительное время рекомендуют реинфузию крови, полученной при дренировании средостения после операций на сердце. Такая кровь во время пребывания в средостении уже подвергалась коагуляции с последующим фибринолизом, она не содержит фибриногена, что устраняет необходимость применения антикоагулянтов перед реинфузией. Уровень гематокрита в ней колеблется от 20 до 25 %, а эритроциты обладают нормальной жизнеспособностью и способностью транспортировать кислород. Продукты распада фибрина обнаруживают у большинства больных, которым переливали неот-фильтрованную кровь из средостения. Это не следует трактовать как признак развития ДВС-синдрома, если отсутствуют клинические при-
184 Анестезия в педиатрии
знаки кровоточивости [103]. Осторожность требуется также и при трактовке показателей ферментативной активности крови таких больных. Повышение его уровня может имитировать лабораторные признаки инфаркта миокарда [104].
Кровь у взрослых часто собирают после радикальных операций на крупных суставах, обычно после тотальной замены тазобедренного или коленного суставов. В педиатрии подобная практика обычно применяется после операций на позвоночнике. Опубликованы предварительные данные по вполне успешному использованию крови, терявшейся у 16 детей после операции Cotrel-Dubousset и заднего остеосинтеза [105]. Объем собранной крови колебался от 200 до 900 мл (в среднем 354 мл).
Возможными осложнениями реинфузии собранной крови могут быть гемоглобинурия (с повреждением почек и без него), коагулопатия из-за введения сохранившихся антикоагулянтов или разведения факторов свертывания крови, воздушная и жировая эмболия, а также сепсис. Подобные осложнения не должны иметь место при точном соблюдении всех инструкций. Гемолиз при отсасывании и сборе крови сводится к минимуму при правильном использовании отсосов и при вакуумном разрежении в допустимых пределах (100—150 мм рт.ст.).
Роль фармакологических средств, снижающих кровопотерю во время операции, продолжает возрастать. Первоначальный энтузиазм по использованию десмопрессин 1-деамино-8-арги-нин вазопрессина (ДДАВП) при операциях на сердце уменьшился после того, как последующие исследования не продемонстрировали дополнительного эффекта от его применения при трансфузии аллогенной крови. Назначение ДЦАВП также не снизило потребность в аллогенной ге-мотрансфузии при операции фиксации позвоночника по поводу идиопатического или нейро-мышечного сколиоза у детей [106,107\.
Апротинин, протеазный ингибитор серина, способен уменьшить кровоточивость и потребность в переливаниях крови при операциях на сердце у детей. Контролируемое и рандомизированное исследование действия апротинина с использованием двойного слепого метода было проведено у 61 ребенка (средний возраст 3,7 года), повторно оперированных на открытом сердце. Потребность в трансфузиях была достоверно ниже при назначении как высоких, так и низких
доз апротинина, по сравнению с введением плацебо [108]. Назначение этого препарата не только снижало количество единиц крови, переливаемой в первые 24 ч после операции, но также сокращало время проведения операции и сроки госпитализации. Другое исследование, проведенное у 31 ребенка, оперированного по поводу врожденных пороков сердца, показало, что назначение апротинина позволило провести операцию без переливания крови в 64 % случаев, в то время как при использовании плацебо это было возможным всего в 25 % случаев [109]. Другое исследование в отношении 80 детей, оперированных по поводу врожденных пороков сердца, подтвердило эффективность апротинина в сокращении сроков сохранения дренажа, времени заживления ран и потребности в трансфузии [110]. Назначение апротинина при паллиативных операциях на единственном желудочке сердца у 46 детей способствовало снижению длительности дренирования и снижению сосудистого сопротивления в системе легочной артерии [111].
Применение апротинина в настоящее время одобрено в США при проведении операций кар-диопульмонального и коронарного шунтирования. Вероятность анафилактических реакций на апротинин существует у всех пациентов, но наиболее велика она у детей с врожденными пороками сердца, нуждающихся в повторных хирургических вмешательствах. Общий риск таких реакций, по оценкам, равен 0,5 %, но он может возрастать до 6—9 % при повторном назначении препарата с промежутками менее 6 мес [112]. Стоимость лечения снижается при использовании малых дозировок апротинина. Применение Е-аминокапроновой и транэксаминовой кислот может стать более дешевой альтернативой апротинина [113,114].

Периоперационное ведение детей с врожденной гематологической патологией должно проводиться в тесном сотрудничестве с детским гематологом. Некоторые подобные заболевания имеют предсказуемое течение, но многие — нет. Важно знать степень тяжести заболевания у каждого ребенка и его реакции на предшествовавшее лечение. Если ребенок уже подвергался операциям, то необходимо пересмотреть соответствующие записи. Может быть повторена предшествующая тактика лечения, если она была успешной, или применены альтернативные методы в случае развившихся осложнений. Многие дети с врожденной патологией крови могут быть достаточно ин-
формированными о своем заболевании и способны участвовать в обсуждении тактики ведения в периоперационном периоде.
Врожденные коагулопатии
Ведение детей с врожденными коагулопатиями существенно изменилось за последние годы. Это касается преимущественно гемофилии А, гемофилии В и болезни Виллебранда (БВб). Концентраты плазменных факторов свертывания крови, освобожденной от вирусов, рекомбинантные продукты, синтетические средства и ДДАВП сделали терапию намного безопаснее. Профилактические режимы снизили частоту и тяжесть суставных поражений у больных гемофилией. Возможно, наибольшим достижением стала редкость переноса вирусных заболеваний, ранее губивших каждого десятого больного гемофилией.
Гемофилия А
Гемофилия А (дефицит фактора VIII) и гемофилия В (дефицит фактора IX) — наследуемое по рецессивному типу заболевание, связанное с аномалией Х-хромосомы и поражающее почти исключительно мальчиков. Примерно в */з случаев заболевание впервые диагностируется у младенцев и детей без каких-либо указаний на подобную патологию в семейном анамнезе. В этих случаях болезнь возникает в результате спонтанной мутации VIII или IX фактора генов [115\. Клинические проявления заболеваний одинаковые, и дифференциальный диагноз возможен лишь при специальных исследованиях. Степень тяжести заболевания бывает различной, но у членов одной семьи она обычно одинаковая. Тяжелые формы отмечаются у 2/з заболевших, у 15 % заболевание имеет среднюю и у 20 % — легкую степень тяжести. Тяжесть выраженности клинической симптоматики зависит от уровня фактора VIII и фактора IX при гемофилии А и гемофилии В соответственно.
Плазматические и рекомбинантные факторы VIII в настоящее время стали доступными для лечения гемофилии А. Их дозировка определяется типом и степенью тяжести кровоточивости и по возможности должна калькулироваться в зависимости от уровня фактора VIII в крови. В среднем 1 ЕД/кг повышает уровень его в плазме на 2 %. Например, для повышения уровня фактора VIII на 50 % необходимо перелить 25 ЕД/кг. При хирургических вмешательствах уровень этого фактора поднимают до 80—100 %. Вводят бо-люсные дозы препарата, повторяя назначение каждые 12 ч. В периоперационном периоде часто прибегают к непрерывному введению фактора VIII. Дети с подавленной способностью к фор-
Переливание крови и ее компонентов 185
мированию антител не реагируют на соответствующие дозы фактора VIII. Реакция на повышенные дозы фактора VIII может возникать у детей с низким титром антител, что в большинстве случаев требует назначения альтернативных средств.
Методом выбора при лечении легких форм заболевания, а также женщин-носителей с пониженным содержанием фактора VIII является ДДАВП [115]. Этот препарат вызывает быстрый выброс из депо фактора VIII и фактора Виллебранда. Первоначальная доза препарата 0,3 мкг/кг. Реакции могут быть различными, но обычно воспроизводимыми у того же пациента. Тахифилак-сия возможна при повторных введениях препарата через небольшие промежутки времени. Анестезиолог должен иметь в виду возможность развития гипонатриемии и водной интоксикации, так как ДДАВП является сильным антидиуретиком. В периоперационном периоде может возникать необходимость ограничивать объем вводимых внутривенно жидкостей.
Гемофилия В
Лечение больных гемофилией В можно проводить несколькими плазматическими и рекомби-нантными препаратами фактора IX. К счастью, тромбозы, ранее развивавшиеся при операциях у больных, получавших концентраты протромби-нового комплекса (например, Конин, Проплекс), не возникают при введении фактора IX. Эти факторы не являются эквивалентом при лечении больных гемофилией В. Процент больных, у которых развивается угнетение, меньше, чем при гемофилии А. В этих ситуациях возможны альтернативные методы терапии.
Болезнь Виллебранда
Болезнь Виллебранда (БВб) относится к наиболее частым врожденным нарушениям свертываемости крови, встречающимся по некоторым данным у 1—2 % населения [115]. Истинная частота данной патологии остается неизвестной, так как легкие формы заболевания обычно не диагностируются. Заболевание следует заподозрить у пациентов при указаниях на длительную кровоточивость в детском возрасте. Носовые кровотечения, длительная кровоточивость после трав или операций, экхимозы после минимальных повреждений, меноррагия и кровоточивость десен относятся к характерным признакам болезни. Ключом к диагнозу могут быть указания в семейном анамнезе на эпизоды недомоганий или кровотечений после приема аспирина. Патология обычно наследуется по аутосомально-доминантному принципу, но может быть вариабельной. Тяжесть
186 Анестезия в педиатрии
заболевания так же, как и реакция на проводимую терапию, могут существенно отличаться у отдельных пациентов.
Основной дефект при болезни Виллебранда связан с фактором Виллебранда (ФВб) большим полимерным гликопротеином плазмы, синтезируемым эндотелиальными клетками и мегака-риоцитами. Присутствие этого фактора бывает необходимым для прилипания тромбоцитов к местам повреждения стенки сосудов. Он также защищает фактор VIII от протеолиза во время циркуляции благодаря тому, что формирует с ним стабилизирующий его комплекс. У пациентов с болезнью Виллебранда отмечаются нарушения качественного и количественного характера. Само заболевание классифицируется по типам в зависимости от структурных особенностей молекулы ФВб. Примерно у 80 % пациентов диагностируют болезнь Виллебранда типа 1, который характеризуется нормальными структурой и функцией ФВб, но слишком низкой его концентрацией. Пациенты с болезнью Виллебранда типа 2 продуцируют ФВб с аномальной структурой и функцией. Уровень же этого фактора может быть нормальным или сниженным. Выделяют несколько вариантов болезни типа 2, которые составляют около 20 % всех случаев этого заболевания. Третий и наиболее тяжелый тип болезни Виллебранда встречается редко. Знание о нем необходимо в связи с особенностями лечения.
Методом выбора при лечении детей БВб типа 1 является назначение ДДАВП [775|. Амбулаторным больным рекомендовано вводить препарат через нос с помощью спрея. В периоперационном периоде препарат вводят внутривенно. Рекомендованы дозы 0,3 мкг/кг каждые 12—24 ч. Антидиуретические свойства препарата могут привести к ги-понатриемии и водной интоксикации. Поэтому на протяжении периоперационного периода необходим мониторинг электролитного состава и ограничение внутривенного введения жидкостей.
Эффект от назначения ДДАВП может отмечаться и при БВб типа 2А. Тест-дозу препарата следует вводить вне периода кровотечения, чтобы проследить за коррекцией времени кровотечения. Пациенты с БВб типа 2А, не реагирующие на введение этого препарата, а также с БВб типов 2В и 3 нуждаются в инфузии концентрата плазматического фактора VIII [115].
Крайне важное значение имеет привлечение детского гематолога к ведению больных коагуло-патиями. Необходимо знание не только типов коагулопатий, но и предшествующих реакций ребенка на проведенную терапию. Речь идет не столько об обычно встречающихся типах коагулопатий, сколько о более редких врожденных коагулопатиях, которые могут встретиться в практике анестезиолога.
Серповидно-клеточная анемия
Замена валина на глутамин в шестой позиции на р-цепи глобина приводит к изменениям гемоглобина, вызывающим заболевание, названное серповидно-клеточной анемией. Полностью оксиге-нированный HbS не вызывает никаких нарушений, но в условиях сниженного напряжения кислорода этот гемоглобин перестраивается, что и придает эритроцитам характерную серповидную форму. Лабораторные исследования показали* что внутриклеточная полимеризация HbS начинается при падении показателей насыщения крови кислородом ниже 85 % [776].
Больные гомозиготным вариантом серповидно-клеточной анемии (т. е. оба гена р-глобина имеют мутацию, характерную для HbS) страдают так называемой SS-болезнью. При сочетании аномального HbS-гена с нормальным НЬА-геном продуцируются оба типа гемоглобина. При электрофорезе у них обнаруживают около 60 % гемоглобина А и 40 % гемоглобина S. У подобных пациентов обнаруживаются серповидные клетки, но обычно без видимых признаков заболевания [777]. Клинические симптомы у них могут отсутствовать, поскольку низкая концентрация гемоглобина S не вызывает серповидной деформации эритроцитов. Выживаемость их остается нормальной, анемия не развивается. Дополнительные нарушения в цепи р-глобина и сниженный синтез этой или многих цепей глобина определяют вариации нарушений и степень выраженности клинической симптоматики.
Дети с серповидно-клеточной анемией (SS-бо-лезнь) страдают от тяжелой анемии, возникающей уже в раннем возрасте. У новорожденных, тем не менее, анемия не развивается, так как у них доминирует HbF, предотвращающий серповидную деформацию эритроцитов. Признаки ее начинают проявляться с возраста 4 мес, когда падает продукция HbF. Уровень гемоглобина при SS-болезни обычно равен 6—9 г/100 мл, а количество ретикулоцитов достигает 10—25 %. По данным электрофореза, от 80 до более 90 % у таких больных составляет HbS.
Серповидно-клеточная анемия проявляется периодическими кризами или обострениями. Иногда возникают признаки аплазии костного мозга, обычно провоцируемые заболеваниями. Во время кризов возможно обтурирование сосудов, приводящее к тканевым инфарктам. Обычно страдают кости, возникают сильные боли. Дети могут нуждаться в госпитализации и назначении наркотических средств для обезболивания. Контролируемое исследование, проведенное с помощью рандомизации и двойного слепого метода, сравнивало внутривенное и энтеральное введение морфина таким пациентам. Эффективность
 Переливание
крови и ее компонентов 187
Переливание
крови и ее компонентов 187
оказалась одинаковой, что позволяет шире проводить амбулаторное лечение таких больных [119\. Аналгезия, контролируемая самим пациентом, применяется все чаще, даже у детей младшего возраста.
Приступы острых болей в груди (острый торакальный синдром) трудно дифференцировать с пневмонией, поскольку лихорадка, кашель, гипоксия, лейкоцитоз и инфильтративные изменения на рентгенограммах одинаковые как для инфаркта, так и для легочной инфекции. Обычно считают, что подобные боли в груди вызваны закупоркой легочных сосудов, тем не менее при этом вполне возможно и присоединение инфекции [120\. Острые боли в животе, вероятнее всего, вызванные нарушениями кровотока в мезен-териальных сосудах, часто неотличимы от симптоматики "острого живота". Острые кризы, связанные с инфарктами селезенки, характеризуются быстро прогрессирующим ее увеличением, накоплением в ней эритроцитов и могут привести к летальному исходу уже в течение немногих часов. Лечение подобных состояний заключается в немедленном восстановлении показателей внутри-сосудистого объема и в трансфузии эритроцитов.
Инсульты регистрируют примерно у 11 % больных серповидно-клеточной анемией. Чаще всего первые подобные эпизоды наблюдаются в возрасте 2—5 лет. Недавно проведенное рандомизированное исследование с использованием метода Допплера у 130 детей (средний возраст 8,3 ± 3,3 года) с высокой степенью риска подтвердило благоприятное действие трансфузий в предотвращении первых случаев инсульта [12Д. Переливания, снижавшие уровень гемоглобина S ниже 30 %, достоверно уменьшали частоту инсультов. В контрольной группе отмечено 10 случаев инфарктов мозга и 1 случай внутримозговой гематомы, в то время как в группе получивших гемотрансфузии инфаркт мозга возник всего у 1 ребенка (достоверное различие в степени риска равно 92 %). Несмотря на убедительность полученных различий, остается ряд нерешенных вопросов. Во-первых, рационально ли ежемесячно проводить трансфузии детям, у подавляющего большинства из которых инсульты вообще на разовьются? Во-вторых, насколько длительно следует проводить подобное лечение?
Ожидаемая продолжительность жизни больных серповидно-клеточной анемией значительно увеличилась за последние 40 лет. В прошлдм вполне обычной была смерть таких детей в возрасте до 5 лет, основной причиной чего были инфекции, вызываемые преимущественно Streptococcus pneumoniae. Профилактика пенициллинбм практически устранила данную причину летальных исходов [120\.
Хирургические вмешательства часто требуется
проводить у многих детей, страдающих серповидно-клеточной анемией. Наиболее частыми из таких операций являются спленэктомия и холе-цистэктомия [122]. Режимы трансфузии остаются наиболее спорным аспектом периоперационного ведения таких пациентов. До совсем недавнего времени стандартной практикой было проводить трансфузии в периоперационном периоде, снижая уровень гемоглобина S ниже 30—50 % и повышая гематокрит примерно до уровня 36 %. Это достигалось при обменном переливании или при "простой" трансфузии. При так называемой простой трансфузии эритроциты (по 10 мл/кг) переливали каждые 3—4 дня начиная с 10—14 дней до операции.
Большие совместные исследования были посвящены изучению частоты осложнений в периоперационном периоде у двух рандомизированных групп больных: у получавших агрессивную трансфузионную терапию для снижения уровня гемоглобина S ниже 30 % (1-я группа) или у получавших более консервативные режимы, направленные на повышение уровня обычного гемоглобина с помощью трансфузий до 10 г/100 мл (2-я группа) [123]. У 551 наблюдавшегося больного было проведено 604 операции. Большинство оперированных были взрослыми, но в исследование включались также и дети. На первом месте по частоте стояла операция холецистэкто-мии, за ней следовали операции на голове и шее, а затем ортопедические операции. За исключением постгрансфузионных осложнений (у 14 % в 1-й группе и 7 % — во 2-й группе), серьезные осложнения наблюдались одинаково часто в обеих группах (у 31 и 35 % соответственно). Острый торакальный синдром развился в 10 % случаев, а болевые кризы, заставившие отложить время выписки, — в. 5 %. Однократная гемотрансфузия была проведена у 11 % больных 2-й группы. В отличие от этого у 57 % больных 1-й группы было проведено заменное переливание крови и у 30 % — повторные трансфузии. Дети из 1-й группы получали в среднем по 3,8 ЕД крови, а дети из 2-й группы — по 1,5 ЕД. Был сделан вывод об одинаковой эффективности обоих режимов в предотвращении периоперационных осложнений. Однако консервативный режим позволил снизить на 50 % частоту постгрансфузионных осложнений.
Та же самая группа авторов сравнивала результаты холецистэктомии у 230 больных, включенных в предыдущее исследование, с результатами этой операции у 134 больных, которым не проводили гемотрансфузии [124]. Холецистэк-томия обычным методом проведена у 58 % больных, а у остальных 42 % — методом лапароскопии. Во втором случае операция занимала больше времени, но пациенты выписывались
188 Анестезия в педиатрии
быстрее. Результаты операции были одинаковыми в обоих случаях. Однако у пациентов, не получавших гемотрансфузии, чаще отмечались сосудистые болевые кризы и острый торакальный синдром.
Консервативный режим переливания ЭрМ, имеющий целью повысить уровень гемоглобина до 10 г/100 мл без уменьшения содержания гемоглобина S, в настоящее время стал общепризнанной практикой при большинстве хирургических вмешательств. Остается сомнительной необходимость трансфузий у детей при небольших операциях [125]. Вполне оправдана концепция о том, что может быть малая хирургия, но не малая анестезия.
Адекватное предоперационное обследование и подготовка, назначение безупречных анестетиков, непрерывное наблюдение и назначение кислорода после операции являются необходимыми. Следует предупреждать такие состояния, как дегидратация, гипоксемия, ацидоз и снижение тканевой перфузии, которые провоцируют изменения эритроцитов. Детям следует давать внутрь обычные жидкости за несколько часов до операции, а во время нее следить за адекватной гидратацией. Идеальным является проведение операции в ранние утренние часы, чтобы уменьшить сроки перерыва в энтеральном поступлении продуктов. Для предотвращения гиперседации и ги-повентиляции лекарственная терапия перед операцией может быть прервана или же соответствующие медикаменты введены уже в предоперационной, где обеспечено непрерывное наблюдение.
Предварительная оксигенация и вентиляция газовой смесью с повышенным содержанием кислорода считаются обязательными. Гипотермия предупреждается повышением температуры в помещении, согреванием вливаемых жидкостей и ингалируемых газов, использованием согревающих одеял и других приспособлений для поддержания температуры тела. Необходимо обеспечить мониторинг газового состава артериальной крови, особенно при больших и длительных операциях на брюшной и грудной полостях.
Регионарная анестезия не противопоказана. Предыдущие сообщения указывали на более высокую частоту осложнений при операциях, выполнявшихся под регионарной анестезией [122]. Однако это могло быть связано не с самой регионарной анестезией, а с типом операций, при котором показано применение этого метода обезболивания. Доза седативных медикаментов при подобном методе должна титроваться особенно точно, а мониторинг быть более строгим для предупреждения передозировки.
Пневматические турникеты можно использовать при операциях в участках с высокой крово-
точивостью. Их применение у пациентов с SS-болезнью не сопровождается ни ацидозом, ни нарастанием частоты необратимой агрегации серповидных клеток [126]. Рекомендовано тщательное обескровливание конечности перед наложением турникета. Умеренная гипервентиляция перед снятием турникета считается полезной, хотя обеспечиваемые при этом преимущества никем не были подтверждены.
Преимущества использования аутологичной крови у пациентов с SS-болезнью остаются неясными из-за ограниченного количества соответствующих наблюдений. Предоперационная заготовка крови у таких больных не столь оптимальна, но вполне допустима [127\. Опубликовано сообщение о кризе из-за трансфузии собранной во время операции и обработанной крови [128]. Признаки патологических изменений в образцах крови от пациентов отсутствуют, хотя серповидная форма может отмечаться у 50 % обработанных эритроцитов. В то же время благоприятные данные были отмечены при операциях с кардио-пульмональным шунтированием у таких больных, как взрослых, так и детей [116]. Этот опыт делает неразумным отказ от сбора крови во время операции и ее использования у больных серповидно-клеточной анемией. Возврат крови также допустим у пациентов с SS-болезнью, особенно у подготовленных с помощью переливаний в предоперационном периоде и при низкой концентрации гемоглобина S [129]. Предложено исследовать мазки обработанной крови на патологию эритроцитов, однако практичность подобного подхода остается сомнительной.
Дети, страдающие серповидно-клеточной анемией, не требуют каких-либо модификаций анестезиологической техники, поскольку изменения их эритроцитов наступают лишь при снижении сатурации до 40 %. Однако при этом необходимо самое тщательное соблюдение всех мельчайших деталей. Анестезиологическое обеспечение детей с серповидно-клеточной анемией может служить моделью для всех анестезиологов.
Наиболее серьезные осложнения (сосудистые кризы, острый торакальный синдром) у больных серповидно-клеточной анемией развиваются в послеоперационном периоде. Пульсокси-метрия и дополнительное назначение кислорода должны быть постоянными. Важное значение имеет адекватная гидратация с помощью энте-рального и/или внутривенного введения жидкости. Анестезиолог должен обеспечить адекватную аналгезию после операции, использовав обезболивание, контролируемое пациентом, или эпидуральную аналгезию. Кроме того, роль анестезиолога велика при устранении болевых сосудистых кризов у детей даже и вне зависимости от операций [130\.
Переливание крови и ее компонентов 189
Опасность переноса заболеваний при гемотрансфузии будет и в дальнейшем оказывать влияние на практику этой службы. Скрининг донорской крови и ее тестирование сделали ее введение наиболее безопасным, чем когда-либо ранее. В настоящее время внедряются все новые методы контроля. Продолжаются исследования по использованию заменителей крови и устранению вирусов. Развиваются исследования роли фармакологических средств, стимулирующих продукцию клеток крови, и совершенствование техники аутологичной трансфузии.
Переливание крови останется и в обозримом будущем методом лечения, спасающим жизнь пациентов. Применение его должно быть разумным, точно документированным, а результаты контролироваться соответствующими клиническими и лабораторными методами. Инструкции по гемотрансфузии должны быть основаны, по возможности, на контролируемых исследованиях, подобно выполненным Исследовательской группой по периоперационным трансфузиям при серповидно-клеточной болезни. Необоснованный страх перед заболеваниями, переносимыми с переливаемой кровью, не должен приводить к отказу от необходимой гемотрансфузии.
Wallace EL, Surgenor DM, Hao HS et al: Collection and transfusion of blood and blood components in the United States, 1989. Transfusion 33:139, 1993
Curran JW, Lawrence DL, Jaffe H et al: Acquired immu nodeficiency syndrome (AIDS) associated with transfu sions. N Engl J Med 310:69, 1984
Centers for Disease Control and Prevention: HIV/AIDS Surveillance Report 10:1, 1998
Goodnough LT, Brecher ME, Kanter MH, et al: Blood transfusion. N Engl J Med 340:438, 1999
Donahue JG, Munoz A, Ness PM et al: The declining risk of post-transfusion hepatitis С virus infection. N Engl J Med 327:369, 1992
Centers for Disease Control and Prevention: Recommen dations for prevention and control of hepatitis С virus (HCV) infection and HCV-related chronic disease. MMWR Morb Mortal Wkly Rep 47(No. RR-19):1, 1998
Schreiber GB, Busch MP, Kleinman SH, et al: The risk of transfusion-transmitted viral infections. N Engl J Med 334:1685, 1996
Alter MJ, Gallagher M, Morris TT, et al: Acute non-A-E hepatitis in the United States and the role of hepatitis G virus infection. N Engl J Med 336:741, 1997
Naoumov NV, Petrova EP, Thomas MG, et al: Presence of a newly described human DNA virus (TTV) in patients with liver disease. Lancet 352:195, 1998
10. Alter HJ, Nakatsuji Y, Melpolder J, et al: The incidence of transfusion-associated hepatitis G virus infection and its relation.to liver disease. N Engl J Med 336:747, 1997
Centers for Disease Control and Prevention and the U. S. P. H. S. Working Group: Guidelines for counseling persons infected with human T-lymphotropic virus type I (HTLV-I) and type II (HTLV-II). Ann Intern Med 118:448, 1993
Sayers MH: Transfusion-transmitted viral infections other than hepatitis and human immunodeficiency virus infec tion. Cytomegalovirus, Epstein-Barr virus, human herpes- virus 6, and human parvovirus B19. Arch Pathol Lab Med 118:346, 1994
Herrera GA, Lackritz EM, Janssen RS, et al: Serologic test for syphilis as a surrogate marker for human immun odeficiency virus infection among United States blood do nors. Transfusion 37:836, 1997
Dobroszycki J, Herwaldt BL, Boctor F, et al: A cluster of transfusion-associated babesiosis cases traced to a single asymptomatic donor. JAMA 281:927, 1999
Murphy MF: New variant Creutzfeldt-Jakob disease (nvCJD): the risk of transmission by blood transfusion and the potential benefit of leukocyte-reduction of blood com ponents. Transfus Med Rev 13:75, 1999
Linden JV, Kaplan HS: Transfusion errors: causes and ef fects. Transfus Med Rev 8:169, 1994
Vamvakas EC: Transfusion-associated cancer recurrence and postoperative infection: meta-analysis of randomized, controlled clinical trials. Transfusion 36:175, 1996
Landers DF, Hill GE, Wong КС, et al: Blood transfusion- induced immunomodulation. Anesth Analg 82:187, 1996
Triulzi DJ, Vanek K, Ryan DH, Blumberg N: A clinical and immunologic study of blood transfusion and postop erative bacterial infection in spinal surgery. Transfusion 32:517, 1992
Patten E, Robbins M, Vincent J et al: Use of red blood cells older than five days for neonatal transfusion. Am J Perinatol 11:37, 1991
Lee DA, Slagle ТА, Jackson TM, et al: Reducing blood donor exposures in low birth weight infants by the use of older, unwashed packed red blood cells. J Pediatr 126:280, 1995
Strauss RG, Sacher RA, Blazina JF, et al: Commentary on small-volume red cell transfusions for neonatal pa tients. Transfusion 30:565, 1990
British Committee for Standards in Haematology Blood Transfusion Task Force: Guidelines for administration of blood products: transfusion of infants and neonates. Transfus Med 4:63, 1994
Hume H, Bard H: Small volume red blood cell transfu sions for neonatal patients. Transfus Med Rev 9:187, 1995
Luban NLC: Massive transfusion in the neonate. Transfus Med Rev 9:200, 1995
Brecher ME, Taswell HF, Clare DE et al: Minimal-expo sure transfusion and the committed donor. Transfusion 30:599, 1990
Strauss RG, Wieland MR, Randels MJ, Koerner TAW: Feasibility and success of a single-donor red cell program for pediatric elective surgery patients. Transfusion 32:747, 1992
Chambers LA: Evaluation of a filter-syringe set for prep aration of packed cell aliquots for neonatal transfusion. Am J Clin Pathol 104:253, 1994
Ciavarella D, Snyder E: Clinical use of blood transfusion devices. Transfusion Med Rev 2:95, 1988
Przepiorka D, LeParc GF, Werch J, et al: Prevention of transfusion-associated cytomegalovirus infection. Practice Parameter. Am J Clin Pathol 106:463, 1996
Sirchia G, Rebullla P: Evidence-based medicine: the case for white cell reduction. Transfusion 37:543, 1997
Przepiorka D, LeParc GF, Stovall MA, et al: Use of irra diated blood components. Practice parameter. Am J Clin Pathol 106:6, 1996
Manno CS, Hedberg KW, Kim HC et al: Comparison of the hemostatic effects of fresh whole blood, stored whole
 Сердечно-легочная
реанимация
Сердечно-легочная
реанимация
Д ОНАЛЬД X. ШАФФНЕР (DONALD H. SHAFFNER), ЧАРЛЬЗ Л. ШЛЕЙЕН (CHARLES L. SCHLEIEN), МАРК К. РОДЖЕРС (MARK С. ROGERS)
Еще в конце 1950-х годов при остановке сердца во время наркоза детям в течение 1,5 мин проводили так называемое искусственное дыхание [1], нажимая коленом на грудную клетку с последующей торакотомией и прямым массажем сердца. В 1958 г. закрытый массаж сердца был с успехом применен у ребенка 2 лет [2\. Этот случай вместе с несколькими последующими примерами эффективной реанимации пациентов, в том числе и находящихся под наркозом, способствовал росту популярности метода закрытого массажа сердца [5]. Высокая эффективность этого метода реанимации после остановки сердца в операционной (42 %) [4] способствовала тому, что закрытый (или непрямой) массаж сердца стал стандартным способом сердечно-легочной реанимации (СЛР).
Из всех учтенных в 1961 г. случаев остановки сердца 44 % произошли в операционной [4\. Остановка сердца во время наркоза, хотя и гораздо реже, но все же встречается и в настоящее время: дети, особенно младенцы, относятся к группе повышенного риска. Остановка сердца во время наркоза у детей происходит в 3 раза чаще, чем у взрослых [5,6\. Опасность этого наиболее велика у ребенка в возрасте до 1 года [7,8]. Причины
столь высокой частоты этого осложнения у детей неизвестны. Среди этиологических факторов остановки сердца во время наркоза первостепенное значение имеют нарушение проходимости дыхательных путей, передозировка ингаляционных средств, обусловленная сукцинилхолином аритмия и применение неадекватных объемов [5,6,8,9]. Согласно последним публикациям, чаще всего остановка сердца происходит на протяжении фазы поддержания наркоза [Щ. Непредвиденные нарушения проходимости дыхательных путей, вызванная сукцинилхолином гиперкалие-мия, злокачественная гипертермия, аспирация и аллергия на латекс в последние годы стали более редкой причиной остановки сердца, чем это имело место в прошлом [Щ. Причины остановки сердца и их предупреждение суммированы в табл. 7.1.
Реанимация по поводу остановки сердца наиболее эффективна в условиях операционной по сравнению с любой иной обстановкой (успешная реанимация в 42 и в 9 % случаев соответственно) [4]. Самые последние сообщения указывают на 53 % эффект оживления детей при остановке сердца во время наркоза [10]. Более высокая эффективность реанимационных мероприятий при
193
194 Анестезия в педиатрии

Успешная СЛР предусматривает своевременное ее начало, восстановление дыхания и циркуляции, а также их поддержание до устранения причин, вызвавших остановку сердца. Эта последовательность действий остается одинаковой при всех поводах для реанимации и не зависит от того, проводится ли она на улице или в операционной. Чем раньше будут предприняты эти меры, тем больше надежд на успешный исход СЛР.
Распознавание необходимости СЛР
Решение о необходимости СЛР у ребенка надо принимать при обнаружении неадекватности главных признаков жизнедеятельности. Осознание потребностей в церебральной и кардиальной перфузии у ребенка необходимо для адекватной оценки наиболее важных жизненных параметров. Вряд ли подобное требование относится ко всем пациентам детского анестезиолога, но его опыт и навыки в отношении детей необходимы для верной оценки необходимости в подобной перфузии. Знание соответствующей значимости вариантов гемодинамики у детей помогает снизить потребность в реанимации. Подтверждением правильности этого положения служит тот факт, что СЛР у детей приходится предпринимать гораздо реже при проведении наркоза детским анестезиологом по сравнению с анестезией, выполняемой анестезиологом общего профиля [8\.
СЛР должна начинаться немедленно при появлении признаков неадекватной циркуляции, не обеспечивающей мозг или сердце кислородом, метаболитами или жизненно важными медикаментами. Признаки нарушения дыхания и кровообращения должны быть достаточно явными у
детей, находящихся в операционной-, и подвергнутых инвазивным методам мониторинга. При отсутствии последних наиболее верными способами определения пульса и сердечного ритма остаются выслушивание грудной клетки и пальпация плечевой или бедренной артерии [11,Щ. Лучше всего определять пульс у детей и взрослых на сонной артерии. Обнаружение только пульса или тонов сердца недостаточно для адекватной перфузии, которая возможна лишь при соответствующих показателях сердечного ритма и кровяного давления.
Восстановление дыхания
Воздух, выдыхаемый спасателем, содержит 16 % кислорода и может обеспечить вполне адекватную оксигенацию жертвы (SaO2 до 90 % и более) [13\. Этот момент служит основой для всех участников СЛР в случаях, когда другие источники кислорода недоступны. Введение 100 % кислоро-

Прежде всего необходимо убедиться, обеспечивает ли периодическое сдавливание грудной клетки достаточную вентиляцию у реанимируемого пациента [3\. К сожалению, обструкция мягкими тканями часто препятствует адекватной вентиляции у таких пациентов, что делает необходимой интубацию и вентиляцию с положительным давлением [14\. Другие вспомогательные методы обеспечения проходимости дыхательных путей не могут заменить эндотрахеальную интубацию у детей [15\. Введение эндотрахе-альной трубки (ЭТТ) остается методом выбора, а правильность ее установки контролируется величиной СО2 в конце дыхательного объема РЕтсо2 (presence of end-tidal CO2).
Частота ошибочного введения эндотрахеальной трубки в пищевод ребенка наиболее велика при
Сердечно-легочная реанимация 195
остановке сердца (19—26 % неадекватной интубации пищевода по сравнению с 3 % в иных ситуациях) [16,17[. Величины Ретсо* после интубации могут служить надежным критерием правильной установки ЭТТ у ребенка со спонтанной циркуляцией [76]. Слабый легочный кровоток, обеспечиваемый СЛР при остановке сердца, создает ошибочно низкие показатели РЕТСо2 даже при правильно установленной эндотрахеальной трубке (у 14— 15 % детей при правильной интубации и реанимации по поводу остановки сердца) [16,17\. Доступные же измерению величины РЕТСо2 могут служить доказательством правильной эндотрахеальной интубации. При невозможности определить этот показатель правильность установки ЭТТ контролируют визуально. Введение ряда лекарственных средств с помощью ЭТТ обеспечивает их поступление в общую циркуляцию (табл. 7.2).
Сопоставление разных характеристик вентиляции во время искусственного дыхания методом сдавливания грудной клетки выявляет существенные особенности оксигенации, циркуляции воздуха и гемодинамики [Щ. Назначение кислорода как под постоянным положительным давлением в дыхательных путях, так и без него обеспечивает адекватную оксигенацию, но не вентиляцию и гемодинамику. Вентиляция, проводимая независимо от сдавливания грудной клетки, перемежающаяся или синхронизированная с ним, способствует адекватной оксигенации, но гемо-динамический эффект при этом весьма вариабелен. Изменения внутригрудного давления во время вентиляции оказывают влияние на гемодинамику. Одновременная вентиляция и сдавливание грудной клетки в наибольшей степени способствуют кровотоку и, как было показано в экспериментах на собаках, увеличивают выживание животных. Правда, эта СЛР проводилась в условиях эксперимента. По современным рекомендациям у интубированных пациентов отнюдь не обязательно синхронизировать вентиляцию со сдавливаниями грудной клетки. В отличие от этого у неинтубированных пациентов вентиляцию следует проводить в промежутках между компрессиями [Щ.
Восстановление кровообращения
Механизмы кровотока во время СЛР
По предположениям Kouwenhoven и соавт. [3\ при наружном массаже сердца оно сдавливается между грудиной и позвоночником, что усиливает выбрасывание из него крови. Это предположение о прямой компрессии сердца во время наружной СЛР стало известным как механизм сердечного насоса. Он основывается на том, что во время компрессии атриовентрикулярные клапаны закрыты,
196 Анестезия в педиатрии

Ряд исследований гемодинамики во время наружного массажа сердца не подтвердил существования механизма сердечного насоса (табл. 7.3). Во-первых, повышение артериального и венозного внутригрудного давления во время наружного массажа предполагает также и общее повышение давления в грудной полости [20\. Во-вторых, восстановление целостности грудной клетки у больных с флотирующей грудиной повышает кровяное давление во время СЛР (по иронии механизм сердечного насоса основан на том, что такая грудина должна непосредственно сдавливать сердце, обеспечивая реанимацию) [21]. В-третьих, у больных при развитии фибрилляции желудочков кровоток еще сохраняется на достаточном уровне для поддержания сознания, если они способны повторно кашлять или делать глубокие вдохи [22—25]. Предположение о том, что стимуляция кровотока происходит благодаря повышению внутригрудного давления без непосредственного сдавливания сердца (например, при кашле), получило название механизм торакального насоса, действующего при СЛР. Продолжаются усиленные исследования обоих механизмов восстановления кровотока при СЛР.
Механизм торакального насоса
Сдавливание грудной клетки во время СЛР создает почти одинаковое давление в левом желудочке, аорте, правом предсердии, легочной арте-
рии, в дыхательных путях и пищеводе [21,25— 31]. Поскольку давление во внутригрудных сосудах остается одинаковым, то внеторакальное давление в артериях должно быть выше внетора-кального давления в венах, что способно обеспечить градиент давления, необходимый для церебральной перфузии. Венозные клапаны, функциональные или анатомические, препятствуют прямой передаче повышенного внутригрудного давления на супраторакальные вены. Подобный яремный венозный клапан имеется у животных [21,26,32—37\ и человека [30,31,33,38— 40]. Такая неэквивалентная передача внутригрудного давления на супраторакальные сосуды определяет возникновение градиента, необходимого для тока крови в направлении мозга во время СЛР.
В нормальных условиях небольшое давление со стороны предсердия на атриовентрикулярный клапан определяет венозный возврат. Экстраторакальное смещение области этого давления в направлении яремной вены и ее клапана, происходящее при действии механизма торакального насоса, подразумевает, что сердце становится всего лишь трубопроводом этого механизма. Ан-гиографические исследования показали, что при простом сдавливании грудной клетки кровь проходит из полой вены в правое сердце и затем в легочную артерию, а из легочной вены — в левое сердце и затем в аорту [28,33]. В отличие от нормального сердечного цикла и открытого массажа сердца, при закрытом методе СЛР, как показали эхокардиографические исследования у собак [28,33] и людей [41—43], атриовентрикулярный клапан открывается уже при выведении крови. Кроме того, также в отличие от нормальных условий и открытого массажа в этот момент диаметр аорты уменьшается, а не увеличивается [33,42]. Эти данные теоретически обосновывают механизм торакального насоса и показывают, что сердце может становиться пассивным проводником кровяного потока.
Сердечно-легочная реанимация 197
 Механизм
сердечного
насоса
Механизм
сердечного
насоса
Явные доказательства существования механизма торакального насоса при наружном сдавливании грудной клетки не исключают того, что в некоторых ситуациях предпочтительнее прибегать к СЛР методом закрытого массажа сердца, приводящему в действие механизм кардиального насоса. Во-первых, применение значительных усилий при компрессиях грудной клетки повышает вероятность прямого сдавливания сердца. Более сильное сдавливание грудной клетки у животных во время СЛР плотнее закрывает атриовентрику-лярный клапан, что подразумевает непосредственное сдавливание сердца [44,45]. Во-вторых, меньшие размеры грудной клетки повышают вероятность прямого сдавливания сердца. Более хорошие гемодинамические показатели достигались при закрытом массажа сердца у взрослых собак с меньшими размерами грудной клетки, чем у собак с крупной грудной клеткой [46]. В-третьих, более податливая грудная клетка у ребенка в значительно большей степени обеспечивает прямое сдавливание сердца. СЛР закрытым методом в эксперименте на поросятах обеспечивала гораздо лучший кровоток, чем аналогичный метод у взрослых животных [47]. В отличие от взрослых вентиляция, проводимая одновременно с компрессией (ОКБ), не улучшала кровоток, создаваемый при СЛР у молодых животных [48]. Подобная неспособность ОКВ улучшить кровоток, обеспечиваемый при СЛР, отмечена и в опытах на щенках [46]. Отмеченные дополнительные преимущества по сравнению с ОКВ при проведении СЛР закрытым методом у детей и молодых животных предполагают хорошую компрессию (возможно и прямое сдавливание сердца) и то, что дополнительное внутригрудное сдавливание уже не обеспечивает преимуществ.
Недавние исследования с применением транспищеводной эхокардиографии показали, что ат-риовентрикулярный клапан действительно закрывается во время СЛР у человека [49,50]. Закрытие этого клапана происходит также при воссоздании модели торакального насоса в опытах с СЛР на животных [51]. Эти сведения подтверждают сдавливание сердца во время СЛР.
Распределение кровотока во время СЛР
Во время проведения СЛР распределение кровотока отличается от нормального физиологического статуса. Общее количество крови в кровотоке снижается, и кровоток распределяется таким образом, чтобы сохранить возможно более оптимальные условия для мозга и сердца. Подобное перераспределение кровотока к жизненно
важным органам должно обеспечивать лучший исход СЛР. Поддержание кровоснабжения миокарда во время СЛР необходимо для восстановления спонтанной гемоциркуляции, а кровоток в мозге определяет качественные показатели всего лечения.
Перераспределение кровотока в направлении мозга определяется следующими тремя градиентами давления: внутриторакально-супраторакаль-ным, внутрикраниально-внекраниальным и кау-дально-ростральным.
Первый из указанных градиентов, внутритора-кально-супраторакальный, обеспечивает ток ок-сигенированной крови из грудной клетки в направлении верхней конечности и головы. Либо венозный коллапс, возникающий из-за повышения внутригрудного давления, либо закрытие клапана в яремной вене предотвращают передачу повышенного внутригрудного давления на венозную систему [21,33,34]. Артериальный коллапс не наступает, и повышенное внутригрудное давление создает тот градиент, который и способствует супраторакальному току крови.
Второй градиент предусматривает движение потока крови от экстракраниальных супратора-кальных сосудов в направлении внутрикраниаль-ных. Вазоконстрикторы почти не действуют на внутримозговые сосуды, но вызывают сужение экстракраниальных, усиливая тем самым мозговой кровоток. Применение эпинефрина, обладающего сосудосуживающим действием, вызывает констрикцию сосудов кожи головы, мышц и языка, одновременно усиливая внутричерепной кровоток [47].
Третий градиент создается в самих внутричерепных сосудах. Одна только СЛР, вероятно, усиливает кровоток в каудальном отделе головного мозга, а ишемия, предшествовавшая СЛР, включает механизмы, существенно увеличивающие кровоток именно в данной области мозга [52—54]. Точно так же более значительный кровоток в мозге имеет место и при других формах глобальной ишемии [55].
Кровоток в миокарде не получает тех преимуществ от высокого экстраторакального градиента давления, которые столь важны для кровоснабжения мозга. Торакальный насос создает одинаковые нагрузки на все внутригрудные структуры. Подобное равенство градиентов является причиной слабого кровотока в миокарде в момент наружного сдавливания грудной клетки. Многочисленные исследования подтвердили, что СЛР методом закрытого массажа стимулирует ток крови в миокарде значительно слабее, чем движение крови в направлении мозга [47,52,56].
Тип проводимой СЛР существенно влияет на ток крови в миокарде. Изучение методов, основанных на прямой компрессии сердца, например
198 Анестезия в педиатрии
высокоимпульсивная СЛР, показало весьма высокий кровоток в миокарде [56,57\. Важное значение при СЛР имеет не только прямое сдавле-ние сердца, но и сама фаза компрессии, во время которой и происходит ток крови через миокард. Он возникает преимущественно в периоды релаксации [57] и коррелирует с так называемым диастолическим давлением [28] либо же осуществляется в момент компрессии, соответствуя систолическому давлению [47,52[.
Регионарный кровоток в миокарде во время СЛР, по-видимому, также изменяется: соотношение нормального распределения субэндокарди-альных отделов к субперикардиальным, равное 1,5:1, смещается до 0,8:1 [47]. Под влиянием введенного эпинефрина это соотношение нормализуется.
Кровоснабжение всех остальных органов во время СЛР резко падает. Исследования на животных показали, что в это время несостоятельность клапанов в инфраторакальных венах приводит к ретроградной трансмиссии и снижению кровотока ниже уровня диафрагмы [58\. Соответствующие наблюдения показали, что кровоток в инфраторакальных органах во время СЛР опускается ниже 20 % исходного (до остановки сердца) и часто почти не обнаруживается [52,59—61]. Дополнительная абдоминальная компрессия не нарушает ток крови во внутригрудных органах [59,61]. Введение эпинефрина во время СЛР методом закрытого массажа почти прекращает кровообращение в органах ниже диафрагмы, за исключением только надпочечников [62].
Имеется очень немного сведений о легочном кровотоке во время СЛР. Он осуществляется главным образом в период снижения внутригруд-ного давления при закрытом массаже сердца [28]. Высокое давление в экстраторакальных венах, создающееся во время компрессии, способствует пульмональному наполнению во время релаксации и падения внутригрудного давления. Методы реанимации, снижающие внутригрудное давление, могут способствовать лучшему наполнению легочных сосудов.
Темп и режим цикла
В 1986 г. Американская ассоциация кардиологов и кардиореаниматологов рекомендовала повысить темп компрессий грудной клетки с 60 до 100 в минуту [63\. Эта рекомендация отражала компромисс между сторонниками механизма торакального насоса и специалистами, убежденными в преимуществах механизма сердечного насоса [64]. Согласно этим двум теориям, механика кровотока различна, однако более быстрый темп сдавливаний благотворен в обоих случаях. Необходимо правильно понимать термины: темп ком-
прессии, режим цикла и сила компрессии для верного понимания механизма СЛР.
Темп компрессии — это число циклов в минуту. Режим цикла — это соотношение продолжительности фазы компрессии к общей длительности цикла компрессия — релаксация в процентах. Например, при темпе 60 компрессий в минуту (общая длительность цикла 1 с) 0,6 с фазы компрессии составят 60 % режим цикла. Режиму цикла отводится разная роль каждой из теорий механизма кровотока (см. табл. 7.3). Сила компрессии — это не только величина прилагаемого давления на грудную клетку, но и скорость его выполнения.
Если кровоток генерируется прямым сдавливанием сердца (сердечный насос), то сила компрессии детерминирует ударный объем. Удлинение компрессии (увеличение режима цикла) сверх времени, необходимого для полного извержения крови из желудочка, никоим образом не увеличивает ударный объем согласно данной теории. Напротив же, ускорение темпа компрессий повышает сердечный выброс, поскольку при каждой из компрессий извергается определенное количество крови. Поэтому, согласно теории кардиального насоса, кровоток зависит преимущественно от темпа, но не от режима цикла.
Если кровоток генерируется механизмом торакального насоса, то объем крови, извергаемый при компрессии, будет больше емкости торакальных сосудов. Согласно механизму торакального насоса, повышение как силы компрессии, так и режима цикла увеличивают кровоток. Изменение темпа компрессии увеличивает кровоток лишь до определенного предела [65]. Но кровоток, согласно теории торакального насоса, в большей степени зависит от режима цикла, а не от теша компрессии.
Согласно математической модели, при действии механизма торакального насоса как сила компрессии, так и ее продолжительность детерминируют кровоток [66,67]. Эксперименты на животных показали, что как торакальный, так и кардиальный насос способны генерировать эффективный кровоток во время СЛР закрытым способом. Различия между результатами отдельных исследований можно было объяснить особенностями примененных методов СЛР и техникой выполнения компрессии. Эти различия могли быть связаны со степенью податливости грудной клетки, ее геометрией, возрастом и степенью зрелости подопытных животных, а также с методикой компрессии грудной клетки. Например, у младенцев можно использовать любой способ j сдавливания их податливой грудной клетки. Различия в технике могли касаться степени подвижности и смещаемости грудины, силы производимой компрессии, ее темпов и режима цикла.
Сердечно-легочная реанимация 199
Ряд исследований на собаках показал преимущество быстрого темпа компрессий (120 в минуту) по сравнению с более медленным, обычно применяемым при СЛР [57,64,68]. Эффективность стандартных методов СЛР оказалась одинаковой при проведении ее у поросят [69], щенков [70] и у людей [38,71,72\. При исследовании у поросят режим цикла оказался ведущим фактором, определявшим перфузионное давление в сосудах мозга [68]. Режим цикла, при котором лимитировался венозный возврат, зависел от возраста. Повышение режима давало более высокий эффект у молодых поросят и с большей вероятностью лимитировало венозный возврат у взрослых.
Расхождения в степени оценки значимости темпов компрессии и режима цикла в разных моделях послужили основанием для сомнений. Увеличение темпов компрессии до 100 в минуту удовлетворило как сторонников более высоких темпов, так и защитников более продолжительного режима цикла, поскольку спасателю физически легче придерживаться 50 % цикла с темпом 100, а не 60 компрессий в минуту (удержание компрессии физически тяжелее при более медленном темпе). Есть все основания придерживаться рекомендаций Американской ассоциации кардиологов от 1986 г. по проведению СЛР. Рекомендации по ускорению темпов компрессии продолжают действовать [ 73].
Геометрия грудной клетки
Особенности геометрии грудной клетки играют важную роль в способности генерировать внут-ригрудное давление с помощью экстраторакальной компрессии. Форма, податливость и деформируемость грудной клетки — это главные ее характеристики, влияющие на эффективность СЛР. Возраст пациента самым непосредственным образом влияет на каждую из этих характеристик, поэтому понятны различия результатов СЛР, выполняемой в экспериментах на молодых и взрослых животных.
Форма грудной клетки
Изменения поперечных размеров грудной клетки при ее компрессии в переднезаднем направлении зависят от ее формы [70]. Торакальный индекс представляет собой соотношение переднезаднего диаметра грудной клетки к латеральному ее диаметру. Килевидная грудная клетка, обычная для взрослых собак, имеет более значительный пе-реднезадний диаметр и соответственно торакальный индекс больше 1. У худых людей с плоской грудной клеткой боковой диаметр значительно больше переднезаднего, и торакальный индекс
меньше 1. Округлая (бочкообразная) грудная клетка характеризуется торакальным индексом, близким к 1, потому что поперечные ее размеры больше, чем при грудной клетке эллипсовидной формы. При компрессии в переднезаднем направлении округлая грудная клетка уплощается, сдавливая находящиеся в этом участке органы. В противоположность этому грудная клетка киле-видной формы при подобной компрессии приближается к округлой. Однако поперечный ее размер уменьшается лишь после того, как под влиянием компрессии такая грудная клетка начинает уплощаться. Это своеобразная пороговая дистанция, после прохождения которой происходит сдавливание внутригрудных органов [74]. Поэтому округлые и уплощенные грудные клетки щенков и поросят для генерирования кровотока при СЛР требуют гораздо меньшего смещения, чем килевидные грудные клетки взрослых животных. Соответственно эффективность внешней торакальной компрессии у щенков с их округлой грудной клеткой выше, чем у взрослых собак, которые имеют килевидную грудную клетку [46].
Податливость грудной клетки
По мере старения хрящи скелета грудной клетки обызвествляются, податливость их уменьшается. Ригидная, малоподатливая, старая грудная клетка требует приложения гораздо большего компрессионного усилия для уменьшения ее переднезаднего диаметра. Так, одинаковое смещение у 3-месячного поросенка требует гораздо больших усилий, чем у поросенка в возрасте 1 мес [741. Податливость грудной клетки влияет не только на степень ее смещения, но и на сами сдавливаемые органы. Прямое компрессионное воздействие на сердце лучше всего обеспечивается у молодых животных с их эластичной грудной клеткой. Церебральный кровоток, создаваемый при СЛР у поросят, значительно сильнее, чем можно было бы ожидать, по сравнению с данными у взрослых животных [47]. Более податливая грудная клетка ребенка может обеспечить прямую компрессию сердца, создавая кровоток, вполне сопоставимый с возникающим при открытом массаже сердца.
Деформация грудной клетки
Изменение формы грудной клетки происходит при длительной СЛР. По мере продолжения реанимационных мероприятий грудная клетка несколько уплощается, уменьшается ее переднезад-ний диаметр. Нарастающая деформация может быть благотворной, если она приводит к прямой компрессии сердца. К сожалению, излишняя де-
200 Анестезия в педиатрии
формация затрудняет расправление грудной клетки в промежутках между ее ^давлениями. Подобное ограничение респравляемости по мере усиливающейся деформации грудной клетки ограничивает смещаемость и снижает эффективность наружной компрессии.
Педиатрическая модель обычной СЛР подтвердила прогрессирующее снижение сроков, в течение которых компрессия грудной клетки продуцирует эффективный кровоток [47,75]. По этой модели стойкая деформация грудной клетки сопровождается уменьшением переднезаднего ее диаметра на 30 % от исходной величины. Попытки уменьшить эту деформацию с помощью повышенного внутригрудного давления путем проведения ОКВ во время реанимации не дали эффекта [48]. При этом не изменились ни величина деформации, ни сроки ухудшения кровотока. Для уменьшения деформации применяли один из способов СЛР у молодых животных, основанный на использовании компрессионной жилетки. Подобная жилетка равномерно распределяет давление по всей грудной клетке и тем самым значительно уменьшает перманентную деформацию (3 % вместо 30 %) [76]. К сожалению, нарушения кровотока развиваются и при этом методе, что может зависеть только от степени деформации.
Остается неясной возможность экстраполяции на человека результатов исследования роли геометрии грудной клетки при СЛР у животных. Исследования, проведенные у 9 взрослых пациентов в процессе СЛР, показали, что масса тела, величина поверхности, окружность грудной клетки и ее диаметр не коррелируют с давлением в аорте во время реанимации [30]. Нельзя было говорить о прямой сопоставимости СЛР у взрослых и детей. Более высокая податливость и деформируемость грудной клетки у ребенка позволяют полагать, что СЛР у них будет более эффективной, чем у взрослых (аналогично модели на животных).
Обеспечение циркуляции
Эффективность кровотока во время СЛР
Кровоток, создаваемый при обычном способе СЛР (закрытый массаж сердца), без использования фармакологических средств очень невелик. У собак он варьируется от 3 до 14 % от состояния перед остановкой сердца [61,77—80]. Церебральное перфузионное давление также низкое, от 4 до 24 % от исходной величины у животных [61,77,78] и только 21 мм рт.ст. у человека [40]. Ток крови в миокарде особенно низок: 1—15 % исходных показателей у собак [26,59,65,76,80].
Перфузионное давление в миокарде у собак коррелирует с кровотоком в нем. Графическое отображение кровотока в миокарде (мл/мин/г) в связи с перфузионным давлением в нем (мм рт. ст.) склоняется к 0,01—0,015 [59,62]. Эти данные позволяют полагать, что соотношение между кровотоком в миокарде (средние величины в мл/мин/100 г) и перфузионным давлением (мм рт. ст.) приближается к 1:1.
Помимо фармакологических средств, на кровоток в мозге и миокарде во время СЛР влияют и другие факторы. Это возраст пострадавшего, его внутричерепное давление, длительность проведения реанимации и сроки предшествующей ей ишемии.
Возраст оказывает несомненное влияние на состояние церебрального кровотока во время СЛР. Так, у поросят 2-недельного возраста мозговой кровоток снижается лишь на 50 %, хотя в миокарде он составляет всего 17 % от состояния перед остановкой сердца. У взрослых животных эти показатели гораздо ниже [47]. Два исследования, проведенные у свиней постарше, дали противоположные результаты. Церебральный кровоток во время СЛР при первом из них колебался от 26 до 95 %, а при втором — от 1 до 4 % от исходного. Соответственно и ток крови в миокарде у них был от 2 до 8 % и от 1 до 6 % [58,60], т. е. церебральный кровоток при первом из этих исследований был значительно выше, чем во втором, в то время как ток крови в сердце оказался почти одинаковым.
Внутричерепное давление определяет отток крови от мозга, но при его повышении ингиби-руется церебральная перфузия. Внутричерепное давление повышается в ответ на увеличение внутригрудного во время СЛР методом закрытого массажа сердца [81]. Эта зависимость имеет линейный характер, т. е. подразумевается, что треть от повышения внутригрудного давления передается на давление в сосудах мозга [35]. Не установлено связи между передачей эндоторакально-го давления на внутричерепное с давлением в ка-ротидных или яремных сосудах. Передача его может быть частично блокирована током венозной крови или цереброспинальной жидкости [35]. Связь повышения внутричерепного давления с компрессией грудной клетки становится очевидной при исходно высоких показателях давления в полости черепа, спровоцированных перетяжкой брюшной полости (при этом 2/з повышения внутригрудного давления передается на внутричерепное). Клиницист должен быть особенно насторожен и помнить о значительном ухудшении эффективности СЛР при повышенном внутричерепном давлении. Поэтому меры по снижению внутричерепного давления (клапанный шунт, дренирование гематомы) должны быть приняты
Сердечно-легочная реанимация 201
 на
возможно более ранних этапах.
Эффективность
СЛР значительно ухудшается при исходном
увеличении внутричерепного давления.
на
возможно более ранних этапах.
Эффективность
СЛР значительно ухудшается при исходном
увеличении внутричерепного давления.
Увеличение продолжительности СЛР оказывает неблагоприятное влияние на церебральный кровоток и, возможно, является одним из наиболее важных критериев у младенцев [47,60]. Продолжительность периода ишемии до начала СЛР также оказывает отрицательное влияние на церебральный кровоток [53,82]. По мере удлинения периода ишемии последующее восстановление кровотока в передних отделах мозга достигается в меньшей степени, чем в стволовой части [53,54]. Гипотермия, по данным опытов на собаках, оказывает некоторое протективное действие, предупреждая подобную редукцию во время ишемии [54]. Причины неблагоприятного эффекта остаются неясными. Представляется очевидным, что сокращение периодов ишемии и быстрая реанимация улучшают окончательные результаты.
Вероятно, существует своеобразный порог минимального кровотока в органах при СЛР. Невозможность поддерживать его выше этого порога во время СЛР вызывает нарушение функции соответствующих органов.
Эффективная дефибрилляция миокарда у собак возможна при кровотоке 20 мл/мин/100 г или выше [35,83]. Нормальная электрическая активность мозга во время СЛР сохраняется при церебральном кровотоке выше 15—20 мл/мин/100 г [52J.
Мониторинг эффективности СЛР
Мониторинг эффективности СЛР может быть затруднен. Необходимо адекватное перфузионное давление в миокарде для того, чтобы сердце начало работать под воздействием реанимации. Согласно приведенным выше данным, возобновление спонтанной циркуляции возможно при кровотоке в сердце, равном 20 мл/мин/100 г. Такая величина кровотока соответствует перфузионно-му давлению в миокарде (ПДМ) 20 мм рт.ст. (релаксационное давление в аорте минус релаксационное давление в правом предсердии). По данным СЛР у человека, при ПДМ 15 мм рт.ст. возможно, но не всегда возобновление спонтанной циркуляции [84]. Часто релаксационное давление в правом предсердии низкое, и тогда диастоличе-ское давление в аорте позволяет поддерживать перфузию миокарда. В клинических условиях отсутствие катетера в центральных артериях затрудняет определение величин подобного "диастоли-ческого" давления.
Определение насыщения венозной крови кислородом считается методом мониторинга эффективности СЛР. Уровень сатурации у человека
коррелирует с показателем возврата при спонтанной циркуляции [85,86]. Контроль этого уровня во время СЛР может быть полезным у пациентов при наличии доступа к центральным венам.
Другим методом мониторинга эффективности миокардиальной перфузии во время СЛР является величина РЕТсо2- Объем экспирируемого СО2 зависит от легочного кровотока. В общем, чем лучше кровоток в легких, тем выше и показатель РЕТСо2- Поэтому по мере восстановления тока крови в сердце и в легких растет величина РЕтсо2-
Контроль РЕтсо2 в течение 20 мин СЛР показал, что при его величине ниже 10 мм рт.ст. исход реанимации обычно бывает неблагоприятным [87—89].
С другой стороны, при РЕтсо2 15 мм рт.ст. и выше прогноз СЛР, как правило, хороший [17,90,91]. Эти данные подразумевают полезность мониторинга Ретсо2 в процессе СЛР. Они также говорят, что при величине РЕТсо2 от 10 до 15 мм рт.ст. или ниже необходимо предпринимать дополнительные меры реанимации. Показатель РЕТСО2 можно представить также как индикатор неулавливаемого сердечного выброса при электромеханической диссоциации, признак восстановления спонтанной циркуляции во время СЛР и как отражение симптомов спонтанной циркуляции при кардиопульмональном шунтировании [91-93].
Контроль РЕТсо2 во время СЛР у пациентов без эндотрахеальной интубации подтвердил полезность определения эффективности кардиальной компрессии в воспроизведении кровотока [94]. Уровень РЕТСО2 во время СЛР у пациентов с лицевой или с ларингеальной масками коррелировал со скоростью восстановления спонтанной циркуляции. Степень этой корреляции была не столь высокой, как у. больных интратрахеальной интубацией. Спонтанная циркуляция восстановилась у более значительного числа больных с низкими показателями РЕТСо2 и У гораздо меньшего — при высоких показателях РЕТСо2, чем при интратрахеальной интубации.
Существуют своеобразные ловушки при мониторинге СЛР по данным РЕТсо3- Введение бикарбонатов увеличивает продукцию СО2 без соответствующего улучшения легочного кровотока. Под влиянием введенного эпинефрина показатели РЕТСО2 могут снизиться, несмотря на улучшение перфузии миокарда. Эти особенности могут стать причиной ошибочной трактовки результатов СЛР [95]. Загрязнение детекторов РЕТС02 медикаментами, применяемыми при реанимации (эпи-нефрин, атропин, лидокаин), способно нарушить их чувствительность в оценке эффективности СЛР, так же как и загрязнение желудочным содержимым при эзофагеальной интубации [96].
202 Анестезия в педиатрии

Обычная СЛР — это закрытый массаж сердца, представляющий собой периодическое сдавливание грудной клетки, перемежающееся вентиляцией после каждых пяти сдавлений (табл. 7.4). Этот метод может быть применен в любой обстановке, не требует специального оборудования и особой тренировки. Большие рандомизированные исследования последних лет не установили преимуществ какого-либо одного из обычных методов мануальной СЛР над другими.
Обычная СЛР проводится путем надавливания на грудину пациента, лежащего навзничь. Опубликовано сообщение о двух пациентах, которым успешную реанимацию потребовалось проводить во время анестезии в положении сгибания [97]. Закрытый массаж у них проводили одной рукой, подведенной под грудину, а давление оказывали другой рукой на спину. Оба этих пациента подвергались операции на заднем отделе черепа и шейном отделе позвоночника, из-за чего их нельзя было быстро перевернуть на спину. При возможности лучше всего реанимацию проводить в разогнутом положении.
Быстрое утомление остается главной проблемой при ручной СЛР в полевых условиях. Индивидуальные особенности выполнения ручной СЛР в полевых условиях также могут создавать сложности. Для преодоления усталости и стандартизации процедуры разработаны механические приспособления, обеспечивающие сдавливание грудной клетки. Наиболее распространенными среди них являются пневматические аппараты поршневого действия. Как ручная, так и механическая СЛР дают вполне сопоставимые результаты у животных
[98] и человека [99]. Существуют механические приспособления, обеспечивающие расширение грудной клетки в релаксационной фазе СЛР. Прибор по команде спасателя сдавливает грудную клетку пациента, как и при ручной реанимации, а активное ее расправление с помощью отсасывания осуществляется прибором, когда спасатель прекращает команду во время релаксации. Механические приспособления в настоящее время применяются только при СЛР у взрослых и не рекомендованы у детей [100\.
Недостаточная эффективность обычной СЛР побудила к разработке различных ее модификаций. Все они отражали попытки усилить действенность торакального и кардиального насоса и кровотока во время СЛР (табл. 7.5). Так, надавливание на грудину предлагали проводить большими пальцами обеих рук, охватывающих грудную клетку младенца, повышая тем самым внутригрудное давление и компрессию сердца [101, 102].

Сердечно-легочная реанимация 203
СЛР при одновременной компрессии и вентиляции
Этот метод СЛР — одновременное проведение компрессии и вентиляции (ОКВ) — отражает попытку повысить эффективность обычной СЛР, увеличивая кровоток механизмом торакального насоса. Обеспечение вентиляции при каждой компрессии (вместо перемежающейся после каждых пяти сдавливаний) увеличивает внутригруд-ное давление и должно усиливать кровоток, создаваемый при закрытом методе СЛР.
Несколько проведенных исследований подтвердили, что при проведении СЛР методом ОКВ в сонных артериях создается более значительный кровоток, чем при обычной СЛР [26,32,46,78,103]. Физиологические преимущества были подтверждены и в опытах на собаках [61,104]. В противоположность этим данным ОКВ не оказывала дополнительного положительного действия при СЛР у поросят [48\ и щенков [46,105,106]. Податливость и вся геометрия грудной клетки у этих молодых животных более предрасполагали к эффекту от прямой компрессии сердца, обеспечивавшему более значительное повышение внутрисосудистого давления [47,69,74]. Исследования на животных также продемонстрировали неблагоприятное влияние избыточного давления в дыхательных путях во время СЛР методом ОКВ, приводящего к артериальному коллапсу [32]. Исследования у человека показали, что при ОКВ коронарная перфузия возрастает минимально (с 3,6 до 6,6 мм рт.ст.) [103] или даже падает (с 11 до 6 мм рт.ст.) [107]. Сравнение показателей выживания у человека [108] и животных [106] при СЛВ обычным методом и ОКВ было не в пользу последнего. Ни в одном из обзоров не отмечено повышения выживания при методе ОКВ.
Перетягивание живота
Исследователи использовали стягивание живота и даже применяли армейские противошоковые рейтузы (АПШР) для повышения эффективности СЛР. Этим обеспечивалось постоянное снижение кровотока ниже диафрагмы. Улучшение результатов СЛР при этом методе может быть связано со следующими тремя механизмами. 1. Перетягивание живота уменьшает смещение диафрагмы и повышает внутригрудное давление. 2. Выдавливание крови из субторакальных структур увеличивает ее внутрисосудистый объем (аутотрансфу-зионный эффект). 3. С давление поддиафрагмаль-ных сосудов повышает сопротивление в них и увеличивает супраторакальный кровоток. Нарастание внутригрудного давления и объема крови повышает давление в аорте и кровоток в сонных
артериях у человека [111,112] и животных [61,109,110]. К сожалению, одновременно с этим диастолическое давление в правом предсердии возрастает в еще большей степени (компонент обратного кровотока коронарного перфузионно-го давления), что существенно ослабляет кровоток в коронарных сосудах [106,109]. Соответственно снижается и кровоток в миокарде [109]. Описанный метод влияет и на церебральное пер-фузионное давление. Повышенное внутригрудное давление передается на сосуды мозга, увеличивая и внутричерепное давление (компонент обратного кровотока церебрального перфузион-ного давления), что приводит к снижению церебральной перфузии [35]. Падение церебрального перфузионного давления при росте внутричерепного давления не было отмечено при контроле давления в яремных венах. Перетягивание живота или использование АПШР не улучшало показатели выживаемости больных [106,113,114]. В то же время повреждения печени при этом методе имели место [103], правда, их частота была такой же, как и при традиционном методе СЛР [21,109,113,1Щ.
Сдавливание живота
СЛР с применением перемежающей абдоминальной компрессии (ПАК) предусматривает сдавливание живота в момент релаксации грудной клетки. Этот метод способен повысить эффективность СЛР в силу нескольких механизмов. Во-первых, при нем усиливается обратный ток крови в направлении грудной клетки во время фазы релаксации (наподобие "первичного насоса", обеспечивающего наполнение желудочка из предсердия [59,116]. Во-вторых, ПАК СЛР поддерживает и дополняет повышенное внутригрудное давление в течение всего цикла компрессии грудной клетки [117]. В-третьих, ПАК СЛР сдавливает аорту и направляет ток крови ретроградно в каротидные и коронарные артерии (наподобие пережимания аорты, улучшающего супрадиаф-рагмальный кровоток) [116].
Несколько исследований показали улучшение гемодинамики при ПАК СЛР. При этом методе, примененном у взрослых животных, сердечный выброс и коронарный кровоток восстанавливались лучше, чем при обычных методах СЛР [59,116—118]. Однако этот результат не наблюдался в опытах на свиньях [119]. Исследования у людей подтвердили более заметное возрастание давления в аорте и коронарной перфузии при методе ПАК по сравнению с традиционным способом СЛР [38,120—124]. Лишь в одном из многих ислледований отмечено возрастание ре-гургитаций до 10 % [118], но в остальных работах не отмечено ни этого осложнения, ни по-
204 Анестезия в педиатрии
вреждений печени [59,117,120,123—126]. Практическое выполнение ПАК требует значительных усилий или специального оборудования и поэтому применяется преимущественно в условиях эксперимента. Показатели выживания при нем неоднозначны. При проведении ПАК СЛР в догоспитальном периоде не отмечено более значительных успехов по сравнению с обычным методом, но при его выполнении в условиях стационара выживаемость значительно повышалась [125,126].
СЛР сдавливающей жилеткой (поясом)
Этот метод СЛР основан на использовании раздуваемых емкостей, окутывающих грудную клетку со всех сторон (наподобие манжетки для измерения артериального давления) и периодически наполняемых воздухом. Данный метод равномерного сплошного сдавливания грудной клетки имеет две уникальные особенности. Во-первых, изменение размеров грудной клетки минимально и прямого сдавливания сердца при нем не происходит (торакальный насос почти в чистом виде). Во-вторых, распределение давления сводит к минимуму вероятность травмирования.
СЛР жилеткой в опытах на собаках улучшала гемодинамику, нормализовала церебральный и коронарный кровоток гораздо лучше, чем обычные методы СЛР [65,104,127]. Точно так же показатели выживаемости у собак были гораздо лучшими при СЛР жилеткой или поясом, чем при обычной методике [36,127]. В педиатрической модели перманентная деформация грудной клетки после 50 мин проведения жилеточной вентиляции не превышала 3 %, в то время как при обычной СЛР она к этому сроку достигала 30 % [47,76]. У человека этот метод повышал систолическое давление в аорте лучше обычных методов, но не оказывал подобного влияния на диастолическое давление [30]. Предварительные испытания метода СЛР с использованием жилетки у людей при остановке сердца во внегоспи-тальных условиях продемонстрировали более выраженную тенденцию к восстановлению спонтанной циркуляции, чем при стандартной СЛР [128]. Продолжаются большие клинические исследования по определению возможных преимуществ этого метода.
Отсутствие металлических деталей позволило в условиях эксперимента во время жилеточной вентиляции провести исследование с помощью ядерного магнитного резонанса показателей внутриклеточного рН мозга [129]. Этот метод был использован как внекардиальный вспомогательный способ исследования у собак с сердечной недостаточностью [130,131]. В клинических
условиях применение жилеточного метода СЛР зависит от наличия соответствующего оборудования и пока не вышло за рамки эксперимента.
Высокоимпульсивная СЛР
Высокоимпульсивная СЛР предусматривает применение гораздо больших усилий при компрессии грудной клетки. Это может заключаться в приложении более значительных нагрузок, в большей их скорости или обоих этих факторах одновременно. Предполагается, что при этом вдавливание грудной клетки будет более выраженным и воздействие на сердце будет эффективнее [132]. Непосредственная компрессия сердца при этом методе более выражена, что в данном случае указывает на большую важность темпа компрессии по сравнению с режимом цикла в соответствии с механизмом сердечного насоса при восстановлении кровотока. Данное обстоятельство поддерживает гипотезу о ведущей роли сердечного насоса при высокоимпульсивной СЛР [57,133].
Улучшение гемодинамики при этом методе СЛР бывает более наглядным, чем при обычных способах реанимации. Исследования на собаках продемонстрировали явное преимущество показателей коронарного и церебрального кровотока при высокоимпульсивной СЛР по сравнению с низкоимпульсивной [56]. При высокоимпульсивной СЛР кровоток в миокарде достигает 60— 75 % от его показателей до остановки сердца [57]. У людей высокоимпульсивная СЛР четко повышала давление в аорте [30]. Однако по показателям выживаемости и по неврологическим последствиям у собак метод высокоимпульсивной СЛР существенно не отличался от обычных методов закрытой СЛР [133].
Активная компрессионно-декомпрессионная СЛР
Активная компрессионно-декомпрессионная (АКД) СЛР предусматривает использование приспособлений, прикрепляемых к грудной клетке и позволяющих спасателю периодически сдавливать ее, а затем расправлять. Теоретическими преимуществами декомпрессии является восстановление формы грудной клетки, активное всасывание газа в легкие и также активное привлек чение крови во внутриторакальные сосуды. Подобные характеристики обеспечивают более вы* сокий эффект при компрессии, так как можна; будет генерировать более высокое внутригрудно? давление и извергнуть при компрессии большее' количество крови.
Предварительные наблюдения у пациентов с тяжелыми нарушениями сердечной деятельности ]
Сердечно-легочная реанимация 205
показали, что АКД СЛР восстанавливает гемодинамику лучше, чем стандартная СЛР [134\. По данным наблюдения за больными с остановкой сердца в госпитальных условиях, проведение АКД СЛР чаще восстанавливало спонтанную циркуляцию, улучшало выживаемость в первые 24 ч и обеспечивало более хорошие показатели по шкале Глазго Кома, чем стандартная СЛР [J35\. Более крупные исследования в отношении больных с остановкой сердца в условиях госпиталя не обнаружили достоверных различий в исходах стандартной СЛР и результатах АКД СЛР [136\. Точно так же несколько серьезных исследований, охватывающих больных с остановкой сердца во внегоспитальных условиях, не отметили различий в эффективности стандартной СЛР и АКД СЛР по таким показателям, как восстановление спонтанной циркуляции, направление в стационары, выписка из стационара или непосредственные неврологические исходы [136— 140\.
Осложнения, по данным большинства исследований, развивались одинаково часто как при стандартной СЛР, так и при проведении АКД СЛР [137—139]. Привлекало внимание, что в тех же наблюдениях было отмечено больше таких осложнений, как кровохарканье и смещение грудины. Лишь одно из немногих больших исследований подтвердило более высокую эффективность АКД СЛР по сравнению со стандартной СЛР у больных во внегоспитальных условиях [141].
Фазовая
компрессионно-декомпрессионная СЛР грудной клетки и живота
Описан новый метод реанимации путем фазовой компрессии и последующей декомпрессии грудной клетки и живота (ФГЖКД) [142]. Этот метод напоминает сочетание активной компрессионно-декомпрессионной СЛР с перемежающейся компрессией живота. Теоретически это обеспечивает достоинства обоих методов, поскольку восстанавливает форму грудной клетки и облегчает поступление крови и газа в грудную клетку во время активной декомпрессии грудной клетки, а также увеличивает кровоток при компрессии и активной декомпрессии живота. Применение метода ФГЖКД СЛР продемонстрировало улучшение коронарной перфузии, восстановление спонтанной циркуляции, хорошую непосредственную выживаемость и более благоприятные неврологические исходы на модели фибрилляции и остановки сердца у свиней [142].
Реанимация при вскрытой грудной клетке (прямой массаж сердца)
Прямой массаж сердца после торакотомии эффективно генерирует кровоток. Применение этого метода требует больших знаний, тренировки, специального оборудования и способностей. Эти требования ограничивают применение данного метода только условиями стационара.
Прямой массаж сердца воспроизводит модель функционирования кардиального насоса. Теоретически при этом методе восстановления кровотока элиминируется внутриторакалъное давление, которое при его трансмиссии способно редуцировать градиент кровотока. Подобное дополнительное увеличение градиента в сочетании с непосредственной компрессией сердца способно воспроизвести почти нормальные величины кровотока.
Сердечный выброс при прямом массаже сердца варьирует от 25 до 61 % от его показателей перед остановкой сердца [78,143,144]. Это в 2—3 раза выше, чем при обычных методах непрямого массажа [78,143—146]. Церебральное перфузион-ное давление, по данным одних исследований, значительно возрастает [145], по другим — нет [78,146]. Возрастание перфузионного давления в миокарде не вызывает сомнений и бывает гораздо выше, чем при непрямой СЛР [145,147]. Церебральный кровоток при прямом массаже сердца у собак достигал 150 % от его показателей перед остановкой сердца [79]. Пережатие нисходящего отдела аорты в это время еще больше повышало кровоток в сонных артериях.
Показатели выживания у собак значительно повышались при переходе с безуспешного непрямого на прямой массаж сердца [148]. Если величина миокардиальной перфузии у собак после 15 мин непрямого массажа оставалась менее 30 мм рт.ст., то в течение 2—4 мин им проводили либо дефибрилляцию, либо прямой массаж сердца. В последнем случае достигались лучшие показатели миокардиальной перфузии и более высокая выживаемость.
Продолжительность непрямой СЛР оказывает четкое влияние на результаты последующего прямого массажа сердца [149]. Если торакотомия и прямой массаж начинали после 20—25 мин неэффективного проведения обычной СЛР, то успех снижался с 38 до 0 %. Эти данные подчеркивают роль фактора времени и преимущества открытого метода СЛР только при раннем его применении.
Рекомендации по рутинному применению открытого метода СЛР в педиатрической практике отсутствуют [150].
206 Анестезия в педиатрии
1
Кардиопульмональное шунтирование
Кардиопульмональное шунтирование (КПШ) является весьма эффективным методом восстановления циркуляции после остановки сердца. Исследования на животных показали, что при КПШ показатели выживаемости в течение 72 ч, восстановление сознания и функции миокарда гораздо лучше, чем при стандартных методах СЛР [151,152]. Неврологические показатели у собак при КПШ после 4 мин ишемии были гораздо лучше, чем при непрямом массаже. (После 12-минутной ишемии неврологические последствия были одинаково плохими в обеих группах [151, 152\.) В течение 24 ч выживали 90 % собак, у которых КПШ проведено через 15—20 мин после остановки сердца, но их было всего 10 % при этом методе, примененном спустя 30 мин даже с использованием дефибрилляции [153\. КПШ в значительно большей степени уменьшало размеры инфаркта миокарда в опытах с окклюзией коронарной артерии, чем обычный метод СЛР [154]. КПШ облегчало реанимацию и повышало ее эффективность в опытах на животных значительно нагляднее, чем стандартный способ СЛР.
Опыт применения КПШ у человека при остановке сердца, произошедшей вне операционной, крайне мал. Временное шунтирование через бедренные артерию и вену было применено у больных с "рефрактерной" остановкой сердца. К сожалению, многие больные, не поддававшиеся стандартной СЛР и стабилизированные с помощью КПШ, в последующем не могли быть сняты с шунтирования, имели малую вероятность продолжительного выживания или благоприятных неврологических исходов [155—159\. Опубликованы сообщения о случаях остановки сердца во время операций или при катетеризации полостей сердца, когда стандартная СЛР была безуспешной, а эффект достигался только при наложении КПШ. Неврологический исход у таких пациентов был хорошим, несмотря на безуспешность стандартной СЛР, продолжавшейся от 30 мин до 2 ч [160,161].
КПШ требует сложного технического обеспечения. Впечатляет, что этот метод можно наладить в течение 10 мин после возникновения необходимости в нем [155,156]. Несмотря на быстрое восстановление циркуляции при этом методе, не столь эффективные его результаты связаны с длительностью предшествующей безуспешной СЛР обычными методами, ограничивающими возможность восстановления функции мозга и миокарда. Возможности применения КПШ крайне невелики при остановке сердца, произошедшей вне госпиталя, так же как и после безуспешного проведения СЛР обычным методом в течение более 30 мин [157,159,162].
Агонисты адренергетиков
Почти одновременно с непрямым методом СЛР в 1960 г. начали использоваться с этой же целью и агонисты адренергетиков типа эпинефрина* Redding и Pearson [163] в 1963 г. первыми описали положительное действие эпинефрина при СЛР по поводу остановки сердца у собак. Они также показали, что повышение диастолического давления, происходящее при назначении этих препаратов, лежит в основе их реанимационного эффекта [164]. По их мнению, повышение общего сосудистого сопротивления, вызываемое эпи-нефрином, имеет важное положительное значение. С тех пор эпинефрин остается препаратом выбора при СЛР.
Yakaitis и соавт. [165] исследовали относительное значение действия а- и р-агонистов адренергетиков во время реанимации. Последняя оказалась успешной лишь у одной из четырех собак, получавших как чистый агонист р-адренергетика (изопротеренол), так и антагонист а-адренерге-тика. В противоположность этому реанимация оказалась успешной у всех собак, получавших одновременно агонист а-адренергетика и антагонист р-адренергетика. Эти результаты показали, что а-адреномиметическое действие эпинефрина на адренорецепторы определяет успех реанимации после остановки сердца.
Последующие исследования подтвердили это положение. Michael и соавт. [52] показали, что эффект эпинефрина при СЛР опосредован селективной вазоконстрикцией периферических сосудов, за исключением сосудов миокарда и мозга. Во время инфузии эпинефрина давление в аорте повышается и удерживается на уровне, достаточном для перфузии сердца и мозга [52]. Наряду с этим происходящая вазоконстрикция ограничивает кровоток в жизненно важных органах, например в почках и кишечнике [47,52,166].
Коронарный кровоток
Повышение диастолического давления в аорте, связанное с эпинефрином или другими препаратами а-адреномиметического действия, имеет решающее значение для поддержания коронарного кровотока и успеха СЛР. Контрактильная способность миокарда усиливается под влиянием агонистов р-адренергетических рецепторов. Во время СЛР эти препараты могут стимулировать спонтанную сократимость миокарда и усиливать фибрилляцию желудочков. При ней инотропный
Сердечно-легочная реанимация 207
эффект агонистов р-адренергетиков может стать нежелательным из-за усиления давления на внутренние стенки миокарда [167], снижающего кровоток и перфузию в нем. Помимо этого, стимулирующее действие р-адренергетиков повышает потребность миокарда в кислороде, увеличивая метаболизм в клетках и потребление кислорода. Сочетание повышенной потребности в кислороде и потребления его со снижением кровотока в миокарде может вызывать его ишемию во время СЛР.
Кровоток в субэндокардиальном слое нормально сокращающегося сердца происходит почти исключительно в период диастолы. При фибрилляции желудочков давление на внутренние стенки миокарда симулирует состояние длительно удерживающейся систолы [168]. Как указывалось, повышенное давление на внутренние стенки миокарда при недостаточности диастолы снижает давление коронарной перфузии и усиливает опасность повреждения уже ишемического сердца.
Другие агонисты а-адренергетиков могут быть с успехом использованы при СЛР. Это препараты типа метоксамина и фенилефрина, вызывающие периферическую вазоконстрикцию. Они, как и эпинефрин, повышают диастолическое давление в аорте, усиливая при этом коронарный кровоток. Однако отсутствие у них прямой стимуляции р-адренергических рецепторов устраняет повышенную потребность миокарда в кислороде, изменяет в благоприятную сторону соотношение между поступлением и протреблением кислорода в ишемизированном сердце. Эти неэпи-нефриновые агонисты а-адренергетиков с большим успехом применяются при СЛР, поддерживая кровоток в миокарде эффективнее эпинеф-рина [163—165,169]. Schleien и соавт. [169] при СЛР у собак показали, что а-адренергетик фени-лефрин поддерживает высокое давление в аорте. Этот препарат, так же как и эпинефрин, поддерживал на хорошем уровне коронарный кровоток и перфузионное давление в миокарде во время СЛР, обеспечивая ее эффективность в 75 % случаев. При назначении обоих данных препаратов соотношение кровотока в эндо- и эпикарде оставалось одинаковым. Дискуссии по поводу достоинств чистых а-адренергетиков при реанимации продолжаются в основном из-за сомнений в преимуществах и недостатках р-адренергического действия эпинефрина [170—172].
Церебральный кровоток
Во время СЛР показатели церебрального кровотока, как и кровотока в миокарде, зависят от спазма сосудов в периферических органах. Эта вазоконстрикция усиливается под влиянием агонистов а-адренергетиков. Эпинефрин и другие
препараты а-адренергического действия вызывали избирательный спазм периферических сосудов (в том числе кожи головы, языка, лицевых мышц), но не сосудов мозга во время опытов по СЛР у взрослых [51,61] и молодых животных [47]. Инфузии эпинефрина или фенилефрина во время СЛР у собак удерживали церебральный кровоток и потребление кислорода мозгом в течение 20 мин на том же уровне, что и до остановки сердца. Это подразумевает, что кровоток в мозге был даже выше необходимого для поддержания адекватного метаболизма [169]. Неврологические последствия через 24 ч были одинаковыми при введении того или иного из этих препаратов после 9 мин фибрилляции желудочков [173]. По данным других исследований, эпинефрин в подобных условиях обеспечивал более надежный кровоток в жизненно важных органах [170,171,174]. Но это могло быть связано с дозировкой препаратов, а не с их способностью повышать внутрисосудистое давление и генерировать кровоток.
Потребление кислорода мозгом может возрасти под действием центральных р-адренергических рецепторов, если во время СЛР через гема-тоэнцефалический барьер проникает достаточно большое количество эпинефрина [175,176]. Кроме того, эпинефрин способен вызывать как сужение, так и расширение церебральных сосудов в зависимости от баланса его а- и р-адренергического действия [177]. Если церебральная ишемия очень кратковременна, то действие эпинефрина и фенилефрина на церебральный кровоток и метаболизм бывает одинаковым. Подобное состояние имеет место при сохранении функции гема-тоэнцефалического барьера [169]. Катехоламины могут проникать через этот барьер при механическом его повреждении или при избыточном воздействии энзимов (например, ингибиторов мо-ноаминоксидазы), накапливающихся при тканевой гипоксии [178,179]. Механические повреждения гематоэнцефалического барьера во время СЛР могут быть связаны с резкими перепадами артериального и венозного давления в мозге во время компрессии грудной клетки. Кроме того, его проницаемость может возрастать в связи с колебаниями артериального давления в сосудах, максимально расширившихся после реанимации [180]. Повышение кислородной потребности мозга в условиях сниженного кровотока может оказать неблагоприятное влияние на восстановление его функций. Нарушение проницаемости гематоэнцефалического барьера было четко выражено у молодых животных, реанимированных через 8 мин после остановки сердца [18Д. У таких животных обнаруживали выраженную вакуолизацию эндотелия и проникновение протеинов через барьер между кровью и мозгом [182].
208 Анестезия в педиатрии
Дозировка
Точная дозировка эпинефрина при СЛР остается спорной. Доза, рекомендованная в настоящее время Американской ассоциацией кардиологов и кардиореаниматологов, изменена, поскольку ни одно из проведенных исследований не подтвердило увеличение показателей выживаемости при назначении более высокой дозировки, чем ранее практиковавшейся при остановке сердца [183]. Более недавние исследования не являются оптимистичными в этом отношении.
Последние исследования были посвящены реакциям животных и человека на повышенные дозы эпинефрина. Церебральный кровоток при этом возрастал весьма значительно [173,184,185]. Несколько исследований на животных подтвердили значительное усиление кровотока в миокарде и в его субэндотелиальном слое под влиянием повышенных доз эпинефрина. Обеспеченность сердца кислородом при этом перекрывала потребность в нем [57,79,186,187]. Однако при фибрилляции миокарда у собак после введения эпинефрина потребление кислорода резко возрастало, а субэндотелиальный кровоток в левом желудочке снижался [167,188]. В опытах на свиньях высокие дозы эпинефрина не поднимали кровоток в миокарде до уровня, обеспечиваемого небольшими дозами [184].
Исследования у человека дали противоречивые результаты по выживанию больных, получавших повышенные дозы эпинефрина после остановки сердца. Оптимистичными были выводы ранних наблюдений, отметивших более значительное повышение диастолического давления в аорте под влиянием высоких доз эпинефрина и более быстрое восстановление спонтанной циркуляции, чем при назначении стандартных его дозировок. Gonzalez и соавт. [189,190] отметили зависимость между дозировкой и подъемом давления в аорте у больных, не поддававшихся длительным попыткам реанимации. Точно так же Paradis и соавт. [84] наблюдали повышение диастолического давления в аорте и успех реанимации при подобном методе терапии. Они описали успешную реанимацию и у 7 детей, получивших эпинефрин в дозе 0,2 мг/кг [191]. Более высокое диастоличе-ское давление в аорте и успешное восстановление циркуляции были отмечены и в других наблюдениях [84,192,193]. Число выживших больных при этих исследованиях, проведенных без рандомизации, было невелико, хотя среди оставшихся в живых были и трое детей.
Энтузиазм по поводу применения высоких доз эпинефрина был охлажден, после того как были опубликованы результаты трех крупных исследований, выполненных в нескольких лечебных центрах. Stiell и соавт. [194] совсем недавно сооб-
щили о 650 больных, перенесших остановку! сердца. Лечение стандартными или повышенны*! ми дозами эпинефрина (7 мг) проводилось в ощ дельных группах, сформированных с помощш] рандомизации. Оказалось, что высокие дозщ эпинефрина не улучшали показатели выживаем! мости (18 и 23 % в течение 1 ч; 3 и 5 % — пр»| выписке из госпиталя) и не влияли на невроло^З гические изменения. Brown и соавт. [195] обо6*| шили результаты совместного проспективного! исследования в отношении 1280 взрослых боль-'| ных с остановкой сердца, получавших либо! обычные (0,02 мг/кг), либо высокие (0,2 мг/кг)J дозы эпинефрина. Оказалось, что между двумя! этими группами больных не было различий ни 11 частоте возобновления спонтанной гемоциркуля* J ции и выживания к моменту выписки, ни в ха-| рактере неврологической патологии. Callaham й-1 соавт., наблюдавшие 816 взрослых больных, co-j общили о более высокой частоте восстановления] спонтанной циркуляции в группе больных, полу^| чавших повышенные дозы эпинефрина. Однако [ никаких различий не было отмечено при сопос*;] тавлении этих групп по частоте выписки из гос-: питаля и по выживанию [196].
Высокие дозы эпинефрина могут быть причин ной подобных реакций, возникающих после реа<| нимации. Они способны провоцировать ишемиМ! миокарда, приводящую к тахиаритмии, вызываш] гипертонические кризы, отек легких, усиливат?I дигиталисную интоксикацию, гипоксемию щ приводить к остановке сердца [183,195,197]. По] наблюдениям Tang и соавт. [198], эпинефрий] способен снижать РаО, и увеличивать вентиляций! мертвого альвеолярного пространства, что можда быть связано с перераспределением легочного"! кровотока, не наблюдавшимся при назначений! а-агонистов.
Различия результатов приведенных исследовгй) ний объясняют нечеткость рекомендацией, при* веденных в руководстве Американской ассоциа*! ции кардиологов и кардиореаниматологов <щ 1992 г. [183]. В соответствии с действующими рИ комендациями предлагается укоротить интервай лы между введением эпинефрина взрослым с Ц мин до 3—5 мин. Назначение высоких доз эпи*| нефрина не рекомендуется, но и не запрещается;; Вполне допустимыми считаются промежуточный; дозы 2—5 мг внутривенно, повышенные дозы от j 1—3 до 5 мг внутривенно и высокие дозы по 0,1 J мг/кг внутривенно. У детей дозировки более оп*; ределенные. Более высокие дозы эпинефрин^] предпочтительно назначать через введенную ин-тратрахеальную трубку, так как его биоусвош| мость при этом снижается. Детям при отсутствии] пульса вначале вводят внутривенно или внутри*] костно 0,01 мг/кг (1:10 000). Эндотрахеальная до*j зировка равна 0,1 мг/кг (1:1000). Вторая и иосмЦ
Сердечно-легочная реанимация 209

Вазопрессин
В последние годы возобновился интерес к вазо-прессину, сосудосуживающему препарату, уже получившему отражение в литературе и в карте медикаментов для СЛР. Исследования на животных и в клинике подтвердили его эффективность в восстановлении поддерживающего жизнь сердечного ритма у больных при остановке сердца на фоне фибрилляции желудочков [199—202], но не при асистолии или беспульсовой электрической активности [203].
Вазопрессин обладает теоретическими преимуществами по сравнению с эпинефрином при проведении СЛР у больных с фибрилляцией желудочков. Это может объясняться отсутствием р-адренергической активности, приводящей к снижению потребности миокарда в кислороде в период ограниченного его поступления. Следствием этого становится снижение ишемии, а также обусловленных адренергаей желудочковой эктопии и тахикардии в послеоперационном периоде.
Этот эффект может быть тем не менее устранен из-за интенсивного сужения сосудов после возобновления спонтанной циркуляции и вызванной им ишемии миокарда [204,205].
Более высокая выживаемость под влиянием вазопрессина по сравнению с эпинефрином не была отмечена ни при одном из проведенных исследований. В одном из них, выполненном неконтролируемым методом, указано на лучшее возобновление спонтанной циркуляции под влиянием вазопрессина. Этот препарат в дозе 40 ЕД внутривенно назначался 8 взрослым больным при фибрилляции желудочков, не поддававшейся ни обычным методам реанимации, ни эпинефри-ну. Во всех 8 случаях возобновилась спонтанная циркуляция, и трое больных были выписаны из клиники с полным восстановлением неврологических функций [206]. Более благоприятные результаты при назначении вазопрессина (40 ЕД внутривенно) по сравнению с эпинефрином были получены при рандомизированном контролируемом исследовании в отношении внегоспи-тальных больных, безуспешно подвергавшихся дефибрилляции. Применение вазопрессина дало эффект у 14 из 20 больных, а эпинефрина — у 7 из 20 больных (р = 0,06). Однако выживание больных до выписки из стационара было одинаковым в обеих группах (р = 0,16) [207]. Роль, которую вазопрессин будет играть у больных с фибрилляцией желудочков, еще предстоит установить.
Бикарбонат натрия
Клиническое действие
Применение бикарбоната натрия при СЛР остается одним из наиболее спорных вопросов. Это связано с возможностью побочных реакций и недостаточностью экспериментальных и клинических данных о преимуществах, действительно обеспечиваемых бикарбонатом натрия при СЛР по поводу остановки сердца [208—210]. Назначение этого средства вызывает его реакцию с ионами водорода, при которой бикарбонат разлагается на воду и двуокись углерода с одновременным повышением рН крови:
НСО3~ + Н+ -> Н2СО3 -> Н2О + СО2.
Возникновение двуокиси углерода при назначении бикарбоната должно предусматривать адекватную легочную вентиляцию.
Показания
Назначение бикарбоната натрия показано для коррекции значительного метаболического ацидоза, особенно при наличии кардиоваскулярной

патологии. Ацидоз подавляет функцию миокарда, снижая его спонтанную активность, пороговую величину фибрилляции желудочков, ино-тропное состояние миокарда, реактивность его к катехоламинам и удлиняя диастолическую деполяризацию [211—214]. Ацидоз также снижает общее сосудистое сопротивление и реакцию периферических сосудов на катехоламины [215]. Результатом всего этого становится вазодилатации вместо необходимой для эффекта СЛР вазокон-стрикции. Кроме того, на фоне ацидоза возрастает сопротивление в сосудах малого круга у больных с повышенной их реактивностью. Rudolph и Yuan [216\ наблюдали повышение сопротивления в сосудах легких у телят при снижении рН с 7,4 до 7,2 даже в условиях нормоксии. Следовательно, устранение ацидоза может помочь в реанимации больных со склонностью к шунтированию справа налево. Введение бикарбоната натрия показано также и при гиперкалиемии, так как под влиянием возрастающего рН калий быстрее проникает в клетки.
Дозировка
При известных величинах РаСО2 и рН доза бикарбоната, необходимая для коррекции рН до 7,0, может быть рассчитана по следующей формуле: (0,3 х массу тела в кг х дефицит оснований) = мг-экв бикарбоната. Из-за возможности побочного действия и значительного артериовенозного градиента двуокиси углерода, характерного для реанимируемых больных, рекомендовано вводить не более половины этой дозы с расчетом на объемное распределение 0,6. Если показатели газов крови неизвестны, то начальная доза бикарбоната равна 1 мг-экв/кг с последующим введением 0,5 мг-экв/кг каждые 10 мин продолжающейся остановки сердца [217\. Крайне важное значение имеет адекватная легочная вентиляция и повторный контроль газов артериальной крови.
Побочное действие
Введение бикарбоната сопряжено с рядом побочных реакций, в том числе с метаболическим алкалозом, гиперкапнией, гипернатриемией [2Щ и гиперосмолярностью [219]. Каждая из них увеличивает вероятность летального исхода. Метаболический алкалоз вызывает сдвиг кривой диссоциации оксигемоглобина влево, нарушая тем самым высвобождение кислорода из оксигемоглобина именно тогда, когда потребность тканей в нем повышается из-за малого сердечного выброса и низкого поступления кислорода [220\. Ги-пернатриемия и гиперосмолярность затрудняют гемоперфузию в тканях из-за провоцируемого
ими интерстициального отека. Существует много-теоретических соображений против широког|| использования бикарбоната. Так, он способен*! вызывать парадоксальный внутриклеточный ацидоз из-за усиленного проникновения двуокиси | углерода внутрь клеток и задержки в них иона] водорода. Значительный гиперкапнический аци-; доз в венозной крови и коронарных сосудах, раз** вивающийся при остановке сердца, может еще! более нарасти после введения бикарбонащ [221,222]. Гиперкапнический ацидоз в коронар-1 ных сосудах может снизить сократительную сшщ собность миокарда [211,212,223]. Falk и соавп| [224] определили средние величины венозно-а териального градиента РаСО2 у пяти больных время СЛР (23,8 ± 15,1 мм рт.ст.). У одного из! этих пациентов после введения бикарбоната дада| ный градиент возрос с 16 до 69 мм рт.ст. По даш ным другого исследования, у 16 больных средний! градиент во время СЛР равнялся 42 мм рт.ш! [222]. В клетках центральной нервной систем»] ацидоз, вероятно, не возникает, если не прово-J дится гиперкоррекция рН. Sessler и соавт. [22Щ продемонстрировали, что после введения новщ рожденным кроликам двух доз бикарбоната та! 5 мг-экв/кг по поводу гипоксического ацидоз*! показатели рН артериальной крови возросли щ 7,41, а рН клеток мозга достигла исходного урощ ня [225]. Парадоксального внутриклеточне ацидоза не наблюдалось. Наконец, Cohen и со»! авт. [226] показали, что концентрация аденозда!
трифосфата (АТФ) в клетках мозга у крыс не изменяется после 70 мин крайней гиперкапнии, несмотря на снижение рН в них до 6,5. После выведения из состояния гиперкапнии эти животные и их мозг ничем не отличались от контрольных. Eleff и соавт. [227\, применяя спектроскопию и ядерный магнитный резонанс для определения рН мозга у собак во время СЛР, отметили снижение этого показателя до 6,29 после 6 мин желудочковой фибрилляции. Одновременно имело место снижение уровня АТФ в ткани мозга. После 6 мин эффективной СЛР уровень АТФ достигал 86 % от исходных показателей, а рН мозга после 35 мин СЛР возвращался к исходному уровню, несмотря на сохраняющийся ацидоз в периферической артериальной крови [227\ (табл. 7.7).
Другие ощелачивающие средства
В опытах на животных и в клинике используют несколько других ощелачивающих средств, не обладающих реальными или предполагаемыми недостатками бикарбоната. К сожалению, ни одно из них не имеет реальных преимуществ. Кар-бикарб, недавно предложенный Международной медицинской системой, представляет собой раствор эквимолярных количеств бикарбоната натрия и карбоната натрия. Он способен поглощать двуокись углерода и воду, продуцируя ионы бикарбоната и натрия:
(Na2CO3 + СО2 + Н2О -> 2НСО3~ + 2Na+).
В опытах на животных карбикарб способствовал более выраженному подъему рН и реже, чем бикарбонат натрия, вызывал повышение РаСо2> лактата и гиперосмолярность сыворотки [228— 230\.
Другой ощелачивающий препарат — дихлор-ацетат (ДХА), стимулирует активность пируват-дегидрогеназы, способствующей конверсии лактата в пируват [231]. Первоначальные исследования в клинике показали, что ДХА снижает уровень лактата вдвое, повышая концентрацию бикарбоната и рН [232]. При его введении увеличивается сердечный выброс, возможно, благодаря усиленному метаболизму лактата и углеводов [233,234]. _К_ сожалению, последующие обширные исследования показали, что ДХА не отличается от стандартного бикарбоната по показателю выживания больных [235].
Трометамин (ТМА) или три-[гидроксиме-тил]аминометан является органическим амином, связывающим водородные ионы. Его выпускают в виде 0,3 М раствора с рН 8,6. Доза его, равная 3 мл/кг, повышает концентрацию бикарбоната до 3 мг-экв/л. Побочное действие может выражаться в гиперкалиемии, гипогликемии, острой
Сердечно-легочная реанимация 211
гипокарбии и апноэ. Важно, что он может вызывать расширение сосудов во время СЛР, что ухудшает перфузию миокарда. ТМА противопоказан больным с почечной недостаточностью.
Кальций
Клиническое действие
Показания для назначения кальция при СЛР в настоящее время весьма ограничены. Прежде всего это обусловлено возможностью того, что в условиях ишемически-перфузионных нарушений назначение кальция может привести к их утяжелению, возникновению постишемической гипо-перфузии, ускорит развитие внутриклеточных токсических процессов и приведет к гибели клетки. Внутриклеточная перегрузка кальцием имеет место во многих патологических состояниях, в том числе и при ишемии, она может стать одним из обычных финальных путей к гибели клеток [236,237]. Тем не менее ни одно из исследований не продемонстрировало, что непродолжительное увеличение уровня кальция в крови ухудшает результаты СЛР после остановки сердца.
Ион кальция необходим в цикле работы миокарда (сокращение — расслабление), он повышает автоматизм желудочков в условиях асистолии [238]. Поэтому кальций может оказаться полезным в состоянии асистолии или электромеханической диссоциации. Снижение ионизированного кальция приводит к снижению работоспособности желудочков, к расширению периферических сосудов и ослаблению гемодинамических реакций на катехоламины [239—243]. Тяжелый дефицит ионизированного кальция в крови (в среднем 0,67 ммоль/л) отмечен у пациентов, перенесших остановку сердца вне стационара [244]. Доказательства положительного действия кальция в подобных клинических ситуациях весьма ограничены [245—247].
Блокаторы кальциевого канала улучшают кровоток после ишемии сердца, почек и мозга [248— 250]. Они также повышают порог фибрилляции ишемизированных желудочков [257]. Следовательно, применение кальция в подобных ситуациях недопустимо.
Показания
Показания для использования кальция во время СЛР весьма ограничены. Это случаи остановки сердца в результате гипокальциемии (общего или ионизированного кальция), гиперкалиемии, ги-пермагнезиемии или передозировки блокаторов кальциевого канала. Гипокальциемия развивается у пациентов с крайне тяжелыми предпосылками к потере кальция, например, в результате
8-998
212 Анестезия в педиатрии

Дозировка
Взрослым хлористый кальций назначают по 200 мг (2 мл 10 % раствора), детям — по 20 мг/кг или 0,2 мл/кг 10 % раствора. Глюконат кальция повышает уровень ионизированного кальция во время СЛР столь же эффективно, как и хлористый кальций [253\. Глюконат кальция назначают в дозах 30—100 мг/кг, максимальная дозировка для детей — 2 г.
Побочное действие
Кальций следует вводить медленно предпочтительно через катетер большого диаметра, установленный в центральную вену. Попадание кальция в подкожную ткань может вызвать тяжелый некроз. При быстром введении кальций может спровоцировать брадикардию, сердечный блок или остановку сердца (табл. 7.8).
Атропин
Клиническое действие
Атропин оказывает парасимпатиколитическое действие, снижая влияние блуждающего нерва на сердце. В силу этого усиливается влияние синусного узла, его эктопическая активность и увели-чивается атриовентрикулярная проводимость [254\. Атропин оказывает минимальное влияние на общее сосудистое сопротивление, на перфузию миокарда и на его сократительную способ-? ность [255].
Показания
Атропин показан при лечении асистолии, электромеханической диссоциации, брадикардии с гипотензией [256], вентрикулярной эктопии, прц сердечном блоке второй или третьей степени и при медленном идиовентрикулярном ритме [257\. Таким образом, атропин полезен в состояниях, сопровождающихся парасимпатическим \ гипертонусом. Острый инфаркт миокарда спосо-]; бен усиливать парасимпатический тонус, вать аритмию вплоть до асистолии, которые устг? раняются при назначении атропина. Первыми признаками приближающейся остановки сердцу у детей обычно бывают брадикардия или асисиь лия, поэтому введение атропина у них являете^ первоочередным мероприятием. Любой стресс периоперационном периоде у младенцев (вклки чая ларингоскопию) способен привести к брадич кардии и даже к асистолии в результате повыше» ния парасимпатического тонуса. Атропин хора* шо устраняет подобные состояния.
Дозировка
Рекомендуемая взрослым доза атропина равна] 0,5 мг внутривенно каждые 5 мин до достижение пульса необходимой частоты (максимальная щщ] 2,0 мг). Полная блокада блуждающего нерва щ взрослых может наступить после введения 2,0 щ\ атропина. При асистолии внутривенно вводя! 1,0 мг атропина, повторяя введение при необжц] димости каждые 5 мин. Для детей дозы атропшш колеблются от 0,01 до 0,02 мг/кг при минималш ной дозе — 0,15 мг и максимальной — 2,0 Знание минимальной дозировки необходимо за возможности парадоксального эффекта — тй растания брадикардии в связи со стимуляцией малыми количествами атропина медуллярнону ядра блуждающего нерва [258\. Атропин моя вводить любым путем: внутривенно, внутрикс но, эндотрахеально, внутримышечно и подк<Щ|| но. Действие его наступает уже через 30 с, а пик -*| через 1—2 мин после внутривенной инфузии.
Сердечно-легочная реанимация 213
Побочное действие
Атропин не следует вводить пациентам, у кого нежелательна тахикардия. Больным после инфаркта или ишемии миокарда с персистирующей брадикардией атропин вводят в самой низкой дозировке, чтобы несколько увеличить частоту сердечных сокращений. Повышенные дозы у таких пациентов могут вызывать тахикардию, сопряженную с повышенной потребностью миокарда в кислороде, и угрожают фибрилляцией желудочков. У больных с нарушениями легочного или общего кровотока или идиопатическим гипертрофическим субаортальным стенозом тахикардия уменьшает наполнение желудочков и снижает сердечный выброс (табл. 7.9).
Глюкоза
Применение глюкозы во время СЛР должно быть ограничено только случаями явной гипогликемии, так как гипергликемия оказывает крайне неблагоприятное влияние на клетки мозга во время ишемии. Myers первым предположил отрицательное действие гипергликемии на неврологический статус и на исходы СЛР [259\. Это было подтверждено работами Siemkowicz и Hansen [260\, наблюдавшими значительно более тяжелые последствия 10-минутной ишемии мозга у крыс в состоянии гипергликемии по сравнению с находившимися в состоянии нормогликемии. Гипергликемия усиливает продукцию молочной кислоты в ткани мозга при анаэробном метаболизме глюкозы. При ишемии мозга у животных с нормальным уровнем сахара в крови концентрация лактата в ткани мозга представляется стабильной ("выходит на плато"). В состоянии гипергликемии содержание лактата продолжает на-

растать в течение всего периода ишемии [261]. Тяжесть внутриклеточного ацидоза во время ишемии мозга прямо пропорциональна содержанию глюкозы в крови в период до развития ишемии [262], Подобное отрицательное действие гипергликемии во время ишемии мозга основано на сохранении пусть минимального притока крови к мозговой ткани. По данным одного из исследований, более значительные неврологические поражения были отмечены в участках локальной ишемии мозга, перфузируемых по неартериальным коллатералям [263]. Клинические наблюдения подтвердили прямую корреляцию между исходным уровнем глюкозы в крови и неврологическими последствиями [264—267]. По данным Longstreth и соавт. [268], высокий уровень глюкозы в крови может быть эндогенной реакцией на сильный стресс, а не причиной более тяжелого повреждения мозга. Представляется разумным поддерживать состояние нормогликемии, особенно учитывая вероятность повторных ишемических состояний в периоде после реанимации. Voll и Auer описали благоприятное действие инсулина на неврологический статус крыс, подвергавшихся ишемии мозга в состоянии гипергликемии [269]. Осталось неясным, в какой степени устранение гипергликемии улучшает исходы у больных в состоянии ишемии. Такой эффект действия инсулина мог не зависеть от его способности устранять гипергликемию, поскольку крысы в состоянии нормогликемии также реагировали на введение инсулина лучше, чем контрольная группа, получавшая плацебо [270]. Точный контроль гликемии необходим при возможности ишемии мозга, например, при нейрохирургических вмешательствах [27Д.
Дети и ослабленные пациенты с очень ограниченными запасами эндогенной глюкозы склонны к гипогликемии в состоянии стресса (например, при операциях). Мониторинг показателей гликемии у таких пациентов может иметь решающее значение из-за опасности развития тяжелой гипогликемии. Введение глюкозы при гипогликемии у больных с остановкой сердца обеспечивает поступление энергетических ресурсов к жизненно важным органам и может иметь важное значение. Лечение гипогликемии проводят внутривенным введением глюкозы в дозе 1 мл/кг 50 % раствора взрослым, по 2 мл/кг 25 % раствора детям и по 3—5 мл/кг 10 % раствора — младенцам.
Дефибрилляция
Физиология
Фибрилляция желудочков представляет собой множественное некоординированное сокращение и расслабление отдельных мышечных воло-
214 Анестезия в педиатрии
кон, не способное обеспечить сердечный выброс и поддерживать кровоток в миокарде. Повторяющиеся множественные импульсы, генерируемые в самих желудочках и постоянно смещающиеся, поддерживают фибрилляцию. Снижению фиб-рилляционного порога способствуют тяжелые физиологические сдвиги, в том числе гипоксия, гиперкапния, ишемия миокарда, гипотермия, метаболический ацидоз и нарушения состава электролитов (натрия, калия, кальция и магния).
Желудочковые тахикардия и фибрилляция относятся к сравнительно редким типам нарушения ритма у детей. Обычно на первоначальных электрокардиограммах (ЭКГ) находят брадиарит-мию, прогрессирующую до развития асистолии. Фибрилляция желудочков стала все чаще встречаться и у детей по мере возрастания частоты врожденных пороков сердца среди них (особенно ранее оперированных), а также детей старшего возраста и подростков, принимавших токсичные вещества. Недавнее исследование показало, что фибрилляция желудочков с самого начала имела место у 19 % детей, госпитализированных по поводу остановки сердца [272\. Этиологическими факторами фибрилляции у этих детей были медикаментозные заболевания, передозировка, утопление, травма и врожденные пороки сердца.
Электрический разряд является методом выбора при лечении фибрилляции желудочков и желудочковой тахикардии с гипотензией или отсутствием пульса. Одна лекарственная терапия не в состоянии прервать подобную патологию. Высоковольтный разряд постоянного электрического тока силой более 2 А, точно направленный, пропускают через сердце, прекращая тем самым фибрилляцию. Желудочки сокращаются, и в последующем восстанавливается спонтанный сердечный ритм, если имеются достаточная оксиге-нация и нормальный кислотно-щелочной статус. Современные дефибрилляторы используют только постоянный ток. Степень повреждения миокарда электрическим разрядом прямо пропорциональна его мощности [273, 274\. Соответственно этому возрастает и частота постфибрилля-ционной аритмии [275]. Повреждения миокарда, вызываемые избыточно сильным электрическим разрядом, снижают вероятность успешной дефибрилляции и часто вызывают постдефибрил-ляционную аритмию [276]. Возникновение подобных аритмий объясняется продолжительной деполяризацией мембран клеток миокарда, становящихся более восприимчивыми к стимуляции [277,278\. Частота аритмий и степень смещения сегмента ST на ЭКГ у больных прямо пропорциональны мощности примененного разряда [257].
Большинству взрослых больных вполне достаточен разряд 100—300 Дж, если он применен с
минимальной задержкой. У полных пациентов! совсем не нужен более высокий вольтаж (500—1 1000 Дж) {276,27% Успешная дефибрилляция! была выполнена у 95 % госпитальных больных т массой тела 100 кг разрядом всего 200 Дж [27Щ Специальное исследование было посвящено! сравнению эффективности дефибрилляции у 2Щ взрослых больных разрядами от 175 до 320 Дж| Показатели выживаемости не зависели от силы! разряда и от массы тела пациентов, достигавшей} 102 кг [276]. По данным одного из исследований; | не отмечено зависимости эффекта от величина! примененного разряда и от массы сердца в грам* мах у больных, подвергшихся аутопсии [28Щ.\ Цель дефибрилляции состоит в воздействии нимальным разрядом на критическую массу же»] лудочков сердца, избегая при этом передозировки, способной дополнительно повредить сердцё|| По данным Zipes и соавт. [281], для прекращения! фибрилляции деполяризация должна быть дос* тигнута в критической массе ткани миокарда.
Оптимальная величина разряда, необходимого! для дефибрилляции у детей и младенцев, точнв! не определена, но имеющиеся сведения позволь! ют рекомендовать в качестве первой дозы 2 /! [282]. При втором и последующих разрядах ис*1 пользуют 4 Дж/кг.
Несколько клинических факторов определяют! эффективность вентрикулярной дефибрилляция. 1 Результаты этого метода снижаются по мере уве*| личения продолжительности фибрилляции;! Краткий срок существования последней — наи«] более точный ориентир успешности предприняв маемой дефибрилляции [280,283]. Эффект !
гается в большинстве случаев, если попытки до фибрилляции предпринимаются в течение 8 после ее возникновения, но чаще всего вует при ее проведении спустя 17 мин [280]. зультаты последнего исследования подтверждают! опыты на собаках, показавшие, что даже краткий| период миокардиальной перфузии знач улучшает результаты дефибрилляции даже послв| длительного периода фибрилляции [284]. Ацидо и гипоксия также неблагоприятно влияют на ре|| зультаты дефибрилляции [280]. Температура тел|| пациента не играет существенной роли [285 Больные в терминальном состоянии хуже подца*| ются дефибрилляции, чем перенесшие инфарк$| миокарда [286].
Правильные размеры и установка электрод имеют решающее значение для успеха дефибрил-1 ляции. При наружной дефибрилляции испольад ют два электрода: диаметром 13 см для вз{ 8 см для детей старшего и 4,5 см — младшег возраста. Желательно использовать более круп«| ные электроды, редуцирующие плотность тока» снижающие повреждение миокарда. Если по*| верхность электрода неплотно прилегает к коа
Сердечно-легочная реанимация 215
 то
вся плотность электрического потока
сосредоточится
на плотно фиксированных участках кожи.
Расположение электродов должно быть
таким,
чтобы между ними находился максимальный
объем сердца. Если по каким-либо причинам
оба электрода невозможно наложить на
переднюю поверхность грудной клетки,
то один из них
устанавливают спереди над областью
сердца, а
другой — сзади между лопатками.
то
вся плотность электрического потока
сосредоточится
на плотно фиксированных участках кожи.
Расположение электродов должно быть
таким,
чтобы между ними находился максимальный
объем сердца. Если по каким-либо причинам
оба электрода невозможно наложить на
переднюю поверхность грудной клетки,
то один из них
устанавливают спереди над областью
сердца, а
другой — сзади между лопатками.
Пространство между электродом и поверхностью кожи можно смазать специальным электродным кремом, пастой, солевым раствором или проложить смоченной в солевом растворе салфеткой. Крем создает меньшее сопротивление, чем паста. Необходимо следить, чтобы пасты из-под электродов не соприкасались между собой, так как ток пойдет между ними по пути наименьшего сопротивления. Это особенно важно у младенцев с очень небольшими размерами тела.
Попытки дефибрилляции должны предприниматься по возможности в самом начале развития соответствующей патологии, нередко возникающей в периоперационном периоде. При безуспешности второй попытки дефибрилляции в дальнейшем следует продолжать обычные методы реанимации, вводить эпинефрин, бикарбонат натрия (при имеющемся метаболическом ацидозе и если для этого остается время). При необходимости третьей попытки дефибрилляции используют разряд в 360 Дж у взрослых и 4 Дж/кг у детей. При возобновлении фибрилляции можно использовать лидокаин, бретилиум или прокаи-намид. Величины разряда совсем не обязательно увеличивать при каждой из удавшихся попыток дефибрилляции. Напротив, порог вентрикуляр-ной фибрилляции часто повышается после проведения СЛР и назначении лекарственных препаратов.
Прямую дефибрилляцию следует проводить только при уже вскрытой грудной клетке во время проводившейся операции. В этих случаях используют заряд 5—20 Дж, начиная с более низких. Применяют специальные электроды, накладывая их непосредственно на сердце. Диаметр этих электродов равен 6 см для взрослых, 4 см — для детей и 2 см — для младенцев. Рукоятки электродов должны быть изолированы. Сами электроды, смазанные солевым раствором, накладываются спереди на правый, а сзади — на левый желудочек.
Автоматизированная наружная дефибрилляция
Автоматизированная наружная дефибрилляция (АНД) в настоящее время рассматривается как метод стандартной терапии при фибрилляции желудочков, развившейся вне стационара у
взрослых больных. Ей отводится ключевая роль в успешной реанимации [287\. Разряд низкой энергии, 150 Дж, юстированный сопротивлением, клинически безопасен и эффективен у взрослых [288\. Продолжают разрабатываться и производиться улучшенные, более легкие, дешевые и простые в использовании дефибрилляторы, приспособленные для АНД [289].
Применение АНД ориентировано преимущественно на взрослых больных в связи с редкостью фибрилляции желудочков у детей. Автоматизация этих приборов создает разряд более высокий, чем обычно необходим детям. Тем не менее по мере роста частоты фибрилляции желудочков, становящихся причиной остановки сердца в детском возрасте, будут возрастать преимущества применения АНД и у детей. Ретроспективный анализ применения АНД службой скорой помощи у 18 детей и подростков в возрасте 5—15 лет подтвердил хорошую переносимость шока и восстановление нормального ритма [2Щ.
Лидокаин
Химическая характеристика
Лидокаин относится к антиаритмическим препаратам класса 1В, он быстро подавляет внутренний натриевый клапан^ повышает рефрактерный период и укорачивает общий потенциал действия. Метаболизм препарата происходит преимущественно в печени с помощью микросомальных ферментных систем [291]. Более 10 % препарата выводится с мочой в неизмененном виде. Содержание неизмененного препарата возрастает в кислой моче. Лидокаин не всасывается в кишечнике и не выводится с желчью.
Электрофизиология
Лидокаин снижает автоматизм синусового узла и его деполяризацию в спонтанной фазе 4. Препарат повышает порог вентрикулярной фибрилляции и слегка увеличивает или не влияет на диа-столический порог деполяризации. Он снижает продолжительность действия потенциалов пучка Пуркинье и миокарда желудочков, повышая эффективность рефрактерного периода этого пучка. Лидокаин не влияет на проводимость атриовен-трикулярного узла и не меняет время прохождения импульса в проводящей системе сердца. Замедляя автоматизм, лидокаин предотвращает или ограничивает вентрикулярную, аритмию, вызываемую эктопическими фокусами. Лидокаин устраняет аритмию типа "возвратного действия", снижая продолжительность потенциалов действия и время проводимости пучка Пуркинье.
216 Анестезия в педиатрии
Влияние лидокаина на ткани в условиях их ишемии и ограниченного проникновения препарата остается неясным [291].
Гемодинамическое действие
Быстрое внутривенное введение лидокаина (болюс) в опытах на животных снижает ударную работу, артериальное давление и общее сосудистое сопротивление [292]. Одновременно снижается сократимость левого желудочка и незначительно учащается пульс [293]. У здоровых взрослых пациентов лидокаин не изменяет ритм сердца и артериальное давление [294,295]. У бодрствующих взрослых больных с кардиальной патологией внутривенное введение лидокаина приводит к некоторому ослаблению функции желудочков [294]. Однако даже введение болюса этого препарата в 1—2 мг/кг больным после инфаркта миокарда не изменяет сердечный выброс, частоту пульса и величину артериального давления [295]. Быстрое внутривенное введение избыточных доз лидокаина может ухудшить функцию сердца у пациентов с тяжелой кардиальной патологией, особенно после острого инфаркта миокарда. Поэтому рекомендовано медленное введение препарата в дозах не более 50—100 мг/мин у взрослых [291]. У пациентов со здоровым сердцем лидокаин вызывает очень незначительные нарушения или не вызывает их вообще.
Антиаритмическое действие
Лидокаин эффективно устраняет желудочковые экстрасистолы (ЖЭС) и желудочковую тахикардию, возникающие во время обычных операций, перед и после операций на сердце, при острых инфарктах миокарда и при интоксикации дигиталисом. Применение лидокаина при лечении ЖЭС после инфаркта миокарда показано при их частоте не более 5 в 1 мин, при одиночном источнике их возникновения, нормальном Г-зубце и при провоцировании ими вен-трикулярной тахикардии. Лидокаин успешно предотвращает и устраняет желудочковую аритмию, возникающую во время катетеризации сердца. Назначение препарата показано после кардиоверсии по поводу желудочковой фибрилляции, особенно при ее повторении или развитии тахикардии. Лидокаин неэффективен при аритмиях предсердного или атриовентрикуляр-ного происхождения.
Фармакокинетика
Терапевтический уровень лидокаина достигается и поддерживается при введении вначале болюс -ной дозы препарата с последующей его медлен-
ной инфузией. Без массивной начальной нагрузки нужный уровень стабильного содержания пре* парата в крови наступает крайне поздно (5 пет риодов полувыведения [291], т.е. при периоде полувыведения в 108 мин потребовалось бы 9 Ч для достижения необходимой плато-концентрации. При введении только одного болюса вен-трикулярная аритмия возобновляется спустя 15-20 мин из-за быстрого клиренса препарата из центрального кровотока [143].
Токсическое действие лидокаина отмечается только у больных с патологией печени или при тяжелой сердечной недостаточности с отеками. Токсичность препарата у таких пациентов прояви ляется при его концентрации в сыворотке 7— 8 мкг/кг. Снижение сердечного выброса в этих случаях уменьшает кровоток в печени и соответственно задерживает клиренс лидокаина. Резкое снижение клиренса препарата происходит и во время СЛР, когда крайне невелики сердечный выброс и печеночный кровоток. Резкое повышение концентрации лидокаина в крови и тканях было отмечено при введении его болюса в 2 мг/кг собакам во время СЛР и артериальном давлении 20 % от исходного уровня. В подобном состоянии распределение препарата, обычно завершаю^ щееся за 20 мин, может происходить более 1 ч. Во время СЛР клиренс и распределение лидокаина могут существенно изменяться из-за нарушений метаболизма и связывания препарата белками [296]. Пик концентрации лидокаина в кро* ви и тканях у больных во время СЛР наступает позднее.
Исследования на собаках, проведенные во время прямой СЛР, не выявили различий в пике концентрации лидокаина при его введении в пе» риферические или центральные сосуды [297\.
Дозировка
Больным с нормальной функцией сердца и печени препарат вводят внутривенно в болюсной дозе 1,5—2 мг/кг с последующей медленной инфузией по 55 мкг/кг/мин (табл. 7.10). При возобновлении аритмии болюсную дозу вводят повторно [238]. При умеренном снижении сердечного выброса и у больных после острого инфаркта миокарда начальная болюсная доза равна 1 — 1,5 мг/ кг, а при последующей медленной инфузии лидокаин вводят в дозе 30 мкг/кг/мин. При значительном снижении сердечного выброса болюсная доза не превышает 0,75 мг/кг, а доза при последующей инфузии — 10—20 мкг/кг/мин. У боль* ных с патологией печени доза препарата снижается наполовину по сравнению с нормальной; Хроническая патология почек или гемодиализ н# изменяют фармакокинетику лидокаина. Однако при длительных инфузиях возможно постепенное
Сердечно-легочная реанимация 217

накопление токсичных метаболитов. Препарат часто вступает во взаимодействие с другими медикаментами. Фенобарбитал ускоряет метаболизм лидокаина, что вынуждает повышать дозировки последнего. Изониазид и хлорамфеникол, напротив, замедляют его выведение, позволяя снижать дозировки. Все препараты, снижающие сердечный выброс (например, (i-блокаторы), увеличивают концентрацию лидокаина в крови, а увеличивающие сердечный выброс и кровоток в печени (например, изопротеренол) снижают этот показатель.
Побочное действие
Токсическое действие лидокаина обычно проявляется нарушениями со стороны центральной нервной системы и выражается судорогами, психозом, сонливостью, парестезиями, дезориентацией, мышечными подергиваниями, возбуждением и остановкой дыхания. При судорогах или психозах хорошее действие оказывают диазепам или барбитураты. Чисто аллергические реакции на лидокаин возникают крайне редко. Осложнения со стороны сердечно-сосудистой системы (описанные выше) обычно возникают в восстановительном периоде после недавно перенесенного инфаркта миокарда. Описаны случаи возникновения полного сердечного блока у больных, страдавших блоком второй степени до применения лидокаина [298\. Наблюдалось также дальнейшее нарастание синусовой брадикардии. Подобные эффекты относятся к весьма редким и
возникают только при назначении повышенных дозировок. Потенциальная опасность побочного действия не запрещает назначение лидокаина.
Амиодарон
Химическая характеристика
Амиодарон представляет собой дийодинирован-ное производное бензофурана, содержащее ди-этилированную третичную цепь амина. Он обладает высокой липотропностью и широко распространяется в тканях. Препарат подвергается метаболизму в печени и выводится преимущественно с желчью. С мочой выделяется незначительная часть принятого препарата. Период полувыведения амиодарона длителен и колеблется от 20 до 47 дней [299\.
Фармакологическое действие
Амиодарон обладает широким спектром фармакологического действия, включая все четыре типа антиаритмического влияния [30О\. Он действует как блокатор К+-канала, блокирует быстрое внутреннее перемещение Na+, является неконкурентным р-блокатором, а также обладает свойствами блокатора Са2+-канала. Примечательно, что его выраженное электрофизиологическое действие зависит от способа и продолжительности назначения [301]. При продолжительном назначении его преимущественная активность проявляется в способности усиливать действие потенциалов длительности большинства тканей сердца (эффект III класса). Острое его действие при внутривенном введении проявляется возрастанием реф-рактерности атриовентрикулярного узла и времени интервала проводимости в нем (адренергиче-ский эффект II класса) или развитием блокады кальциевого канала (эффект IV класса) [302].
Амиодарон, кроме того, вызывает расширение коронарных сосудов и сосудов общей сети [303]. Он обладает способностью ингибировать активность фосфодиэстеразы [304] и является селективным ингибитором метаболизма тиреоидного гормона [300].
Клинические показания
Изучение амиодарона было проведено как в качестве профилактического препарата длительного назначения больным с органическими заболеваниями сердца и высоким аритмогенным потенциалом, так и в качестве средства экстренной помощи при острых, угрожающих жизни аритмиях. Более 15 исследований подтвердили эффективность амиодарона при тахикардии и фибрилляции желудочков у больных, безуспешно лечен-
218 Анестезия в педиатрии
ных лидокаином или бретилиумом [299,305— 308\. Рандомизированное исследование по внутривенному введению амиодарона по сравнению с плацебо подтвердило его высокую эффективность. Улучшение наступало у большинства больных, доставленных в отделение скорой помощи после остановки сердца, произошедшей вне госпиталя [309].
Изучение амиодарона было проведено и у детей, отличающихся более благоприятными исходами. Perry и соавт. отметили ликвидацию аритмии у 6 из 10 детей (средний возраст 6,8 года), не поддававшейся действию многих других антиаритмических средств [310]. Figa и соавт. наблюдали 30 младенцев и детей с угрожающей жизни аритмией, в том числе осложненной суправен-трикулярной и вентрикулярной тахикардией. Эти нарушения были устранены у 71 % детей, и еще у 23 % наступило значительное улучшение клинического состояния и сердечного ритма [311].
Большое число наблюдений подтвердило эффективность препарата при лечении хронических больных с высоким риском внезапной смерти, связанной с аритмией. Продолжается проведение проспективных рандомизированных исследований сердечного ритма.
Побочное действие
Побочные реакции на амиодарон становятся более редкими при снижении дозировки препарата [312]. Чаще всего со стороны сердечно-сосудистой системы отмечается гипотензия, вызванная расширением сосудов и отрицательным инотроп-ным действием амиодарона. Сообщалось о случаях брадиаритмии, застойной сердечной недостаточности, остановки сердца и о желудочковой тахикардии. Возможно также развитие проарит-мии, но она развивается реже, чем при назначении других антиаритмических средств III класса. Частота этого осложнения, как полагают, равна примерно 2 %. Смещение точки пуска ритма отмечается в трети всех случаев [ЗЩ.
Побочные реакции со стороны легких являются наиболее частым из всех внесердечно-сосудистых осложнений. Гиперчувствительные пневмониты могут развиваться уже на раннем этапе терапии. Интерстициальные пневмониты развиваются чаще всего при длительном энтеральном приеме препарата. Симптомами служат кашель, высокая лихорадка, одышка, похудание, боли при дыхании и двусторонние инфильтративные изменения интер-стициального характера. Все эти симптомы проходят после отмены препарата [313].
Токсические изменения со стороны печени чаще отмечаются при приеме амиодарона внутрь. Нарушения функции щитовидной железы по типу гипо- или гипертиреоза наблюдаются у 10 %
пациентов. Неврит оптического нерва или ней-ропатия, выражающиеся снижением остроты., зрения и его затуманенностъю, могут прогрессировать вплоть до полной слепоты. Неврологические нарушения могут проявляться в виде aTaicf сии, тремора, периферической нейропатии слабости и утомляемости, нарушений сна, головокружений и головных болей. Изменения со стороны кожи выражаются появлением аллергических высыпаний, фоточувствительностью и голубовато-серой пигментацией [314].
Соталол
Химическая характеристика
Соталола гидрохлорид является рацемическим; компонентом, состоящим из эквимолярных ко центраций 1- и d-изомеров. Первые обладаю?] наибольшей р-блокирующей активностью. Оба изомера оказывают одинаковое антиаритмиче* ское действие по типу III класса [315]. ■
Фармакологическое действие
Соталол является некардиоселективным р-блока-.] тором. Помимо действия по II классу, он обладает антиаритмическим действием по III классу: Бета-блокирующее действие включает увеличен ние продолжительности синусового цикла, АН* интервала и эффективного рефрактерного периода атриовентрикулярного узла. Все эти эффектЙ I зависят от величины дозы. Действие по III классу состоит в увеличении продолжительности потенциала действия и в удлинении эффективногд и абсолютного рефрактерного периодов всей ткани сердца. Вызываемое соталолом удлинение продолжительности потенциала действия зависит от исходной частоты сердечных сокращении] наиболее оно выражено при низкой его частоте! [316]. На клеточном уровне влияние препарата на 1 потенциал действия связано с задержкой выхода калия, который активируется при наступлении фазы плато потенциала действия [317\. Действие сотанола в некоторой степени зависит от возрасти пациента. Увеличение интервала Q—Г и удлинение продолжительности потенциала действия у новорожденных щенков выражено сильнее, чему взрослых собак [318]. Удлинение интервалов P—Q и Q—T, а также увеличение продолжительности синусового цикла происходят в результате пролонгирования процесса реполяризации.
Фармакокинетика
Соталол при приеме внутрь почти полностью всасывается в желудочно-кишечном тракте и не подвержен метаболическому воздействию при
Сердечно-легочная реанимация 219
первом прохождении через печень. Пик концентрации препарата в плазме достигается через 2— 4 ч после приема. Выделяется препарат почти исключительно почками, не подвергаясь существенному метаболизму. Поскольку соталол высокогидрофилен, его влияние на центральную нервную систему значительно слабее, чем у других р-блокаторов [319\.
Электрофизиологические сдвиги происходят быстро после внутривенного введения болюсной или инфузионной доз препарата. Они выражаются значительным увеличением эффективного рефрактерного периода правого желудочка [320[. Доза сотанола при внутривенном введении от 0,5 до 1,5 мг/кг при инфузии на протяжении 1—5 мин [320].
Клинические показания
Применение соталола показано при лечении различных форм повторных суправентрикулярных тахиаритмий, сопровождающихся успешным прохождением примерно 90 % всех возникающих импульсов [315\. Препарат также применялся с умеренным успехом у больных с эктопической предсердной тахикардией и при предсердном флаттере [315, 318, 321].
Назначение соталола при желудочковых тахи-аритмиях не получило столь значительного распространения, как у взрослых. Умеренная эффективность препарата отмечена у больных с угрожающими жизни желудочковыми тахиарит-миями [315, 318].
Побочное действие
Клинические проявления побочного действия соталола связаны с его свойствами р-блокатора и выражаются слабостью, головокружением, бра-дикардией [322]. У пациентов с ишемической болезнью сердца могут отмечаться нарушения функции левого желудочка и застойная сердечная недостаточность [323]. Проаритмическое действие соталола, вероятнее всего, обусловлено индуцированием раннего последеполяризацион-ного эффекта [324]. Проаритмия проявляется преимущественно смещением пусковых точек или неподдерживающейся вентрикулярной тахикардией у взрослых. У детей проаритмия развивается реже и выражается обострениями бради-кардии и желудочковой эктопией [315, ЗЩ.
Бретилиум
Химическая характеристика
Бретилиум относится к антиаритмическим препаратам III класса (удлиняет фазу 3 реполяриза-ции, увеличивая рефрактерный период). Он
представляет собой четырехкомпонентный аммониевый бромбензил, структурно не связанный с лидокаином. Время полувыведения препарата постепенно увеличивается и в среднем равно 9,8 ч [325]. Около 80 % неизмененного препарата выводится с мочой в течение 24 ч после приема. Еще около 10 % выводится на протяжении следующих 72 ч [326].
Механизм действия
Механизм действия бретилиума во многом остается спорным, но наиболее выражены его свойства адренергического стимулятора. Это проявляется первоначальным высвобождением нор-эпинефрина окончаниями адренергических нервов с последующим ингибированием этого процесса [327]. Он также блокирует повторное поглощение норэпинефрина и эпинефрина окончаниями адренергических нервов, потенцируя тем самым действие этих агонистов на адренорецеп-торы.
Бретилиум, по-видимому, оказывает и прямое влияние на сердце, не устраняющееся предшествующим назначением резерпина или денерваци-ей сердца [328]. Препарат увеличивает продолжительность потенциала действия сердечной мышцы и повышает эффективность рефрактерного периода пучка Пуркинье и проводящих волокон в желудочках. У собак бретилиум уравнивает разницу продолжительности потенциалов действия между зоной инфаркта и нормальным миокардом. В этом состоит основное объяснение его антиаритмического влияния [329]. Препарат также повышает порог желудочковой фибрилляции нормального миокарда и при его инфаркте. Дефибрилляция при назначении бретилиума может произойти и без применения электрического разряда [330\.
Клиническое действие
По данным ряда исследований, бретилиум подавляет желудочковую аритмию эффективнее других современных методов, в том числе устраняя вентрикулярную фибрилляцию, не поддающуюся воздействию электрического разряда [287]. В настоящее время препарат назначают при угрожающих жизни желудочковых аритмиях, особенно вентрикулярных фибрилляциях и тахикардии, не поддающихся лечению адекватными дозами препаратов первого ряда (лидокаина и прокаинамида) [33Г]. Электрокардиоверсия остается первоочередным методом терапии желудочковых фибрилляций и желудочковых тахикардии, сопровождающихся гипотензией. Бретилиум не используют для лечения бессимптомных ЖЭС и аритмий предсердного происхождения. Лидокаин
220 Анестезия в педиатрии
и бретилиум одинаково эффективны при начальной терапии желудочковой фибрилляции [332\. Сравнение, проведенное при реанимации вне госпиталя, не выявило различий между ними в плане числа больных со стабилизацией сердечного ритма, срока наступления этой стабилизации и показателей выживания. У больных, учтенных в данном исследовании, ни разу не применялась электрокардиоверсия [ЗЗО\.
Дозировка
Бретилиум при лечении вентрикулярной фибрилляции или тахикардии вводят внутривенно болюсом в дозе 5—10 мг/кг. В менее срочной ситуации 500 мг препарата разводят в 50 мл или более жидкости и инфузируют медленно (более 10 мин). При медленном введении реже наблюдается тошнота у бодрствующих больных. Строгий мониторинг ЭКГ и артериального давления крайне необходим во время введения бретилиу-ма. Действие препарата по устранению желудочковой фибрилляции и повышению эффекта электрокардиоверсии начинает сказываться уже через несколько минут, но может задержаться до 10—15 мин. При внутримышечной инъекции этот срок удлиняется до 20—60 мин. Препарат продолжает действовать в течение 6—12 ч [332].
После внутривенного введения дозы бретилиу-ма следует применять электрический разряд. При сохранении аритмии повторные введения препарата проводят каждые 15—30 мин до общей дозы 30 мг/кг. Если аритмия устранена, то переходят на поддерживающую терапию такими же дозами бретилиума, вводимыми каждые 6—8 ч. При лечении желудочковых аритмий вторую дозу вводят спустя 1—2 ч, а последующие с промежутком 6— 8 ч. Препарат можно также вводить длительно по 1—2 мг/мин взрослым пациентам.
Побочное действие
Побочные реакции на бретилиум чаще всего проявляются со стороны сердечно-сосудистой системы. Высвобождение норэпинефрина, происходящее обычно вслед за введением начальной дозы препарата, приводит к повышению артериального давления. По данным одного из исследований, это имело место у 16 % больных [333]. Возможно некоторое учащение пульса или ЖЭС. Бретилиум также оказывает инотропное влияние [327].
Вслед за начальным повышением артериального давления у большей половины пациентов наступает его снижение, особенно выраженное у больных в положении сидя [331]. Это падение артериального давления обусловлено блокированием адренергического эффекта под воздействи-
ем бретилиума. В случаях тяжелой гипотензйШ; необходимо внутривенное введение жидкости |i сосудосуживающих препаратов [327]. Под влия?| нием бретилиума резко возрастает чувствитей)Й | ность к дофамину, норэпинефрину и эпинефрй^ | ну, а их введение может вызывать чрезмерный! реакции. При назначении поддерживающих дбё | пациенты более резистенты к гипотензивном*^ действию бретилиума на протяжении нескольких! дней. Быстрые инфузии препарата часто сопро3! вождаются тошнотой и рвотой. ЭнтеральныИ прием бретилиума может осложниться опухан# ем слюнных желез и их болезненностью [ЗЩ (см. табл. 7.10). '■''•*:
Сердечно-легочная реанимация — это не какой-* то определенный метод терапии при останови! сердца, а система поддержания дыхания и цирку? ляции до тех пор, пока не удастся коррекция главной причины заболевания. У детей такой причиной может быть патология дыхательных путей, восстановление их проводимости в самом начале СЛР может стать лечебным воздействием^ Ограниченные возможности СЛР делают особенно необходимым более раннее распознавание основной причины заболевания и коррекцию пато-

Сердечно-легочная реанимация 221
 логии
для восстановления спонтанной
циркуляции.
Во время наркоза такими мерами могут
быть
восстановление проходимости дыхательных
путей, уменьшение глубины анестезии
или устранение
гиповолемии. При электромеханической
диссоциации
и хорошей проходимости дыхательных
путей следует в первую очередь исключить
гиповолемию,
напряженный пневмоторакс, пе-рикардиальную
тампонаду. Фибрилляция желудочков
(крайне редко наблюдающаяся у детей
без
врожденных болезней сердца) должна
вызвать
предположение о гипокальциемии,
гипока-лиемии,
гипомагнезиемии, гипогликемии.
Необходимо
также исключить гипотермию и интоксикацию
из-за передозировки дигиталиса или
три-циклических
антидепрессантов. Перечень сопутствующих
и способствующих факторов приведен в
табл. 7.11.
логии
для восстановления спонтанной
циркуляции.
Во время наркоза такими мерами могут
быть
восстановление проходимости дыхательных
путей, уменьшение глубины анестезии
или устранение
гиповолемии. При электромеханической
диссоциации
и хорошей проходимости дыхательных
путей следует в первую очередь исключить
гиповолемию,
напряженный пневмоторакс, пе-рикардиальную
тампонаду. Фибрилляция желудочков
(крайне редко наблюдающаяся у детей
без
врожденных болезней сердца) должна
вызвать
предположение о гипокальциемии,
гипока-лиемии,
гипомагнезиемии, гипогликемии.
Необходимо
также исключить гипотермию и интоксикацию
из-за передозировки дигиталиса или
три-циклических
антидепрессантов. Перечень сопутствующих
и способствующих факторов приведен в
табл. 7.11.
Rainer EH: Respiratory and cardiac arrest during anaes thesia in children. Br Med J 2:1024, 1957
Sladen A: Closed-chest massage. JAMA 251:3137, 1984
Kouwenhoven WB, Jude JR, Knickerbocker GG: Closed- chest cardiac massage. JAMA 173:1064, I960
Jude JR, Kouwenhoven WB, Knickerbocker GG: Cardiac arrest: report of application of external cardiac massage on 118 patients. JAMA 178:1063, 1961
Keenan RL, Boyan CP: Cardiac arrest due to anesthe sia: a study of incidence and causes. JAMA 253:2373, 1985
Olsson GL, Hallen B: Cardiac arrest during anaesthesia. A computer-aided study in 250 543 anaesthetics. Acta An- aesthesiol Scand 32:653, 1988
Cohen MM, Cameron CB, Duncan PG: Pediatric an esthesia morbidity and mortality in the perioperative pe riod. Anesth Analg 70:160, 1990
Keenan RL, Shapiro JH, Dawson KD: Frequency of an esthetic cardiac arrests in infants: effect of pediatric an esthesiologists. J Clin Anesth 3:433, 1991
Crone RK: Frequency of anesthetic cardiac arrests in in fants: effect of pediatric anesthesiologists. J Clin Anesth 3:431, 1991
Flisk R, Martin LD: Twelfth annual meeting of the Soci ety for Pediatric Anesthesia, Orlando, Florida, October 16, 1998. Anesth Analg 88:955, 1999
Lee CJ, Bullock LJ: Determining the pulse for infant CPR: Time for a change? Milit Med 156:190, 1991
Cavallaro DL, Melker RJ: Comparison of two techniques for detecting cardiac activity in infants. Crit Care Med 11:189, 1983
Elam JO, Brown ES, Elder JD: Artificial respiration by mouth-to-mask method. N Engl J Med 250:749, 1954
Safar P, Brown TC, Holtey WJ,. Wilder RJ: Ventilation and circulation with closed-chest cardiac massage in man. JAMA 176:92, 1961
American Heart Association's Guidelines for Cardiopul monary Resuscitation and Emergency Cardiac Care. JA MA 268:2202, 1992
Bhende MS, Thompson AE, Cook DR, Saville AL: Va lidity of a disposable end-tidal CO2 detector in verifying endotracheal tube placement in infants and children. Ann Emerg Med 21:142, 1992
Bhende MS, Thompson AE: Evaluation of an edn-tidal
CO2 detector during pediatric cardiopulmonary resuscitation. Pediatrics 95:395, 1995
Wilder RJ, Weir D, Rush BF, Ravitch MM: Methods of coordinating ventilation and closed chest cardiac massage in the dog. Surgery 53:186, 1963
American Heart Association's Guidelines for Cardiopul monary Resuscitation and Emergency Cardiac Care. JA MA 268:2200, 1992
Weale FE, Rothwell-Jackson RL: The efficiency of cardi ac massage. Lancet 1:990, 1962
Rudikoff MT, Maughan WL, Effron M et al: Mechanism of blood flow during cardiopulmonary resuscitation. Cir culation 61:345, 1980
Criley JM, Blaufuss AH, Kissel GL: Cough-induced car diac compression: self-administered form of cardiopulmo nary resuscitation. JAMA 236:1246, 1976
Niemann JT, Rosborough JP, Hausknecht M et al: Cough-CPR: documentation of systemic perfusion in man and in an experimental model: a "window" to the mecha nism of blood flow in external CPR. Crit Care Med 8:141, 1980
Harada Y, Fuxeno H, Ohtomo T et al: Self-administered hyperventilation cardiopulmonary resuscitation for 100s of cardiac arrest during holter monitoring. Chest 99, 1991
MacKenzie GJ, Taylor SH, McDonald AH, Donald KW: Haemodynamic effects of external cardiac compression. Lancet 1:1342, 1964
Chandra N, Weisfeldt ML, Tsitlik J et al: Augmentation of carotid flow during cardiopulmonary resuscitation by ventilation at high airway pressure simultaneous with chest compression. Am J Cardiol 48:1053, 1981
Niemann JT, Rosborough JP, Hausknecht M et al: Blood flow without cardiac compression during closed chest CPR. Crit Care Med 9:380, 1981
Cohen JM, Chandra M, Alderson PO et al: Timing of pul monary and systemic blood flow during intermittent high intrathoracic pressure cardiopulmonary resuscitation in the dog. Am J Cardiol 49:1883, 1982
Raessler KL, Kern KB, Sanders AB et al: Aortic and right atrial systolic pressures during cardiopulmonary resuscita tion: a potential indicator of the mechanism of blood flow. Am Heart J 115:1021, 1988
Swenson RD, Weaver WD, Niskanen RA et al: Hemody- namics in humans during conventional and experimental methods of cardiopulmonary resuscitation. Circulation 78:630, 1988
Paradis NA, Martin GB, Goetting MG et al: Simultane ous aortic, jugular bulb, and right atrial pressures during cardiopulmonary resuscitation in humans: insights into mechanisms. Circulation 80:361, 1989
Chandra N, Rudikoff M, Weisfeldt ML: .Simultaneous chest compression and ventilation at high airway pressure during cardiopulmonary resuscitation. Lancet 1:175,1980
Niemann JT, Rosborough JP, Hausknecht M et al: Pres sure-synchronized cineangiography during experimental cardiopulmonary resuscitation. Circulation 64:985, 1981
Fisher J, Vaghaiwall F, Tsitlik J et al: Determinants and clinical significance of jugular venous valve competence. Circulation 65:188, 1982
Guerci AD, Shi A, Levin H et al: Transmission of in trathoracic pressure to the intracranial space during car diopulmonary resuscitation in dogs. Circ Res 56:20, 1985
Criley JM, Niemann JT, Rosborough JP, Hausknecht M: Modification of cardiopulmonary resuscitation based on the cough. Circulation 74(suppl IV):lV-42, 1986
Gudipati CV, Weil MH, Deshmukh HG et al: Right atri- al-jugular venous pressure gradients during experimental CPR. Chest 89:443s, 1986
Chandra N, Tsitlik J, Halperin HR et al: Observations of hemodynamics during human cardiopulmonary resuscita tion. Crit Care Med 18:929, 1990
Goetting MG, Paradis MA: Right atrial-jugular venous
