
Ход работы
Включить освещение камерки с лежащим в ней препаратом (подсветка снизу) и сфокусировать бинокулярный микроскоп на поверхность мышцы для отыскания синаптических зон. Поиск ведется при увеличении: объектив 2, 4; окуляр 8. Под контролем бинокуляра движением винта микроманипулятора опускать микроэлектрод в камерку до тех пор, пока не станет видно, что он вошел в раствор, но еще не касается мышцы. Порядок включения приборов: сначала – компьютер, а затем – первый усилитель биопотенциалов (Nihon Kohden) и второй (самодельный) усилитель, а также - осциллограф. Необходимо вывести луч на экран осциллографа С1-18. Для этого нужно воспользоваться ручкой «Усилитель YII», плавно. На экране осциллографа должен появиться луч. Усилитель Nihon Kohden Micro-electrode Amplifer переключить на режим калибровки CAL. и установить нужную величину калибровочного импульса (10 или 20 мВ). Далее на осциллографе С1-18 плавно отрегулировать полосу пропускания (MHz) так, чтобы амплитуда калибровочного сигнала составила 1 клетку. Для записи минПКП на усилителе Nihon Kohden Micro-electrode Amplifer установить величину калибровочного сигнала 1 мВ, а для записи ПКП – 20 мВ. На втором усилителе с помощью ручек «Усиление» и «Уст.0» добиться того, чтобы калибровочный сигнал целиком был виден на экране компьютера и составлял пример четверть от размера экрана. Далее переключить усилитель Nihon Kohden Micro-electrode Amplifer в режим работы EXT.
Сначала необходимо приобрести навык введения микроэлектрода в мышечное волокно с помощью микроманипулятора. Микроэлектрод подводят к поверхности клетки осторожными и очень малыми поворотами микровинта. При этом внимательно наблюдают за лучом осциллографа С1-18. Резкий скачок луча вниз указывает на попадание микроэлектрода в волокно. Если микроэлектрод хорошо введен в волокно и оно не повреждено, то значения мембранного потенциала порядка 70-80мВ. Для поиска синаптических зон важно подобрать оптимальный контраст освещенности (с помощью зеркала под камеркой с препаратом). Синаптические зоны у диафрагмальной мышцы располагаются по ходу хорошо видных веточек нерва. В зависимости от контрастности освещения нерв и его конечные разветвления могут быть белого или темного цвета. На рис.6. схематически изображены препарат и расположение синапсов.
Веточки нерва
Рис. 6. Схема нервно-мышечного препарата диафрагмы мыши и входящего в нее диафрагмального нерва. Точками указаны вероятные места расположения синаптических контактов.
При попадании электродом в синаптическую зону на экране компьютера появляются минПКП. Амплитуда МПКП в среднем должна быть около 0,8-1 мВ. О близости введенного электрода к синапсу можно судить по короткому времени нарастания потенциала. Убедившись, что видны минПКП, близкие по амплитудно-временным параметрам к среднестатистическим для данного объекта, то есть имеющее время нарастания около 1-1,5 мс и амплитуду 0,5-1мВ, – переходите к их регистрации. Смену физиологического раствора в экспериментальной камере проводить не реже, чем раз в 10-15 минут!
Регистрация минПКП. Для анализа амплитудного распределения минПКП в каждом синапсе необходимо зарегистрировать 80-100 минПКП при непрерывной записи (рис.7). Для этого в программе PowerGraph надо нажать кнопку «Старт», вести запись в течении 3 минут, в конце регистрации записать калибровочный сигнал (1 мВ), далее остановить запись кнопкой «Стоп». Сохранить полученный блок отдельным файлом. Необходимо отмечать в тетради уровень мембранного потенциала в каждом синапсе, при котором велась регистрация минПКП.
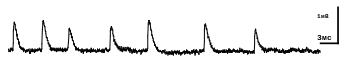
Рис. 7. Вид минПКП при регистрации микроэлектродом. Развертка луча монитора -3 мс/см, амлитдуда калибровочного сигнала - 1мВ.
Анализ воздействия вещества Х на минПКП. Зарегистрировать минПКП от 3-5 синапсов в нормальном растворе Лайли. Затем заменить нормальный (контрольный) раствор Лайли на опытный, содержащий исследуемое вещещство (исследуемое вещество Х и его концентрация задаются преподавателем, в зависимости от поставленной задачи). Препарат промыть в растворе, содержащем вещество Х, несколько раз. Зарегистрировать минПКП от максимально возможного числа разных синапсов, строго фиксируя для каждой записи время, прошедшее с момента замены нормального раствора Лайли на опытный.
Обработка результатов
Обработка полученных результатов ведется в пограмме MiniAlaysis. Для обработки полученные записи необходимо конвертировать их в формат .abf с помощью ABF Utility (File→Run ABF Utility Program).
Параметры конвертации
Byte location of data block 0
Sampling intaerval (in micro second) 2,5
ADC Voltage Range (Volts) 10
ADC Resolution (12 bit=2048) 8192
Unit (pA of mV) mV
Scaling Factor (Volts/Unit) -подбирается индивидуально
Параметр Scaling Factor (Volts/Unit) подбирается для каждой записи таким образом, чтобы после конвертации амплитуда калибровочного сигнала совпадала с амплитудой, выставленной на усилителе (дли минПКП – 1 мВ, для ПКП – 20 мВ).
В программе MiniAlaysis открыть файл и выставить параметры обсчета сигналов
Threshold (pA) 0
Period to search a local maximum (us) 2500
Time before a peak for baseline (us) 2500
Period to search a decay time (us) 10000
Fraction of a peak to find a decay time 0,5
Period to average a baseline (us) 100
Area threshold (fC) 0
Direction of Peak Positive
Далее следует подобрать параметры развертки, при которых записанные минПКП будут хорошо видны. Развертка по вертикали «Gain», развертка по горизонтали «# Blocks». Навигация внутри файла с записью осуществляется клавишами A (в начало файла), S (назад), D (вперед), F(в конец файла). Далее на записи надо отметить минПКП нажатием на них левой кнопкой мыши. После того, как в файле отмечено 100 минПКП с одного синапса, необходимо сортировать отмеченные минПКП по времени (Events→Sort Events→By time) и сохранить полученный файл. Амплитуды всех отмеченных минПКП в одном файле копируюся в программу Excel, где происходит их дальнейшая обработка.
В программе Excel расчитать среднюю амплитуду минПКП (функция СРЕДНЕЕ (AVERAGE)) и по полученным значениям амплитуд в каждом синапсе построить гистограммы амплитудного распределения минПКП. Построить гистограмму амплитудного распределения минПКП по всем синапсам (cуммарную гистограмму). Для построения гистограммы амплитудного распределения необходимо определить частоту встречаемости амплитуд в синапсе. Для этого в одном столбце выставляются интервалы в которых будут группироваться значения амплитуд минПКП с шагом 0,2 мВ (0; 0,2; 0,4 и т.д.), далее выделается соседний столбец, используется функция ЧАСТОТА (FREQUENCY). В поле Массив Интервалов (Bins_array) выделяется соседний столбец с шагом амплитуд, а в поле Массив Данных (Data_Array) – значения амплитуд минПКП из обсчитанного файла. Далее нажать на строку с функцией и нажать Ctrl+Shift+Enter. По полученным значениям построить гистограммы распределения амплитуд минПКП.
Измерить временные параметры минПКП: время нарастания и время полуспада, а также частоту минПКП. Для этого открыть обсчитанный файл в программе MiniAlaysis. Далее нажать Events→Show Column Statistics→All Events. Из полученной таблицы значения времени нарастания и полуспада и частоты минПКП скопировать в Excel, посчитать средние значения.
Сравнить среднюю частоту, амплитуду, гистограммы амплитудного распределения и временные параметры минПКП до и после действия исследованного вещества.
Задача 2. Определение временных и амплитудных параметров вызванных ПКП в норме и под действием физиологически активных веществ
Цель задачи. Зарегистрировать ПКП в ответ на раздражение диафрагмального нерва, исследовать их временные параметры и амплитудное распределение. Проследить за изменением параметров ПКП под действием исследуемого вещества.
Методика и ход работы.
Материалы и оборудование – те же, что в задаче 1.
