
- •В. И. Летунов Аналитическая химия и физико-химические методы анализа
- •Рецензент: д-р. Ф.-м.Н., доцент н. П. Степанов. Задания для контрольной работы обсуждены на заседании кафедры естественнонаучных дисциплин зип СибУпк. Протокол № 7 от 22.03.2012 г.
- •Содержание
- •Введение
- •Программа курса
- •Правила оформления контрольной работы
- •Методические рекомендации
- •Варианты контрольной работы
- •Решение типовых задач
- •К массе раствора. Пример 1
- •Пример 2
- •Пример 3
- •Пример 4
- •2. Находим массу кислоты в образце.
- •Пример 5
- •Молярная масса эквивалента окислителя (восстановителя) рассматривается как отношение молярной массы вещества к числу электронов, принявших участие в реакции.
- •Пример 6
- •Пример 7
- •Пример 8
- •Задачи контрольной работы
- •БиблиограФический список
- •Аналитическая химия и физико-химические методы анализа
- •672086, Г. Чита, ул. Ленинградская, 16.
Решение типовых задач
В аналитической химии используются следующие обозначения и понятия:
ав - навеска образца анализируемого вещества, г;
mв - содержание (масса) вещества, г;
Мэк - молярная масса эквивалента вещества, г/моль;
Мэк - это отношение молярной массы вещества (Мв) к числу атомов водорода (для кислот), или гидроксильных групп (для оснований), участвующих в реакции. Например:
NaOH + H2SO4 = NaHSO4 + Н2 О,
Mэ,н2so4,= Мн2so4/1 = Mн2so4,
Mэ,NaOH =MNaOH/l =MNaOH.
2NaOH + H2SO4 = Na2SO4 + 2H2O,
Mэ,н2so,= M н2so4/2 = 1/2 M н2so4,
Mв - молярная масса вещества, кг/моль, г/моль;
Сэк - молярная концентрация эквивалента вещества - это отношение числа эквивалентов вещества к объему раствора (V). Выражается в кмоль/м3 или моль/л; Св - молярная концентрация вещества (моль/л) равна отношению количества молей вещества (пв) к объему раствора;
Cm - моляльная концентрация вещества в растворе (моль/кг растворителя) - это отношение количества молей растворенного вещества к массе растворителя (кг);
Т - титр раствора (г/мл) - это отношение массы растворенного вещества к объему раствора (в мл);
V - объем раствора, л, мл;
р - плотность раствора - масса одного литра или одного мл раствора, кг/дм3, г/мл;
ω - массовая доля вещества - это отношение массы растворенного вещества
К массе раствора. Пример 1
Определите молярную концентрацию эквивалента вещества и молярную концентрацию 62%-ного раствора H2SO4. Плотность раствора 1,52 г/мл.
Решение:
1. Находим массу 1 литра раствора. Mр-ра = р • V = 1000 • 1,52 = 1520г
2.Находим массу безводной Н2SО4,содержащейся в 1 литре 62%-ного раствора H2SO4.
100
г содержит 62 г H2SO4
m
=
![]() =942 г
=942 г
1520 г - // - // - mв
3. Находим молярную концентрацию раствора.
CВ
=

4.Находим Сэк.
Сэк
=
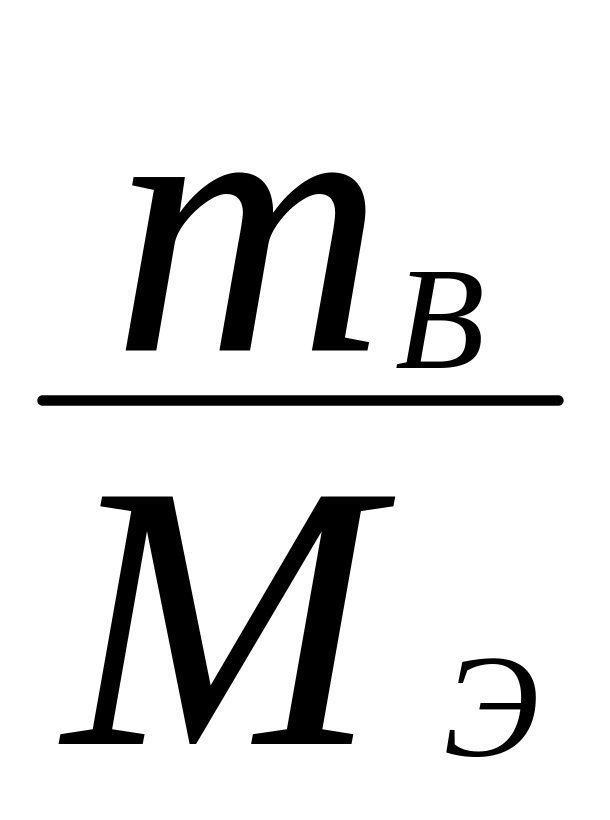 ;
Мэк =
;
Мэк =
 =
49г/моль Сэк =
=
49г/моль Сэк =
![]() = 19,2 моль/л.
= 19,2 моль/л.
Пример 2
Определите титр 0,1020н раствора НСl по определяемому веществу NaOH.
Решение:
1. Титр по определяемому веществу показывает, сколько граммов определяемого вещества реагирует с 1 мл титрованного раствора.
Количество моль-эквивалентов, содержащихся в 1 мл 0,1020н раствора НСl:
n
эк (НС1)
=
![]() =1.020 ∙ 10-4
моль/л
=1.020 ∙ 10-4
моль/л
Такое же количество моль-эквивалентов NaOH прореагирует с 1 мл раствора НС1.
2. Находим массу NaOH, которая прореагирует с 1 мл р-ра НС1:
mNaOH =n эк (NaOH) • Мэк(NаОН) Мэк(NаОН) = 40 г/моль.
mNaOH = 1,020 • 10-4 • 40 = 4,08 -10-3 = 0,00408 г/мл
THCl/NaOH
=
 = 0.00408 г/мл
= 0.00408 г/мл
Пример 3
Для установления титра раствора NaOH навеска массой 3,1513г щавелевой кислоты (Н2С2О4 • 2Н2О) растворена в мерной колбе на 500 мл. На титрование 25,00 мл полученного раствора расходуется 24,36 мл раствора NaOH. Рассчитать Сэк и Т раствора NaOH.
Т - титр раствора, показывающий, сколько граммов вещества содержит 1мл раствора, г/мл.
Решение:
Находим Мэк(Н2С2О4 • 2Н2О) и Mэк(NaOH).
Н2С2О4 + 2NaOH = Na2C2O4 + 2H2O
Мэк
(Н2С2О4
• 2Н2О)
=
 =
=
![]() = 63.03
г/моль
= 63.03
г/моль
Мэк
(NaOH) =
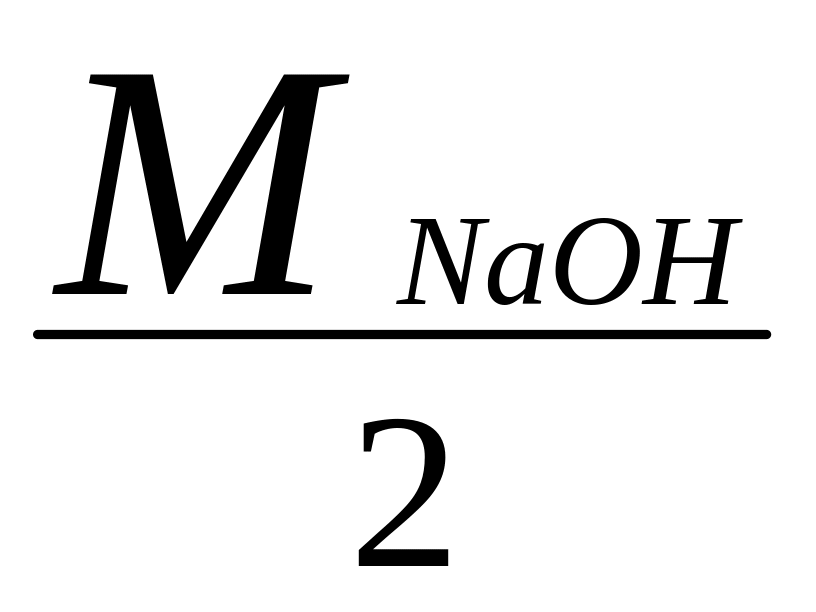 = 40 г/моль
= 40 г/моль
2.Находим Сэк(Н2С2О4 • 2Н2О).
Сэк
(Н2С2О4)
=

3. Находим Cэк(NaOH).
Сэк(NаОН) • V NaOH = Сэк(Н2С2О4 • 2Н2О) • V(Н2С2О4 • 2Н2О).
Сэк
(NaOH)
=
![]() = 0,1026 моль/л.
= 0,1026 моль/л.
4. Находим TNaOH
TnaOH
=
 =0,004103
г/мл
=0,004103
г/мл
