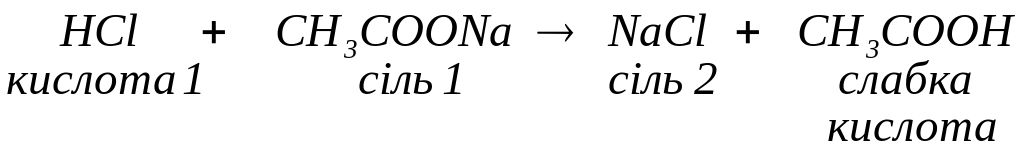- •Міністерство освіти і науки, молоді та спорту україни національний технічний університет україни
- •Атомно – молекулярне вчення. Основні поняття атомно – молекулярного вчення. Стехіометричні закони хімії. Класи неорганічних сполук.
- •Нтуу “кпі”
- •Навчальний електронний посібник
- •Атомно-молекулярне вчення
- •Основні поняття атомно-молекулярного вчення
- •Стехіометричні закони хімії Закон збереження маси
- •Закон сталості складу
- •Закон еквівалентів
- •Закони ідеальних газів
- •Закон Авогадро
- •Закон Дальтона
- •Класи неорганічних сполук Оксиди
- •Способи добування оксидів
- •Кислоти
- •Способи добування кислот
- •Способи добування основ
- •Амфотерні гідроксиди
- •Способи добування амфотерних гідроксидів
- •Способи добування солей
- •Генетичний зв’язок між основними класами неорганічних сполук
- •Завдання для самостійної підготовки
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додатки Додаток а Назви деяких простих речовин і елементів (дсту 2439-94)
- •Додаток б
- •Додаток в Розчинність кислот, основ та солей у воді (р – розчиняється, н – не розчиняється, м – мало розчиняється, '-' –не існує або розкладаються водою)
- •Додаток г
- •Додаток д Періодична система елементів д.І.Менделєєва
Способи добування оксидів
Взаємодія простих речовин з киснем (горіння). Але так можна одержати не всі оксиди:
![]()
![]()
![]()
![]() .
.
Розклад основ. Деякі основи або амфотерні гідроксиди за нагрівання втрачають воду, утворюючи відповідні основні або амфотерні оксиди. Ступінь окиснення металу не повинна змінюватися.
![]()
(![]() -
основний оксид);
-
основний оксид);
![]()
(![]() -
основний оксид);
-
основний оксид);
![]()
(![]() -
амфотерний оксид);
-
амфотерний оксид);
![]()
(![]() -
амфотерний оксид).
-
амфотерний оксид).
Розклад нестійких кислот. Нестійкі кисневмісні кислоти (при спробі їх добування за реакціями обміну) втрачають воду, перетворюючись на кислотні оксиди:
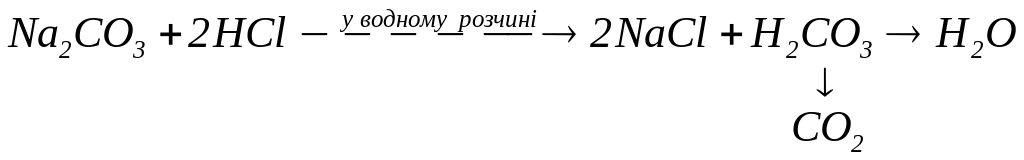
 .
.
Розклад солей, утворених кисневмісними кислотами. В результаті розкладу утворюються оксид металу (основний чи амфотерний) та кислотний оксид:
![]()
(![]() -
основний оксид,
-
основний оксид,
![]() -
кислотний оксид);
-
кислотний оксид);
![]()
(![]() -
амфотерний оксид,
-
амфотерний оксид,
![]() -
кислотний оксид).
-
кислотний оксид).
Взаємодія складних речовин з киснем (горіння):
![]()
![]()
![]()
Взаємодія кислот – сильних окисників (сульфатної концентрованої, нітратної розведеної та концентрованої) з деякими металами:
![]()
![]()
![]()
![]()
Кислоти
Кислотами називаються сполуки, які мають у своєму складі атоми гідрогену, які здатні заміщуватись на атоми металу, та кислотний залишок.
Кількість
атомів гідрогену, здатних заміщуватись
на метал з утворенням солей, визначає
основність кислоти. Розрізняють кислоти
одноосновні (![]() ),
двохосновні (
),
двохосновні (![]() ),
трьохосновні (
),
трьохосновні (![]() ),
чотирьохосновні (
),
чотирьохосновні (![]() ).
В деяких кислотах не всі атоми гідрогену
здатні заміщуватись металами. Наприклад,
молекула ацетатної (оцтової) кислоти
).
В деяких кислотах не всі атоми гідрогену
здатні заміщуватись металами. Наприклад,
молекула ацетатної (оцтової) кислоти
![]() має чотири атоми гідрогену, але
заміщуватись на метал здатен лише атом
гідрогену карбоксильної групи
має чотири атоми гідрогену, але
заміщуватись на метал здатен лише атом
гідрогену карбоксильної групи
![]() ,
тому ацетатна кислота є одноосновною.
,
тому ацетатна кислота є одноосновною.
За
хімічним складом розрізняють кислоти
безоксигенові та оксигеновмісні.
Прикладами безоксигенових кислот є
фторидна (плавикова)
![]() ,
хлоридна (соляна)
,
хлоридна (соляна)
![]() ,
бромідна
,
бромідна
![]() ,
йодидна
,
йодидна
![]() ,
сульфідна
,
сульфідна
![]() ,
ціанідна
,
ціанідна
![]() та інші кислоти. Прикладами оксигеновмісних
кислот є нітратна (азотна)
та інші кислоти. Прикладами оксигеновмісних
кислот є нітратна (азотна)
![]() ,
нітритна (азотиста)
,
нітритна (азотиста)
![]() ,
сульфатна (сірчана)
,
сульфатна (сірчана)
![]() ,
сульфітна (сірчиста)
,
сульфітна (сірчиста)
![]() та інші. Оксигеновмісні кислоти є
гідратами кислотних оксидів. Більшість
кислотних оксидів утворюють оксигеновмісні
кислоти шляхом безпосереднього приєднання
води. Молекули деяких кислотних оксидів
за різних умов можуть приєднувати різні
кількості молекул води. Тоді сполуку з
меншим вмістом води позначають префіксом
мета-,
а сполуку з більшим вмістом води –
префіксом орто-.
Наприклад:
та інші. Оксигеновмісні кислоти є
гідратами кислотних оксидів. Більшість
кислотних оксидів утворюють оксигеновмісні
кислоти шляхом безпосереднього приєднання
води. Молекули деяких кислотних оксидів
за різних умов можуть приєднувати різні
кількості молекул води. Тоді сполуку з
меншим вмістом води позначають префіксом
мета-,
а сполуку з більшим вмістом води –
префіксом орто-.
Наприклад:
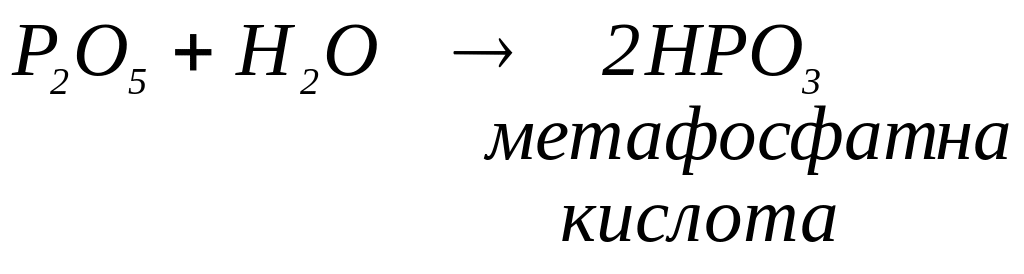
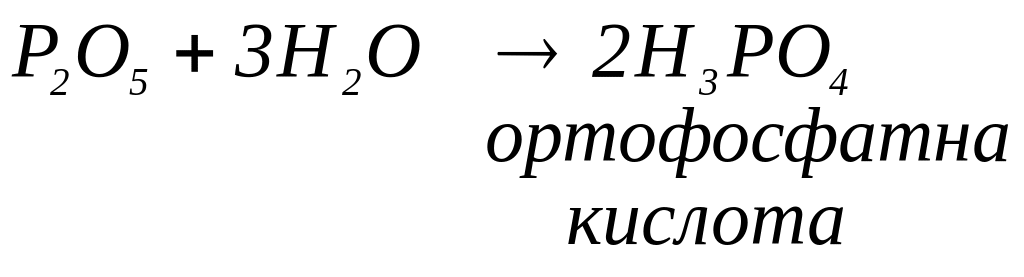
Назви деяких безоксигенових кислот наведені в табл.1.
Табл.1
Формула кислоти |
Назви кислоти |
Формули відповідних солей |
Назви відповідних солей |
|
Фтороводнева Фторидна Плавикова |
|
Фториди |
|
Хлоридна Хлороводнева Соляна |
|
Хлориди |
|
Бромідна Бромоводнева |
|
Броміди |
|
Йодидна Йодоводнева |
|
Йодиди |
|
Сульфідна Сірководнева |
|
Сульфіди Гідросульфіди |
|
Селенідна Селеноводнева |
|
Селеніди Гідроселеніди |
|
Телуридна Телуроводнева |
|
Телуриди Гідротелуриди |
|
Ціанідна Ціановоднева |
|
Ціаніди |
|
Тіоціанатна Тіоціановоднева |
|
Тіоціанати |
Назви деяких оксигеновмісних кислот наведені в табл.2.
Табл.2
Елемент |
Кислотний оксид |
Формула кислоти, що відповідає оксиду |
Назви кислот |
Формули відповідних солей |
Назви відповідних солей |
|
|
|
Гіпохлоритна Хлорнуватиста |
|
Гіпохлорити
|
|
|
Перхлоратна Хлорна |
|
Перхлорати
|
|
|
|
|
Сульфітна Сірчиста |
|
Сульфіти Гідросульфіти |
|
|
Сульфатна Сірчана |
|
Сульфати Гідросульфати |
|
|
|
|
Нітритна Азотиста |
|
Нітрити |
|
|
Нітратна Азотна |
|
Нітрати |
|
|
|
|
Силікатна Кремнієва |
|
Силікати |
|
|
|
Карбонатна Вугільна |
|
Карбонати Гідрокарбонати |
- |
|
Ацетатна Оцтова |
|
Ацетати |
Продовження табл.2.
|
|
|
Метафосфатна Метафосфорна Ортофосфатна Ортофосфорна
|
|
Метафосфати
Ортофосфати (фосфати) Гідроорто-фосфати (гідрофосфати) Дигідроорто-фосфати (дигідро-фосфати) |
|
|
|
Перманганатна Манганова |
|
Перманганати |
|
|
|
Хроматна Хромова Дихроматна Дихромова |
|
Хромати
Дихромати |
Кислоти
також можна розділити за їхньою здатністю
до дисоціації у водних розчинах на
слабкі (наприклад
,
![]() ,
,
![]() ,
які дисоціюють частково та оборотньо)
та сильні (
,
,
,
,
які дисоціюють частково та оборотньо)
та сильні (
,
,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() тощо), які дисоціюють практично повністю
та необоротньо. Це необхідно враховувати
під час визначення можливості здійснення
реакції між кислотами та солями. Такі
реакції на практиці можна здійснити,
якщо дією сильної кислоти на сіль може
утворитися слабка (або нестійка) кислота.
тощо), які дисоціюють практично повністю
та необоротньо. Це необхідно враховувати
під час визначення можливості здійснення
реакції між кислотами та солями. Такі
реакції на практиці можна здійснити,
якщо дією сильної кислоти на сіль може
утворитися слабка (або нестійка) кислота.
Кислоти реагують:
з основами з утворенням солей:
![]()
Якщо кислота багатоосновна, в реакціях з основами можуть утворюватись декілька солей в залежності від молярних співвідношень кислоти та основи. Наприклад, в реакції між сульфатною кислотою та гідроксидом натрію з молярним співвідношенням 1:1 утворюється кисла сіль (продукт неповного заміщення гідрогену кислоти на катіони металу):
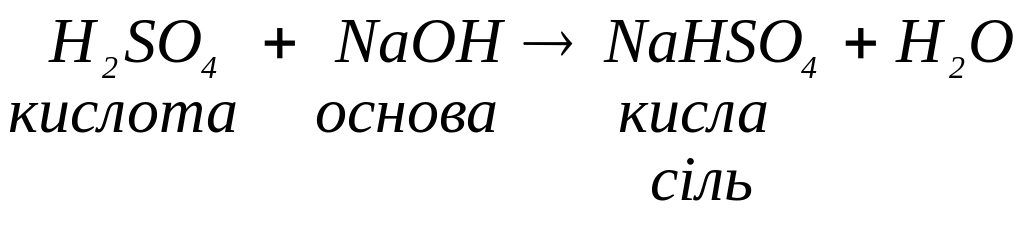
Якщо це співвіднонення становитиме 1:2 (надлишок основи) утворюється середня сіль як продукт повного заміщення гідрогену кислоти катіонами металу:
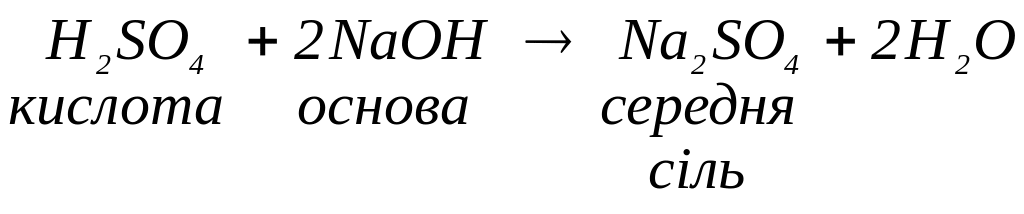
з основними оксидами з утворенням солей:
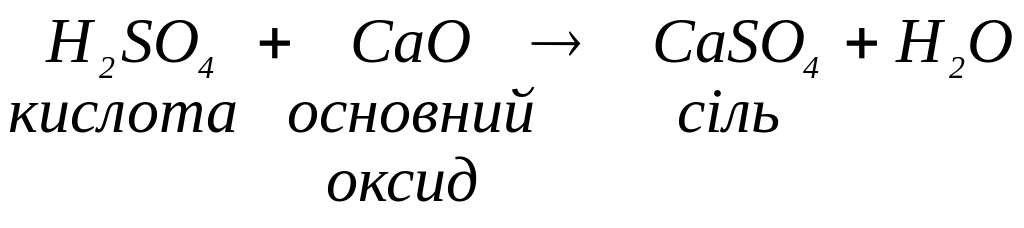
з амфотерними гідроксидами з утворенням солей:
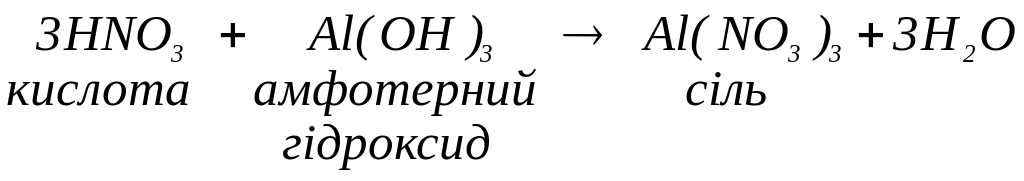
з амфотерними оксидами з утворенням солей (іноді за нагрівання):
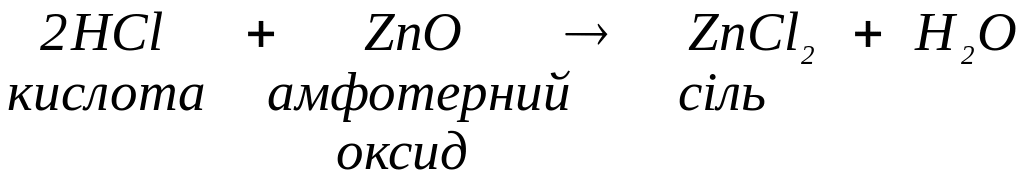
з солями, якщо в результаті реакції обміну утворюються малорозчинна сіль:
![]()
малорозчинна кислота:
![]()
нестійка кислота:
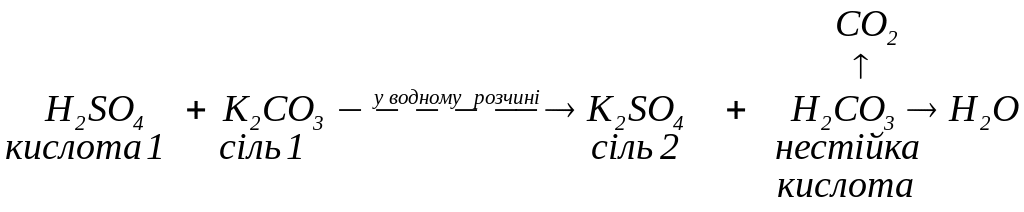
слабка кислота: