
- •Н. М. Кузьменок Азотсодержащие производные углеводородов
- •Азотсодержащие производные углеводородов. Нитросоединения лекции 1,2
- •1. Классификация азотсодержащих производных углеводородов.
- •Классы азотсодержащих производных углеводородов
- •2. Нитросоединения. Классификация и номенклатура нитросоединений.
- •3. Способы получения.
- •4. Физические свойства.
- •5. Строение нитрогруппы, параметры связей, электронные смещения нитрогруппы как заместителя (I-, m-эффекты).
- •6. Химические свойства нитросоединений.
- •7. Применение, важнейшие представители.
- •Амины лекции 3,4
- •1. Классификация и номенклатура аминов.
- •2. Способы получения аминов.
- •3. Физические свойства и строение алкиламинов
- •4. Химические свойства алкиламинов
- •В неводных растворах или газовой фазе
- •5. Химические свойства ариламинов
- •Диазо- и азосоединения лекции 5,6
- •1. Классификация азо- и диазосоединений.
- •2. Ароматические соли диазония: строение, номенклатура.
- •2.1. Строение ароматических солей диазония
- •2.2. Номенклатура диазосоединений
- •3. Синтез солей арилдиазония.
- •4. Кислотно-основные равновесия в растворах диазосоединений.
- •5. Химические свойства солей арилдиазония.
- •6. Ароматические азосоединения.
- •7. Элементы теории цветности.
- •8. Общие представления об алифатических диазосоединениях.
- •Учебное издание
- •Азотсодержащие производные углеводородов Курс лекций
8. Общие представления об алифатических диазосоединениях.
8.1. Строение диазоалканов. Ранее мы отмечали неустойчивость алкандиазониевых ионов и их малую ценность для препаративного синтеза. Но при наличии протона у углеродного атома, связаного с диазоогруппой, алкандиазониевый ион может превращаться в другое соединение – диазоалкан:
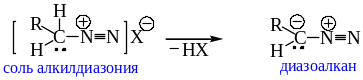
Электронное строение диазометана представляют в виде набора резонансных структур:

Отрицательный заряд вследствие мезомерного эффекта распределен между концевыми атомоми азота и углерода, т.е. диазоалканы являются 1,3-диполями.
Названия алифатических диазосоединений, содержащих нейтральную N2-группу (формально цвиттер-ион), связанную с атомом углерода, называют, добавляя приставку «диазо-» к родоначальной структуре:
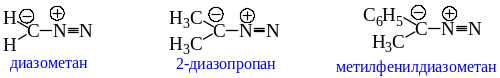
Диазоалканы относятся к числу нестабильных соединений. Неустойчивость диазоалканов связана с легкостью протекания реакций нуклеофильного замещения в ряду алифатических производных; а выигрыш в энергии за счет образования устойчивой молекулы азота вполне достаточен для образования карбокатиона. В ряду первичных диазоалканов тенденция к разложению снижается в ряду:
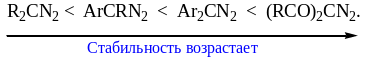
8.2. Получение диазоалканов
8.2.1. Разложением N-нитрозоамидов карбоновых кислот.
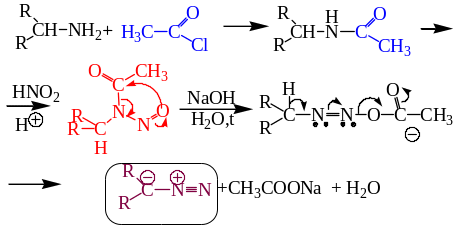
8.2.2. Действием щелочей на N-метил-N-нитрозокарбомат (N-метил-N-нитрозоуретан).
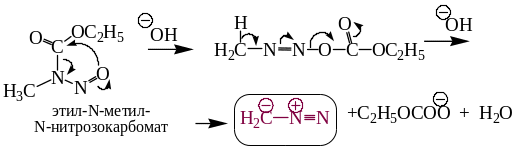
8.2.3.Получение диазометана разложением N-нитрозометилмочевины.
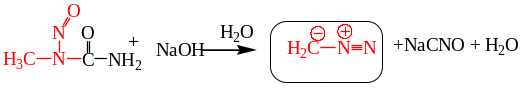
8.3. Химические свойства алифатических диазосоединений.
В молекулах алифатических диазосоединений атом углерода представляет собой нуклеофильный центр, который подвергается атаке электрофильными реагентами. Протонирование нуклеофильного атома углерода алифатических диазосоединений приводит к потере возможности сопряжения диазогруппы с остальной частью молекулы, что вызывает выделение азота. Образующийся карбокатион стабилизируется присоединением нуклеофила; в случае гомологов диазометана возможно также и образование алкенов.
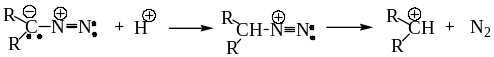
8.3.1. Алкилирование. Диазометан – мягкий алкилирующий агент. Его используют для метилирования карбоновых кислот и фенолов. Получение метиловых эфиров карбоновых кислот и метилфениловых эфиров по этой реакции имеет препаративное и аналитическое значение. Реакция метилирования протекает количественно и в очень мягких условиях. На первой стадии происходит перенос протона к диазометану с образованием нестабильного катиона метилдиазония CH3N2+, который, элиминируя азот, взаимодействует с карбоновой кислотой или другим нуклеофильным агентом с образованием конечного продукта метилирования.
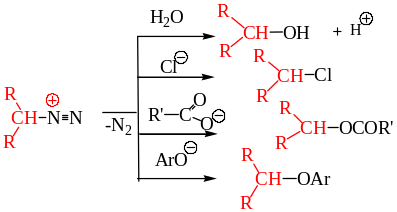
Кислотность спиртов недостаточна, чтобы под действием диазометана превратить их в метиловые эфиры, но при добавлении каталитических количеств эфирата трифторида бора (BF3 ∙(С2Н5)2О) можно осуществлять и это превращение:
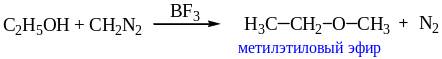 .
.
8.3.2. Реакция с альдегидами и кетонами для получения их высших гомологов. Диазометан может использоваться для получения гомологов альдегидов и кетонов. В качестве побочных продуктов образуются оксираны. Вначале реакции диазометан присоединяется по карбонильной группе, после чего следует элиминирование азота с образованием бетаина, дальнейшие трансформации которого определяют состав продуктов реакции:
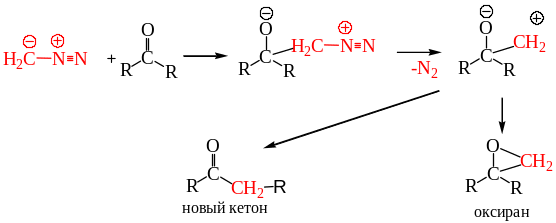
8.3.3. Реакция Арндта-Эйстерта. Превращение карбоновой кислоты в её ближайший гомолог взаимодействием хлорангидрида с диазометаном, перегруппировка образовавшегося диазокетона в кетен и превращение его в кислоту получило название реакции Арндта-Эйстерта:
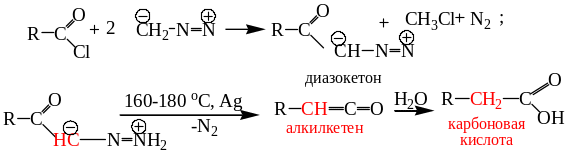
8.3.4. Генерирование карбенов Простейшие алифатические диазосоединения могут быть использованы для генерирования карбенов. Карбены – это соединения двухвалентного углерода с шестью валентными электронами общей формулы R1R²C. Существует два состояния карбенов: синглетное и триплетное. В синглетном состоянии у карбена два несвязывающих электрона со спаренными спинами находятся на одной орбитали, а в триплетном – два неспаренных электрона с параллельными спинами находятся на двух орбиталях одинаковой энергии. Синглетная форма диазометана менее устойчива по сравнению с триплетной.
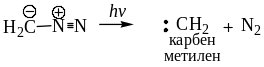
Карбены – высоко реакционноспособные соединения, которые вступают в следующие реакции:
– внедрение по σ-связям;
– присоединение по кратным связям;
– внутри- и межмолекулярное отщепление атома водорода с последующими превращениями радикалов.
При фотолизе диазометана в смеси с алкеном образующийся метилен синхронно стереоспецифично присоединяется по кратной связи с образованием производных циклопропана:
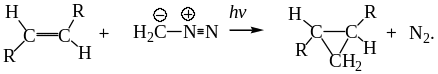 .
.
Частица карбена может внедряться в С-С связи, а также присоединяться по кратным связям:
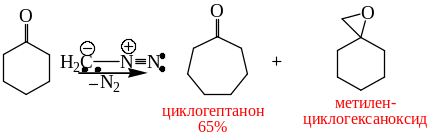 .
.
8.3.5. Реакции циклоприсоединения. Особую группу реакций диазоалканов составляют реакции 1,3-диполярного циклоприсоединения к активированным алкенам и алкинам с образованием пятичленных гетероциклических соединений. Примерами этих реакций является 1,3-диполярное циклоприсоединение диазометана к диметил-2,3-диметилмалеату и диметил-2,3-диметилфумарату:
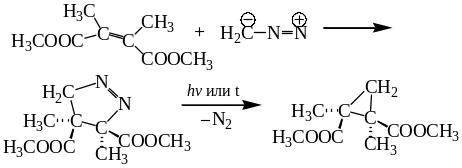
Реакция протекает стереоспецифично как син-присоединение.
Кроме диазосоединений в реакции 1,3-диполярного присоединения могут вступать и другие азотсодержащие 1,3-диполи. Более подробно эти реакции будут рассмотрены позже при изучении способов синтеза гетероциклических соединений.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1 Травень, В. Ф. Органическая химия: в 2 т. – М.: ИКЦ «Академкнига», 2004. – 2006. –. 2. т.
2 Органическая химия: учеб. для вузов: в 2 кн./ под ред. Н. А. Тюкавкиной. – М.: Дрофа, 2002. – Кн. 1: Основной курс. – 640 с.
3 Органическая химия. Реакционная способность основных классов органических соединений / А. Э. Щербина [и др.]. – Минск: БГТУ, 2000. – 612 с.
4 Кузьменок, Н. М. Органическая химия. Тесты, задачи, упражнения: учеб. пособие для студентов химико-технологических специальностей / Н. М. Кузьменок, Т. С. Селиверстова. – Минск: БГТУ, 2007. –225 с.
содержание
ЛЕКЦИИ 1,2. АЗОТСОДЕРЖФЩИЕ ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ. НИТРОСОЕДИНЕНИЯ 1. Классификация азотсодержащих производных углеводородов. 2. Нитросоединения. Классификация и номенклатура нитросоединений. 3.Способы получения. 4. Физические свойства. 5. Строение нитрогруппы, параметры связей, электронные смещения нитрогруппы как заместителя (I-, M-эффекты). 6. Химические свойства нитросоединений. 7. Применение, важнейшие представители.
|
3
|
ЛЕКЦИИ 3,4. АМИНЫ 1. Классификация и номенклатура аминов. 2. Способы получения аминов. 3. Физические свойства и строение алкиламинов. 4. Химические свойства алкиламинов. 5. Химические свойства ариламинов. 6. Некоторые практически важные амины.
|
30
|
ЛЕКЦИ 5,6. ДИАЗО- И АЗОСОЕДИНЕНИЯ 1. Классификация азо- и диазосоединений. 2. Ароматические соли диазония: строение, номенклатура. 3. Синтез солей арилдиазония. 4. Кислотно-основные равновесия в растворах диазосоединений. 5. Химические свойства солей арилдиазония. 6. Ароматические азосоединения. 7. Элементы теории цветности. 8. Общие представления об алифатических диазосоединениях.
|
64 |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
|
96 |
