
- •Введение
- •1. Основные понятия
- •2. Подготовка к работе с программой
- •3. Работа с приложением «практикум по фх»
- •4. Построение градуировочного графика
- •5. Расчеты при экспериментальном определении электропроводности растворов электролитов
- •Лабораторные работы, в которых используется графическая обработка результатов экспериментального определения электропроводности растворов электролитов
- •6. Оценка погрешности градуировочного графика
- •7. Построение кривых титрования
- •Лабораторные работы, в которых осуществляется построение кривых титрования
- •8. Отсеивание грубых промахов с помощью q-теста
- •Лабораторные работы, в которых может использоваться q-тест
- •9. Статистическая обработка результатов измерений
- •10. Термохимия
- •11. Кинетика
- •Лабораторные работы, в которых осуществляется определение константы скорости реакции колориметрическим методом
- •12. Оценка неопределенности измерений
- •13. Построение графиков
- •14. Построение выходной кривой
- •15. Построение градуировочной кривой при наличии области нелинейности
- •Приложения Приложение 1. Справочные величины
- •Значения коэффициента Стьюдента для расчета доверительных границ
- •Приложение 2. Пример выполнения индивидуального задания по разделу «Химическая кинетика» с использованием электронных таблиц
- •Приложение 3. Основные статистические функции электронных таблиц Microsoft Excel
- •Приложение 4. Задания по компьютерной обработке
- •Задания по компьютерной обработке результатов лабораторных работ (лр)
- •Список использованной литературы
- •Содержание
- •Использование электронных таблиц для обработки экспериментальных данных в курсе физической химии
Приложения Приложение 1. Справочные величины
Таблица П1
Значения Q-критерия
Доверительная вероятность, Р, % |
Число измерений, n |
|||||||
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
90 |
0,94 |
0,76 |
0,64 |
0,56 |
0,51 |
0,47 |
0,44 |
0,41 |
95 |
0,98 |
0,85 |
0,73 |
0,64 |
0,59 |
0,54 |
0,51 |
0,48 |
99 |
0,99 |
0,93 |
0,82 |
0,74 |
0,68 |
0,63 |
0,60 |
0,57 |
Таблица П2
Значения коэффициента Стьюдента для расчета доверительных границ
Число измерений, n |
Число степеней свободы, k = n – 1 |
Коэффициенты Стьюдента при значениях доверительной вероятности, Р, % |
||||
80 |
90 |
95 |
99 |
99,9 |
||
2 |
1 |
3,08 |
6,31 |
12,70 |
63,70 |
637,00 |
3 |
2 |
1,89 |
2,92 |
4,30 |
9,92 |
31,60 |
4 |
3 |
1,64 |
2,35 |
3,18 |
5,84 |
12,90 |
5 |
4 |
1,53 |
2,13 |
2,78 |
4,60 |
8,60 |
6 |
5 |
1,48 |
2,02 |
2,57 |
4,03 |
6,86 |
7 |
6 |
1,44 |
1,94 |
2,45 |
3,71 |
5,96 |
8 |
7 |
1,42 |
1,90 |
2,36 |
3,50 |
5,40 |
9 |
8 |
1,40 |
1,86 |
2,31 |
3,36 |
5,04 |
10 |
9 |
1,38 |
1,83 |
2,26 |
3,25 |
4,78 |
11 |
10 |
1,37 |
1,81 |
2,23 |
3,17 |
4,59 |
12 |
11 |
1,36 |
1,80 |
2,20 |
3,11 |
4,44 |
13 |
12 |
1,36 |
1,78 |
2,18 |
3,06 |
4,32 |
14 |
13 |
1,35 |
1,77 |
2,16 |
3,01 |
4,22 |
15 |
14 |
1,34 |
1,76 |
2,14 |
2,98 |
4,14 |
Приложение 2. Пример выполнения индивидуального задания по разделу «Химическая кинетика» с использованием электронных таблиц
Воспользуемся исходными данными примера 4.1.1 из учебно-методического пособия [3, С. 38].
При изучении кинетики реакции A + B → D + E были получены следующие экспериментальные результаты
t, мин |
0 |
10 |
20 |
30 |
40 |
60 |
90 |
я |
0,250 |
0,196 |
0,154 |
0,121 |
0,0951 |
0,0585 |
0,0283 |
Начальные концентрации веществ A и B одинаковы и составляют 0,250 моль·л–1. Определить порядок реакции, константу скорости и период полупревращения.
Решение.
1. Метод подбора (подстановки). Введем исходные данные в книгу Microsoft Excel, например, в ячейки В4:С10, и подготовим шапку таблицы для расчета констант скорости (рис. П2.1)

Рис. П2.1. Ввод данных для расчета
Константа скорости реакции нулевого порядка может быть найдена из соотношения
![]() .
.
Введем в ячейку D5 формулу для расчета k0
D5→ |
=1/B5*($C$4-C5) |
При t = 0 расчет не имеет смысла, поэтому в ячейке D4 поставим прочерк.
Электронные таблицы устроены таким образом, что, если скопировать любым способом ячейку D5 и вставить результат копирования в соседнюю в столбце ячейку (D6), то адреса ячеек в формуле изменятся на величину смещения, кроме тех символов, перед которыми стоит знак $, запрещающий их изменение при копировании. В нашем случае текущая концентрация С0, А должна изменяться, а начальная концентрация С0 должна оставаться постоянной, поэтому ссылка на ячейку С4 должна быть защищена от изменений при копировании.
Для создания «жестких ссылок» (знак $) следует использовать клавишу F4. Нажимая ее несколько раз, можно получить требуемую комбинацию знака $, буквы обозначения столбца и номера строки.
После ввода формулы в ячейку D5 необходимо скопировать ее в ячейки D6:D10, либо растянуть на этот диапазон мышкой за правый нижний угол, когда курсор пример форму крестика (рис. П2.2).
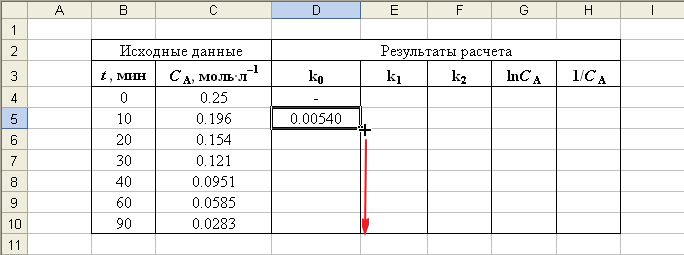
Рис. П2.2. Заполнение ячеек
В результате получим значения констант скорости реакции для всех концентраций (рис. П2.3).
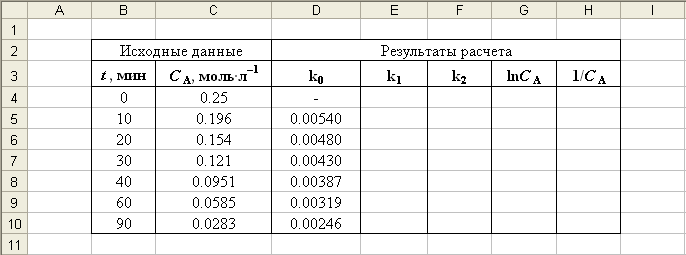
Рис. П2.3. Результат расчета констант скорости реакции для нулевого порядка
Как следует из рис. П2.3, рассчитанные значения константы скорости варьируются в значительных пределах, следовательно, порядок реакции не нулевой.
Вычислим значения константы скорости, исходя из предположения, что порядок реакций первый. На основании кинетического уравнения реакции первого порядка можно записать
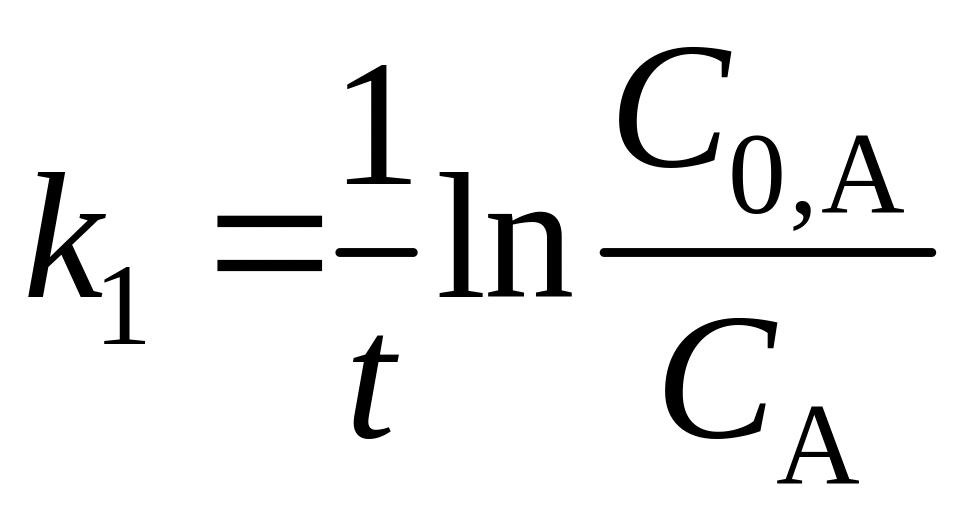 .
.
Тогда формула в ячейке Е5 запишется следующим образом
E5→ |
=1/B5*LN($C$4/C5) |
Здесь LN() – встроенная функция для вычисления натурального логарифма. Аналогичным образом заполняется диапазон Е5:Е10.
Для расчета константы скорости реакции второго порядка воспользуемся соответствующим кинетическим уравнением

Тогда формула в ячейке F5 примет вид
F5 → |
=1/B5*(1/C5-1/$C$4) |
Результат расчета представлен на рис. П2.4. Проанализируем полученные результаты.
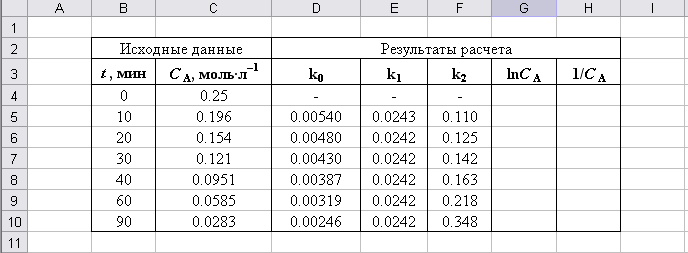
Рис. П2.4. Результаты расчета константы скорости для 0-го, 1-го и 2-го порядков
Как следует из рис. П2.4, значения, полученные для второго порядка, имеют значительный разброс, в то время как результаты расчета для первого порядка близки. Кроме этого, порядок реакции действительно 1-й, т.к. при уменьшении CA константы k0 и k2 изменяются в различных направлениях: k0 уменьшается, а k2 возрастает.
Рассчитаем среднее значение константы скорости в ячейке Е11 с помощью встроенной функции СРЗНАЧ():
Е11→ |
=СРЗНАЧ(E5:E10) |
Вычислим в ячейке Е12 величину периода полупревращения по формуле
 .
.
Используем в
качестве k1
рассчитанное среднее значение из ячейки
Е11, тогда формула для расчета
![]() будет иметь вид
будет иметь вид
Е12→ |
=LN(2)/E11 |
Окончательно лист с расчетами по методу подбора кинетического уравнения примет вид, представленный на рис. П2.5. Формулы, использованные для вычислений, приведены на рис. П2.6.
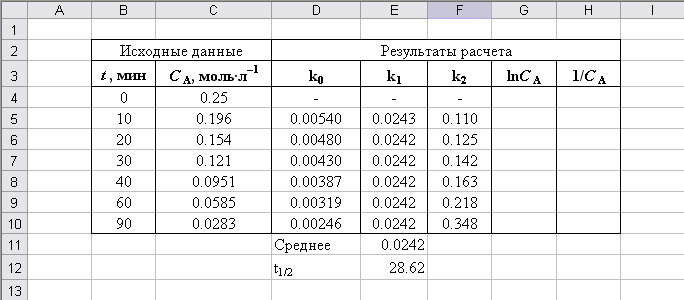
Рис. П2.5. Результаты определения порядка реакции методом подбора кинетического уравнения
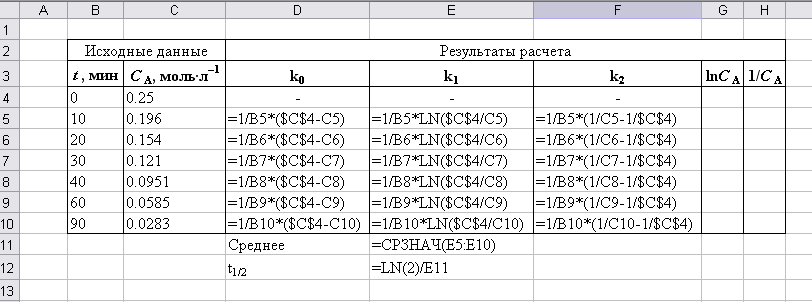
Рис. П2.6. Расчетные формулы
2. Графический метод. Для определения порядка реакции этим методом следует построить зависимости различных функций концентрации от времени: С = f(t) – для 0-го, ln С = f(t) – для первого и 1/С = f(t) – для 2-го порядка соответственно.
Рассчитаем величины ln CA и 1/CA и сведем их в таблицу (рис. П2.7).

Рис. П2.7. Расчеты для графического метода определения порядка реакции
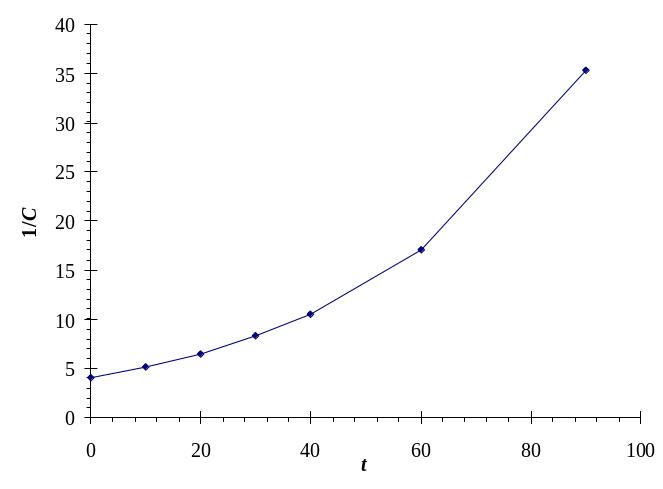
Построим графики С = f(t), ln С = f(t) и 1/С = f(t), результат показан на рис. П2.8.
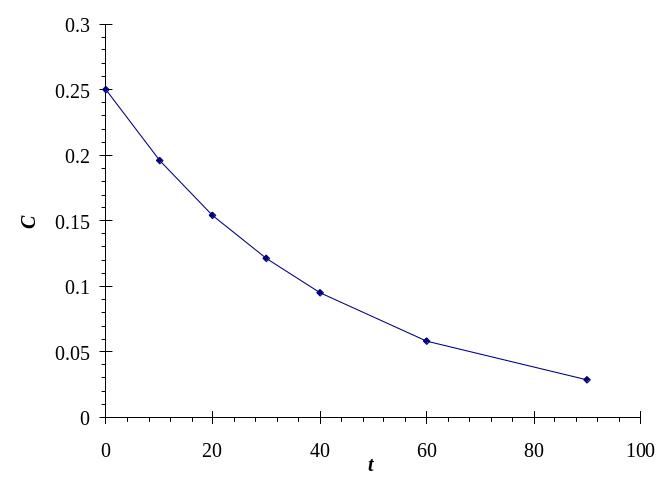
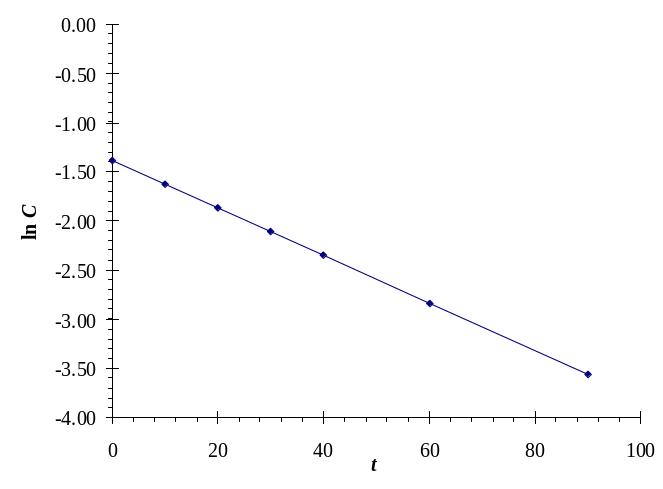
а б в
Рис. П2.8. Проверка линейности зависимостей для 0-го (а), 1-го (б) и 2-го (в) порядков
Как следует из рис. П2.8, график линеаризуется в системе координат ln С = f(t), что свидетельствует о 1-м порядке рассматриваемой реакции.
Для определения порядка реакции этим методом можно построить линию тренда для зависимости ln С = f(t) и отобразить на графике уравнение прямой линии (см. раздел 1). Пример графика с уравнением, полученным методом наименьших квадратов, приведен на рис. П2.9.
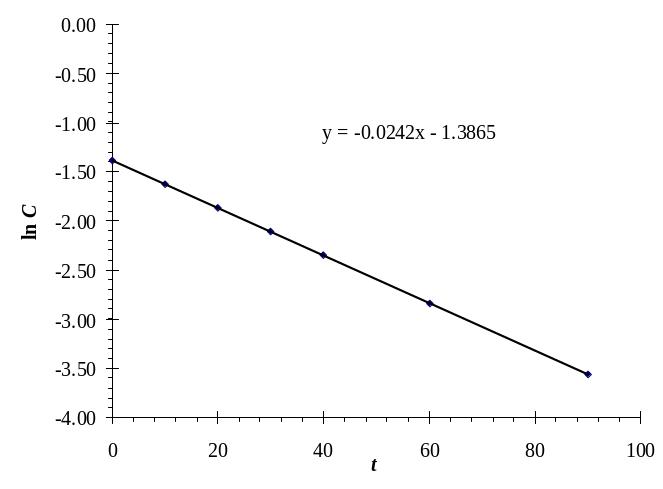
Рис. П2.9. График ln С = f(t) с нанесенной линией тренда
Другим способом расчета углового коэффициента линии является использование функции НАКЛОН(). Поместим в ячейку Е13 следующую формулу
Е13→ |
=НАКЛОН(G4:G10;B4:B10) |
В результате расчета получим значение k1 = –0.0242 – такое же, как и на графике. Для вычислений можно пользоваться любым из приведенных способов.
Окончательный вид листа с вычислениями приведен на рис. П2.10, а использованные для расчетов формулы – на рис. П2.11.
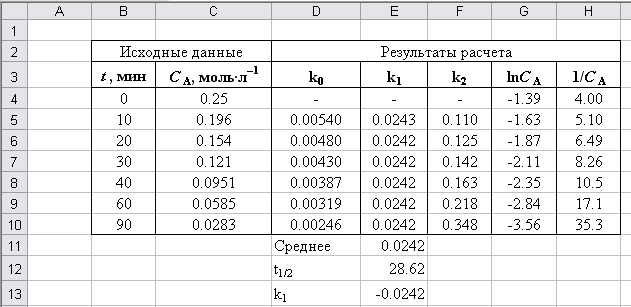
Рис. П2.10. Результаты расчетов

Рис. П2.11. Формулы для вычислений
Размерности констант скорости: моль/(л · мин) – для 0-го порядка, мин–1 – для 1-го и л/(моль · мин) – для 2-го. Размерность – мин.
Определение порядка реакции другими методами может быть выполнено аналогичным образом.
