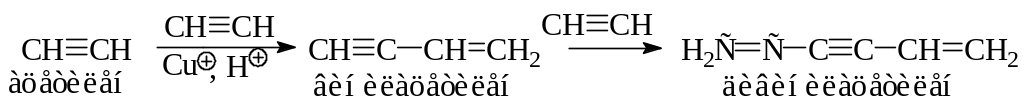- •А.Д. Алексеев органическая химия
- •Предисловие
- •Лекция 1 введение
- •1. Предмет органической химии
- •2. Структурная теория строения органических веществ
- •3. Сырьевые источники органических соединений
- •4. Классификация органических соединений
- •5. Номенклатура органических соединений
- •Названия некоторых алкильных групп
- •Основы рациональных названий и окончаний по систематической номенклатуре основных классов органических соединений
- •Лекция 2 химическая связь
- •Природа и типы химической связи. Способы образования и разрыва ковалентной связи
- •Параметры ковалентной связи. Водородные связи
- •Делокализованные связи
- •Лекция 3 химическая реакция
- •Основные понятия, классификация реагентов
- •Типы органических реакций и их механизмы
- •3. Кислоты и основания. Общие положения протолитической теории кислот и оснований Бренстеда-Лоури и теории Льюиса
- •Значения рKвн
- •Лекция 4 алканы
- •1.1. Физические свойства насыщеных углеводородов
- •1.2. Химические свойства насыщенных углеводородов.
- •Детонационные свойства углеводородов
- •Природные источники насыщенных углеводородов
- •Лекция 5 непредельные углеводороды
- •Алкены (олефины)
- •1.3.4. Отдельные представители этиленовых углеводородов.
- •2. Алкадиены
- •Присоединение же молекулярного водорода в присутствии катализатора идет в оба положения, что дает смесь бут-1-ена и бут-2-ена.
- •3.Ненасыщенные углеводороды ряда ацетилена (алкины)
- •Пропин 2-хлорпропен 2,2-дихлорпропан
- •Пропин 2-хлорпропен 2,2-дихлорпропан
- •Пропин 2-хлорпропен 2,2-дихлорпропан
- •Продукт димеризации (винилацетилен) используют для получения хлоропренового каучука:
- •1. Общая характеристика углеводородов ряда бензола
- •2.3. Правила замещения в бензольном кольце
- •Промышленные методы получения ароматических углеводородов Методы синтеза аренов см. В [1], стр. 351-354.
- •Лекция 7 гидроксилпроизводные углеводородов
- •Одноатомные спирты.
- •Многоатомные спирты.
- •1. Одноатомные спирты
- •Многоатомные спирты
- •3. Простые эфиры
- •Лекция 8 оксосоединения (альдегиды и кетоны)
- •Способы получения альдегидов и кетонов см. [1], с. 570-576.
- •Отдельные представители альдегидов и кетонов
- •Лекция 9 карбоновые кислоы и их производные
- •Насыщенные одноосновные кислоты
- •Эти реакции, называемые реакциями ацилирования (введение в молекулу ацильного остатка «r–co–»), протекают в две стадии по механизму нуклеофильного присоединения – отщепления (sn):
- •2. Отдельные представители предельных одноосновных кислот
- •Тексты лекций
Пропин 2-хлорпропен 2,2-дихлорпропан
СH3—CCH + HCl CH3—CCl=CH2 + HCl CH3—CCl2—CH3.
Пропин 2-хлорпропен 2,2-дихлорпропан
СH3—CCH + HCl CH3—CCl=CH2 + HCl CH3—CCl2—CH3.
Пропин 2-хлорпропен 2,2-дихлорпропан
Присоединение воды (реакция гидратации, 1881г., М. Кучеров) происходит в присутствии солей окисной ртути в сернокислом растворе. Образующийся виниловый спирт неустойчив и перегруппировывается по правилу Эльтекова: водород гидроксильной группы перемещается к соседнему С-атому, π-С–С связь которого разрывается и возникает новая двойная связь между углеродом и кислородом. Таким образом, в результате реакции образуется соединение с карбонильной группой (>С=О). Из ацетилена при гидратации получается уксусный альдегид, а взаимодействие с водой его гомологов – всегда приводит к кетонам:
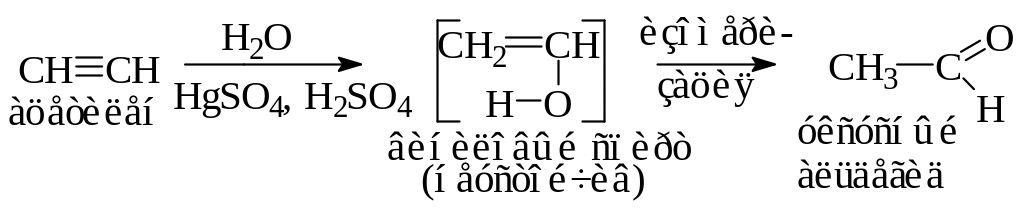

Присоединение монооксида углерода (реакция В. Реппе) идет в присутствии кобальтовых катализаторов и дает производные этилена, применяющиеся как мономеры:

3.3.2. Реакции окисления. Ацетиленовые углеводороды окисляются еще легче, чем этиленовые, обычно с распадом молекулы по месту тройной связи и образованием карбоновых кислот. Фиолетовая окраска содового раствора KMnO4 при действии его на алкины быстро исчезает, что служит качественной реакцией на эти непредельные соединения; в кислой среде KMnO4 окисляет алкины до карбоновых кислот:
 .
.
3.3.3.Реакции алкинов по терминальной С–Н связи. Реакции присоединения и окисленияч алкинов аналогичны реакциям углеводородов ряда этилена. Отличительной особенностью алкинов является подвижность атомов водорода, связанных с С-атомами при тройной связи. Вследствие повышенной электроотрицательности sp-гибридного С-атома, концевая ≡Сδ––Нδ+ связь обладает заметной полярностью. Поэтому в присутствии сильных оснований возможен разрыв С–Н связи с образованием ацетиленид-иона и передачей протона основанию:
 .
.
Кислотность алкинов невысока и проявляется только при взаимодействии с очень сильными основаниями, такими как амид натрия NaNH2, металлоорганические соединения, сухие порошкообразные щелочи. При этом водород замещается на металл и образуются ацетилениды:

При пропускании струи ацетилена в бесцветный прозрачный раствор оксида серебра в аммиачной воде – Ag(NH3)2OH –образуется белый осадок ацетиленида серебра:
HCCH + 2Ag(NH3)2OH AgCCAg + 2H2O + 4NH3.
Аналогично, при взаимодействии ацетилена и терминальных алкинов с аммиачным раствором соли закиси меди – [Сu(NH3)2Сl образуется красно-бурый осадок ацетиленида меди состава CuCCCu или R–CCCu. Таким образом, реакции с аммиачными растворами AgNO3 или CuCl являются качественными на алкины с концевой тройной связью. Ацетилениды серебра и меди в сухом виде сильно взрываются от удара или при нагревании. Под действием соляной кислоты ацетилениды разлагаются с выделением исходного ацетиленового углеводорода.
3.3.4.Полимеризация ацетилена. При пропускании ацетилена над нагретым активированным углем (400оС) происходит его тримеризация с образованием циклического углеводорода бензола (метод Н.Д. Зелинского и Б.А. Казанского). Превращение ацетилена в бензол происходит и при простом нагревании его в стеклянных трубках, но при 500оС (1860, М. Бертло).
В присутствии солей меди (I) и кислоты ацетилен легко димеризуется и далее тримеризуется: