
- •Элементы кристаллографии.
- •Кристаллические системы элементов
- •Дефекты кристаллов.
- •Механическая смесь
- •Твердый раствор
- •Химическое соединение.
- •Правило отрезков
- •Диаграммы плавкости
- •Диаграмма равновесия жидкость-пар
- •Тройные системы.
- •Влияние легирующих элементов
- •Классификация сталей
- •Маркировка сталей.
- •Углеродистые стали обыкновенного качества (гост 380).
- •Качественные углеродистые стали.
- •Качественные и высококачественные легированные стали.
- •Легированные конструкционные стали.
- •Основные превращения в сталях при термообработке
- •Влияние легирующих элементов на превращения в стали
- •Основные виды термической обработки стали.
- •Сплавы на медной основе - бронзы, латуни.
- •Алюминий и сплавы на его основе: дуралюмин, силумин
- •Белый чугун
- •Серый чугун
- •Ковкий чугун
- •Высокопрочный чугун
- •Цементуемые и улучшаемые стали Цементуемые стали.
- •Стали строительные.
- •Углеродистые стали.
- •Пружинные стали.
- •Инструментальные стали пониженной прокаливаемости
- •Инструментальные стали пониженной прокаливаемости
- •Классификация электротехнических материалов Для чего необходимо знать свойства различных электротехнических материалов
- •По каким основным признакам классифицируют электротехнические материалы
- •29.Виды химической связи
- •Неэргетическая зона
- •§ 240.Понятие о зонной теории твердых тел
- •Зависимость сопротивления проводника от температуры
- •Электрические свойства металлических сплавов
- •Материалы высокой проводимости
- •1. Абсорбционные токи
- •Резиновые материалы
- •Состав, классификация и свойства пластмасс
- •Классификация волочения по термическим условиям деформации
- •Способы волочения со сниженным коэффициентом трения
- •Изделия, получаемые волочением проволоки
- •Прессование металлов
- •Свободная ковка
- •Холодная объёмная штамповка
- •Оборудование для листовой штамповки
Диаграмма равновесия жидкость-пар
При р = const каждому составу жидкой смеси отвечает определенная температура равновесия с паром и определенный состав пара, отличающийся, как правило, от состава жидкой смеси. На диаграмме состояния (рис. 8, а) кривые кипения и конденсации изображают зависимости температур начала кипения и конденсации от состава и отделяют поля жидкости L и пара V от поля (L + V) гетерогенных состояний жидкость-пар. На кривой кипения может быть экстремум: максимум (рис. 8, б) или минимум (рис. 8, в); в этих точках кривая кипения касается кривой конденсации, т.е. составы равновесных жидкости и пара совпадают. Жидкие смеси такого состава полностью выкипают, подобно чистым жидкостям, при постоянной температуре без изменения состава (см. Азеотропные смеси). Диаграммы состояния, описывающие равновесия двухкомпонентных твердых растворов с жидкими растворами и жидких растворов с паром, подобны.
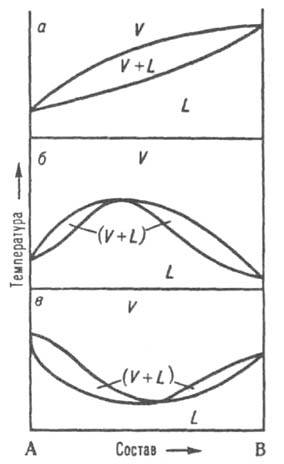
Рис. 8. Диаграммы состояния, двойной системы, описывающие равновесие жидкость - пар. L и V - области существования жидкости и пара соответственно. (L + V) - область сосуществования жидкой и паровой фаз; а - система без азеотропной точки; б и в - два типа азеотропных смесей.
Тройные системы.
Состояния тройных систем однозначно определяются четырьмя независимыми параметрами: Т, р и молярными (массовыми) долями двух компонентов (доля третьего компонента определяется из условия равенства единице суммы долей всех компонентов). Поэтому при построении диаграммы состояния тройных систем один из независимых параметров (р или Т) или два (р и T) фиксируют и рассматривают пространственные изобарные или изотермические диаграммы или плоские изобарно-изотермические диаграммы, соответствующие одному из сечений пространственной диаграммы состояния. Каждому составу тройной смеси отвечает определенная точка на плоскости составов. Область возможных составов тройных систем называется композиционным треугольником или треугольником составов. В системе прямоугольных координат он представляет собой прямоугольный равнобедренный треугольник, вершины которого отвечают компонентам А, В и С, а стороны - двойным смесям АВ, ВС и СА. Более распространено использование равностороннего композиционного треугольника. В этом случае все компоненты равноправны, а за начало координат можно с равным основанием принять любую из его вершин (см. Многокомпонентные системы).
Для построения пространственной изобарной или изотермической диаграммы состояния по координатной оси, перпендикулярной композиционному треугольнику, откладывают соответственно T или р. При этом фигуративные точки системы в целом и ее трехкомпонентных фаз оказываются расположенными внутри трехгранной призмы, грани которой изображают двойные системы, ребра - однокомпонентные системы. На рис. 9, а изображена простейшая диаграмма плавкости тройной системы, компоненты которой А, В и С не образуют друг с другом твердых растворов и (или) химических соединений и не расслаиваются в жидком состоянии (неограниченно взаимно растворимы). Поверхность температур начала кристаллизации тройных расплавов (поверхность ликвидуса) состоит из трех полей -ТAЕ1ЕЕ3, TBE1EE2 и ТCE2EE3, отвечающих кристаллизации А, В и С соответственно и разделенных тремя пограничными кривыми E1E, E2E и E3E. Ортогональные проекции пограничных линий на композиционный треугольник образуют так называемую плоскую диаграмму плавкости тройной системы (рис. 9, б) с тремя полями кристаллизации компонентов AE1EE3, ВE1EE2, СE2EE3. Более полную информацию о системе дает плоская диаграмма с нанесенными на ней изотермами проекциями кривых пересечения поверхности ликвидуса равноотстоящими плоскостями (рис. 9, в). Рассмотрим с помощью диаграммы состояния процессы, происходящие при охлаждении жидкого расплава, первоначальное состояние которого изображается, например, фигуративной точкой М. Поскольку вертикальная прямая, проходящая через М, пересекает поле кристаллизации В (на плоской диаграмме проекция точки М находится в поле кристаллизации В), первым начинает кристаллизоваться именно этот компонент.
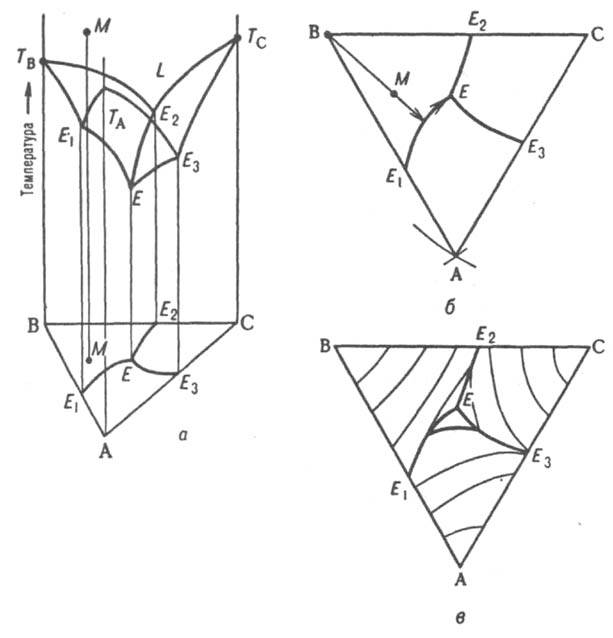
Рис. 9. Диаграмма плавкости тройной системы эвтектического типа: а - пространственная диаграмма, б - плоская диаграмма, в - плоская диаграмма с нанесенными на ней изотермами. ТА, ТB, ТC температуры плавления компонентов А, В и С соответственно, L - область существования жидкой фазы; E1, E2, E3 - эвтектические точки двойных систем АВ, ВС и СА соответственно, Е - тройная эвтектическая точка; М - фигуративная точка системы.
Первоначально однофазная и четырехвариантная (условно трехвариантная) система становится двухфазной и трехвариантной (условно дивариантной). Соотношение количеств А и С в расплаве при кристаллизации В не изменяется, поэтому состав жидкости в ходе кристаллизации В изменяется вдоль прямой (луча кристаллизации), проходящей через точки М и В в направлении удаления от вершины В. В точке пересечения луча кристаллизации с пограничной кривой Е1Е начинает кристаллизоваться еще и А, система становится трехфазной (условно моновариантной). При дальнейшем охлаждении фигуративная точка жидкой фазы смещается вдоль пограничной линии Е1Е по направлению к тройной эвтектической точке Е, в которой происходит кристаллизация всех трех компонентов при постоянной температуре, завершающаяся полным затвердеванием системы. Эвтектическая температура отвечает условно нонвариантному равновесию всех четырех фаз. Кристаллизация тройной жидкой смеси любого состава в системе такого типа всегда заканчивается образованием тройной эвтектики, т.е. поверхностью солидуса рассматриваемой системы является горизонтальная плоскость, проходящая через точку Е.
Обычно рассматривают изотермическое сечение изобарной пространственной диаграммы, называемой изобарно-изотермической. Если при некоторой температуре все три компонента - жидкости, из которых две ограниченно смешиваются друг с другом, на диаграмме состояния, как и в случае двойных систем, имеется область сосуществования двух жидких фаз, ограниченная бинодалью ЕKF (рис. 10). Если жидким является лишь один из компонентов, например, вода в системе, содержащей еще две соли В и С с общим ионом, диаграмма растворимости (рис. 11) состоит из четырех полей, отвечающих одной жидкой фазе L (поле ADEF), двухфазным состояниям (L + SВ) (поле DEB) и (L + SC) (поле FEC) с нодами, проходящими соответственно через точки В и С, и условно нонвариантному трехфазному состоянию (L + SB + SС) (поле ВЕС), в котором твердые В и С находятся в равновесии с насыщенным этими веществами раствором состава Е, который называется эвтоническим; отвечающая ему фигуративная точка называется эвтонической или эвтоникой.
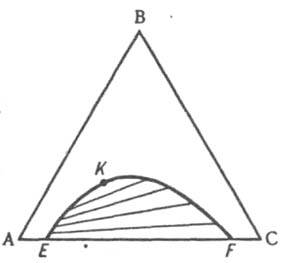
Рис. 10. Изобарно-изотермическая диаграмма состояния тройной системы ABC с ограниченной взаимной растворимостью компонентов А и С в жидком состоянии. EKF - бинодаль, К - верхняя критическая точка растворимости.
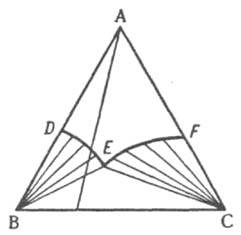
Рис. 11. Изобарно-изотермическая диаграмма растворимости твердых В и С в жидком растворителе A. DE и EF - линии растворимости (кристаллизации), Е - эвтоническая точка (эвтоника).
Линии DE и FE - геометрическое место точек жидких фаз, находящихся в равновесии соответственно с твердыми В и С; они называются линиями растворимости, или линиями кристаллизации, этих компонентов, т.к. в частном случае водных растворов при изотермическом испарении воды, сопровождающемся движением фигуративной точки жидкости вдоль луча испарения, выходящего из вершины А, по достижении фигуративной точкой одной из этих линий начинается кристаллизация соответствующего компонента.
При образовании в тройной системе химических соединений (двойных солей, кристаллогидратов, интерметаллических соединений и т.п.), а также твердых растворов пространственные диаграммы состояния и их плоские сечения усложняются. Для тройных водно-солевых систем, содержащих соли с общими ионами, при построении изобарно-изотермической диаграммы состояния по координатным осям (в прямоугольной системе координат) иногда откладывают не массовые или молярные доли компонентов, а молярные концентрации солей или молярную долю одной из солей в общей солевой массе и число молей воды на 100 молей солевой массы.
Разработаны специальные методы построения диаграмм состояния для тройных систем, между компонентами которых возможны реакции замещения (обмена) или вытеснения, а также для систем, содержащих четыре и более компонентов.
7
Связь свойств сплавов с типом диаграммы состояния (закономерности Курнакова)
Р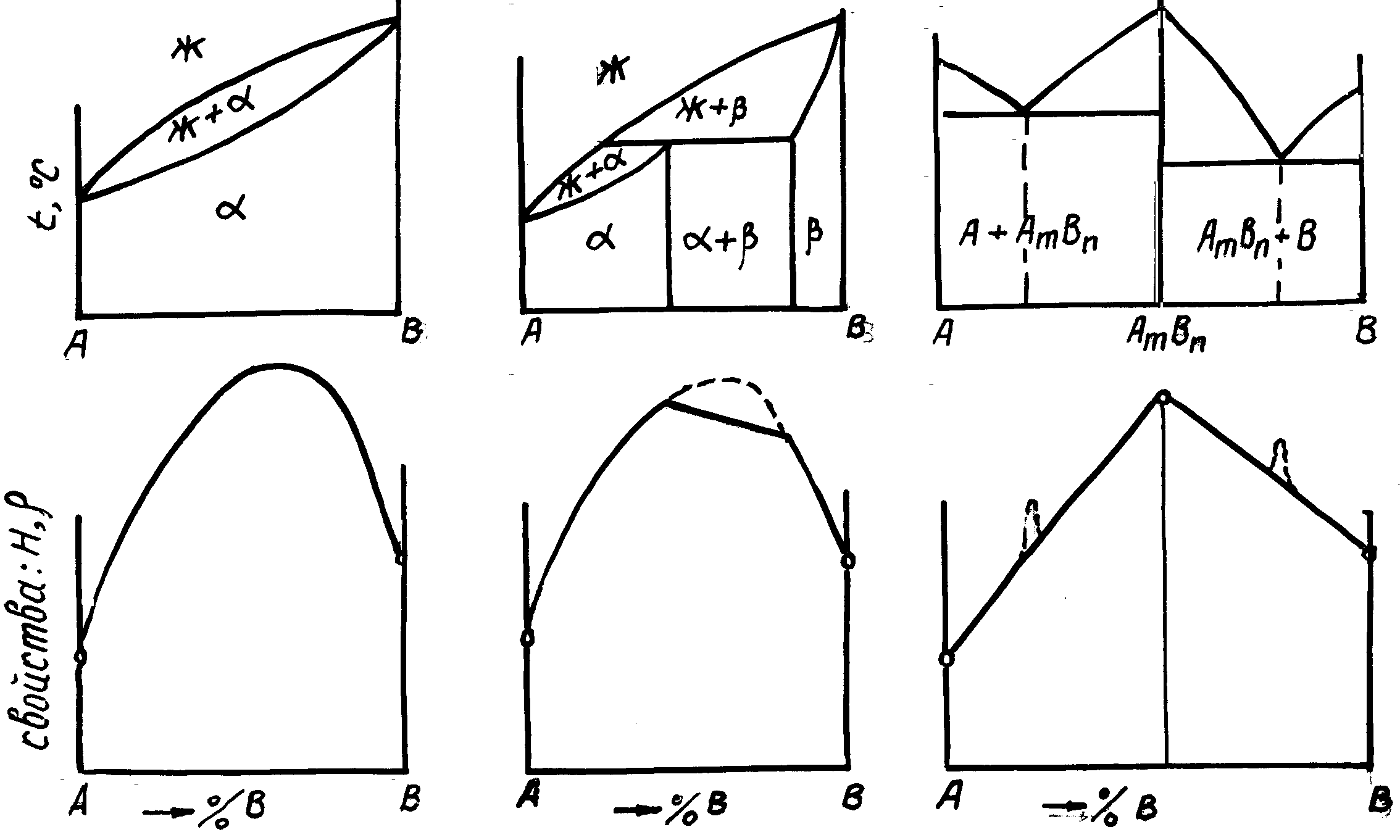 ис.
18. Зависимость свойств сплавов от типа
диаграммы состояния.
ис.
18. Зависимость свойств сплавов от типа
диаграммы состояния.
H - твердость; r - электросопротивление.
Зависимость физических свойств - твердость (Н), электросопротивление (r) показаны на рис. 18.
В сплавах с неограниченной растворимостью свойства изменяются по криволинейной зависимости от состава сплавов. Максимальные свойства (максимум на кривой зависимости свойств) наблюдается как правило при 50 % (атомных) компонентов. В двухфазной области зависимость свойств от концентрации компонентов линейная.
Зная фазовый состав сплавов, можно с достаточной для практики точностью прогнозировать технологические свойства.
Самой высокой пластичностью обладают обычно однофазные сплавы, но они плохо обрабатываются резанием, так как образуют из-за большой пластичности витую стружку. Поэтому в изделиях из таких сплавов трудно получить высокое качество поверхности. Кроме этого большинство однофазных сплавов имеют неудовлетворительные литейные свойства.
Двухфазные сплавы имеют меньшую пластичность, поэтому их можно подвергать только горячей обработке давлением. Однако эти сплавы хорошо обрабатываются резанием. Обработкой резанием в них можно добиться очень малой шероховатости поверхности. Большинство двухфазных сплавов имеют низкий коэффициент трения, поэтому многие из них применяют в качестве подшипников скольжения и других сопряженных деталей, например в парах. Двухфазные сплавы имеют удовлетворительные литейные свойства; наилучшими литейными свойствами обладают эвтектические сплавы и сплавы, содержащие эвтектику.
8
Кривая охлаждения. Полиморфизм железа
Полиморфизм. Способность одного и того же металла образовывать несколько разных кристаллических структур называется полиморфизмом. Различные структурные модификации одного и того же металла называют еще аллотропическими модификациями, а такие превращения под воздействиями температуры или давления называют аллотропическими превращениями.
Полиморфизм распространен среди многих металлов и имеет важное значение для техники, так как оказывает влияние на поведение металлов и сплавов при их нагреве и охлаждении во время термической обработки и при эксплуатации деталей в машинах.
Полиморфные модификации, происходящие при самых низких температурах, обозначают символом α, при более высоких - символом β при еще более высоких - символом γ и т. д.
Полиморфизмом обладают железо, кобальт, титан олово, марганец, ванадий, стронций, кальций, цирконий и др.
Физическая суть полиморфного превращения заключается в том, что кристаллическое вещество при разных температурах переходит в состояние с меньшим запасом свободной энергии. Например, полиморфное равновесие титана наблюдается при 880 °С, а олова - при 13,2 °С. Переход металла из одной аллотропической модификации в другую сопровождается выделением теплоты при охлаждении металла и поглощением теплоты при его нагреве, а внешняя температура остается постоянной. Полиморфные превращения сопряжены с изменением компактности кристаллической решетки и изменением объема вещества. Переход железа из α- в γ-модификацию при температуре примерно 910 °С сопровождается изменением объема на 1,6 %. Плотность γ-железа на 1,05 % больше плотности α-железа, а удельный объем γ-железа соответственно меньше. Анизотропия. В кристаллическом теле атомы образуют правильно повторяющиеся конфигурации (решетки), но в разных направлениях плотность атомов в этих конфигурациях различна и условно можно представить, что кристалл пересекается плоскостями под разными углами с различным количеством атомов в каждой из этих плоскостей. Атомы этих плоскостей связаны друг с другом и между всеми атомными плоскостями также действуют силы притяжения. В гранецентрированной и объемно центрированной решетках имеются три главные плоскости с наиболее плотной упаковкой атомов, которые обозначаются (100), (110), (111). Эти плоскости имеют минимальную поверхностную энергию (на рисунке).
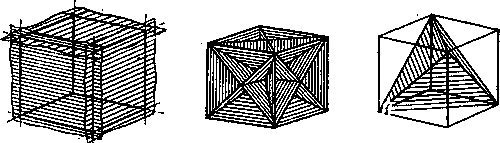 Условные
плоскости в кубической решетке с наиболее
плотной упоковкой атомов
1 -
плоскости (100); 2 - плоскости (110); 3
- плоскости (111);
Условные
плоскости в кубической решетке с наиболее
плотной упоковкой атомов
1 -
плоскости (100); 2 - плоскости (110); 3
- плоскости (111);
Плоскости с наименьшей поверхностной энергией и плотной упаковкой атомов наиболее легко перемещаются относительно друг друга при деформации кристалла. Следовательно, требуется наименьшая затрата энергии для деформации кристалла в направлении указанных плоскостей, т. е. механические свойства в этих направлениях будут минимальными. Также отличаются магнитная проницаемость, модули упругости, теплопроводность и ряд других свойств, измеряемых в разных направлениях кристалла (по разным кристаллографическим плоскостям). Такая неодинаковость свойств кристалла в разных кристаллографических направлениях называется анизотропией. Следовательно, отдельный кристалл - тело анизотропное, т. е. имеет различные свойства в различных направлениях. Но на практике дело обычно имеют с поликристаллическими телами, состоящими из большого количества различно ориентированных друг к другу мелких (10-1-10-4 см) кристаллов, образующих кристаллиты или зерна. Поэтому анизотропия в поликристаллическом теле не имеет ярко выраженного характера и свойства как бы усредняются во всех направлениях благодаря различной ориентации мелких кристаллов. В этом случае поликристаллическое тело становится изотропным подобно аморфным телам и приобретает одинаковые свойства во всех направлениях
График, показывающий зависимость между временем и температурой во время охлаждения материала. Используется для определения температур, при которых происходят фазовые превращения. Иногда используются не время, а другие показатели, например тепловое расширение.
Кривые охлаждения показывают, что сплавы в отличие от чистых металлов имеют две критические точки: температуру начала и температуру конца кристаллиазации. При нижней критической температуре (246°С) все сплавы Pb—Sb окончательно затвердевают. При верхних критических температурах, которые для разных по составу сплавов неодинаковы, происходит только начало затвердевания сплава (начало перехода из жидкого состояния в твердое). При этом в зависимости от процентного содержания Pb и Sb в сплавах в момент начала затвердевания начинает кристаллизоваться либо Pb, либо Sb (это зависит от того, каким из указанных металлов пересыщен сплав данного состава при соответствующей температуре). При соединении точек начала и конца затвердевания кривых охлаждения получается диаграмма состояния сплавов свинца и сурьмы (рис. 14).
9
Общие сведения о диаграмме железо – углерод
В системе железо-углерод можно выделить несколько типов сплавов: железо, стали и чугуны. В отличие от чистого, технически чистое железо содержит до 0,025 % углерода, а также в незначительных количествах кремний, марганец и некоторые другие элементы. Стали содержат до 2 % углерода, чугуны – более 2 %.
Чистое железо
Железо – ферромагнитный переходный полиморфный металл, с порядковым номером в таблице Д.И. Менделева 26. Электронная структура: 1S2 2S2 2p6 3s2 3p6 3d6 4s2.
Температура плавления чистого железа 1539 ˚С. Плотность при комнатной температуре 7,684 г/см3, атомная масса 55,85. Структура железа представляет собой равноосные полиэдры, разделенные тонкими прожилками границ зерен. Чистое железо имеет сравнительно крупные зерна. Техническим железом называют сплавы железа с углеродом, если содержание углерода в них не превышает 0,02% (по массе). Увеличение количества примесей, в том числе углерода измельчает размер зерна и увеличивает толщину границ. В техническом железе возможно выделение прожилок третичного цементита вдоль границ зерен. Железо имеет ряд критических точек (А4 = 1392 ˚С, А3 = 911˚С), соответствующих полиморфным превращениям, а также точку полиморфного превращения (точка Кюри – 770 ˚С).
При температурах ниже 911˚С железо имеет решетку объемноцентрированного куба (ОЦК), параметр решетки 2,8605 кХ при 20 ˚С. Эта модификация носит название альфа – железо. До 770 ˚С альфа–железо ферромагнитно, выше – парамагнитно. Ферромагнетизм исчезает при температуре точки Кюри без какого либо изменения в кристаллической структуре. Точка Кюри не обладает термическим гистерезисом, т.е. при охлаждении железа ниже 770 ˚С ферромагнетизм восстанавливается.
Температура 911 ˚С является критической точкой (А3), при которой происходит полиморфное превращение aFeÛgFe. При нагреве до температуры выше 911 ˚С происходит перестройка кристаллической структуры железа из решетки объемно-центрированного куба в решетку с более плотной упаковкой атомов – куб гранецентрированный (ГЦК) – гамма-железа. Превращение aFe®gFe сопровождается уменьшением удельного объема примерно на 1%. Параметр ГЦК решетки γ–железа 3,6409 кХ при 950 ˚С.
В равновесных условиях при очень медленном нагреве перестройка решетки из альфа в гамма–железо начинается приблизительно на 10 ˚С выше, чем при образовании альфа из гамма–железа при очень медленном охлаждении. Поэтому, для того, чтобы различить температуры, при которых начинаются превращения, используют дополнительные индексы c и r соответственно при нагреве и охлаждении. В этом случае обозначение критических точек соответственно Ас3 и Аr3 при нагреве и охлаждении. Разница в температурных значениях Ас3 и Аr3 называется температурным гистерезисом превращения.
Гамма–железо существует в температурном интервале 911–1392 ˚С. Температура 1392 ˚С (А4) является критической точкой, при которой происходит перестройка gFeÛdFe. Дельта–железо, существующее до температуры плавления имеет решетку аналогичную альфа–железу, решетку объемно–центрированного куба, отличающуюся от альфа–железа параметром решетки (2,93 кХ при 1425 ˚С). Гамма и дельта–железо парамагнитны.
Системы железа с углеродом
Взаимодействие железа и углерода, природа фаз, характер фазового равновесия в системе и сама диаграмма железо–углерод определяется электронным строением железа и углерода.
Железо в металлическом состоянии в реальных условиях, описываемых диаграммой железо–углерод, отдает два его внешних валентных электрона с оболочкой 4s2 в коллективизированное состояние. Открывающиеся при этом орбитали d6 электронной оболочкой перекрываются, образуя решетку объемно–центрированного куба (ОЦК). Такое электронное строение свойственно альфа и дельта–железу.
В интервале температур от 911 до 1392 ˚С d6 - орбитали не перекрываются, в связи с чем сферическая симметричная электронная конфигурация электронной оболочки обеспечивает образование плотной упаковки гранецентрированного куба, отвечающей решетке гамма–железа.
Электронная конфигурация атомов углерода 1S2 2S2 2p2. Четыре электрона на внешней оболочке могут переходить либо в коллективизированное состояние при образовании растворов, либо принимать участие в валентных связях при образовании химических соединений. Кроме того, внешняя оболочка углерода может заполняться до уровня 2S2 2p6 при образовании металлических карбидов.
Углерод в системах с железом при нормальном давлении может находиться в свободном состоянии в виде графита, а также в растворенном состоянии в твердых и жидких растворах. Кроме того, он образует карбиды, например, цементит Fe3C.
Цементит – соединение с преимущественной ковалентной связью, усиленной небольшой долей ионной связи между ионами железа и углерода, а также металлической связью. Наличие некоторой части металлической связи в цементите обусловливает его проводимость в связи с появлением в связи с ней некоторой электронной концентрации.
При образовании цементита происходит обмен электронами между соседними атомами железа и углерода по одному d-электрону иона Fe2+ с конфигурацией d6 и электроном внешней оболочки атома углерода. У атома углерода принимают участие в образовании связей шесть валентных электронов, захваченных на уровень 2p. Шесть орбиталей 2p6–оболочки перекрываются с шестью d-орбиталями шести ближайших атомов железа (d6). При этом возникают шесть обменных двухэлектронных связей ковалентного типа, определяя преимущественную ковалентную связь в решетке цементита.
Графит имеет гексагональную слоистую структуру вследствие возникновения полуторных связей между атомами углерода.
При растворении углерода в железе, его атомы теряют валентные электроны, которые коллективизируются и переходят в электронный газ вместе с электронами железа. Оголяющаяся при этом 1S2 электронная конфигурация иона углерода приобретает сферическую конфигурацию и имеет очень малый размер (около 1,1 кХ). Это позволяет размещаться ионам углерода в октаэдрических пустотах ГЦК и ОЦК решеток железа, образуя твердые растворы внедрения: g-твердый раствор (аустенит), a-феррит и d-феррит.
Жидкие растворы углерода в железе выше температуры плавления сплавов в системе железо – углерод имеют то же электронное строение, что и твердые растворы: d-феррит и g-аустенит. При плавлении сохраняется тот же ближний порядок в кристаллическом строении сплавов, который наблюдался до плавления в данном сплаве в твердом состоянии. При плавлении нарушается лишь дальний порядок.
Фазовые состояния железоуглеродистых сплавов, в зависимости от состава и температуры, описываются диаграммами стабильного и метастабильного равновесия. Термодинамический анализ показывает, что наиболее стабильной системой, образованной двумя компонентами: железом и углеродом, является система железо – графит. Метастабильной является система железо – цементит.
Диаграмма железо – графит построена в условиях очень медленного нагрева и охлаждения (доли градуса в минуту). Диаграмма железо – цементит строится в условиях более высоких скоростей нагрева и охлаждения (порядка нескольких градусов в минуту).
Диаграммы позволяют описать как фазовый состав, так и структуру сплава. В этом случае диаграммы называют, соответственно, фазовой или структурной. Часто обозначения фазового и структурного состава сплавов объединяют.
Характеристика фазовых и структурных составляющих железоуглеродистых сплавов
В соответствии с ранее данными определениями фазовой и структурной составляющих системы, в системе железо-углерод к фазовым составляющим относятся: жидкий раствор (L), твердые растворы: феррит (α), аустенит (γ) , высокотемпературный феррит (δ), а также цементит и графит (Г).
Жидкий раствор в системе железо-углерод представляет собой раствор углерода в расплавленном железе. При температурах значительно выше линии ликвидус (преимущественно выше 1700˚С) жидкость является статистически неупорядоченным раствором со статистически плотной упаковкой. При небольшом перегреве выше линии ликвидус жидкий раствор имеет сравнительно регулярное строение. Жидкий раствор, образовавшийся при плавлении δ-феррита (до 0,51% углерода), сохраняет ближний порядок по ОЦК-решетке δ-железа. Жидкий раствор, образующийся при плавлении аустенита, имеет ближний порядок, соответствующий ГЦК-решетке γ -железа.
Феррит – это твердый раствор внедрения углерода в α-железе. Решетка феррита – объемно-центрированный куб с расположением атомов углерода в сравнительно небольших октаэдрических пустотах решетки, сильно искажающим ее. Растворимость углерода в феррите невелика.
При температуре 727 ˚С в феррите растворяется 0,02% С; при понижении температуры растворимость уменьшается, достигая величины 0,006%С при комнатной температуре. Структура феррита представляет собой сравнительно равноосные полиэдрические кристаллы, разделенные между собой тонкими высокоугловыми границами. Выявляется обычно структура феррита при травлении растворами азотной кислоты.
Феррит до температуры точки Кюри (770˚С) сильно ферромагнитен, хорошо проводит тепло и электрический ток. В равновесном состоянии феррит пластичен (относительное удлинение порядка 40%), имеет небольшую прочность и твердость (HB = 65 - I30, в зависимости от величины зерна).
Феррит, в зависимости от характера протекающих фазовых превращений, в структуре железоуглеродистых сплавов может находиться в виде различных структурных состояний: феррит, как основа структуры сплава (Ф); феррит, как вторая (избыточная) фаза, располагающаяся по границам перлитных колоний, в виде отдельных включений равноосной или игольчатой формы; феррит, входящий в качестве фазы в состав другой структурной составляющей – перлита или феррито-графитного эвтектоида.
При температурах выше критической точки А4 стабильной становится модификация высокотемпературного δ–феррита, имеющего, как и низкотемпературный α–феррит, объемно-центрированную кубическую решетку, но с большими по сравнению с ним параметрами. δ -феррит парамагнитен.
Аустенит – твердый раствор внедрения углерода в γ-железе. Решетка аустенита – гранецентрированный куб (ГЦК). Атомы углерода располагаются в крупных октаэдрических пустотах решетки.
Растворимость углерода в аустените значительно больше, чем в феррите: 2,03 и 2,14% при температурах эвтектического превращения, соответственно, в стабильной и метастабильной системе. При понижении температуры растворимость уменьшается до 0,69 и 0,80% в упомянутых системах, что соответствует температурам эвтектоидного превращения в той и другой системах.
Аустенит в структуре выявляется так же, как и феррит в виде сравнительно равноосных полиэдров, но отличается от него значительным количеством двойников в теле зерна. Аустенит – парамагнитная составляющая во всем температурном интервале его существования. Аустенит мягок, хотя тверже феррита (HB = 200-250). Он пластичен (относительное удлинение 40-50% и выше). Превращение феррита и феррито-цементитной смеси в аустенит сопровождается уменьшением объема.
Структурное состояние аустенита (А) в железоуглеродистых сплавах аналогично ферриту: он может быть единственной структурной составляющей в сплаве; составлять основу сплава; входить в него, как остаточный аустенит; содержаться в виде фазовой составляющей в составе более сложной структурной составляющей – эвтектической аустенито-цементитной смеси (ледебурита), существующей при температурах выше эвтектоидной линии на диаграмме железо-углерод.
Цементит – метастабильное соединение железа с углеродом, соответствующее формуле Fe3C. Цементит имеет сложную орторомбическую решетку, основа которой представляет собой трехгранную, слегка искаженную призму, образованную шестью атомами железа. Часть атомов железа имеет 11 соседних атомов железа, а часть – 12. Пустоты заполняются атомами углерода. В этом структура цементита близка по своему строению к структуре аустенита, а также к плотнейшей гексагональной модификации ε – железа.
Цементит – соединение практически постоянного состава. Растворимость железа в цементите имеет место, но ее величина очень мала, и практически незначима. Цементит при повышении температуры сравнительно легко разлагается на железо (аустенит или феррит) и графит. Это свойство цементита лежит в основе явления графитизации, и используется для получения серых и ковких чугунов. Цементит хрупок, очень тверд (НВ около 800), слабо магнитен до температуры 210˚С. Выше этой температуры цементит парамагнитен.
Структурное состояние цементита определяется, в основном, типом превращения, при котором он образуется. Различают первичный цементит (ЦI), который представляет собой крупные игольчатые кристаллы, образующиеся при кристаллизации непосредственно из жидкости в заэвтектическом белом чугуне. Вторичный цементит (ЦII) выделяется в заэвтектоидных сталях и доэвтектических чугунах, в основном, в виде сетки по границам зерен аустенита, а также в ряде случаев в виде равномерно распределенных по объему аустенитного зерна скоагулированных частиц или игл. Вторичный цементит – это избыточная фаза в железоуглеродистых сплавах, выделяющаяся из аустенита при охлаждении в результате уменьшения растворимости углерода в аустените при понижении температуры.
Выделение третичного цементита (ЦIII) характерно для технического железа и малоуглеродистой стали. Выделяется третичный цементит из феррита в результате уменьшения растворимости углерода в феррите с понижением температуры от 727˚С до комнатной температуры. Третичный цементит в структуре железа и малоуглеродистой стали в микроструктуре наблюдается в виде тонких прожилок по границам зерен феррита. Такие выделения третичного цементита охрупчивают железо и малоуглеродистые стали. Поэтому такие сплавы подвергают термической обработке с целью изменения структурного состояния третичного цементита. Желательное его положение в структуре сплава – равномерно рассредоточенные выделения в объеме ферритных зерен. Этого добиваются путем закалки и старения.
Кроме того, цементит в качестве фазовой составляющей входит в состав сложных двухфазных структурных составляющих в железо-углеродистых сплавах – перлита и ледебурита. В этом случае такой цементит называют эвтектоидным и эвтектическим (Цэ), соответственно.
Графит – важнейшая фазовая и структурная составляющая (Г) серых, ковких и высокопрочных чугунов, обусловливающая их малую усадку при кристаллизации, высокие антифрикционные свойства, малую изнашиваемость, большое внутренние трение, обеспечивающее уменьшение вибраций, и ряд других полезных свойств. Графит – гексагональная модификация углерода. При нормальном давлении графит является стабильной составляющей до температур около 4000˚С.
В решетке графита атомы расположены слоями с гексагональной симметрией. В первом и третьем слоях атомы расположены друг над другом. Во втором (среднем) слое атомы сдвинуты вдоль наибольшей диагонали шестигранника на величину параметра решетки (длину стороны шестигранника). Расстояние между слоями (3,35 кХ) значительно больше, чем расстояния между соседними атомами в гексагональном слое. Из-за легкой подвижности слабо связанных гексагональных слоев графит – наименее прочная фаза железоуглеродистых сплавов.
Графит в структуре железоуглеродистых сплавов находится либо в виде избыточной фазы (в заэвтектическом сером чугуне), либо в качестве фазовой составляющей, входящей в состав аустенито-графитной эвтектики. Графит имеет форму разветвленных крабовидных включений. Эвтектический графит отличается от первичного меньшими размерами и большей разветвленностью.
После модифицирования жидкого чугуна магнием и некоторыми другими элементами, а также после отжига белого чугуна на ковкий, в структуре можно наблюдать глобулярный (хлопьевидный или шаровидный) графит. Эта форма графита обеспечивает получение повышенной прочности и пластичности чугуна.
Все описанные фазовые составляющие могут одновременно быть и структурными составляющими, если они в структуре сплава находятся в виде избыточных фаз или составляют основу структуры сплава.
Кроме однофазных структурных составляющих в железоуглеродистых сплавах имеют место и сложные двухфазные: перлит, ледебурит, графито-аустенитная эвтектика и феррито-графитный эвтектоид.
Перлит – это эвтектоидная физико-химическая смесь двух фаз: феррита и цементита, образовавшаяся в метастабильной системе железо-углерод за счет диффузионного расслоения аустенита по эвтектоидной реакции. Перлит образуется при переохлаждении аустенита ниже линии PSK диаграммы железо-углерод. Строение перлита определяется величиной переохлаждения, при котором происходит распад.
При малом переохлаждении (на 20-30 ˚С ниже линии эвтектоидного превращения) образуется зернистый перлит. Зернистый перлит представляет собой феррито-цементитную структуру, в которой основой является феррит, а по его объему статистически равномерно распределены зернистые, близкие к сферическим, включения цементита.
При большем переохлаждении образуется структура пластинчатого перлита, состоящего из регулярно чередующихся пластин цементита и феррита, причем, пластины феррита примерно в 7 раз толще пластин цементита.
Абсолютные значения толщины цементитных и ферритных пластин, величина расстояния между одноименными пластинами в составе эвтектоидной смеси, называемая межпластиночным расстоянием, и характеризующая степень дисперсности структуры, определяются степенью переохлаждения аустенита ниже равновесной температуры эвтектоидной реакции. Чем больше степень переохлаждения, тем выше дисперсность феррито-цементитной эвтектоидной смеси. Высокодисперсные феррито-цементитные смеси носят названия сорбит и троостит. Троостит наиболее дисперсная феррито-цементитная смесь.
Перлит присутствует в структуре сталей и чугунов. Количество перлита растет в доэвтектоидных сталях с увеличением содержания углерода от 0,02 до 0,8%. Эвтектоидная сталь имеет чисто перлитную структуру (100% перлита).
Дальнейшее увеличение содержания углерода в стали, соответствующее переходу к заэвтектоидным сталям, а далее – к чугунам, сопровождается уменьшением доли перлита в структуре за счет появления и увеличения количества вторичного, эвтектического и, наконец, первичного цементита.
Перлит в малоуглеродистых сталях появляется сначала в виде отдельных включений между зернами феррита, затем при увеличении его количества, он постепенно занимает в структуре все большее поле зрения на поверхности шлифа. Пока перлита в структуре мало, строение его не выявляется при малых и средних увеличениях оптического микроскопа. В эвтектоидной и заэвтектоидной сталях пластинчатое строение его выявляется уже при небольших увеличениях (×100 - 200). В структуре чугуна перлит находится как в виде избыточных колонийных структурных составляющих – продуктов распада избыточного аустенита, так и в составе ледебурита. Механические свойства перлита определяются его структурным состоянием. Расчет по правилу аддитивности твердости перлита, исходя из известных значений твердости феррита и цементита, дает значения 150-180 НВ. Экспериментально определенные значения твердости пластинчатого перлита, сорбита и троостита соответственно равны 170 - 230, 230 - 330 и 330 - 400 НВ. Таким образом, можно видеть, что чем выше степень дисперсности феррито-цементитной смеси, тем выше его твердость.
Ледебурит – эвтектическая физико-химическая смесь аустенита и цементита, образующаяся в результате эвтектической кристаллизации из жидкости, содержащей 4,3% углерода.
Ледебурит представляет собой колонийную структуру, основу которой составляют пластины цементита, проросшие разветвленными кристаллами аустенита. Ветви аустенита в составе ледебурита располагаются регулярно по всему объему эвтектической цементитной пластины и имеет форму стержней примерно цилиндрической конфигурации. На шлифе колония ледебурита в зависимости от направления поверхности шлифа относительно аустенитных ветвей может выглядеть либо в виде «зернистой» смеси при поперечном сечении колонии, либо «пластинчатой» - при продольном сечении. При сечении колонии под углом к плоскости базиса цементита, сечения аустенитных ветвей в составе ледебурита эллиптической конфигурации.
Кроме колонийного (сотового) ледебурита эвтектическая смесь аустенита и цементита может встречаться в виде пластинчатой эвтектики, представляющей собой пакет тонких цементитных пластинок, разделенных аустенитом. Такие пакеты образованы двумя переплетенными кристаллами цементита и аустенита. Вероятность образования пластинчатого ледебурита увеличивается с ростом степени переохлаждения жидкости при кристаллизации. При этом увеличивается доля пластинчатого ледебурита в структуре белого чугуна. Чаще всего пакет пластинчатого ледебурита составляет основу, на которой зарождается и растет колония сотового ледебурита.
При очень больших скоростях охлаждения весь ледебурит может оказаться пластинчатым. В этом случае цементит разветвляется, приобретая вид веерообразных колоний. При еще больших скоростях охлаждения появляются сферолитные колонии. Ледебурит, состоящий из эвтектической смеси аустенита и цементита, устойчив в температурном интервале от эвтектической до эвтектоидной линии на диаграмме железо-углерод. При понижении температуры ниже 727 ˚С аустенит в составе ледебурита претерпевает эвтектоидное превращение, в результате чего при комнатной температуре ледебурит представляет собой эвтектическую смесь перлита с цементитом. Строение перлита в ледебурите такое же, как и в сплавах с меньшим содержанием углерода (сталях).
Ледебурит, как и цементит, образующий его основу, тверд, износостоек и обладает практически нулевой пластичностью. Эти свойства ледебурита лежат в основе использования такой структуры в белых чугунах, используемых в качестве одних из наиболее износостойких материалов.
Аустенито-графитная эвтектика образуется в стабильной системе железо-углерод и представляет собой смесь кристаллов графита, сформировавшуюся при одновременном выделении из жидкости состава 4,25% углерода обеих фазовых составляющих. При малых степенях переохлаждения графит эвтектики имеет, как и первичный графит, разветвленную пластинчатую форму. Увеличение скорости охлаждения приводит к расщеплению графитных пластин и образованию сферических кристаллов. Эвтектическая аустенито-графитная структура мало отличается от выделения первичных кристаллов графита. Главное отличие этих структур заключается в размере графитных включений. Они в эвтектике мельче первичных кристаллов.
Феррито-графитный эвтектоид – продукт эвтектоидного распада аустенита, содержащего 0,69% углерода, который реализуется в условиях очень медленного охлаждения при температурах ниже 738˚С.
Феррито-графитный эвтектоид – дисперсная смесь феррита, составляющего основу структуры сплава, и дисперсных разветвленных или сферических графитных частиц, распределенных в феррите статистически равномерно. Однако в большинстве случаев эвтектоидный графит при распаде аустенита осаждается на ранее образовавшихся первичных и эвтектических графитных кристаллах. Эвтектоидное превращение с образованием феррито-графтного эвтектоида используется при термической обработке чугунов и графитизированной стали для получения феррито-графитной структуры, обладающей хорошими антифрикционными свойствами при сохранении достаточно высокой пластичности сплавов.
Характеристика основных точек и линий диаграммы железо-углерод
Все точки диаграммы железо-углерод имеют определенный физический смысл и общепризнанные в мировой практике буквенные обозначения. Знание основных свойств и характеристик этих точек облегчает понимание диаграммы и ее практическое использование. Ниже приведены краткие характеристики точек и линий диаграммы.
Основные точки диаграммы железо-углерод
А – точка, соответствующая плавлению – кристаллизации чистого железа. Температура, отвечающая этой точке 1539 °С. Число степеней свободы в этой точке равно нулю. На термических кривых для чистого железа температуре точки А соответствуют горизонтальные площадки, которые возникают за счет выделения скрытой теплоты кристаллизации. Переход из твердого в жидкое состояние, соответствующий точке А, сопровождается резким увеличением объема (около 6%), связанным с нарушением дальнего порядка в кристаллическом строении d-железа. При кристаллизации чистого железа в этой точке наблюдаются обратные явления.
В – точка предельного насыщения железом жидкого раствора, находящегося в равновесии одновременно с кристаллами d- и g-твердых растворов при перитектической температуре. Точке В соответствует содержание углерода в жидкости 0,51%, температура 1496 °С.
С – эвтектическая точка в метастабильной системе Fe – Fe3C. Температура 1147 °C, концентрация углерода, соответствующая точке С – 4,3% – это содержание углерода в жидком растворе, находящемся в равновесии одновременно с аустенитом и цементитом при эвтектическом превращении. Число степеней свободы, соответствующее этой точке, равно нулю. На термических кривых охлаждения и нагрева точке С соответствуют горизонтальные площадки, аналогичные площадкам плавления – кристаллизации чистого железа.
С¢ – эвтектическая точка в стабильной системе железо-графит. Температура, соответствующая точке 1153 °С, концентрация углерода – 4,25% – это содержание углерода в жидкости, находящейся в равновесии с аустенитом и графитом при эвтектической кристаллизации. Как и в точке С, в данной точке система нонвариантна.
D – согласно принятым обозначениям точку D относят к температуре плавления цементита. Однако известные данные свидетельствуют о том, что цементит представляет собой термодинамически неустойчивую фазу, в связи с чем, перед плавлением он разлагается на железо и графит. При этом положение точки D на диаграмме оказывается неопределенным.
D¢ – точка, соответствующая температуре плавления графита (около 4000°С).
Е – точка, отвечающая предельному содержанию углерода в аустените, находящемся в равновесии с цементитом и жидкостью при эвтектической температуре (1147 °С) в метастабилъной системе. Значение содержания углерода 2,14%. Точка Е на концентрационной оси диаграммы является своеобразной границей между сталями и чугунами. При содержании углерода в сплавах меньше 2,14% в их структуре отсутствует ледебурит; при содержании углерода более 2,14% ледебурит присутствует в структуре сплавов. Это – важнейшая структурная составляющая чугунов.
Е¢ – точка, отвечающая предельному содержанию углерода в аустените, находящемся в равновесии с графитом и жидким раствором при эвтектической температуре (1153 °С) в стабильной системе. Значение содержания углерода, соответствующего этой точке, равно 2,03 %.
F – точка предельного насыщения цементита железом при эвтектической температуре (1147°С). Значение концентрации углерода, соответствующее точке F, практически близко к 6,67%, хотя последние работы показывают наличие некоторой весьма малой растворимости железа в цементите.
F¢ – точка предельного насыщения графита железом при эвтектической температуре (1153 °С).
G – точка полиморфного превращения в чистом железе a Û g. Температура превращения 911°С. Число степеней свободы системы в этой точке равно нулю. Перестройка кристаллической решетки a ® g сопровождается уменьшением объема, обратный переход g ® a увеличивает удельный объем образца, что связано с различной плотностью упаковки атомов в гранецентрированной решетке g - железа и объемно-центрированной решетке a - железа. Точка G соответствует для чистого железа критической точке А3.
Н – точка предельного насыщения углеродом d-феррита при температуре перитектического превращения. Температура, соответствующая этой точке 1496 °С, концентрация углерода 0,10%, что Это соответствует концентрации d-феррита, находящегося в равновесии с аустенитом и жидкостью при температуре перитектики.
I – перитектическая точка, точка трехфазного равновесия, соответствующая равновесной концентрации аустенита, образующегося по перитектичеокой реакции в изотермических условиях из жидкости состава точки В и d-феррита состава точки Н. Температура, в точке I, равна 1496 °С, концентрация углерода 0,16%.
К – точка предельного насыщения железом цементита при эвтектоидной температуре 727°С. Точке практически соответствует концентрация 6,67% углерода.
К¢ – точка предельного насыщения железом графита при эвтектоидной температуре (738°С).
М – точка Кюри чистого железа. Температура этой точки 770 °С. Точка соответствует потере ферромагнетизма a-железа при нагреве и восстановлению его ферромагнетизма при охлаждении.
N – точка полиморфного превращения d Û g в чистом железе. Температура превращения 1392 °С. Точка N для чистого железа соответствует критической точке А4. В этой точке система нонвариантна.
О – точка наибольшей растворимости углерода в аустените, находящемся в контакте с немагнитным ферритом при температуре 770 °С. Содержание углерода в аустените в этой точке примерно равно 0,5%.
Р – точка предельного содержания углерода в феррите, находящемся в равновесии с цементитом и аустенитом при эвтектоидной температуре (727°С). Значение содержания углерода для этой точки 0,02%. Точка Р на концентрационной оси диаграммы отделяет техническое железо от стали. В сталях (содержание углерода выше 0,02%) в качестве структурной составляющей содержится перлит. В техническом железе (содержание углерода не более 0,02%) перлит отсутствует.
S – эвтектоидная точка в метастабильной системе. Температура, соответствующая этой точке, 727 °С, содержание углерода 0,8%. Это содержание углерода в аустените, находящемся в равновесии c ферритом и цементитом при эвтектоидной реакции. Число степеней свободы, как и для других трехфазных реакций в данной системе, равно нулю.
S¢ – эвтектоидная точка в стабильной системе железо-графит. Температура, отвечающая данной точке 738 °С, содержание углерода в аустените, соответствующее точке S¢ç, равно 0,69%. Это содержание углерода в аустените, находящемся в состоянии равновесия с ферритом и графитом в момент развития прямого или обратного эвтектоидного превращения. Система в точке S¢ç -нонвариантна.
Q – точка предельной растворимости углерода в феррите (значение 0,006% при комнатной температуре). Увеличение концентрации углерода в феррите до значений более 0,006% приводит к изменению фазового состава и в первую очередь к появлению в структуре третичного феррита.
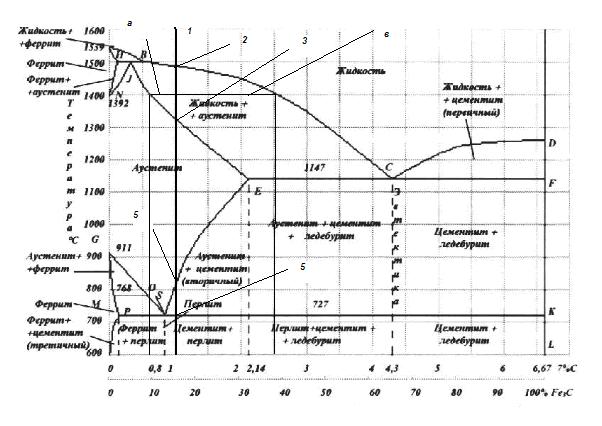
Структурные составляющие железоуглеродистых сплавов. Начало изучению железоуглеродистых сплавов и процессов термической обработки было положено опубликованной в 1868 г. Работой Д.К. Чернова «Критический обзор статей Лаврова и Калакуцкого о стали и стальных орудиях и собственные исследования Д.К. Чернова по этому же предмету». Д.К. Чернов впервые указал на существование в стали критических точек и дал первое представление о диаграмме железо-цементит. В дальнейшем изучению железоуглеродистых сплавов и построению диаграмм железо-углерод были посвящены работы Ф. Осмонда, Ле-Шателье (Франция), Р. Аустена (Англия), А.А. Байкова и Н.Т. Гудцова (Россия), Розенбаума (Голландия), П. Геренса (Германия) и др. Основными компонентами, от которых зависит структура и свойства железоуглеродистых сплавов, являются железо и углерод. Чистое железо - металл серебристо-белого цвета; температура плавления 1539°С. Железо имеет две полиморфные модификации: α и γ. Модификация α существует при температурах ниже 911°С и выше 1392°С; γ-железо - при 911-1392°С. В зависимости от температуры и концентрации углерода железоуглеродистые сплавы имеют следующие структурные составляющие. 1. Феррит (Ф) - твердый раствор внедрения углерода в α-железе. Растворимость углерода в α-железе при комнатной температуре до 0,005%; наибольшая растворимость - 0,02% при 727°С. Феррит имеет незначительную твердость (НВ 80-100) и прочность (σв=250 МПа), но высокую пластичность (δ=50%; φ=80%). 2. Аустенит (А) - твердый раствор внедрения углерода в γ-железе. В железоуглеродистых сплавах он может существовать только при высоких температурах. Предельная растворимость углерода в γ-железе 2,14% при температуре 1147°С и 0,8% - при 727°С. Эта температура является нижней границей устойчивого существования аустенита в железоуглеродистых сплавах. Аустенит имеет твердость НВ 160-200 и весьма пластичен (δ=40-50%). 3. Цементит (Ц) - химическое соединение железа с углеродом (карбид железа Fe3C). В цементите содержится 6,67% углерода. Температура плавления цементита около 1600°С. Он очень тверд (НВ~800), хрупок и практически не обладает пластичностью. Цементит неустойчив и в определенных условиях распадается, выделяя свободный углерод в виде графита по реакции Fe3C→3Fe+C. 4. Графит - это свободный углерод, мягок (НВ 3) и обладает низкой прочностью. В чугунах и графитизированной стали содержится в виде включений различных форм (пластинчатой, шаровидной и др.). С изменением формы графитовых включений меняются механические и технологические свойства сплава. 5. Перлит (П) - механическая смесь (эвтектоид, т. е. подобный эвтектике, но образующийся из твердой фазы) феррита и цементита, содержащая 0,8% углерода. Перлит может быть пластинчатым и зернистым (глобулярным), что зависит от формы цементита (пластинки или зерна) и определяет механические свойства перлита. При комнатной температуре зернистый перлит имеет предел прочности σв=800 МПа; относительное удлинение δ=15%; твердость НВ 160. Перлит образуется следующим образом. Пластинка (глобуль) цементита начинает расти или от границы зерна аустенита, или центром кристаллизации является неметаллическое включение. При этом соседние области обедняются углеродом и в них образуется феррит. Этот процесс приводит к образованию зерна перлита, состоящего из параллельных пластинок или глобулей цементита и феррита. Чем грубее и крупнее выделения цементита, тем хуже механические свойства перлита. 6. Ледебурит (Л) - механическая смесь (эвтектика) аустенита и цементита, содержащая 4,3% углерода. Ледебурит образуется при затвердевании жидкого расплава при 1147°С. Ледебурит имеет твердость НВ 600-700 и большую хрупкость. Поскольку при температуре 727°С аустенит превращается в перлит, то это превращение охватывает и аустенит, входящий в состав ледебурита. Вследствие этого при температуре ниже 727°С ледебурит представляет собой уже не смесь аустенита с цементом, а смесь перлита с цементитом. Помимо перечисленных структурных составляющих в железоуглеродистых сплавах могут быть нежелательные неметаллические включения: окислы, нитриды, сульфиды, фосфиды – соединения с кислородом, азотом, серой и фосфором. На их основе могут образовываться новые структурные составляющие, например фосфидная эвтектика (Fe+Fe3P+Fe3C) с температурой плавления 950°С. Она образуется при больших содержаниях фосфора в чугуне. При содержании фосфора около 0,5-0,7% фосфидная эвтектика в виде сплошной сетки выделяется по границам зерен и повышает хрупкость чугуна.
10
Диаграмма состояния железо - цементит. В диаграмме состояния железо – цементит (Fe-Fe3C) рассматриваются процессы кристаллизации железоуглеродистых сплавов (стали и чугуна) и превращения в их структурах при медленном охлаждении от жидкого расплава до комнатной температуры. Диаграмма (рис.18) показывает фазовый состав и структуру сплавов с концентрацией от чистого железа до цементита (6,67% С). Сплавы с содержанием углерода до 2,14% называют сталью, а от 2,14 до 6,67% - чугуном. Диаграмма состояния Fe-Fe3C представлена в упрощенном виде. Первичная кристаллизация, т. е. затвердевание жидкого сплава начинается при температурах, соответствующих линии ликвидуса ACD. Точка А на этой диаграмме соответствует температуре 1539° плавления (затвердевания) железа, точка D – температуре ~1600°С плавления (затвердевания) цементита. Линия солидуса AECF соответствует температурам конца затвердевания. При температурах, соответствующих линии АС, из жидкого сплава кристаллизуется аустенит, а линии CD - цементит, называемый первичным цементитом. В точке С при 1147°С и содержании углерода 4,3% из жидкого сплава одновременно кристаллизуется аустенит и цементит (первичный), образуя эвтектику - ледебурит. При температурах, соответствующих линии солидуса АЕ, сплавы с содержанием углерода до 2,14% окончательно затвердевают с образованием аустенита. На линии солидуса ECF сплавы с содержанием углерода от 2,14 до 6,67% окончательно затвердевают с образованием эвтектики (ледебурита) и структур, образовавшихся ранее из жидкого сплава, а именно: в интервале 2,14-4,3% С - аустенита, а в интервале 4,3-6,67% С - цементита первичного (см. рис. 18). В результате первичной кристаллизации во всех сплавах с содержанием углерода до 2,14%, т. е. в сталях, образуется однофазная структура - аустенит. В сплавах с содержанием углерода более 2,14%, т. е. в чугунах, при первич ной кристаллизации образуется эвтектика ледебурита.
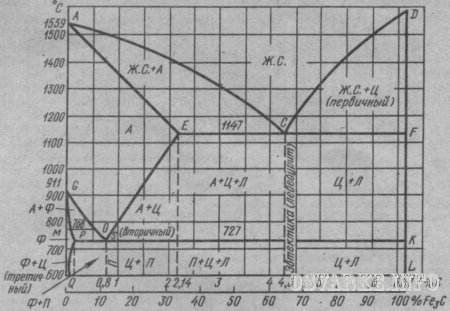 Рис.
18. Диаграмма состояния железо-цементит
(в упрощенном виде):
А – аустенит, П
– перлит, Л – ледебурит, Ф – феррит, Ц
- цементит
Рис.
18. Диаграмма состояния железо-цементит
(в упрощенном виде):
А – аустенит, П
– перлит, Л – ледебурит, Ф – феррит, Ц
- цементит
Вторичная кристаллизация (превращение в твердом состоянии) происходит при температурах, соответствующих линиям GSE, PSK и GPQ. Превращения в твердом состоянии происходят вследствие перехода железа из одной аллотропической модификации в другую (γ в α) и в связи с изменением растворимости углерода в аустените и феррите. С понижением температуры растворимость уменьшается. Избыток углерода выделяется из твердых растворов в виде цементита. В области диаграммы AGSE находится аустенит. При охлаждении сплавов аустенит распадается с выделением феррита при температурах, соответствующих линий GS, и цементита, называемого вторичным, при температурах, соответствующих линии SE. Вторичным называют цементит, выделяющийся из твердого раствора аустенита, в отличие от первичного цементита, выделяющегося из жидкого расплава. В области диаграммы GSP находится смесь феррита и распадающегося аустенита. Ниже линии GP существует только феррит. При дальнейшем охлаждении до температур, соответствующих линии PQ, из феррита выделяется цементит (третичный). Линия PQ показывает, что с понижением температуры растворимость углерода в феррите уменьшается от 0,02% при 727°С до 0,005% при комнатной температуре. В точке S при содержании 0,8% углерода и температуре 727°С весь аустенит распадается и превращается в механическую смесь феррита и цементита - перлит. Сталь, содержащую 0,8% углерода, называют эвтектоидной (рис. 19,6). Стали, содержащие от 0,02 до 0,8% углерода, называют доэвтектоидными (рис. 19, а ) , а от 0,8 до 2,14% углерода - заэвтектоидными (рис. 19, в). При температурах, соответствующих линии PSK, происходит распад аустенита, оставшегося в любом сплаве системы, с образованием перлита, представляющего собой механическую смесь феррита и цементита. Линию PSK называют линией перлитного превращения. При температурах, соответствующих линии SE, аустенит насыщен углеродом, и при понижении температуры из него выделяется избыточный углерод в виде цементита (вторичного). Вертикаль DFKL означает, что цементит имеет неизменный химический состав. Меняется лишь форма и размер его кристаллов, что существенно отражается на свойствах сплавов. Самые крупные кристаллы цементита образуются, когда он выделяется при первичной кристаллизации из жидкости. Белый чугун, содержащий 4,3% углерода, называют эвтектическим (рис. 20). Белые чугуны, содержащие от 2,14 до 4,3% углерода, называют доэвтектическими, а от 4,3 до 6,67% углерода - заэвтектическими. По достижении температуры 727°С (линия PSK) аустенит, обедненный углеродом до эвтектоидного состава (0,8% углерода), превращается в перлит. После окончательного охлаждения доэвтектические белые чугуны состоят из перлита, ледебурита (перлит+цементит) и цементита (вторичного). Чем больше в структуре такого чугуна углерода, тем меньше в нем перлита и больше ледебурита. Белый эвтектический чугун (4,3% углерода) при температурах ниже 727°С состоит только из ледебурита. Белый заэвтектический чугун, содержащий более 4,3% углерода, после окончательного охлаждения состоит из цементита (первичного) и ледебурита. Следует отметить, что при охлаждении ледебурита ниже линии PSK входящий в него аустенит превращается в перлит, т. е. ледебурит при комнатной температуре представляет собой уже смесь цементита и перлита. При этом цементит образует сплошную матрицу, в которой размещены колонии перлита. Такое строение ледебурита является причиной его большой твердости (НВ>600) и хрупкости. Диаграмма состояния железо-цементит имеет большое практическое значение. Ее применяют для определения тепловых режимов термической обработки и горячей обработки давлением (ковка, горячая штамповка, прокатка) железоуглеродистых сплавов. Ее используют также в литейном производстве для определения температуры плавления, чтo необходимо для назначения режима заливки жидкого железоуглеродистого сплава в литейные формы.
 Рис.
19. Микроструктура:
а – доэвтектоидная
сталь – феррит (светлые участки) и перлит
(темные участки) при 500х увеличении, б –
эвтектоидная сталь – перлит (1000х), в –
заэвтектоидная сталь – перлит и цементит
в виде сетки (200х)
Рис.
19. Микроструктура:
а – доэвтектоидная
сталь – феррит (светлые участки) и перлит
(темные участки) при 500х увеличении, б –
эвтектоидная сталь – перлит (1000х), в –
заэвтектоидная сталь – перлит и цементит
в виде сетки (200х)
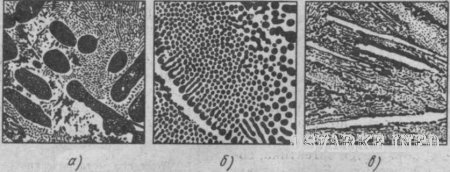 Рис.
20. Микроструктура белого чугуна при
500х увеличении:
а- доэвтектический
чугун – перлит (темные участки) и
ледебурит (цементит вторичный в структуре
не виден), б – эвтектический чугун –
ледебурит (смесь перлита и цементита),
в – заэвтектический чугун – цементит
(светлые пластины) и ледебурит
Рис.
20. Микроструктура белого чугуна при
500х увеличении:
а- доэвтектический
чугун – перлит (темные участки) и
ледебурит (цементит вторичный в структуре
не виден), б – эвтектический чугун –
ледебурит (смесь перлита и цементита),
в – заэвтектический чугун – цементит
(светлые пластины) и ледебурит
11
Примеси в углеродистых сталях и их влияние на свойства стали
Полезные примеси: марганец и кремний
Вредные примеси: сера, фосфор, а также скрытые примеси – газы: кислород, азот водород.
Случайные примеси: медь, хром, никель
Полезные примеси
Марганец и кремний. Их вводят в сталь в процессе выплавки для раскисления (удаления кислорода из жидких металлов для повышения качества стали). Марганец увеличивает прокаливамость стали и уменьшает вредное влияние серы. Кремний эффективно раскисляет сталь и способствует ее упрочнению.
Вредные примеси
Сера, фосфор. Сера снижает пластичность и вязкость стали, а также придает стали красноломкость при прокатке и ковке. Повышенное содержание серы допускается лишь в автоматных сталях для изготовления изделий неответственного назначения, т.к. сера улучшает обрабатываемость стали. Основной источник серы в стали - это исходное сырье, т.е. чугун. Фосфор также снижает пластичность железа, т.к. резко отличается от него по типу кристаллической решетки, диаметру атомов и их строению. Основной источник фосфора в стали – это руда, из которой выплавлен исходный чугун. Кислород, водород, водород, азот. Даже небольшую присутствие этих примесей оказывает резко отрицательное воздействие на свойства стали. Кислород и азот способствуют снижению вязкости и пластичности стали. Повышенное содержание водорода делает сталь хрупкой, а также приводит к образованию внутренних трещин – флокенов. Для выведения скрытых примесей используется метод вакуумирования
Стали являются наиболее распространенными материалами. Обладают хорошими технологическими свойствами. Изделия получают в результате обработки давлением и резанием.
Достоинством является возможность, получать нужный комплекс свойств, изменяя состав и вид обработки. Стали, подразделяют на углеродистые и легированные.
Влияние углерода и примесей на свойства сталей.
Углеродистые стали являются основными. Их свойства определяются количеством углерода и содержанием примесей, которые взаимодействуют с железом и углеродом.
Влияние углерода.
Влияние углерода на свойства сталей показано на рис. 10.1
С ростом содержания углерода в структуре стали увеличивается количество цементита, при одновременном снижении доли феррита. Изменение соотношения между составляющими приводит к уменьшению пластичности, а также к повышению прочности и твердости. Прочность повышается до содержания углерода около 1%, а затем она уменьшается, так как образуется грубая сетка цементита вторичного.
Углерод влияет на вязкие свойства. Увеличение содержания углерода повышает порог хладоломкости и снижает ударную вязкость.
Повышаются электросопротивление и коэрцитивная сила, снижаются магнитная проницаемость и плотность магнитной индукции.
Углерод оказывает влияние и на технологические свойства. Повышение содержания углерода ухудшает литейные свойства стали (используются стали с содержанием углерода до 0,4 %), обрабатываемость давлением и резанием, свариваемость. Следует учитывать, что стали с низким содержанием углерода также плохо обрабатываются резанием.
В сталях всегда присутствуют примеси, которые делятся на четыре группы. 1.Постоянные примеси: кремний, марганец, сера, фосфор.
Марганец и кремний вводятся в процессе выплавки стали для раскисления, они являются технологическими примесями.
Содержание марганца не превышает 0,5…0,8 %. Марганец повышает прочность, не снижая пластичности, и резко снижает красноломкость стали, вызванную влиянием серы. Он способствует уменьшению содержания сульфида железа FeS, так как образует с серой соединение сульфид марганца MnS. Частицы сульфида марганца располагаются в виде отдельных включений, которые деформируются и оказываются вытянутыми вдоль направления прокатки.
Содержание кремния не превышает 0,35…0,4
%. Кремний, дегазируя металл, повышает
плотность слитка. Кремний растворяется
в феррите и повышает прочность стали,
особенно повышается предел текучести, ![]() .
Но наблюдается некоторое снижение
пластичности, что снижает способность
стали к вытяжке
.
Но наблюдается некоторое снижение
пластичности, что снижает способность
стали к вытяжке
Содержание фосфора в стали 0,025…0,045
%. Фосфор, растворяясь в феррите,
искажает кристаллическую решетку и
увеличивает предел прочности ![]() и
предел текучести
и
предел текучести ![]() ,
но снижает пластичность и вязкость.
,
но снижает пластичность и вязкость.
Располагаясь вблизи зерен, увеличивает температуру перехода в хрупкое состояние, вызывает хладоломкость, уменьшает работу распространения трещин, Повышение содержания фосфора на каждую 0,01 % повышает порог хладоломкости на 20…25oС.
Фосфор обладает склонностью к ликвации, поэтому в центре слитка отдельные участки имеют резко пониженную вязкость.
Для некоторых сталей возможно увеличение содержания фосфора до 0,10…0,15 %, для улучшения обрабатываемости резанием.
S – уменьшается пластичность, свариваемость и коррозионная стойкость. Р–искажает кристаллическую решетку.
Содержание серы в сталях составляет 0,025…0,06 %. Сера – вредная примесь, попадает в сталь из чугуна. При взаимодействии с железом образует химическое соединение – сульфид серы FeS, которое, в свою очередь, образует с железом легкоплавкую эвтектику с температурой плавления 988oС. При нагреве под прокатку или ковку эвтектика плавится, нарушаются связи между зернами. При деформации в местах расположения эвтектики возникают надрывы и трещины, заготовка разрушается – явление красноломкости.
Красноломкость – повышение хрупкости при высоких температурах
Сера снижает механические свойства,
особенно ударную вязкость а![]() и
пластичность (
и
пластичность (![]() и
и ![]() ),
а так же предел выносливости. Она ухудшают
свариваемость и коррозионную стойкость.
),
а так же предел выносливости. Она ухудшают
свариваемость и коррозионную стойкость.
2. Скрытые примеси - газы (азот, кислород, водород) – попадают в сталь при выплавке.
Азот и кислород находятся в стали в виде хрупких неметаллических включений: окислов (FeO, SiO2, Al2O3 ) нитридов (Fe 2N), в виде твердого раствора или в свободном состоянии, располагаясь в дефектах (раковинах, трещинах).
Примеси внедрения (азот N, кислород О) повышают порог хладоломкости и снижают сопротивление хрупкому разрушению. Неметаллические включения (окислы, нитриды), являясь концентраторами напряжений, могут значительно понизить предел выносливости и вязкость.
Очень вредным является растворенный в стали водород, который значительно охрупчивает сталь. Он приводит к образованию в катанных заготовках и поковкахфлокенов.
Флокены – тонкие трещины овальной или округлой формы, имеющие в изломе вид пятен – хлопьев серебристого цвета.
Металл с флокенами нельзя использовать в промышленности, при сварке образуются холодные трещины в наплавленном и основном металле.
Если водород находится в поверхностном
слое, то он удаляется в результате
нагрева при 150…180![]() ,
лучше в вакууме
,
лучше в вакууме ![]() мм
рт. ст.
мм
рт. ст.
Для удаления скрытых примесей используют вакуумирование.
3. Специальные примеси – специально вводятся в сталь для получения заданных свойств. Примеси называются легирующими элементами, а стали - легированные сталями.
12
