
- •Элементы кристаллографии.
- •Кристаллические системы элементов
- •Дефекты кристаллов.
- •Механическая смесь
- •Твердый раствор
- •Химическое соединение.
- •Правило отрезков
- •Диаграммы плавкости
- •Диаграмма равновесия жидкость-пар
- •Тройные системы.
- •Влияние легирующих элементов
- •Классификация сталей
- •Маркировка сталей.
- •Углеродистые стали обыкновенного качества (гост 380).
- •Качественные углеродистые стали.
- •Качественные и высококачественные легированные стали.
- •Легированные конструкционные стали.
- •Основные превращения в сталях при термообработке
- •Влияние легирующих элементов на превращения в стали
- •Основные виды термической обработки стали.
- •Сплавы на медной основе - бронзы, латуни.
- •Алюминий и сплавы на его основе: дуралюмин, силумин
- •Белый чугун
- •Серый чугун
- •Ковкий чугун
- •Высокопрочный чугун
- •Цементуемые и улучшаемые стали Цементуемые стали.
- •Стали строительные.
- •Углеродистые стали.
- •Пружинные стали.
- •Инструментальные стали пониженной прокаливаемости
- •Инструментальные стали пониженной прокаливаемости
- •Классификация электротехнических материалов Для чего необходимо знать свойства различных электротехнических материалов
- •По каким основным признакам классифицируют электротехнические материалы
- •29.Виды химической связи
- •Неэргетическая зона
- •§ 240.Понятие о зонной теории твердых тел
- •Зависимость сопротивления проводника от температуры
- •Электрические свойства металлических сплавов
- •Материалы высокой проводимости
- •1. Абсорбционные токи
- •Резиновые материалы
- •Состав, классификация и свойства пластмасс
- •Классификация волочения по термическим условиям деформации
- •Способы волочения со сниженным коэффициентом трения
- •Изделия, получаемые волочением проволоки
- •Прессование металлов
- •Свободная ковка
- •Холодная объёмная штамповка
- •Оборудование для листовой штамповки
1
Кристаллическое строение вещества
Вещества в твердом состоянии могут быть аморфные и кристаллические. Особенностью кристаллического строения является наличие пространственной периодичности расположения частиц. В зависимости от типа химической связи атомов частицами являются либо атомы, либо ионы, либо молекулы. Для аморфных тел, также как и для жидких и газообразных веществ, дальний порядок в расположении атомов отсутствует. Частицы в кристаллах совершают периодическое движение относительно их равновесного состояния, а для тел, находящихся в жидком и особенно в газообразном состояниях, наблюдается хаотичное движение частиц.
Свойства упругости, пластичности и деформационного упрочнения характерны для кристаллических тел
Механические и физические свойства кристаллических веществ зависят от типа химической связи атомов и типа кристаллической структуры. Различают ионные кристаллы, для которых характерна ионная связь, обусловленная переходом электронов от одного атома к другому с образованием положительных и отрицательных ионов. Такая связь характерна для солей и оксидов. Ионные кристаллы имеют малую теплопроводность, которая возрастает при нагреве. Для ковалентных кристаллов характерна связь, возникающая в случае, когда электроны, находящиеся на внешней оболочке, принадлежат двум соседним атомам. Сила притяжения атомов по сравнению с ионными кристаллами уменьшается, но она достаточная для прочного фиксирования взаимного расположения атомов. Такая связь характерна для алмаза, кремния, германия и др. Ковалентные кристаллы имеют электронную проводимость, однако электропроводность низкая. Они обладают высокой твердостью и температурой плавления, но малой пластичностью. Даже малые деформации приводят к нарушению межатомных связей и разрушению (например, сурьма, висмут и др.)
В узлах кристаллической решетки молекулярных кристаллов находятся молекулы с прочной атомной связью. Связь между молекулами осуществляется за счет смещения центров электрических зарядов в молекулах, но кулоново притяжение частиц значительно слабее, чем в ковалентных и, особенно ионных кристаллах. Молекулярные кристаллы образуются у водорода и инертных газов при затвердевании при низких температурах. Молекулярные кристаллы имеют низкую температуру плавления и легко переходят из твердого состояния в газообразное, то есть сублимируются.
Свойства кристаллов зависят:
От электронного строения атомов.
Характера взаимодействия их в кристалле.
От пространственного расположения элементарных частиц.
Химического состава.
Размера и формы кристаллов.
В зависимости от размеров структурных составляющих и применяемых методов их выявления используют следующие понятия:
Тонкая структура.
Микроструктура.
Макроструктура.
Тонкая структура описывает расположение элементарных частиц в кристалле и электронов в атоме. Изучается дифракционными методами (рентгенография, элетронография, нейтронография). Анализируя дифракционную картину, получаемую при взаимодействии атомов кристалла с короткими волнами рентгеновских лучей можно получить обширную информацию о строении кристаллов. Такую мелкокристаллическую структуру наблюдают с помощью электронного микроскопа.
Микроструктура. Микроскопические методы дают возможность определить (объект изучения - шлиф, оборудование – микроскоп. Увеличение до 1400):
Размер и форму кристаллов.
Наличие различных по своей природе кристаллов.
Их распределение и относительные объёмные количества.
Форму инородных включений.
Микропустоты.
Ориентирования кристаллов.
Макроструктура. Макроанализ предусматривает изучения строения кристаллов невооружённым глазом или при небольших увеличениях с помощью лупы. Этот метод даёт возможность выявить:
Характер излома.
Усадочные раковины, поры.
Размер и форму крупных кристаллов
Трещины.
Химическую неоднородность (ликвацию).
Исследование макроструктуры, несмотря на свою простоту, является очень ценным методом изучения материалов.
Элементы кристаллографии.
Кристаллическая решётка. В кристалле элементарные частицы (ионы, атомы, молекулы), из которых построен кристалл, сближены до соприкосновения и располагаются различно, но закономерно по разным направлениям. Наименьший параллелепипед, в котором в узлах находятся элементарные частицы, называют элементарной ячейкой. Последовательное перемещение его образует пространственную кристаллическую решётку.
Для описания элементарной ячейки кристаллической решётки используют шесть величин: три отрезка – период решётки a, b, c, три угла между этими отрезками
α, β, γ. Соотношения между этими величинами определяют форму ячейки. По форме элементарных ячеек все кристаллы подразделяют на семь систем.
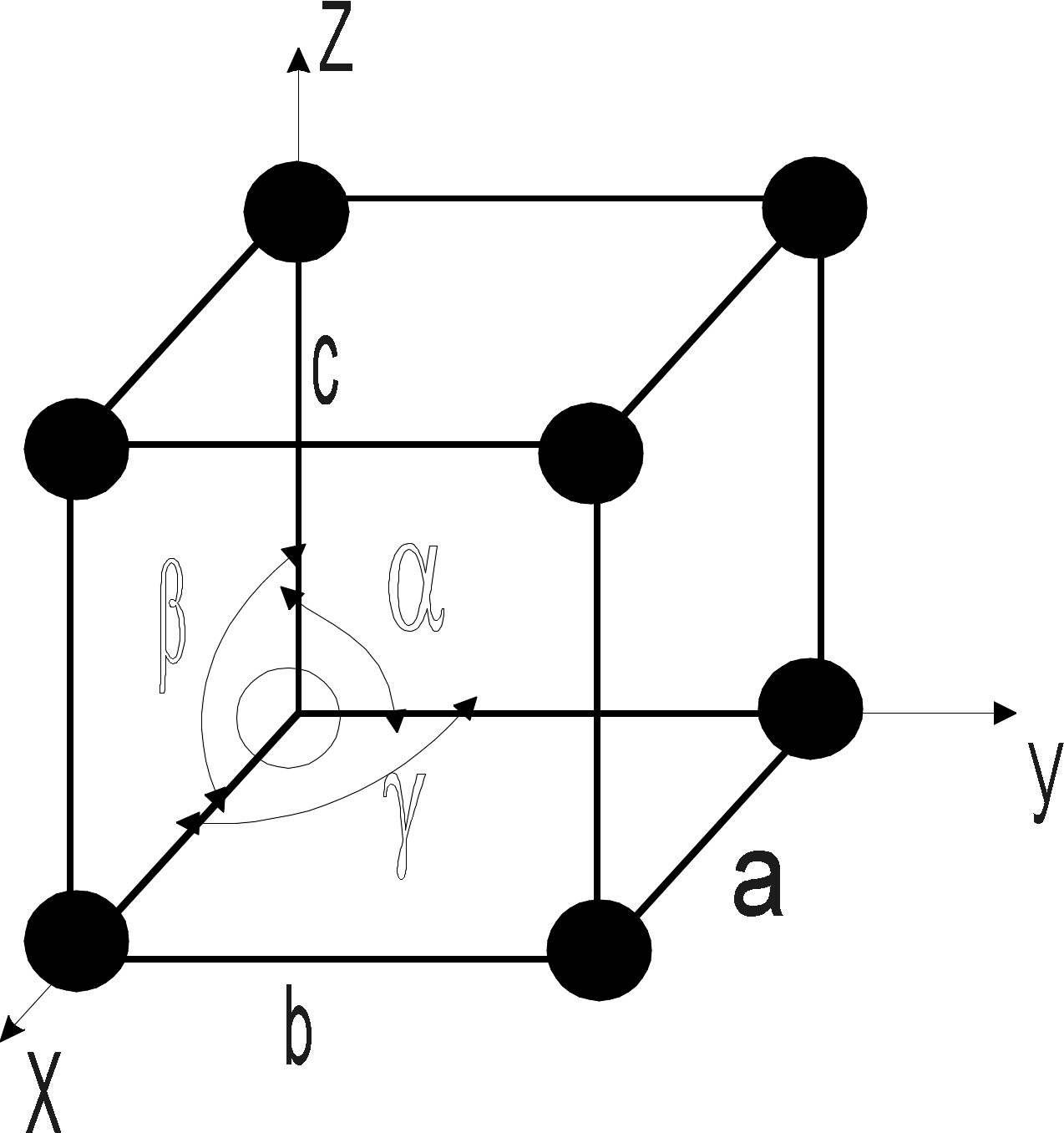
Кристаллические системы элементов
Система |
Период (рёбра) |
Углы |
Триклинная |
a ≠ b ≠ c |
α ≠ β ≠ γ |
Моноклинная |
a ≠ b ≠ c |
α = β = 90о γ ≠ 90о |
Ромбическая |
a ≠ b ≠ c |
α = β = γ =90о |
Ромбоэдрическая |
a = b = c |
α = β = γ ≠ 90о |
Гексагональная |
a = b ≠ c |
α = β = 90о γ = 120о |
Тетрагональная |
a = b ≠ c |
α = β = γ =90о |
Кубическая |
a = b = c |
α = β = γ =90о |
В большинстве случаев решётки сложны, так как элементарные частицы находятся не только в узлах кристаллической решётки, но и на её гранях или в центре решётки.
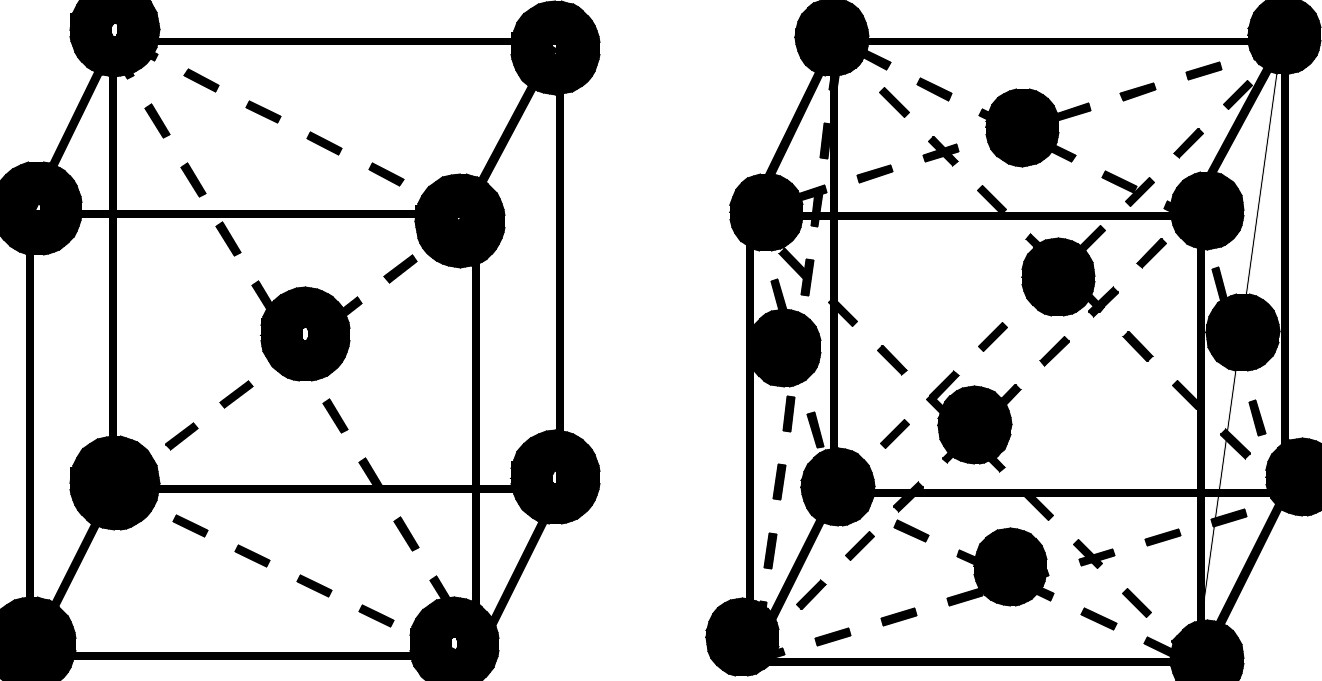
О степени сложности судят по числу частиц, приходящихся на одну элементарную ячейку. В простой пространственной решётке всегда на одну ячейку приходится одна частица. На ОЦК ячейку – две частицы. На ГЦК ячейку – четыре частицы.
Система, период, число частиц, приходящихся на элементарную ячейку, полностью определяют расположение элементарных частиц в кристалле.
Дополнительные характеристики: координационное число и коэффициент компактности.
Координационное число – число ближайших и равноудалённых элементарных частиц. (К). Для ОЦК – К8. Для ГЦК – К12. Для простой кубической решётки – К6.
Коэффициент компактности – отношение объёма всех элементарных частиц, приходящихся на одну элементарную ячейку, ко всему объёму элементарной ячейки.
Для простой кубической решётки – 0,52. Для ОЦК – 0,68. Для ГЦК – 0,74.
Оставшееся пространство образуют поры, которые дифференцируют на октаэдрические (восьмигранник) и тетраэдрические (четырёхгранник).
Кристаллографические индексы.
По параллельным направлениям свойства одинаковы, поэтому достаточно указать для всего семейства параллельных прямых одно направление, проходящее через начало координат (узел кристаллической решётки). Координаты этого узла выражают целыми числами u, v, w в единицах отрезков a, b, c, заключают в квадратные скобки [u, v, w ] и называют индексами направлений. Их всегда выражают целыми числами, а отрицательное значение обозначается знаком минусом над индексом.
Положение плоскости в пространстве определяется отрезками, отсекаемыми плоскостью по осям x, y, z. Эти отрезки выражают целыми числами m, n, p в единицах отрезков a, b, c. Принято за индексы плоскостей брать обратные отрезки:
h = 1/m; k = 1/n; l = 1/p. Три этих числа (h, k, l) заключённые в круглые скобки, называют индексами плоскостей. Если плоскость отсекает по осям отрицательные отрезки, то это отмечается знаком минус над соответствующим индексом.
Анизотропия. (греч. anisos неравный + tropos свойства)
Это зависимость свойств кристалла от направления, возникающая в результате упорядоченного расположения атомов (ионов, молекул) в пространстве. В кристалле расстояния между атомами в различных кристаллографических направлениях различны, а поэтому различны и свойства. Прочность и пластичность монокристалла изменяется в зависимости от направления. В природных условиях кристаллические тела – поликристаллы, т.е. состоят из множества мелких различно ориентированных кристаллов. В связи с этим поликристаллические тела считают мнимоизотропными. В процессе обработки давлением поликристалла кристаллографические плоскости одного индекса в различных зёрнах могут ориентироваться параллельно. Такие поликристаллы называют текстурованными, и они, подобно монокристаллам, анизотропны.
2
