
- •Белки. Обмен белков и аминокислот.
- •2. Первичная структура белка. Наследственные протеинопатии: серповидно-клеточная анемия.
- •3. Вторичная структура белка. Основные типы связей, характерные для вторичной структуры белка.
- •4. Третичная структура белка. Связи, стабилизирующие третичную структуру белка.
- •5. Четвертичная структура белка. Зависимость биологической активности белков от четвертичной структуры.
- •6. Образование и обезвреживание аммиака в организме.
- •7. Заменимые и незаменимые аминокислоты. Биосинтез заменимых аминокислот с использованием глюкозы.
- •8. Декарбоксилирование аминокислот. Образование физиологически активных аминов.
- •9. Генетические дефекты метаболизма фенилаланина и тирозина.
- •10.Переваривание белков в желудке. Пепсин, его строение и функция в процессе переваривания белка.
- •11. Синтез мочевины(схема). Гипераммонемия.
- •Коферментные функции витаминов рр и в2
- •Фад. Зависимые дегидрогеназы: сукцинатдегидрогеназы
- •Вопрос 3
- •Метаболизм углеводов
- •Переваривание и всасывание углеводов в желудочно-кишечном тракте
- •Анаэробный распад глюкозы
- •3. Аэробный метаболизм пирувата. Окислительное декарбоксилирование пировиноградной кислоты. Механизм действия пируватдегидрогеназного комплекса.
- •Биомембраны и биоэнергетика
- •Состав и строение биологических мембран. Основные функции биомембран.
- •Цикл трикарбоновых кислот: схема и биологическое значение этого процесса
- •Биологическая ценность цтк
- •Матричные биосинтезы.
- •2. Первичная и вторичная структура днк.
- •3. Строение рибосомы. Механизм синтеза полипептидных цепей на рибосомах.
8. Декарбоксилирование аминокислот. Образование физиологически активных аминов.
Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования. Продукты образующиеся в результате декарбоксилирования аминокислот называются биогенными аминами, которые оказывают сильное фармакологическое действие на множество физиологических функций человека. Есть 4 вида декарбоксилирование аминокислот в организме.
1. α-Декарбоксилирование:
R – СH(NH2) – COOH R – CH2 – NH2 + CO2
2.

H OOC – CH2 – CH(NH2) – COOH CH3 – CH(NH2) – COOH + CO2
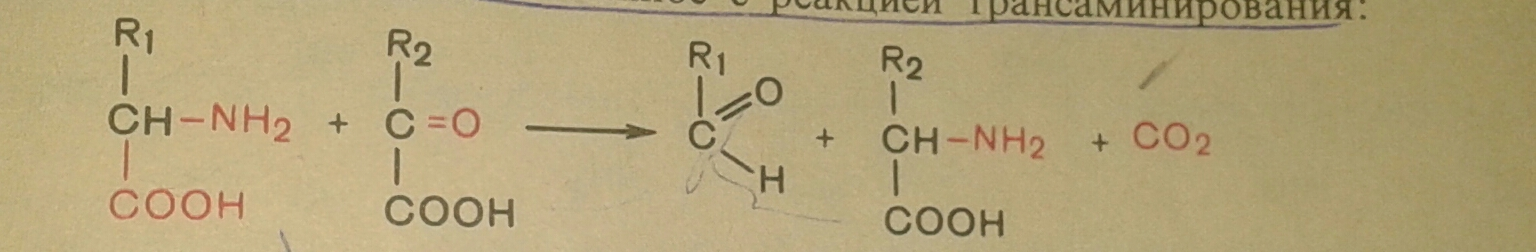
3. Декарбоксилирование, связанное с реакцией трансминирования:
4. Декарбоксилирование, связанное с реакцией конденсации двух молекул:
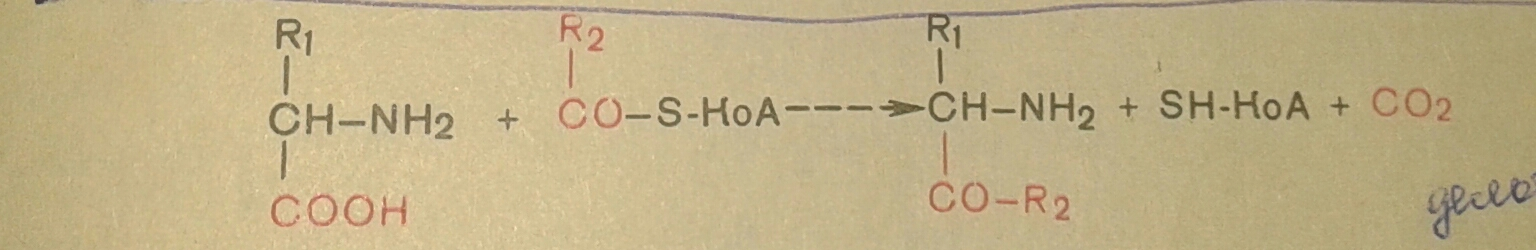
Реакция декарбоксилирования в отличии от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот. Одним из хорошо изученных ферментов я вляется декарбоксилаза ароматических аминокислот, которая катализируют декарбоксилирование L – изомеров триптофана, 5 – окситриптофана и 3,4 – диоксифенилаланина (ДОФА):
В животных тканях с высокой скоростью протекает декарбоксилирование гистидина:
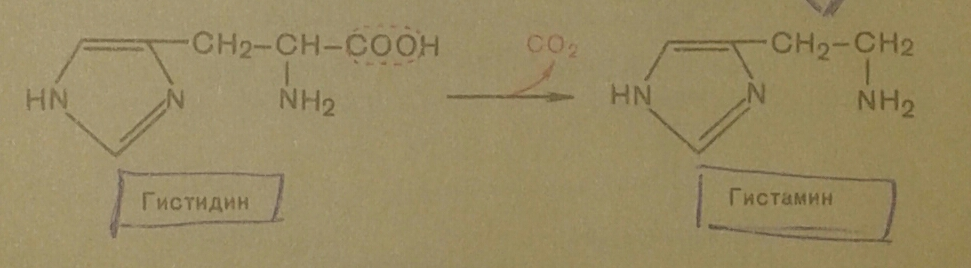
Гистамин обладает широким спектром биологического действия. По сосудорасширяющему действию на кровеносные сосуды он резко отличается от других биогенных аминов, оказывающих сосудосуживающее действие. Вызывая расширение сосудов в области воспаления, гистамин тем самым ускоряет приток лейкоцитов. Гистамин участвует в секреции соляной кислоты, кроме того ему приписывают роль медиатора боли.
9. Генетические дефекты метаболизма фенилаланина и тирозина.
Фенилкетонурия развивается как результат потери способности организма синтезировать фенилаланин-4-монооксигеназу, катализирующая превращение фенилаланина в тирозин. Характерной особенностью болезни является резкое замедление умственного развития ребенка, экстракция с мочой больших количеств фенилпировинаградной кислоты и фенилацетилглутамина, а также накопления в тканях фенилаланина.
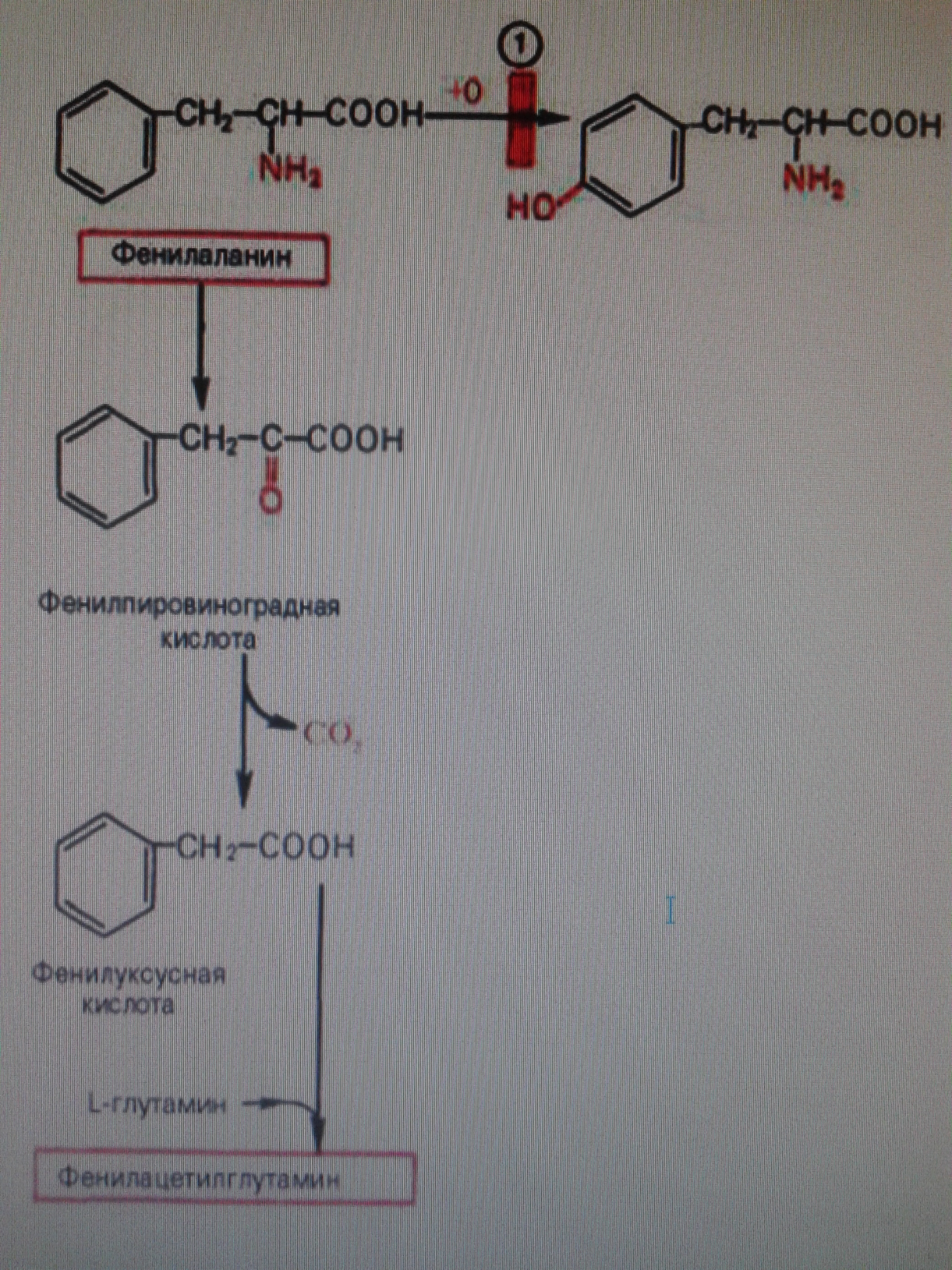
Развитие болезни можно предотвратить, если значительно снизить или исключить прием фенилаланина с пищей с самого рождения.
Альбинизм характеризуется врожденным отсутствием пигментов в коже, волосах и сетчатке. Метаболический дефект связан с потерей меланоцитами способности синтезировать тирозиназу – фермент, катализирующий окисление тирозина в диоксифенилаланин и диоксифенилаланинхинон, являющихся предшественниками меланина.
10.Переваривание белков в желудке. Пепсин, его строение и функция в процессе переваривания белка.
В желудке имеются все условия для переваривания белков. Во-первых в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке свободной соляной кислоты для действия пепсина создается оптимальная среда. Соляная кислота переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина, в присутствии соляной кислоты происходит набухание белков, происходит частичная денатурация, кроме того она ускоряет всасывание железа и оказывает бактерицидное действие. Пепсин вырабатывается в клетках слизистой оболочки желудка в неактивной форме – в виде пепсиногена, активатором которого является соляная кислота. Пепсин гидролизует преимущественно пептидные связи, образованные аминогруппами ароматических аминокислот. Он расщепляет практически все природные белки. Наибольший гидролитический эффект пепсин оказывает на денатурированные белки.
