
- •Белки. Обмен белков и аминокислот.
- •2. Первичная структура белка. Наследственные протеинопатии: серповидно-клеточная анемия.
- •3. Вторичная структура белка. Основные типы связей, характерные для вторичной структуры белка.
- •4. Третичная структура белка. Связи, стабилизирующие третичную структуру белка.
- •5. Четвертичная структура белка. Зависимость биологической активности белков от четвертичной структуры.
- •6. Образование и обезвреживание аммиака в организме.
- •7. Заменимые и незаменимые аминокислоты. Биосинтез заменимых аминокислот с использованием глюкозы.
- •8. Декарбоксилирование аминокислот. Образование физиологически активных аминов.
- •9. Генетические дефекты метаболизма фенилаланина и тирозина.
- •10.Переваривание белков в желудке. Пепсин, его строение и функция в процессе переваривания белка.
- •11. Синтез мочевины(схема). Гипераммонемия.
- •Коферментные функции витаминов рр и в2
- •Фад. Зависимые дегидрогеназы: сукцинатдегидрогеназы
- •Вопрос 3
- •Метаболизм углеводов
- •Переваривание и всасывание углеводов в желудочно-кишечном тракте
- •Анаэробный распад глюкозы
- •3. Аэробный метаболизм пирувата. Окислительное декарбоксилирование пировиноградной кислоты. Механизм действия пируватдегидрогеназного комплекса.
- •Биомембраны и биоэнергетика
- •Состав и строение биологических мембран. Основные функции биомембран.
- •Цикл трикарбоновых кислот: схема и биологическое значение этого процесса
- •Биологическая ценность цтк
- •Матричные биосинтезы.
- •2. Первичная и вторичная структура днк.
- •3. Строение рибосомы. Механизм синтеза полипептидных цепей на рибосомах.
Белки. Обмен белков и аминокислот.
1. Строение, физико-химические свойства белков и их функции. Классификация аминокислот, входящих в состав белка.
Белки – это высокомолекулярные азотосодержащие органические вещества, молекулы которых построены из остатков аминокислот. Характерными физико–химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое и высокое онкотическое давление, способность к поглащению УФ-лучей. Белки, как и аминокислоты, обладают свойствами кислот и оснований благодаря наличию –NH2 и –СООН групп. Функции белков:
1. Питательная и резервная.
2. Каталитическая.
3. Транспортная.
4. Защитная.
5. Сократительная.
6. Гормональная.
7. Структурная.
Аминокислоты – это структурные элементы белка. Они связаны между собой с помощью пептидных связей (-CONH). Аминокислоты классифицируют на основе химического строения радикалов. Различают ароматические и алифатические аминокислоты, содержащие серу или гидроксильные группы. Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой. Она включает 4 класса аминокислот: 1) гидрофобные; 2) гидрофильные незаряженные; 3)отрицательно заряженные; 4) положительно заряженные.
2. Первичная структура белка. Наследственные протеинопатии: серповидно-клеточная анемия.
Под первичной структурой белков подразумевается порядок, последовательность расположения аминокислотных остатков в полипептидной цепи.
Н2N – CH – CONH – CH – CONH – CH – CONH – CH – COOH

 CH2
CH3
CH CH2
CH2
CH3
CH CH2

 OH
Ala CH3
CH3
OH
Ala CH3
CH3
Ser Val
Phe
Известно одно из заболеваний крови серповидно-клеточной анемии. При этом заболевании эритроциты отдавая кислород тканям принимают форму серпа. Исследования аномального гемоглобина обнаружило, что одна аминокислота (Gln-несет заряд), стоящая по счету 6, заменена на Val (нейтральный). В результате этого они слипаются и принимают форму серпа. Такие эритроциты обладают пониженной стойкостью и пониженной кислород-транспортирующей способностью, поэтому у больных серповидно-клеточной анемией повышено разрушение эритроцитов в селезенке, укорочен срок их жизни, повышен гемолиз и часто имеются признаки хронической гипоксии.
3. Вторичная структура белка. Основные типы связей, характерные для вторичной структуры белка.
Вторичная структура белка – вентообразное расположение аминокислотных остатков на предполагаемой цилиндрической оси. Фиксируется α-спираль водородными связями. Закручивание полипептидной цепи происходит по часовой стрелке. Движущей силой в возникновении α-спирали является способность аминокислот к образованию водородных связей. На каждый виток приходится 3,6 аминокислотных остатка. Шаг спирали равен 0,54 нм на виток. Угол подъема спирали равен 26˚. Водородная связь включает не только электростатические силы притяжения между полярными группами, но и электронные связи такого же типа, как в ряде комплексных соединений. В белковой молекуле наиболее важные водородные связи образуются между ковалентно связанным атомом водорода, несущим частичный положительный заряд, и отрицательно заряженным ковалентно связанным атомом кислорода. Виды водородных связей белке:
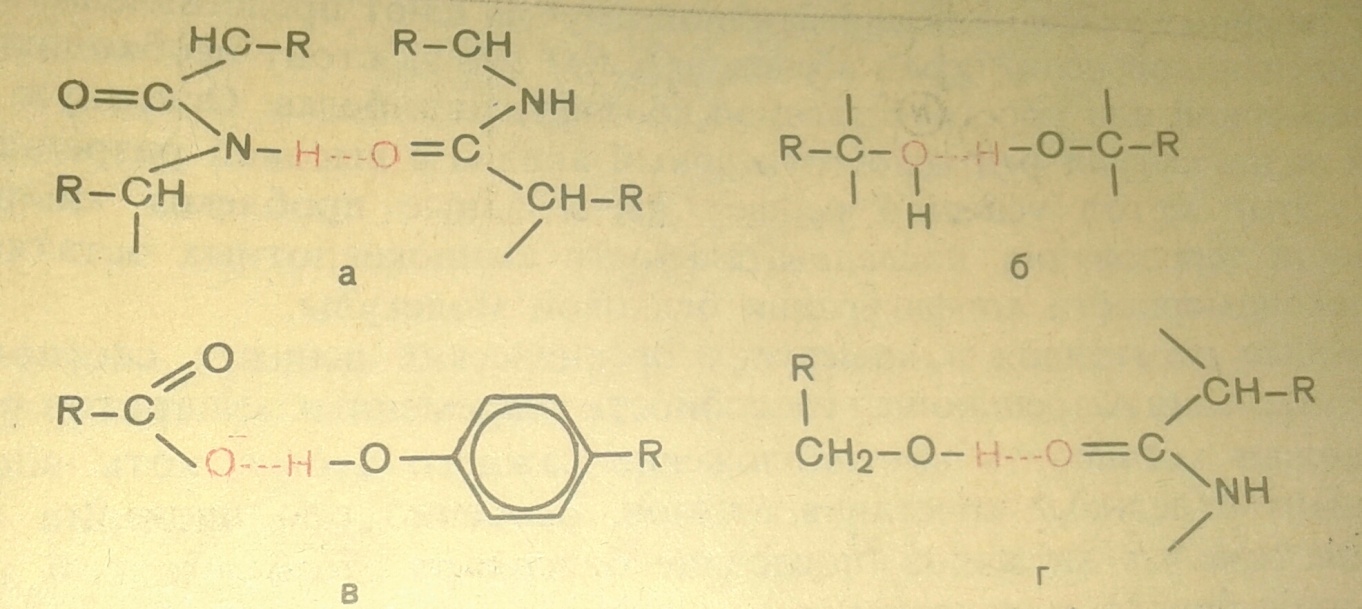
а) пептидными цепями; б) двумя гидроксильными группами; в) ионизированной СООН-группой и ОН-группой тирозина; г) ОН-группой серина и пептидной связью.
Другой тип конфигурации полипептидных цепей получил название ß-структуры. В этом случае два или более линейные полипептидные цепи, расположенные параллельно, прочно связываются водородными связями, образуя структуру типа складчатого слоя.
