
- •Вопрос № 1 Система си
- •Вопрос № 2. Плотность вещества.
- •Зависимость координаты тела от времени при равномерном прямолинейном движении.
- •Вопрос №4
- •Вопрос №5 Движение по окружности. Период. Частота. Угловая скорость. Линейная скорость. Центростремительное ускорение. Связь между линейной и угловой скоростями.
- •Закон всемирного тяготения. Сила тяжести. Вес.
- •Закон всемирного тяготения (1687г.)
- •Первая космическая скорость.
- •Вопрос №8 Силы в механике
- •Вопрос №9 Импульс тела. Закон сохранения импульса.
- •Вопрос №10 Работа силы. Мощность.
- •Потенциальные силы: гравитационные, упругости.
- •Абсолютно не упругий удар.
- •Вопрос №11 Энергия. Закон сохранения энергии
- •Вопрос №12 Основные положения м.К.Т. И их опытное обоснование.
- •Вопрос № 13 Броуновское движение.
- •Вопрос № 14 Характеристика газообразного состояния вещества.
- •Вопрос № 15 Измерение скорости движения молекул газа. Опыт Штерна(вывод формулы).
- •Вопрос № 16 Размеры и массы молекул и атомов. Постоянная Авогадро и постоянная Лошмидта.
- •Вопрос № 19
- •Вопрос № 20 Абсолютный нуль. Термодинамическая шкала температур. Абсолютная температура.
- •Вопрос №26 Внутренняя энергия идеального газа.
- •Вопрос №27 Работа газа при изменении его объема. Физический смысл молярной газовой постоянной.
- •Вопрос №28 Закон сохранения и превращения внутренней энергии в механических и тепловых процессах. I-ое начало термодинамики.
- •Вопрос №29 Применение I-го начала термодинамики к изопроцессам в идеальном газе.
- •Вопрос №30 Адиабатный процесс
- •Вопрос №32 Пары, насыщающие и не насыщающие пространство и их свойства
- •Вопрос №33 Процесс кипения жидкости. Зависимость температуры кипения жидкости от внешнего давления.
- •Вопрос №34 Подсчет теплоты, выделяемой при сжигании топлива. К.П.Д. Нагревателя
- •Вопрос №35 Понятие о влажности воздуха. Абсолютная и относительная влажность воздуха
- •Вопрос №36 Приборы для определения влажности воздуха
- •Вопрос №37 Характеристика жидкого состояния вещества
- •Вопрос №38 Поверхностный слой жидкости. Энергия поверхностного слоя жидкости. Поверхностное натяжение
- •Вопрос №39 Смачивание. Краевой угол. Капиллярность. Давление, создаваемое.Искривленной поверхностью жидкости. Капиллярные явления в быту, природе, технике
- •Капиллярные явления в быту, природе, технике
- •Вопрос №40 Характеристика твердого состояния вещества. Кристаллы. Анизотропия кристаллов. Пространственная решетка
- •Вопрос № 41 Виды кристаллических структур.
- •Вопрос №42 Виды деформаций. Привести примеры
- •Вопрос №43 Механическое напряжение. Упругость, пластичность, вязкость, хрупкость, твердость. Способы определения твердости тела
- •Вопрос №44. Закон Гука. Модуль упругости
- •Вопрос №45 Энергия упруго-деформированного тела
- •Вопрос №46 Линейное расширение твердых тел при нагревании
- •Вопрос № 47 Объемное расширение тел при нагревании
- •Вопрос №48 Зависимость плотности вещества от температуры
- •Вопрос №49 Значение теплового расширения тел в природе и технике
- •Вопрос №50 Электризация тел. Закон сохранения зарядов
- •Вопрос №51 Опыты Резерфорда. Ядерная модель строения атома
- •Вопрос №52 Силы взаимодействия электрических зарядов. Закон Кулона
- •Вопрос №53 Диэлектрическая проницаемость среды. Международная система единиц си в электричестве. Электрическая постоянная
- •Вопрос №54 Электрическое поле как особый вид материи
- •Вопрос №55 Напряженность электрического поля
- •Вопрос №56 Линии напряженности электрического поля. Однородное поле. Поверхностная плотность заряда
- •Вопрос №57 Работа электрического поля при перемещении заряда. Потенциальная энергия заряда
- •Вопрос №58 Потенциал. Разность потенциалов и напряжение. Эквипотенциальные поверхности
- •Вопрос №59 с вязь между напряженностью поля и напряжением
- •Вопрос №60 Электроемкость проводника. Единица измерения
- •Вопрос №61 Конденсаторы. Последовательное соединение конденсаторов в батарею
- •Вопрос №62 Параллельное соединение конденсаторов в батарею. Энергия заряженного конденсатора.
- •Вопрос №63 Сила тока и плотность тока в проводнике
- •Вопрос №64 Электродвижущая сила источника электрической энергии
- •Вопрос №65 Закон Ома для участка цепи без э.Д.С. Сопротивление проводника
- •Вопрос №66 Зависимость сопротивления от материала. Длины и площади поперечного сечения проводника
- •Вопрос №67 Зависимость сопротивления от температуры. Сверхпроводимость
- •Вопрос №68 Последовательное и параллельное соединение потребителей энергии тока
- •В опрос № 69 Закон Ома для всей цепи (вывод)
- •В опрос №70 Соединение одинаковых источников электрической энергии в батарею
- •Вопрос №71 Работа и мощность электрического тока
- •В опрос №72 Тепловое действие электрического тока. Закон Джоуля-Ленца
- •Вопрос №73 Сравнение свойств проводников, диэлектриков и полупроводников
- •Вопрос №74 Чистые и примесные полупроводники
- •Вопрос №75 Электронно-дырочный переход. Полупроводниковый диод
- •Вопрос №76 Взаимодействие токов. Магнитное поле как особый вид материи
- •Вопрос №77 Линии магнитной индукции. Понятие о вихревом поле
- •Вопрос №78 Магнитное поле прямолинейного тока, кругового тока и соленоида
- •Вопрос №79 Сила взаимодействия параллельных токов. Магнитная проницаемость среды. Определение Ампера. Магнитная постоянная
- •Вопрос №80 Сила Ампера. Силовая характеристика магнитного поля
- •Вопрос №81 Работа при перемещении проводника с током в магнитном поле. Магнитный поток
- •Вопрос №82 Индукция магнитного поля, создаваемая в веществе проводниками с током различной формы
- •Вопрос №83 Напряженность магнитного поля и ее связь с индукцией и магнитной проницаемостью среды
- •Вопрос №84 Сила Лоренца. Движение заряда в магнитном поле
- •Вопрос №85 Потокосцепление и индуктивность (задача)
- •Вопрос №86 Явление электромагнитной индукции. Опыт Фарадея
- •Вопрос №87 э.Д.С. Индукции, возникающая в прямолинейном проводнике при его движении в магнитном поле. Правило правой руки
- •Вопрос №88 Закон Ленца для электромагнитной индукции. Величина э.Д.С. Индукции
- •Вопрос №89 Явление самоиндукции. Э.Д.С. Самоиндукции
- •В опрос №90 Энергия магнитного поля (задача)
- •Вопрос №91 Длина волны. Скорость распространения волн (задача)
- •Вопрос №92 Преобразование переменного тока. Трансформатор. Получение, передача электрической энергии на расстоянии
- •Вопрос №93 Превращение энергии в закрытом колебательном контуре. Частота собственных колебаний. Затухающие электромагнитные колебания
- •Вопрос №94 Электрический резонанс
- •Вопрос №95 Электромагнитное поле. Постулаты Максвелла
- •Вопрос №96 Открытый колебательный контур
- •Вопрос №97 Электромагнитные волны и их свойства. Скорость и распространения. Опыт Герца
- •Вопрос №98 Природа света. Скорость распространения света
- •Вопрос №99 Отражение света. Законы отражения
- •Вопрос №100 Преломление света. Законы преломления
- •Вопрос №101 Полное отражение света. Предельный угол
- •Вопрос №102 Прохождение света через пластинку с параллельными гранями и через трехгранную призму
- •Вопрос №103 Интерференция и дифракция света (Волновые свойства света)
- •Вопрос №104 Дисперсия света. Цвета тел
- •Вопрос №105 Виды спектров. Спектры поглощения газов. Приборы для получения и исследования спектров
- •Вопрос №106 Спектральный анализ и его применение в технике и науке
- •Вопрос №107 Рентгеновские лучи, их практическое применение
- •Вопрос №108 Шкала электромагнитных волн
- •Вопрос №109 Внешний фотоэлектрический эффект
- •Вопрос №110 Законы фотоэффекта. Объяснение законов фотоэффектов на основе квантовой теории
- •Вопрос №111 Фотоэлементы с внешним фотоэффектом. Их применение
- •Вопрос №112 Внутренний фотоэффект. Фотосопротивление и фотоэлементы, их применение
- •Вопрос №113 Излучение и поглощение энергии атомом
- •Вопрос №114 Способы наблюдения и регистрации заряженных частиц
- •Вопрос №115 Строение атома. Постулаты Бора
- •Вопрос №116 Радиоактивность. Законы радиоактивного распада
Вопрос № 16 Размеры и массы молекул и атомов. Постоянная Авогадро и постоянная Лошмидта.
За
единицу количества вещества принимают
1 моль,
![]() = 1 моль. Число молекул вещества применяют
в 1 моле любого вещества есть величина
постоянная – число Авогадро.
= 1 моль. Число молекул вещества применяют
в 1 моле любого вещества есть величина
постоянная – число Авогадро.
NA = 6,022
141 29(27)·1023 моль−1.
В одном кубическом метре газа при
нормальных условиях содержится:
 –число
Лошмидта
–число
Лошмидта
Один
моль любого газа при нормальных условиях
имеет объем:
 ,
или 22,4 л.
,
или 22,4 л.
m0 = M/NA – Формула для нахождения массы одной молекулы.
Вопрос № 17
Число столкновений и длина свободного пробега молекул
Расстояние,
которое молекула пролетает между двумя
последовательными столкновениями,
называют длиной свободного пробега и
обозначают ![]() (Греч.«Лямбда»).
(Греч.«Лямбда»).
С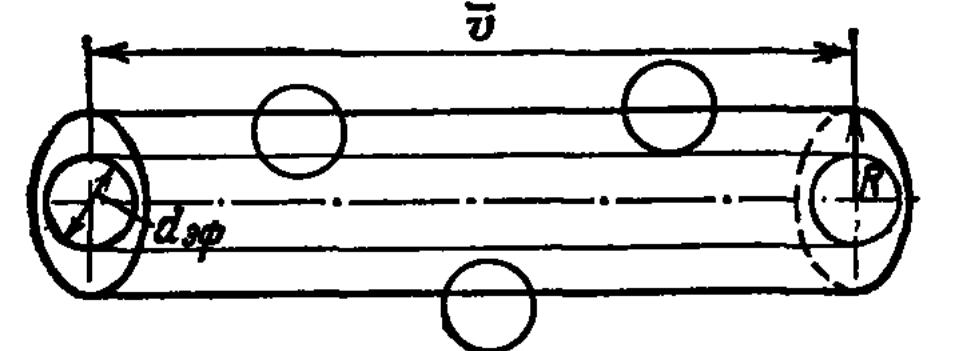 редняя
длина свободного пробега
редняя
длина свободного пробега

=
 =
=


Вопрос № 18
Идеальный газ. Основные уравнения М.К.Т. (без вывода).
Идеальный газ – это такой газ, которым можно пренебречь взаимодействием между молекулами, а молекулы принять за материальные точки. Поскольку молекулы идеального газа не притягиваются друг к другу, он должен оставаться в газообразном состоянии при любых внешних условиях. По своим свойствам ближе всего к идеальному газу подходит водород и гелий. При не слишком больших давлениях и не очень низких температурах.
Основное уравнение М.К.Т.
Давление газа на стенках сосуда обусловлено ударами молекул. Чем большее среднее кинетическая энергия поступательного движение каждой молекулы, тем больше сила, возникающая при ее ударе о стенку. Чес больше молекул в единицу объема, тем чаще они ударяются о стенку.
![]()
Основное
уравнение м.к.т. газов, где
 – давление [Па]; n0–
концентрация молекул или число молекул
[
– давление [Па]; n0–
концентрация молекул или число молекул
[ ];
];
 –средняя
кинетическая энергия поступательного
движения молекул.
–средняя
кинетическая энергия поступательного
движения молекул.
= ;
;

 ;
;


 [
[ ]=[
]=[ ]
]
Вопрос № 19
Зависимость давления газа от температуры при V=const; m= const



 давление
газа при 0
давление
газа при 0
 – давление
газа при t
– давление
газа при t
 – изменение
давления газа при нагревании.
– изменение
давления газа при нагревании.


 ;
;
 ;
;


 (температурный
коэффициент давления). Не зависит от
рода газа, только для идеального газа,
небольшая плотность и при любых изменениях
температуры
(температурный
коэффициент давления). Не зависит от
рода газа, только для идеального газа,
небольшая плотность и при любых изменениях
температуры

Вопрос № 20 Абсолютный нуль. Термодинамическая шкала температур. Абсолютная температура.
Давление, при которой должно прекратиться поступательное движение молекул газа, называется абсолютным нулем.(внутри молекул элементарные частицы продолжают движение)
Температура ниже абсолютного нуля в природе быть не может
При температуре абсолютного нуля уже нельзя было бы отнимать энергию теплового движения у молекул тела и понижать далее температуру. (энергия теплового движения не может быть отрицательной)




Термодинамическая шкала температур

 абсолютная
температура или термодинамическая
температура
абсолютная
температура или термодинамическая
температура
 – кельвин
– кельвин
T
=


Вопрос № 21
Связь между температурой и кинетической энергией молекул. Постоянная Больцмана


 =
=

 =
=

Для данной массы газа, при постоянном объеме, давление газа прямо пропорционально абсолютной температуры.





 , где
– давление [Па],
, где
– давление [Па],
 – число молекул [
– число молекул [ ],
],
 ,
,
 – абсолютная температура [
– абсолютная температура [ ]
]
Давление газа не зависит от его природы, определяется только концентрацией молекул и его температурой (абсолютной).
Среднее значение кинетической энергии поступательного движения молекул не зависит от природы газа, а определяется только его температурой.
Вопрос №22
Термодинамические параметры газа. Объединенный газовый закон. Приведение объема газа к нормальным условиям.
Состояние между значениями тех или иных параметров в начале или в конце процесса, называется газовым законом.


 Газовый
закон, выражающий связь между всеми
тремя параметрами газа, называется
объединенный
газовый закон.
Газовый
закон, выражающий связь между всеми
тремя параметрами газа, называется
объединенный
газовый закон.
Объединенный газовый закон. Приведение объема газа к нормальным условиям.
;
m = const;


 ;
;
 ;
;
Объединенный газовой закон.
 ;
;
При постоянной массе газа произведение объема газа на давление деленное на абсолютною температуру, есть величина постоянная для всех состояний этой массы газа.

 m
= const
m
= const


Вопрос №23
Уравнение Клапейрона-Менделеева. Молярная газовая постоянная (вывод).
[ ] – масса газа
 ;
- число молей.
;
- число молей.


 ;
;
 ,
где
,
где
 ;
;


Вопрос №24 Зависимость средней квадратичной скорости молекул газа от температуры.


Вопрос №25 Изопроцессы в газах и их графики
Процессы, при которых масса газа и один из его параметров остаются постоянными, называются изопроцессами. (от греческого “изос” – равный, одинаковый).
Изохорический процесс
Процесс в газе, который происходит при постоянной массе и неизменном объеме, называется изохорическим (от греческого “хора” - пространство). Графики для этого процесса называются изохарами.
 ;
;
 ;
Закон Шарля;
;
Закон Шарля;

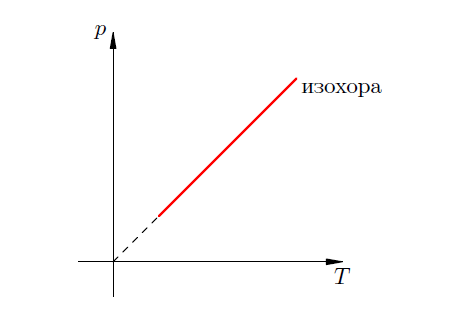

Изохорический
процесс подчиняется закону Шарля: при
постоянной массе газа и неизменном
объеме давления газа прямо пропорционально
его абсолютной температуре.
Это видно из уравнения Клапейрона –
Менделеева:
 ;
;
Так
как
 остаются постоянными, то из уравнения
Клапейрона – Менделеева следует, что
остаются постоянными, то из уравнения
Клапейрона – Менделеева следует, что
 .
.
Изобарический процесс
П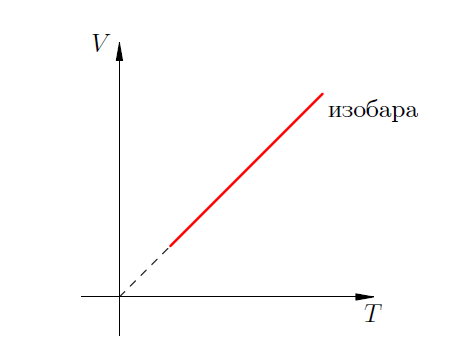
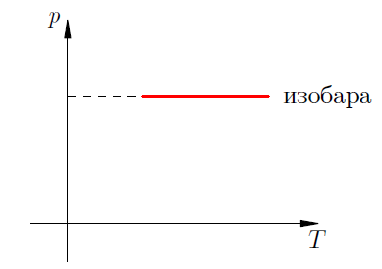 роцесс
в газе, который происходит при постоянной
массе и неизменном давлении, называется
изобарическим (от греческого “брос”
– тяжесть). График изобарного процесса
называется изобарой.
Поскольку
при изобарическом процессе
– постоянно, то после сокращения на
формула принимает вид:
роцесс
в газе, который происходит при постоянной
массе и неизменном давлении, называется
изобарическим (от греческого “брос”
– тяжесть). График изобарного процесса
называется изобарой.
Поскольку
при изобарическом процессе
– постоянно, то после сокращения на
формула принимает вид:
 ;
Формула является математическим
выражение закона Гей – Люссака: при
постоянной массе и неизменном давлении
объем газа прямо пропорционален его
абсолютной температуре. (Это
видно из уравнения Клапейрона –
Менделеева: так как
;
Формула является математическим
выражение закона Гей – Люссака: при
постоянной массе и неизменном давлении
объем газа прямо пропорционален его
абсолютной температуре. (Это
видно из уравнения Клапейрона –
Менделеева: так как
 )
)
Изотермический процесс
П роцесс
в газе, который происходит при постоянной
температуре, называется изотермическим.
Изотермический
процесс в газе был установлен английским
ученым Р. Бойлем и французским ученым
Э. Мариоттом. Установленная ими опытным
путем связь получается непосредственно
из формулы
после сокращения на T:
роцесс
в газе, который происходит при постоянной
температуре, называется изотермическим.
Изотермический
процесс в газе был установлен английским
ученым Р. Бойлем и французским ученым
Э. Мариоттом. Установленная ими опытным
путем связь получается непосредственно
из формулы
после сокращения на T:
 ;
Формула является математическим
выражением закона Бойля – Мариотта:
при
постоянной массе газа и неизменной
температуре давление газа обратно
пропорциональна его объему.
Иначе говоря, в этих условиях произведение
объема газа на соответствующее давление
есть величина постоянная:
;
Формула является математическим
выражением закона Бойля – Мариотта:
при
постоянной массе газа и неизменной
температуре давление газа обратно
пропорциональна его объему.
Иначе говоря, в этих условиях произведение
объема газа на соответствующее давление
есть величина постоянная:
 ;
;
