
- •Программа курса «Материаловедение»
- •Раздел I. Материаловедение
- •Тема 1. Введение. Общие сведения о металлах, сплавах и неметаллических материалах
- •Тема 2. Физико-механические свойства материалов и методы их определения
- •Тема 3. Основы теории сплавов
- •Тема 4. Железоуглеродистые сплавы
- •Тема 5. Основы технологии термической обработки материалов
- •Тема 6. Цветные металлы и их сплавы
- •Тема 7. Вспомогательные и неметаллические материалы
- •Тема 8. Поведение материалов в особых условиях. Коррозия металлических материалов и её виды. Защита металлов и сплавов от коррозии
- •Задания к контрольной работе №1 Вариант 01
- •Вариант 02
- •Вариант 03
- •Вариант 04
- •Вариант 05
- •Вариант 06
- •Вариант 07
- •Вариант 08
- •Вариант 09
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Методические указания к выполнению контрольной работы №1 по дисциплине «Материаловедение»
- •Характерные линии и области диаграммы
- •Кривая охлаждения заэвтектоидной стали, содержащей 1,2%с
- •Примерные вопросы для подготовки к зачёту (экзамену)
- •Структура и свойства.
- •Структура сталей и чугунов в равновесном состоянии.
- •Маркировка сталей.
- •Цветные металлы и сплавы.
- •Пластмассы.
- •Рекомендуемая литература: основная:
- •Дополнительная:
- •1.1.Теоретическая часть
- •1.2. Методика ручной дуговой сварки
- •1.3. Порядок выполнения работы
- •1.4. Контрольные вопросы
- •1.5. Пример выполнения задания
- •1. Исходные данные (табл. 1, приложение).
- •2. Выбор типа и марки электрода
- •3. Расчет режима сварки
- •Механические свойства металла шва, не менее
- •Химический состав наплавленного металла, %
- •Приложение
- •Химический состав наплавленного металла
- •Литература
- •Примерное содержание тестов для подготовки к зачету(экзамену)
- •Диаграммы состояния систем двухкомпонентных сплавов
Вариант 25
A) Вычертить диаграмму состояния сплавов системы «алюминий Al – кремний Si» (рис. П.3). Указать основные линии, точки, а также структурно-фазовый состав всех областей диаграммы. Для сплава, содержащего 30% кремния Si, построить кривую охлаждения и описать происходящие при охлаждении фазовые превращения. Для данного сплава определить количественное соотношение структурно-фазовых составляющих и их состав при температуре 600ºC. Схематично изобразить и описать структуру заданного сплава.
Б) Вычертить диаграмму состояния сплавов системы «Fe-Fe3C» (рис. П.7). Указать основные линии, точки и структурно-фазовый состав всех областей диаграммы. Для любого эвтектоидного сплава построить кривую охлаждения и описать происходящие при охлаждении структурно-фазовые превращения. Схематично изобразить и описать структуру заданного сплава.
B) 1. Что такое феррит?
2. Какие линии диаграммы железо-цементит соответствуют перитектическому, эвтектическому и эвтектоидному превращениям?
3. В каком виде находится основная часть углерода в белом чугуне?
4. Укажите фазы и структурные составляющие, имеющиеся при комнатной температуре в сплаве с 1,38 % С. Дайте характеристику этого сплава по диаграмме железо-цементит.
5. Определите по диаграмме железо-цементит для заданного сплава (1,38 % С) химический состав фаз и их весовое количество при температуре 250°С.
Г) Для изготовления деталей, работающих в активных коррозионных средах, выбрана сталь 08Х18Н12Т. Указать состав и объяснить причины введения легирующих элементов в эту сталь. Назначить и обосновать режимы термической обработки для данной стали.
Д) Требуется подвергнуть улучшению изделия из стали 40. Назначить режимы термической обработки, описать сущность происходящих явлений, структуру стали в результате термообработки.
Е) Опишите микроструктуру и свойства металлических образцов (например, технического никеля) после деформирования при комнатной температуре и при температуре 550 °С. Объясните процессы, протекающие при этом.
Ж) Выберите оловянистую бронзу для отливок сложной конфигурации. Расшифруйте состав и опишите структуру бронзы. Назначьте режим термообработки для снятия внутренних напряжений, возникающих после литья. Опишите механические свойства этой бронзы.
З) Пружины из стали 55 после правильно выполненной закалки и последующего отпуска имеют твердость значительно выше, чем это предусматривается по техническим условиям. Чем вызван этот дефект, и как можно его исправить? Укажите, какая твердость и структура обеспечивают высокие упругие свойства пружин.
И) Расшифруйте представленные марки сталей и сплавов. Приведите их полный химический состав, назначение и область применения. Х27Ю5Т, 35Л, 10Х17Н3М2Т, БрБ2, ВТ9, 44НХТЮ, Вст3сп.
Методические указания к выполнению контрольной работы №1 по дисциплине «Материаловедение»
т,°с
350
327°С
0
10 20 30 40 50 60 70 80 90 100% Sn
РЬ 100% 90 80 70 60 50 40 30 20 10 0
Рис. 1. Диаграмма состояния сплавов системы «свинец Pb - олово Sn»
Диаграмма состояния сплавов системы «свинец Pb - олово Sn» (рис. 1) относится к разновидности диаграмм состояния двойных сплавов III типа, является диаграммой состояния сплавов, испытывающих фазовые превращения в твёрдом состоянии (диаграмма состояния сплавов с переменной растворимостью компонентов в твёрдом состоянии). По внешнему виду диаграмма похожа на диаграмму состояния сплавов с ограниченной растворимостью компонентов в твёрдом состоянии. Отличие только состоит в том, что линии предельной растворимости компонентов не перпендикулярны оси концентрации. На диаграмме имеются области, в которых из однородных твёрдых растворов при понижении температуры выделяются вторичные фазы. Поэтому данный тип диаграммы характерен для сплавов, образующих при сплавлении компонентов твёрдые растворы, имеющих ограниченную взаимную растворимость друг в друге, изменяющуюся с изменением температуры.
Основные линии диаграммы:
ACB — линия ликвидус, линия начала процесса кристаллизации;
ADCEB — линия солидус, линия конца процесса кристаллизации;
Dm — линия переменной предельной растворимости олова Sn в свинце Pb;
En — линия переменной предельной растворимости свинца Pb в олове Sn;
DCE — линия кристаллизации эвтектики (T = 183ºC).
Основные точки диаграммы:
A — температура кристаллизации чистого свинца Pb (T = 327ºC);
B — температура кристаллизации чистого олова Sn (T = 232ºC);
C — температура кристаллизации эвтектического сплава 62% Sn + 38% Pb (T = 183ºC);
D — максимальная предельная растворимость олова Sn в свинце Pb (13% олова Sn в 87% свинца Pb при T = 183ºC);
E — максимальная предельная растворимость свинца Pb в олове Sn (4% свинца Pb в 96% олова Sn при T = 183ºC).
На диаграмме условно обозначены следующие фазы:
α — твёрдый раствор олова Sn в основном компоненте-растворителе свинце Pb;
β — твёрдый раствор свинца Pb в основном компоненте-растворителе олове Sn.
Из данной диаграммы видно, что с понижением температуры растворимость олова Sn в свинце Pb и, соответственно, свинца Pb в олове Sn (линии Dm и En соответственно) уменьшаются. Вследствие этого из твёрдых растворов выделяются избыточные фазы, то есть в сплаве образуются равномерно распределённые зоны, содержащие избыточное количество растворённого компонента. Таким образом, из α-твёрдого раствора, например, выделяются вторичные кристаллы β-твёрдого раствора (β II) переменного состава; из β-твёрдого раствора — вторичные кристаллы α-твёрдого раствора (αII). Составы этих вторичных кристаллов определяются соответственно линиями Dm и En.
Причинами выделения вторичных фаз (αII и βII) в сплавах в твёрдом состоянии при понижении температуры являются:
изменение параметров кристаллических решёток основных компонентов-растворителей;
изменение типов кристаллических решёток сплавляемых компонентов при понижении температуры (полиморфное превращение), что приводит к изменению растворяющей способности.
Сплавы составов левее точки m состоят из однородного α-твёрдого раствора — твёрдого раствора олова Sn в основном компоненте-растворителе свинце Pb, а сплавы стоящие правее точки n — из однородного β-твёрдого раствора — твёрдого раствора свинца Pb в основном компоненте-растворителе олове Sn.
Сплавы составов от точки m до точки d имеют микроструктуру, состоящую из кристаллов α-твёрдого раствора переменного состава и вторичных кристаллов β II-твёрдого раствора, а от точки e до точки n — из кристаллов β-твёрдого раствора переменною состава и вторичных кристаллов α II-твёрдого раствора.
На диаграмме также можно выделить следующие сплавы:
Эвтектический сплав (эвтектика). На диаграмме данный сплав соответствует проекции точки С на ось концентраций, содержит 62% олова Sn и 38% свинца Pb. Этот сплав начинает кристаллизоваться при самой низкой температуре 183ºC среди всех сплавов рассматриваемой системы; имеет при понижении температуры постоянный количественный состав компонентов; структура его в твёрдом состоянии представляет собой мелкодисперсную механическую смесь кристаллов α- и β-твёрдых растворов переменного состава.
Доэвтектические сплавы, имеющие состав от точки d до точки c состоят из первичных кристаллов α-твёрдого раствора, эвтектики (α + β) и мелких вторичных кристаллов β II-твёрдого раствора, выделившихся из твёрдой фазы при понижении температуры. Первичные кристаллы α-твёрдого раствора равномерно распределены в эвтектике (α + β). Доэвтектические сплавы начинают кристаллизоваться с выделения из жидкой фазы кристаллов α-твёрдого раствора переменного состава (область диаграммы ADC, лежащая между линиями ликвидус и солидус).
Заэвтектические сплавы, имеющие состав от точки c до точки e, состоят из первичных кристаллов β-твёрдого раствора, эвтектики (а + β) и мелких вторичных кристаллов α II-твёрдого раствора, выделившихся из твёрдой фазы при понижении температуры. Первичные кристаллы β-твёрдого раствора равномерно распределены в эвтектике (α + β). Заэвтектические сплавы начинают кристаллизоваться с выделения из жидкой фазы кристаллов β-твёрдого раствора переменного состава (область диаграммы CEB, лежащая между линиями ликвидус и солидус).
Таким образом, в структурно-фазовом составе сплавов рассматриваемой системы важное место занимает эвтектика, представляющая собой смесь мелкодисперсных фаз α и β. Она имеет постоянный количественный состав компонентов (Pb и Sn) и кристаллизуется при наименьшей для данной системы сплавов температуре tэ = 183ºC, т. е. температуре, соответствующей линии DCE. Ниже этой линии находится область двухфазных сплавов.
Выше линии ликвидус (линии ACB) сплавы представляют собой жидкие фазы — неограниченные растворы компонентов (свинца Pb и олова Sn) друг в друге в жидком состоянии.
Для диаграмм состояния сплавов III типа характерно то, что кристаллы сплавляемых компонентов в чистом виде ни в одном из сплавов системы не присутствуют.
Рассмотрим процесс кристаллизации сплава, содержащего 80% Pb и 20% Sn (рис. 2, 3).
Т,°С
350
327°С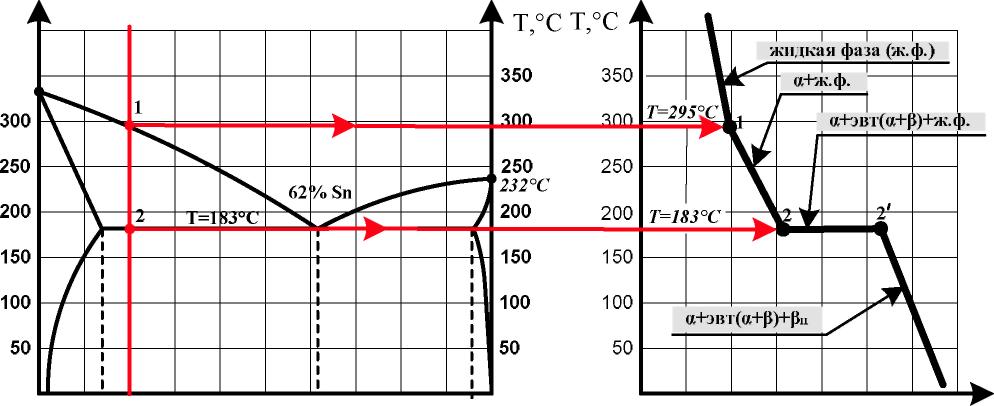
сплавa «80%Pb+20%Sn»
Рис. 2. Построение кривой охлаждения сплава «80% Pb + 20% Sn»

Рис. 3. Кривая охлаждения сплава «80% Pb + 20% Sn»
Построение кривой охлаждения сплава «80% Pb + 20%Sn» проводится в следующей последовательности:
а) через точку оси абсцисс, соответствующую составу сплава «80% Pb + 20%Sn», проводится вертикаль — линия сплава (рис. 1, 2);
б) точки пересечения линии сплава с линиями диаграммы обозначаются цифрами (рис. 2). Это — критические точки, указывающие критические температуры начала и конца процесса кристаллизации, перекристаллизации (если она имеется) данного сплава;
в) в соответствии с выявленными критическими температурами строится кривая охлаждения сплава в координатах «температура - время» (рис. 2, 3).
Согласно представленной на рис. 3 кривой охлаждения при кристаллизации сплава «80% Pb + 20%Sn» происходят следующие структурно-фазовые превращения.
При температуре выше точки 1 (T = 295ºC) сплав находится в жидком состоянии (жидкая фаза) и представляется собой неограниченный раствор компонентов (Pb и Sn) друг в друге. Соответственно, точка 1, лежащая на линии ликвидус A C, — температура начала кристаллизации данного сплава.
При охлаждении сплава ниже температуры точки 1 из жидкой фазы начинают выделяться кристаллы α-твёрдого раствора — кристаллы твёрдого раствора олова Sn в основном компоненте-растворителе свинце Pb состава, соответствующему абсциссе точки a, лежащей на линии солидус (линии ADCEB) диаграммы. Таким образом, при понижении температуры количественный состав выделяющихся из жидкой фазы первичных кристаллов α-твёрдого раствора изменяется по линии AD от точки A до D. При этом характер хода кривой охлаждения изменяется, процесс охлаждения замедляется, что вызвано выделением скрытой теплоты кристаллизации при образовании кристаллов α-твёрдого раствора из жидкой фазы. Поэтому на кривой охлаждения наблюдается излом (участок 1 - 2). Фазовый состав сплава на участке 1 - 2 кривой охлаждения — жидкая фаза + первичные кристаллы α-твёрдого раствора.
При достижении температуры точки 2 (T = 183ºC, линия DCE диаграммы) возникает нонвариантная система (количество степеней свободы системы C = 0). То есть количество независимых внутренних и внешних параметров системы (температура, давление, концентрация), которые можно произвольно изменять без изменения количества фаз (равновесия) в системе, равно нулю. В данном случае при T = 183ºC (точка 2) в равновесии находятся одновременно три фазы:
жидкая фаза, соответствующая количественному составу точки C диаграммы (62% Sn + 38% Pb);
кристаллы α-твёрдого раствора, количественного состава, соответствующего точке D диаграммы (13% Sn + 87% Pb);
кристаллы β-твёрдого раствора, количественного состава, соответствующего точке E диаграммы (96% Sn + 4% Pb)
При температуре, соответствующей линии DCE — линии кристаллизации эвтектики (T = 183ºC), возникает эвтектическое превращение
LC → α d + βE .
Трём фазам соответствуют определённые количественные составы компонентов, характеризующиеся проекциями точек D, C и E, хотя температура их превращения постоянна.
При кристаллизации сплава между точками 2 и 2′ (T = 183ºC) кроме первичных кристаллов α-твёрдого раствора, образуется также эвтектика (α + β) — мелкодисперсная механическая смесь кристаллов α- и β-твёрдого раствора, количественного состава (62%Sn + 38% Pb). Температура кристаллизации эвтектики постоянна, независимо оттого, что дополнительной теплоты от внешней среды не поступает. Причиной постоянства температуры кристаллизации эвтектики также является выделение скрытой теплоты кристаллизации. В точке 2 эвтектика полностью находится ещё в жидком состоянии, между точками 2 и 2′ — в жидком и твёрдом состояниях, в точке 2′ — полностью в твёрдом состоянии. На участке 2 - 2′ кривой охлаждения фазовый состав сплава — первичные кристаллы α-твёрдого раствора, эвтектика (α + β) и жидкая фаза. В точке 2′ сплав полностью переходит в твёрдое состояние.
При дальнейшем охлаждении сплава ниже точки 2′ из первичных кристаллов α-твёрдого раствора выделяются вторичные кристаллы βII-твёрдого раствора. При обычных температурах кристаллы α-твёрдого раствора сплава имеют количественный состав компонентов, соответствующий точке m диаграммы (2,5%Sn + 97,5% Pb), а кристаллы βII-твёрдого раствора — соответствующий точке n диаграммы (99%Sn + 1% Pb). Причиной выделения вторичных кристаллов βII-твёрдого раствора из α-твёрдого раствора являются: 1) изменение параметров кристаллической решётки компонента-растворителя (свинца Pb), что приводит к снижению его растворяющей способности; 2) структурно-фазовые (полиморфные) превращения кристаллических решёток сплавляемых компонентов, что также приводит к снижению их взаимной растворимости друг в друге.
Окончательно охлаждённый сплав содержит только две фазы — кристаллы
α-твёрдого раствора и кристаллы β-твёрдого раствора. Каждый из этих видов кристаллов содержится как в мелкодисперсном состоянии в составе эвтектики (α + β), так и в виде более крупных фаз — α и β, равномерно распределённых по объёму сплава.
Для определения количественного соотношения структурно-фазовых составляющих при температуре 250ºC для сплава, содержащего 20% Sn и 80%
Pb, надо воспользоваться «правилом отрезков».
Для этого в замкнутой области ADC диаграммы на уровне температуры 250ºC проведём горизонтальную линию — коноду abf (рис. 1). Данная линия пересекает вертикальную линию, характеризующую состав сплава (линию сплава), в точке b.
Количество твёрдой фазы Qтв. (количество выпавших кристаллов α-твёрдого раствора) при T = 250ºC определим из соотношения:
Q me = (bf / af ) х 100% = 58,06% .
Таким образом, количество твёрдой фазы Qтв. определяется отношением длины отрезка горизонтали (коноды), прилегающего к линии ликвидус ACB, ко всей длине горизонтали.
Количество жидкой фазы Qж при T = 250ºC определим из соотношения:
Qж = (af/аf) х 100% = 41,94%.
Количество жидкой фазы Qж определяется отношением длины отрезка горизонтали (коноды), прилегающего к линии солидус ADCEB, ко всей длине горизонтали.
Количественный состав выделяющихся при кристаллизации сплава первичных кристаллов α-твёрдого раствора при T = 250ºC определяется абсциссой точки a — 8% Sn + 92% Pb.
Количественный состав жидкой фазы при T = 250ºC определяется абсциссой точки f — 38% Sn + 62% Pb.
Количество образующейся эвтектики при T = 183ºC в точке 2′ составит:
Qэвт = (Dp/ DC) х 100% = 14,3%
Количество образующихся первичных кристаллов α-твёрдого раствора при T = 183ºC составит:
Qтв.= (pC / DC ) х 100% = 85,7%
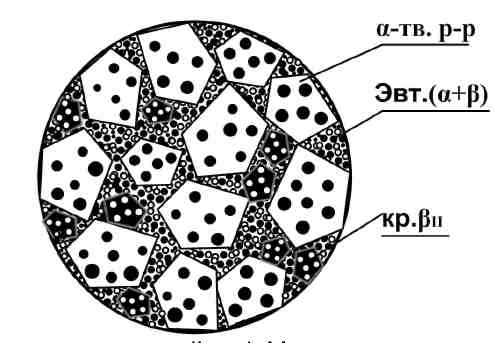

Рис. 4. Микроструктура сплава «80% Pb + 20% Sn»
Б) Вычертить диаграмму состояния сплавов системы «железо Fe-углерод C» (рис. П.7). Указать основные линии, точки и структурно-фазовый состав всех областей диаграммы. Для сплава, содержащего 1,2% углерода C, построить кривую охлаждения и описать происходящие при охлаждении структурно-фазовые превращения. Схематично изобразить и описать структуру заданного сплава.

34
На диаграмме железоуглеродистых сплавов (рис. 5) нанесены сплошные и пунктирные линии. Это связано с тем, что углерод в сплавах может находиться как в свободном виде (в виде графита), так и в виде химического соединения (цементита Fe3C). Поэтому, диаграмма состояния железоуглеродистых сплавов может быть:
система «Fe-Fe3C» (метастабильная);
система «Fe-C» (стабильная).
Характерные точки диаграммы:
А (Т= 1539ºC) — температура плавления чистого железа Fe;
В (Т= 1493ºC; 0,5%С) — состав жидкой фазы при перитектической реакции;
J (Т= 1493ºC; 0,18%С) — состав аустенита при перитектической реакции;
Н (Т= 1493ºC; 0,1%С) — состав феррита при перитектической реакции;
N (Т= 1392ºC) — температура полиморфного превращения железа Feα ↔ Feγ;
С (Т= 1147ºC; 4,3%С) — состав эвтектики (ледебурит = аустенит + цементит);
D (Т= 1600ºC; 6,67%С) — условная температура плавления цементита Fe3С;
Е (Т= 1147ºC; 2,14%С) — предельная растворимость углерода в γ-железе Fe;
G (Т= 911ºC) — температура полиморфного превращения железа Feγ ↔ Feα;
S (Т= 727ºC; 0,80%С) — состав эвтектоидного сплава (перлит = феррит + цементит);
Р (Т= 727ºC; 0,02%С) — предельная растворимость углерода в α-железе Feα;
К (Т= 727ºC; 6,67%С) — состав цементита;
Q (Т= 20ºC; 0,006%С) — минимальная растворимость углерода в железе.
Компоненты и фазы железоуглеродистых сплавов
Компонентами железоуглеродистых сплавов являются железо Fe, углерод C и цементит Fe3C.
Железо Fe — переходный металл серебристо-светлого цвета. Имеет высокую температуру плавления — 1539oС ± 5oС.
В твёрдом состоянии железо может находиться в двух модификациях. Полиморфные превращения происходят при температурах 911ºС и 1392ºС. При температуре ниже 911ºС существует α-железо (Feα), обладающее объёмно-центрированной кубической решёткой. В интервале температур 911÷1392ºС устойчивым является γ-железо (Feγ), обладающее гранецентрированной кубической решёткой. Выше 1392ºС железо имеет объёмно-центрированную кубическую решётку и называется (δ-железо (Feδ) или высокотемпературное a-железо (Fea). Высокотемпературная модификация α-железа (Feα) не представляет собой новой аллотропической формы. Критическую температуру 911ºС превращения Feα ↔ Feγ обозначают точкой А3, а температуру 1392ºС превращения Feδ ↔ Feγ — точкой А4.
При температуре ниже 768ºС железо ферромагнитно, а выше — парамагнитно. Точка Кюри железа 768ºС обозначается А2.
Железо технической чистоты обладает невысокой твёрдостью (80 НВ) и прочностью (предел прочности — σВ = 250 МПа, предел текучести — σТ = 120 МПа) и высокими характеристиками пластичности (относительное удлинение — δ = 50%, а относительное сужение — ψ= 80%). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна.
Железо характеризуется высоким модулем упругости Е, которым характеризуются и сплавы на его основе, благодаря чему обеспечивается высокая жёсткость и прочность деталей из этих сплавов.
Железо со многими элементами образует растворы: с металлами — твёрдые растворы замещения, с углеродом, азотом и водородом — твёрдые растворы внедрения.
Углерод С относится к неметаллам. Он обладает явлением полиморфизма. В зависимости от условий образования углерод может существовать в форме графита с гексагональной слоистой кристаллической решёткой (температура плавления — 3500ºС, плотность — ρ = 2,25 г/см) или в форме алмаза со сложной кубической решёткой с координационным числом k = 4 (температура плавления — 5000ºС). Графит является мягким материалом и обладает низкой прочностью. Однако с увеличением температуры прочность графита аномально растёт: при 20ºC σВ = 20 МПа, а при 2500ºC σВ = 40 МПа. При 2500ºC графит прочнее всех тугоплавких металлов.
В сплавах с железом углерод образует либо твёрдые растворы внедрения, либо химическое соединение — цементит Fe3C. Также углерод может находиться в свободном состоянии в виде графита (в серых чугунах).
В случае образования твёрдых растворов растворимость углерода в железе зависит от его кристаллической структуры. Размеры пор ОЦК кристаллической решётки значительно меньше, чем размеры пор ГЦК решётки. Поэтому α-железо (Feα) способно растворять углерод в очень малом количестве, а растворимость углерода в γ-железе (Feγ) значительно больше.
В системе железо - углерод существуют следующие фазы: жидкая фаза, феррит, аусте-нит, цементит, графит.
Жидкая фаза. В жидком состоянии железо Fe хорошо растворяет углерод C в любых пропорциях с образованием однородной жидкой фазы.
Феррит (Ф) — твёрдый раствор внедрения углерода в a-железе Feα.
Феррит имеет переменную предельную растворимость углерода: минимальную — 0,006% при комнатной температуре (точка Q), максимальную — 0,02% при температуре 727ºС (точка P). Углерод располагается в дефектах кристаллической решётки железа.
При температуре выше 1392ºС существует высокотемпературный феррит с предельной растворимостью углерода С (0,1%) в δ-железе Feδ при температуре 1499ºС (точка H).
Свойства феррита близки к свойствам железа. Он мягок (твёрдость — 130 НВ, предел прочности — σв = 300 МПа) и пластичен (относительное удлинение — δ = 30%), обладает магнитными свойствами до 768ºС.
Аустенит (А)— твёрдый раствор внедрения углерода С в γ-железе Feγ.
В аустените углерод занимает место в центре гранецентрированной кубической ячейки. Аустенит имеет переменную предельную растворимость углерода: минимальную — 0,8% при температуре 727ºС (точка S), максимальную — 2,14% при температуре 1147ºС (точка Е).
Аустенит имеет твёрдость 200…250 НВ, пластичен (относительное удлинение его составляет — δ = 40… 50%), обладает парамагнитными свойствами.
И в феррите и в аустените могут растворяться многие легирующие элементы, образуя твёрдые растворы замещения и резко изменяя их свойства. Кроме того, легирование может значительно изменять температурные границы существования фаз.
Цементит (Ц) (Fe3C) — химическое соединение железа с углеродом (карбид железа), содержащее 6,67% углерода С.
Цементит не испытывает полиморфных превращений при изменении температуры. Кристаллическая решётка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу.
Температура плавления цементита точно не установлена (по разным данным она составляет 1250ºС или 1550ºС). При низких температурах цементит слабо ферромагнитен. Магнитные свойства он теряет при температуре около 217ºС.
Цементит имеет высокую твёрдость (более 800 НВ, легко царапает стекло), но очень низкую, практически нулевую, пластичность. Такие свойства являются следствием сложного строения кристаллической решётки цементита. Цементит способен образовывать твёрдые растворы замещения. Атомы углерода C могут замещаться атомами неметаллов: азотом N, кислородом O; атомы железа Fe — металлами: марганцем Mn, хромом Cr, вольфрамом W и др. Такой твёрдый раствор на базе решётки цементита получил название легированный цементит.
Цементит — соединение неустойчивое и при нагреве распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов.
В железоуглеродистых сплавах выделяют три вида цементита в зависимости от температуры образования: цементит первичный (ЦI), цементит вторичный (ЦII), цементит третичный (ЦIII). Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих фаз в сплавах. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зёрен аустенита (при охлаждении — вокруг зёрен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ зёрен феррита.
