
- •Системы отсчета. Характеристики механического движения: перемещение, скорость, ускорение.
- •Виды движения ( равномерное, равноускоренное) и их графическое описание. Движение по окружности с постоянной по модулю скоростью.
- •Взаимодействие тел.
- •7 Закон сохранения импульса и реактивное движение.
- •8. Импульс тела. Закон сохранения механической энергии.
- •9. Работа и мощность.
- •10 Механические колебания.
- •11 Амплитуда, период, частота, фаза колебаний.
- •12 Свободные и вынужденные колебания.
- •13 Резонанс. Механические волны.
- •14 Свойства механических волн.
- •15 Длина волны.
- •16. Звуковые волны.
- •17. Ультразвук и его использование в технике и медицине.
- •18. Молекулярная физика.
- •19. Термодинамика.
- •20. Основные положения молекулярно-кинетической теории.
- •21. Наблюдения и опыты, подтверждающие атомно-молекулярное строение вещества.
- •22. Масса и размеры молекул.
- •23. Тепловое движение.
- •24. Первое начало термодинамики и его применение к изопроцессам. Необратимость тепловых процессов. Тепловые двигатели и охрана окружающей среды. Кпд тепловых двигателей.
- •25. Парообразование и конденсация, испарение.
- •26. Процесс кипения жидкостей.
- •27. Влажность воздуха. Приборы для измерения влажности.
- •28. Характеристика жидкого состояния вещества.
- •29. Капиллярность. Капиллярные явления в природе и технике.
- •30. Характеристика твердого состояния вещества.
- •31. Плавление и кристаллизация.
- •32. Тепловое расширение тел.
- •33. Электрический разряд. Закон сохранения электрического заряда. Закон Кулона.
- •34. Электрическое поле. Напряженность поля. Потенциал поля. Разность потенциалов.
- •35. Линии напряженности электрического поля. Однородное электрическое поле.
- •36. Работа электрического поля при перемещении заряда.
- •37. Потенциал. Разность потенциалов. Напряжение.
- •38. Проводники в электрическом поле.
- •39. Диэлектрики в электрическом поле.
- •40. Электроёмкость проводников.
- •41. Принцип суперпозиции полей точечных зарядов.
- •42. Электрическая емкость. Конденсатор. Их устройство и применение.
- •43. Постоянный электрический ток.
- •44. Сила тока, напряжение, электрическое сопротивление. Закон Ома для участка цепи.
- •45. Последовательное и параллельное соединение проводников. Эдс источника тока.
- •46. Тепловое действие электрического тока.
- •47. Закон Джоуля- Ленца. Мощность электрического тока.
- •48. Полупроводники. Собственная и примесная проводимости полупроводников.
- •49. Полупроводниковый диод. Полупроводниковые приборы.
- •50. Магнитное поле.
- •51. Постоянные магниты и магнитное поле тока.
- •52. Сила Ампера. Принцип действия электродвигателя. Электроизмерительные приборы.
- •53. Индукция магнитного поля.
- •54. Магнитный поток. Явление электромагнитной индукции и закон электромагнитной индукции Фарадея.
- •55. Вихревое электрическое поле. Правило Ленца. Самоиндукция. Индуктивность.
- •56. Принцип действия электрогенератора.
- •57. Переменный ток.
- •58. Трансформатор. Производство, передача и потребление электроэнергии.
- •Электрообогрев и электроплиты:
- •Холодильные установки и кондиционеры:
- •Потребление бытовых и прочих устройств пользуйтесь энергосберегающим «спящим» режимом, если он есть в приборе или устройстве;
- •60. Колебательный контур. Свободные электромагнитные колебания.
- •61. Вынужденные электромагнитные колебания. Действующие значения силы тока и напряжения.
- •62. Конденсатор и катушка в цепи переменного тока. Активное сопротивление . Электрический резонанс. Конденсатор в цепи переменного тока
- •Катушка индуктивности в цепи переменного тока
- •63. Электромагнитное поле и электромагнитные волны. Распространение колебаний в упругой среде. Волны, их характеристики. Уравнение плоской волны, ее характеристики.
- •2. Электромагнитные волны. Предсказание электромагнитных волн
- •64. Скорость электромагнитных волн. Принципы радиосвязи и телевидения.
30. Характеристика твердого состояния вещества.
По сравнению с газообразным и жидким состоянием твердые вещества имеют наибольшую упорядоченность. Именно этой высокой упорядоченностью объясняются многие физические свойства твердых веществ.
Сжимаемость твердых веществ практически равна нулю. Все твердые вещества имеют определенный объем. Одним из наиболее известных свойств твердых веществ является их способность сохранять свою форму. Могут выдерживать значительные внешние нагрузки. Плотность каждого вещества в твердом состоянии значительно больше, чем в газообразном и жидком. Исключение составляет вода, которая в жидком состоянии обладает большей плотностью, чем лед. Кристаллические твердые вещества имеют строго определенную температуру плавления, но аморфные твердые вещества, как, например, стекла, размягчаются в некотором интервале температур.
Все твердые вещества характеризуются определенным давлением пара, хотя оно, как правило, очень мало
Твердые вещества делятся на аморфные и кристаллические Кристаллические вещества плавятся при строго определенной температуре, аморфные – не имеют резко выраженной температуры плавления; при нагревании они размягчаются и переходят в жидкое или вязкотекучее состояние
Твердые вещества могут значительно отличаться друг от друга по своим пластическим свойствам. Некоторые из них, например ионные вещества, обычно раскалываются под нагрузкой. Такое свойство называется хрупкостью. Другие, как резина, являются упругими. После удаления внешней нагрузки они приобретают свою первоначальную форму. Многие металлы обладают свойствами ковкости и тягучести. Ковкий металл можно превратить ударами в тонкий лист, а тягучий металл вытянуть в тонкую проволоку.
Твердые вещества сильно различаются по способности проводить тепло и электрический ток. Все металлы обладают хорошей теплопроводностью и электропроводностью. Неметаллические вещества, как правило, являются изоляторами (диэлектриками), хотя, графит проводит электрический ток.
31. Плавление и кристаллизация.
Чтобы расплавить твердое кристаллическое тело, ему необходимо передать некоторое количество теплоты.
Наполним коническую колбу мелкими кусочками льда. Вставив в нее термометр и закрыв колбу пробкой, начнем ее нагревать. Мы увидим, что ни при - 15 °С, ни при - 10 °С, ни при -5 °С со льдом ничего особенного происходить не будет: он по-прежнему будет оставаться твердым. Изменения начнут происходить при 0 °С. С этого момента лед будет плавиться, превращаясь в воду, и, до тех пор, пока весь лед не растает, его температура останется неизменной. Температура вещества в колбе вновь начнет повышаться лишь после того, как в ней останется одна вода. Когда эта вода нагреется до 20 °С, выключим горелку.
Если
построить график зависимости температуры
вещества в колбе от времени, то мы получим
линию, изображенную на рисунке 79.
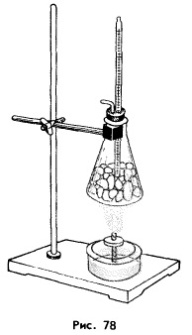
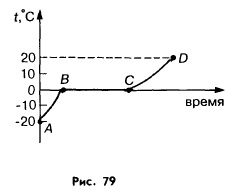
Участок АВ этого графика описывает нагревание льда от -20 до 0 °С. Благодаря контакту с горячей колбой (нагреваемой горелкой) средняя кинетическая энергия молекул льда увеличивается и температура льда повышается.
На участке ВС вся энергия, получаемая содержимым колбы, тратится на разрушение кристаллической решетки льда: его молекулы перестраиваются таким образом, что вещество становится жидким. Средняя кинетическая энергия молекул при этом остается неизменной. Неизменной поэтому оказывается и температура вещества.
Температура, при которой плавится вещество, называется температурой плавления.
Участок СD описывает нагревание воды, образовавшейся после плавления льда. Получая энергию от нагревателя, молекулы воды начинают двигаться все более и более интенсивно. Их средняя кинетическая энергия возрастает, и температура воды повышается.
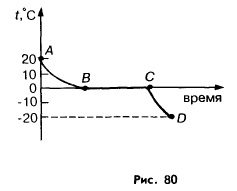
На рисунке 80 изображен график обратного процесса. Сначала вода, отдавая энергию, охлаждается от 20 до 0 °С. При этом ее молекулы движутся все менее и менее интенсивно. При 0 °С они начинают выстраиваться в определенном порядке, образуя кристаллическую решетку льда. Пока этот процесс (называемый кристаллизацией) не завершится, температура вещества не изменится.
Температура, при которой вещество отвердевает (кристаллизуется), называется температурой кристаллизации вещества.
Из
графика (см. рис. 80) видно, что температура,
при которой вода превращается в лед,
совпадает с температурой, при которой
лед превращается в воду. Это не случайный
факт. Опыты показывают, что любое вещество
кристаллизуется и плавится при одной
и той же температуре.
Одни вещества (например, водород и кислород) плавятся (и отвердевают) при очень низких температурах, другие (например, осмий и вольфрам) - при очень высоких. Металлы, плавящиеся при температуре выше 1650 °С, называют тугоплавкими (титан, хром, молибден и др.). Самой высокой температурой плавления среди них обладает вольфрам (около 3400 °С) Тугоплавкие металлы и их соединения используют в качестве жаропрочных материалов в самолетостроении, ракетной и космической технике, атомной энергетике и т. д.
