- •Тема №2. Ферменты
- •3. Роль в организме
- •Задача № 1
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •Задача № 5
- •Задача № 6
- •Ответ к задаче №6 липогенез- процесс, при котором глюкоза и другие вещества из содержащихся в пище углеводов превращаются в организме в жирные кислиоы
- •Задача № 7
- •Задача № 12
- •Ответ к задаче №16
- •Витамины группы к участвуют во многих процессах, протекающих в организме. Основными из них являются:
Тема №2. Ферменты
Задача № 1
Глутаматдекарбоксилаза катализирует реакцию:
В6
Глутаминовая кислота → ГАМК + СО2
1. По изменению концентрации каких веществ можно охарактеризовать активность фермента?
2. Как можно увеличить скорость данной реакции?
Ответ к задаче №1
Активность фермента определяется по убыли субстрата или накоплению продукта (глутаминовой кислоты, СО2, ГАМК). Увеличить скорость реакции можно за счет повышения концентрации субстрата, фермента или кофермента.
Скорость ферментативной реакции определятся количеством вещества, которое превращается в единицу времени. Скорость этих реакции зависит от влияния внещних условий(температуры , рН среды, влияние природных и чужеродных соединений) Скорость исчезновения субстрата или нарастания количества продуктов реакции в единицу времени служат мерой активностью фермента
Задача № 2
Фермент трипсин способен расщеплять пептидные связи белков. Почему обработка трипсином приводит к инактивации многих ферментов?
Для обоснования ответа вспомните:
1. Что такое ферменты?
2. К какому классу ферментов относится трипсин?
Ответ к задаче №2
Ферменты являются белками точнее биологические катализаторы белковой природы, ни один хим. процесс не может протекать в живых организмах без ферментов.
Классификация ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы. Трипсин действует на пептидные связи, что приводит к инактивации ферментов.
Задача № 3
Ингибитор снижает активность фермента до 30% от исходного уровня. Повышение концентрации субстрата катализируемой реакции восстанавливает 80% активности фермента. К какому типу относится данный ингибитор?
Для ответа:
1. Вспомните типы ингибирования.
2. Действие какого ингибитора зависит от концентрации субстрата?
Ответ к задаче №3
Ингибиторы вызывают специфическое снижение активности фермента. По механизму действия ингибиторы ферментов делятся на следующие основные типы: конкурентные, неконкурентные, бесконкурентные, субстратные, аллостерические.
Конкурентным ингибированием называется торможение ферментативной реакции, сходного по структуре с субстратом и препятствующего образованием фермент-субстратного комплекса. Конкурентный ингибитор, так как он связывается в активном центре фермента и его действие снижается при увеличении концентрации субстрата.
Задача № 4
О чем может свидетельствовать резкое повышение в крови активности аспартатаминотрансферазы (АСТ), если известно, что этот фермент локализован преимущественно в сердце?
Для ответа вспомните:
1. К какому классу относится АСТ?
2. Почему при патологии в крови повышается активность внутриклеточных ферментов?
Ответ к задаче №4
Инфаркт миокарда. АСТ является внутриклеточным ферментом и его активность в крови повышается при разрушении клеток.
Аспартатаминотрансфераза (АСТ) относится к аминотрансферазам, которое состоящий из апофермента и кофермента. Значительная группа ферментов высвобождается в кровь, как результат нормального оборота клеток. Эти ферменты являются внутриклеточными и не несут никакой физиологической нагрузки в плазме крови. Еще есть такая версия ну в результате цитолиза (разрушении клеток) ферменты попадают в кровь
Задача № 9
Оптимальными условиями действия амилазы – фермента, расщепляющего крахмал, являются рН=6,8; температура 37ºС.
1. Как изменится активность фермента при изменении условий реакции?
2. Укажите причину изменений.
а) рН инкубационной среды =5;
б) температура инкубации 70ºС;
в) при добавлении в инкубационную среду СuS04;
г) при увеличении концентрации крахмала в присутствии СuS04 в инкубационной среде.
Ответ к задаче №9
а) активность амилазы снизится, так как ацидоз вызовет изменение конформации фермента;
б) активность снизится, так как происходит тепловая денатурация фермента;
в) активность снизится, так как СuSО4 является ингибитором фермента (Сu2+ является тяжелым металлом);
г)добавление крахмала в присутствии ингибитора не увеличит активность амилазы.
Задача № 11
Сравните специфичность действия двух групп пептидаз – пищеварительного тракта и свертывающей системы крови. В каком случае специфичность выше?
Для обоснования ответа вспомните:
1. Что такое пептидазы, к какому классу они относятся?
2. Что такое специфичность фермента?
Ответ к задаче №11
Пептидазы свертывающей системы крови действуют лишь на 1-2 строго определенных белка. Пищеварительные пептидазы действуют на любые белки, содержащие определенные пептидные связи. Таким образом, специфичность пептидаз свертывающей системы крови выше.
Пептидазы или Экзопептидазы- ферменты, ведущие гидролиз пептидной связи в полипептидах разной сложности, разрушая их до отдельных аминокислот. Сами пептидазы относятся к классу гидролаза.
Задача № 13
Раствор, содержащий высокомолекулярные вещества различной природы (полисахариды, белки, нуклеиновые кислоты), проявляет каталитическую активность по отношению к какой-либо определенной реакции. Природа катализатора неизвестна. Установлено, что он обладает следующими свойствами: а) снижает энергию активации; б) ускоряет прямую и обратную реакции; в) обладает высокой специфичностью; г) ускоряет момент достижения равновесия, не сдвигая его; д) прекращает каталитическое действие после добавления в раствор вещества, разрушающего пептидные связи. Какие из свойств служат прямым доказательством белковой природы катализатора?
Для обоснования ответа вспомните:
1. Что такое фермент?
2. Чем отличаются действия органических и неорганических катализаторов?
Ответ к задаче №13
в, д
Ферменты специальные белки которые направляют реакции в зависимости от соответствующих потребностей клеток.
действие неорганических катализаторов:
1.они катализируют только энергетически возможные реакции,
2. Они не изменяют равновесия обратимой реакции
3. Катализаторы и ферменты не изменяют направление реакции,
4. Катализаторы и ферменты не расходуются в процессе реакции
Задача № 14
Зерна в свежесобранных початках кукурузы сладкие из-за большого содержания в них глюкозы. Чем дальше от момента сбора, тем менее сладкими становится зерна в связи с превращением глюкозы в крахмал. Для сохранения сладкого вкуса початки сразу же после сбора помещают на несколько минут в кипящую воду и потом охлаждают. Как объяснить смысл такой обработки?
Для обоснования ответа вспомните:
1. Что такое фермент?
2. Как зависит активность ферментов от температуры?
Ответ к задаче №14
При тепловой обработке инактивируется фермент, превращающий глюкозу в крахмал.
Ферменты специальные белки которые направляют реакции в зависимости от соответствующих потребностей клеток
Температура при которой ферменты обладают максимальной активностью называется температурном оптимум. При снижении температуры ниже оптимальной у ферментов наблюдается обратимая инактивация также фермент способен восстановить свою активность если он опять окажется в режиме оптимальной температуры. Одним словом уменьшение скорости связана понижением температуры, повышение скорости связаны ускорением реакции
ТЕМА №3. БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Задача № 1
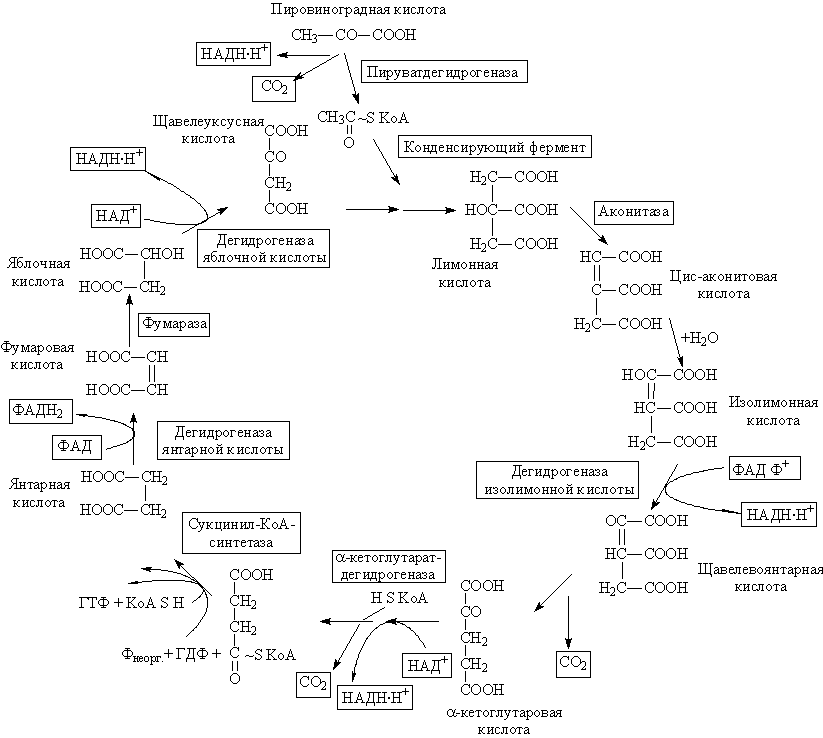
К препарату митохондрий печени крыс добавили НАД+. Активность каких ферментов цикла Кребса при этом увеличится?
Для обоснования ответа:
1. Напишите схему реакций цикла Кребса.
2. Какую функцию выполняет НАД+?
3. С какими ферментами цикла Кребса он работает?
Ответ к задаче №2
Изоцитратдегидрогеназа, 2-оксоглутаратдегидрогеназа, малатдегидрогеназа, так как они являются НАД+зависимыми.
ЦТК или цикл Кребса происходит в митохондриях. Он состоит из последовательных реакции протекающих в митохондриях только в одним направлением- в сторону окисления ацитил-КОА
НАД выступает в качестве промежуточных переносчиков водорода являются коферментом дегидрогеназ и действует на этапе превращения субстратов цикла Кребса и терминальных стадиях дегидрирования в дыхательной цепи.
Задача № 15
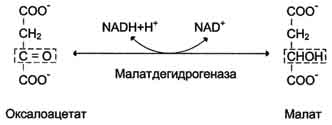
В эксперименте к изолированным митохондриям добавили малат. Чему равен коэффициент Р/О для малата?
Для обоснования ответа:
1. Вспомните, что такое коэффициент Р/О?
2. Напишите реакцию окисления малата и укажите фермент.
Ответ к задаче №15
Коэффициент фосфорилирования ( Р/О) для малата равен 3, так как малатдегидрогеназа является НАД-зависимым ферментом.
Коэффициент Р/О –это число молей неорганического фосфата, пошедшего на образование АТФ в расчете на каждый атом поглощенного кислорода. А величина его в норме равна 3или 2.
Задача № 16
В эксперименте к изолированным митохондриям добавили сукцинат. Чему равен коэффициент Р/О для сукцината?
Для обоснования ответа:
1. Вспомните, что такое коэффициент Р/О?
2. Напишите реакцию окисления сукцината и укажите фермент.
Ответ к задаче №16
Коэффициент фосфорилирования ( Р/О) для сукцината равен 2, так как сукцинатдегидрогеназа является ФАД-зависимым ферментом. Коэффициент Р/О –это число молей неорганического фосфата, пошедшего на образование АТФ в расчете на каждый атом поглощенного кислорода. А величина его в норме равна 3или 2.
ТЕМА №4. УГЛЕВОДНЫЙ ОБМЕН
Задача № 1
Животному внутривенно ввели стерильный раствор сахарозы. Появится ли сахароза в моче?
Для ответа вспомните:
1. Что такое сахароза?
2. Каким превращениям в организме она подвергается?
Ответ к задаче №1
Появится, так как в тканях нет фермента, расщепляющего сахарозу, и она будет выведена из организма с мочой.
1.Сахароза - дисахарид, состоящий из α-D-глюкозы и β-D-фруктозы, соединённых α,β-1,2-гликозидной связью. В сахарозе обе аномерные ОН-группы остатков глюкозы и фруктозы участвуют в образовании гликозидной связи. Следовательно, сахароза не относится к восстанавливающим сахарам. Сахароза - растворимый дисахарид со сладким вкусом. Источником сахарозы служат растения, особенно сахарная свёкла, сахарный тростник. Последнее объясняет возникновение тривиального названия сахарозы - "тростниковый сахар".
2.Если прокипятить
раствор сахарозы с несколькими каплями
соляной или серной кислоты и нейтрализовать
кислоту щелочью, а после этого нагреть
раствор, то появляются молекулы с
альдегидными группами, которые и
восстанавливают гидроксид меди(II) до
оксида меди(I). Эта реакция показывает,
что сахароза при каталитическом действии
кислоты подвергается гидролизу, в
результате чего образуются глюкоза и
фруктоза:
![]()
Задача № 2
Употребление в пищу кондитерских изделий, конфет вызывает у ребенка рвоту, понос. Он плохо переносит и сладкий чай, тогда как молоко не вызывает отрицательных реакций. Выскажите предположение о молекулярном дефекте.
Для обоснования ответа вспомните:
1. Какой дисахарид содержится в кондитерских изделиях, а какой - в молоке?
2. Что такое энзимопатия?
3. Какие виды энзимопатий вы знаете?
Ответ к задаче №2
Можно предположить дисахаридоз, вызванный отсутствием сахаразы. Возможной причиной перечисленных симптомов также может быть наследственная непереносимость фруктозы (дефект альдолазы фруктозо-1-фосфата).
1.Сахароза содержится в кондитерских изделиях, варенье, мороженом, сладких напитках, в некоторых овощах и фруктах: абрикосах, ананасах, апельсинах, дынях, бананах, мандаринах, моркови, персиках, сахарной свекле, сливах, тростнике, сорго.
В грудном молоке и молочных продуктах содержится дисахарид лактоза . Расщепляется на составные части в кишечнике под влиянием фермента лактазы.
2.Энзимопатии (ферментопатии) в широком смысле слова — патологические изменения активности ферментов. В более узком смысле этим термином обозначают наследственные заболевания, при которых вследствие изменения активности ферментов нарушается течение соответствующих биохимических реакций в организме и развиваются болезни обмена веществ. Приобретенные энзимопатии чаще всего отмечаются у детей после тяжелых, хронически протекающих заболеваний.
3. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. Приобретённые энзимопатии, как и вообще протеинопатии, по-видимому, наблюдают при всех болезнях.
Задача № 3
У некоторых людей прием молока вызывает расстройство кишечника, а прием простокваши - нет. Почему это происходит?
Для обоснования ответа вспомните:
1. Чем отличаются по составу молоко и простокваша?
2. Какой углевод содержится в молоке?
3. Что может быть причиной кишечных расстройств в данном случае?
Ответ к задаче №3
У людей с недостаточностью лактазы в кишечном соке лактоза молока становится питательной средой для кишечных бактерий. В простокваше лактоза отсутствует, так как она расщепляется микроорганизмами.
Задача № 4
Больной страдает от судорог в мышцах при напряженной физической работе, но в остальном чувствует себя здоровым. Биопсия мышечной ткани выявила, что концентрация гликогена в мышцах этого больного гораздо выше нормы. Почему накапливается гликоген? Ваши рекомендации такому человеку.
Для ответа:
1. Напишите схему обмена гликогена.
2. Укажите, какой из процессов обмена гликогена нарушен у данного больного?
3. Что такое энзимопатии?
Ответ к задаче №4.
У больного мышечная форма гликогеноза (возможна болезнь Мак-Ардла). Рекомендации: режим работы и отдыха, избегать напряженной физической работы; прием пищи частый, небольшими порциями.
1
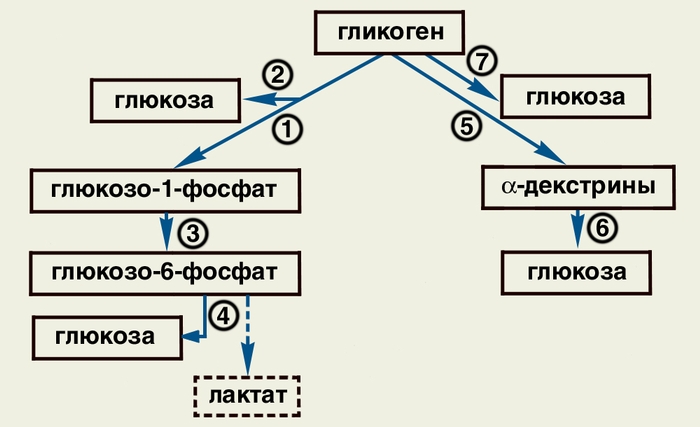
Схема распада в организме гликогена до глюкозы; цифрами обозначены реакции, катализируемые следующими ферментами: 1 — фосфорилазой; 2 — амило-1,6-глюкозидазой; 3 — фосфоглюкомутазой; 4 — глюкозо-6-фосфатазой; 5 — a-амилазой; 6 — нейтральными a-глюкозидазами; 7 — кислой a-глюкозидазой a-амилазой); пунктиром обозначена реакция образования лактата из глюкозо-6-фосфата в мышцах в условиях отсутствия активности глюкозо-6-фосфатазы.
2.Гликогенозы – группа наследственных заболеваний, для которых характерно отсутствие одного или нескольких ферментов, отвечающих за преобразование поступающего в организм сахара в гликоген либо гликогена обратно в глюкозу, являющуюся источником энергии для орга низма человека. Для гликогенозов характерно накопление в тканях организма избыточн ого количества гликогена либо появление в тканях патологических разновидностей гликогена. Усиление распада гликогена происходит при возбуждении центральной нервной системы. Импульсы по симпатическим путям идут к депо гликогена (печень, мышцы) и активируют гликогенолиз и мобилизацию гликогена. Кроме того, в результате возбуждения центральной нервной системы повышается функция гипофиза, мозгового слоя надпочечников, щитовидной железы, гормоны которых стимулируют распад гликогена.Повышение распада гликогена при одновременном увеличении потребления мышцами глюкозы происходит при тяжелой мышечной работе.
3. Энзимопатии (ферментопатии) в широком смысле слова — патологические изменения активности ферментов. В более узком смысле этим термином обозначают наследственные заболевания, при которых вследствие изменения активности ферментов нарушается течение соответствующих биохимических реакций в организме и развиваются болезни обмена веществ.
Задача № 5
Адреналин стимулирует процесс гликогенолиза в мышцах. Как это отразится на концентрации глюкозы в крови?
Для ответа:
Вспомните, что такое гликогенолиз?
Напишите схему данного процесса.
Какой продукт гликогенолиза накапливается в крови?
Каковы пути его использования?
Ответ к задаче №5
Образовавшийся в результате активации гликогенолиза в мышцах лактат поступает в печень и участвует в процессе ГНГ. Активация ГНГ в печени является дополнительным источником глюкозы в крови.
Гликоген – главный запасной полисахарид организма человека и животных. Накапливается в печени и мышцах. Гликогенолиз - это распад гликогена , запасного полисахарида. Гликогенолиз происходит непрерывно, и за счет этого поддерживается постоянная концентрация глюкозы в крови в промежутках между приемами пищи. Расщепление гликогена включает несколько этапов. Сначала фосфорилаза последовательно отщепляет остатки глюкозы от концов боковых цепей гликогена При этом фосфорилируются альфа-1,4-связи и образуются молекулы глюкозо-1-фосфата . Фосфорилаза атакует боковую цепь до тех пор, пока не дойдет до точки, отстоящей на 4 остатка глюкозы от места ветвления (т. е. от альфа-1,6-связи). Затем вступает в действие система отщепления боковых цепей гликогена. Первый фермент этой системы - 4-альфа-D-глюканотрансфераза - отщепляет 3 из 4 остатков глюкозы и переносит их на свободный конец другой боковой цепи. Второй фермент - амило-1,6-глюкозидаза - отщепляет от главной цепи четвертый остаток глюкозы. После этого главная цепь гликогена становится доступной для фосфорилазы. В реакции, катализируемой амило-1,6-глюкозидазой, образуется глюкоза .
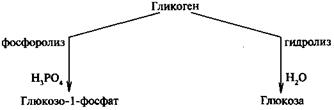
Гликогенолиз – это просто распад накопившегося в печени гликогена до глюкозо-6-фосфата. Последний под действием специфической фосфатазы (содержащейся в печени, но не в мышцах) расщепляется с высвобождением в кровь свободной глюкозы.
Это высвобождение глюкозы из печени, по-видимому, служит адекватным средством адаптации к острым потребностям, но постоянная концентрация глюкозы в крови не могла бы сохраняться длительное время, даже если бы весь гликоген из печени поступил в кровь в виде глюкозы. Масса печени человека – около 1500 г; если на долю гликогена приходится даже 4% массы органа, то полный гликогенолиз мог бы обеспечить поступление в кровь не более 60 г глюкозы (или всего 240 калорий) в условиях длительного лишения глюкозы (при голодании) или в отсутствие реабсорбции глюкозы в почках (при флоридзиновом диабете), для эффективного поддержания постоянной концентрации глюкозы в крови необходимо участие какого-то иного механизма. Этот другой, длительный процесс, происходящий в печени, называется глюконеогенез.
Задача № 6
Введение животным адреналина вызывает гипергликемию. Почему это не наблюдается у животных с удаленной печенью? Почему неэффективно введение лактата, пирувата и галактозы в этом случае?
Для обоснования ответа:
1. Вспомните, какова роль печени в обмене углеводов?
2. Объясните гипергликемический эффект адреналина.
Ответ к задаче №6
Гипергликемия объясняется тем, что в печени протекают процессы, являющиеся источником глюкозы для крови (распад гликогена и ГНГ), которые стимулируются адреналином.
У животных, лишенных печени, эти процессы не происходят, как и процесс унификации галактозы.
Роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени.
Адреналин выделяется из клеток мозгового вещества надпочечников в ответ на сишалы нервной системы, идущие из мозга при возникновении экстремальных ситуаций (например, бегство или борьба), требующих внезапной мышечной деятельности. Адреналин является сигналом "тревоги". Он должен мгновенно обеспечить мышцы и мозг источником энергии.
Задача № 7
Описано два типа заболеваний. Для одного характерен дефект фосфорилазы мышц, для другого - печени. Назовите признаки этих заболеваний. Как изменится концентрация лактата в крови после физической нагрузки? Какова реакция больных на введение глюкагона?
Для ответа:
1. Вспомните, в каком процессе участвует фосфорилаза?
2. Напишите схему процесса. Чем различаются эти процессы в печени и мышцах?
3. В каком случае физическая нагрузка сопровождается гиперлактатемией?
4. Что такое глюкагон? Его участие в регуляции углеводного обмена.
Ответ к задаче №7
При дефекте фосфорилазы мышц будет наблюдаться мышечная слабость. При дефекте фосфорилазы печени будут увеличены размеры этого органа, наблюдается гипогликемия. Концентрация лактата после физической нагрузки не изменится. Введение глюкагона вызовет гипергликемию за счет стимуляции глюконеогенеза.
1.Фосфорилазы переводят полисахариды (в частности, гликоген) из запасной формы в метаболически активную форму; в присутствии фосфо-рилазы гликоген распадается с образованием фосфорного эфира глюкозы (глюкозо-1-фосфата) без предварительного расщепления на более крупные обломки молекулы полисахарида. В общей форме эту реакцию можно представить в следующем виде: (C6H10O5)n+ H3PO4–> (C6H10O5)n–1+ Глюкозо-1-фосфат, где (С6Н10О5)n означает полисахаридную цепь гликогена, а (С6Н10О5)n-1,– ту же цепь, но укороченную на один глюкозный остаток. На рис. 10.1 изображены процесс распада гликогена до глюкозо-1-фосфата и участие в этом процессе цАМФ. Фермент фосфорилаза существует в двух формах, одна из которых (фосфорилаза а) активна, в то время как другая (фосфорилаза b) обычно неактивна. Обе формы могут диссоциировать на субъединицы. Фосфорилаза b состоит из двух субъединиц, а фосфорилаза а – из четырех. Превращение фосфо-рилазы b в фосфорилазу а осуществляется фосфорилированием белка: 2 Фосфорилаза b + 4 АТФ –> Фосфорилаза а + 4 АДФ.
2.Диапазон нормальных значений лактата менее 1,8ммоль/л.
При непродолжительных физических нагрузках уровень лактата может повышаться на некоторое время до 15ммоль/л, но увеличение показателя до 8ммоль/л в течение продолжительного времени у пациентов, получающих интенсивную терапию, указывает на высокую степень вероятности летального исхода. Причинами увеличения показателя лактата (гиперлактемия) могут быть кислородное голодание и метаболические причины. Следует помнить, что лейкоцитоз может вызывать увеличение концентрации лактата максимум до 2,7 мг/дл или 0,3 ммоль/л.
Задача № 8
Один спортсмен пробежал дистанцию 100 м, а другой – 5000 м. У которого из них будет выше содержание молочной кислоты в крови и почему?
Для обоснования ответа вспомните:
1. Продуктом какого процесса является молочная кислота?
2. В каких условиях происходит окисление глюкозы в мышцах у первого и второго спортсмена?
3. Чем отличается энергетический выход при этих процессах?
Ответ к задаче №8
У спортсмена, пробежавшего 100 м, содержание молочной кислоты в крови будет выше, чем у бегуна на длинные дистанции, так как в этом случае спортсмен получает энергию за счет гликолиза, конечным продуктом которого является лактат.
Молочная кислота формируется при распаде глюкозы. Иногда называемая «кровяным сахаром», глюкоза является главным источником углеводов в нашем организме. Это основное топливо для мозга и нервной системы, так же как и для мышц во время физической нагрузки. Когда расщепляется глюкоза, клетки производят АТФ (аденозинтрифосфат), который обеспечивает энергией большинство химических реакций в организме. Уровень АТФ определяет, как быстро и как долго наши мышцы смогут сокращаться при физической нагрузке.
Задача № 9
При добавлении АТФ к гомогенату мышечной ткани снизилась скорость гликолиза. Концентрация глюкозо-6-фосфата и фруктозо-6-фосфата увеличилась, а концентрация всех других метаболитов при этом снизилась. Укажите фермент, активность которого снижается при добавлении АТФ.
Для ответа вспомните:
1. Что такое гликолиз?
2. Почему при добавлении АТФ увеличивается концентрация глюкозо-6-фосфата и фруктозо-6-фосфата?
3. Почему снижается концентрация остальных метаболитов?
Ответ к задаче №9
АТФ является аллостерическим ингибитором фосфофруктокиназы – ключевого (лимитирующего) фермента гликолиза. Поэтому повышается концентрация метаболитов предшествующих реакций и снижается количество метаболитов последующих реакций.
Гликолиз — это катаболический путь обмена веществ в цитоплазме; он, по-видимому, протекает почти во всех организмах и клетках независимо от того, живут они в аэробных или анаэробных условиях. Баланс гликолиза простой: в аэробных условиях молекула глюкозы деградирует до двух молекул пирувата. Кроме того, образуются по две молекулы АТФ и НАДН + H+ (аэробный гликолиз). В анаэробных условиях пируват претерпевает дальнейшие превращения, обеспечивая при этом регенерацию НАД+ (см. с. 148). При этом образуются продукты брожения, такие, как лактат или этанол (анаэробный гликолиз). В этих условиях гликолиз является единственным способом получения энергии для синтеза АТФ из АДФ и неорганического фосфата.
Задача № 12
Синтез глюкозы – это процесс, требующий затраты энергии. Рассчитайте энергетический выход окисления сахарозы до углекислого газа и воды. Сколько АТФ при этом образуется?
Для расчета вспомните:
1. Что такое сахароза?
2. Каким превращениям в организме подвергается сахароза?
3. Напишите схему превращений.
Ответ к задаче №12
76 молекул АТФ.
Сахароза C12H22O11, или свекловичный сахар, тростниковый сахар, в быту просто сахар — дисахаридиз группы олигосахаридов, состоящий из двух моносахаридов — α-глюкозы и β-фруктозы.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многихфруктах, плодах и ягодах. Особенно велико содержание сахарозы в сахарной свёкле и сахарном тростнике, которые и используются для промышленного производства пищевого сахара.
Сахароза имеет высокую растворимость. В химическом отношении сахароза довольно инертна, так как при перемещении из одного места в другое почти не вовлекается в метаболизм. Иногда сахароза откладывается[где?] в качестве запасного питательного вещества.
Переваривание сахарозы начинается в тонком кишечнике. Кратковременное воздействие амилазы слюны существенной роли не играет, так как в просвете желудка кислая среда инактивирует этот фермент. В тонком кишечнике сахароза под действием фермента сахаразы, продуцируемой клетками кишечника, не выделяясь в просвет, а действуя на поверхности клеток (пристеночное пищеварение) Расщепление сахарозы приводит к высвобождению глюкозы и фруктозы. Проникновение моносахаридов через клеточные мембраны (всасывание) происходит путем облегченной диффузии при участии специальных транслоказ. Глюкоза всасывается еще и путем активного транспорта за счет градиента концентрации ионов натрия. Это обеспечивает ее всасывание даже при низкой концентрации в кишечнике. Основной моносахарид, поступающий в кровоток из кишечника, - глюкоза. С кровью воротной вены она доставляется в печень, частично задерживается клетками печени, частично поступает в общий кровоток и извлекается клетками других органов и тканей.
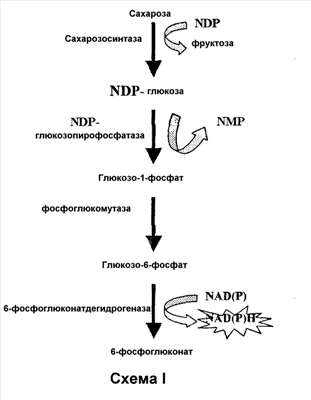
Задача № 13
Сколько молекул АТФ нужно затратить на синтез 10 молекул глюкозы из пирувата?
Для расчета:
1. Вспомните, как называется процесс синтеза глюкозы?
2. Напишите схему процесса синтеза глюкозы из пирувата.
3. Какие реакции идут с участием АТФ?
Ответ к задаче №13
60 молекул АТФ
1.Глюконеогенез — процесс образования в печени и отчасти в корковом веществе почек (около 10 %) молекул глюкозы из молекул других органических соединений — источников энергии, например свободных аминокислот, молочной кислоты, глицерина. Свободные жирные кислоты у млекопитающих для глюконеогенеза не используются.