- •Термодинамические параметры состояния (τ,ρ,V)
- •Основные законы идеальных газов. Уравнение состояния идеальных газов.
- •Эквивалентность теплоты и работы газов.
- •Внутренняя энергия газов (идеальных и реальных).
- •Аналитическое выражение работы газов.
- •Энтальпия жидкости и газа. Уравнение энтальпии.
- •Теплоёмкость идеальных газов. Уравнение Майера.
- •Термодинамические процессы идеальных газов. Изобарный процесс.
- •Термодинамические процессы идеальных газов. Адиабатный процесс.
- •Термодинамические процессы идеальных газов. Политропный процесс.
- •Второй закон термодинамики. Понятие о круговом процессе.
- •Цикл Карно и его термодинамическое значение.
- •Обратный цикл Карно. Определение холодильного коэффициента.
- •Процесс парообразования воды в координатах р-V
- •Дросселирование пара и газа.
- •Теплоёмкость. Определение и выражение теплоемкости.
- •Внутренняя энергия рабочего тела.
- •Силы, действующие в газе. Условие равновесия газов.
- •Законы движения газов.
- •Напор газов при движении в замкнутом пространстве.
- •Виды и режимы движения жидкости и газов.
- •Расчет сопротивлений при движении жидкости и газов. Потери напора
- •Местные потери напора.
- •Движение газов в замкнутом пространстве печи. Геометрические потери энергии движения газов.
- •Определение потерь напора на трение.
- •Общие положения теории подобия.
- •Критерий подобия Нуссельта. Характеристика критерия.
- •Критерий подобия Рейнольдса. Характеристика критерия.
- •Критерий Грасгофа. Характеристика критерия.
- •Виды и режимы теплообмена.
- •Стационарная теплопроводность.
- •Нестационарная теплопроводность.
- •Основной закон Стефана-Больцмена при излучении.
- •Закон Ньютона и коэффициент теплоотдачи.
- •Теплообмен между серыми телами в лучепрозрачной среде.
- •Излучение и поглощение в газах. Коэффициенты излучения некоторых тел и газов.
- •Сложный теплообмен и теплопередача.
- •Передача тепла через многослойную вертикальную стенку теплопроводностью.
- •Теплообмен излучением. Распределение лучистой энергии падающей на тело.
- •Изменение температуры по толщине однослойной цилиндрической стенки.
- •Понятие об условном топливе.
- •Химический состав топлива.
- •Теплота сгорания топлива. Определение теоретического объёма воздуха для горения метана.
Термодинамические процессы идеальных газов. Политропный процесс.
Политропный процесс Уравнение политропного процесса имеет вид
![]()
где n - показатель политропы, который изменяется для разных процессов от 0 до + бесконечности. Рассмотренные ранее процессы являются частными случаями иолитроппых процессов:

если n = к, то pvk = const — адиабатный процесс; если n = 1, то pv = const — изотермический процесс; если n = 0, то pv0 = p = const — изобарный процесс; если n ± ?, то представив pvn = const как рn v = const, имеем v=const — изохорный процесс. Показатель изотропы n можно определить, если известны два состояния политропном процесс
![]()
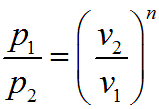

Графическое изображение политропного процесса в р—v-диа-грамме имеет вид кривой, которая называется политропой. Соотношение параметров данного процесса можно получить, заменив в уравнениях адиабатного процесса показатель степени k на показатель n: Изменение внутренней энергии в политропном процессе для произвольной массы вещества определяется по формуле
Работа изменения объема в политропном процессе для 1 кг рабочего тела равна
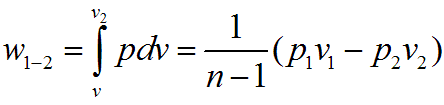
или, учитывая уравнение состояния Клапейрона,
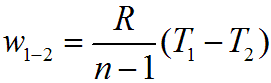
Для произвольной массы газа
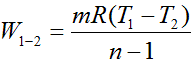
Количество теплоты в политропном процессе для m кг вещества определяется выражением, полученным в соответствии с первым законом термодинамики
![]()
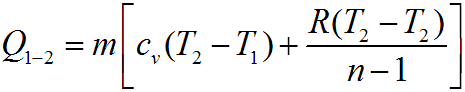
Второй закон термодинамики. Понятие о круговом процессе.
В изолированной термодинамической системе через некоторый промежуток времени устанавливается внутреннее равновесие, при котором рабочее тело по всей массе имеет одинаковую температуру и давление.
При равенстве давлений в системе и в окружающей среде изменение объема рабочего тела прекращается, и передача энергии в форме работы отсутствует (система находится в механическом равновесии со средой). Равенство температур рабочего тела и среды обеспечивает термическое равновесие. При этом между системой и окружающей средой не возникает передачи энергии в форме теплоты. Термодинамический процесс возможен только при нарушении механического или термического равновесия, и чем сильнее нарушается равновесие, тем быстрее протекает процесс. Все реальные термодинамические системы не изолированы от окружающей среды, которая выводит их из равновесия. Поэтому они являются неравновесными. Учитывая чрезвычайную сложность теплотехнических расчетов таких процессов, на практике их заменяют равновесными, то есть такими, при которых система проходит последовательно бесчисленное множество равновесных состояний. Эти равновесные процессы называют квазистатическими.
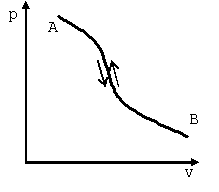
|
Рис.. Линии обратимых прямого A-B и обратного B-A процессов на pv-диаграмме |
Различают механически и термически обратимые процессы.
В механически обратимом процессе обмен энергией между системой и окружающей средой протекает в форме работы при бесконечно малой разности давлений.
В термически обратимом процессе термодинамическая система обменивается с окружающей средой энергией в форме теплоты при бесконечно малой разности температур.
Любой равновесный термодинамический процесс изменения состояния рабочего тела будет всегда обратимым. Обратимые процессы являются идеальными.
Действительные термодинамические процессы совершаются при конечной разности давлений и температур рабочего тела и окружающей среды и поэтому являются неравновесными. Такие процессы необратимы.
Необратимый термодинамический процесс – это процесс, при котором система не возвращается в исходное состояние после обратного процесса. Все необратимые процессы протекают в направлении достижения в термодинамической системе равновесия, то есть выравнивания в ней давлений, температур, концентраций.
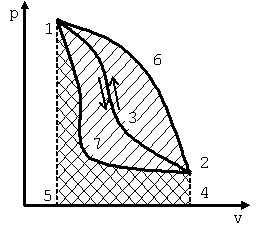
При однократном расширении рабочего тела можно получить ограниченное количество работы. Поэтому разомкнутый процесс непригоден для непрерывного превращения теплоты в работу. Для повторного получения работы необходимо возвратить рабочее тело в исходное состояние, то есть сжать рабочее тело. На сжатие рабочего тела должна быть затрачена работа. Эта работа подводится от какого-либо внешнего источника. Причём процесс сжатия рабочего тела должен осуществляться по пути, отличному от пути процесса расширения. В противном случае суммарная работа, полученная в результате кругового процесса, будет равна нулю. Поэтому путь процесса сжатия выбирается таким, чтобы работа сжатия по абсолютной величине была меньше работы расширения. На рис. 5.2 приведен круговой процесс, в котором рабочее тело расширяется по кривой 1-3-2. При этом работа расширения численно равна площади 132451. Процесс возвращения рабочего тела из конечного состояния 2 в начальное состояние 1 может осуществляться одним из следующих путей:
|
Рис. 5.2. К выбору кругового процесса |
2. По кривой сжатия 2-6-1, расположенной над кривой расширения 1-3-2. При этом работа сжатия (площадь 261542) больше работы расширения (площадь 132451). Суммарная работа в таком круговом цикле будет отрицательной.
3. По кривой сжатия 2-7-1, расположенной ниже кривой расширения. В этом круговом процессе работа расширения (площадь 132451) больше работы сжатия (площадь 271542), а площадь, ограниченная замкнутой кривой 1-3-2-7-1, представляет собой работу цикла. Следовательно, чтобы работа была положительной, нужно, чтобы кривая сжатия 2-7-1 в pv-диаграмме была расположена ниже кривой расширения 1-3-2. Многократно повторяя такой круговой процесс, можно за счёт подвода теплоты получить любое количество работы.
Циклы, в которых теплота превращается в положительную работу, называютсяпрямыми. Такие циклы в pv-диаграмме протекают по часовой стрелке. По прямым циклам работают тепловые двигатели.
Цикл, в котором получается отрицательная работа, называется обратным. В нём работа сжатия больше работы расширения. По обратным циклам работают холодильные машины.
Циклы могут быть обратимыми и необратимыми. Обратимым термодинамическим циклом называется цикл, все процессы которого обратимы. Необратимым термодинамическим циклом называется цикл, в котором хотя бы один из составляющих его процессов необратим.