
- •Термодинамические параметры состояния (τ,ρ,V)
- •Основные законы идеальных газов. Уравнение состояния идеальных газов.
- •Эквивалентность теплоты и работы газов.
- •Внутренняя энергия газов (идеальных и реальных).
- •Аналитическое выражение работы газов.
- •Энтальпия жидкости и газа. Уравнение энтальпии.
- •Теплоёмкость идеальных газов. Уравнение Майера.
- •Термодинамические процессы идеальных газов. Изобарный процесс.
- •Термодинамические процессы идеальных газов. Адиабатный процесс.
- •Термодинамические процессы идеальных газов. Политропный процесс.
- •Второй закон термодинамики. Понятие о круговом процессе.
- •Цикл Карно и его термодинамическое значение.
- •Обратный цикл Карно. Определение холодильного коэффициента.
- •Процесс парообразования воды в координатах р-V
- •Дросселирование пара и газа.
- •Теплоёмкость. Определение и выражение теплоемкости.
- •Внутренняя энергия рабочего тела.
- •Силы, действующие в газе. Условие равновесия газов.
- •Законы движения газов.
- •Напор газов при движении в замкнутом пространстве.
- •Виды и режимы движения жидкости и газов.
- •Расчет сопротивлений при движении жидкости и газов. Потери напора
- •Местные потери напора.
- •Движение газов в замкнутом пространстве печи. Геометрические потери энергии движения газов.
- •Определение потерь напора на трение.
- •Общие положения теории подобия.
- •Критерий подобия Нуссельта. Характеристика критерия.
- •Критерий подобия Рейнольдса. Характеристика критерия.
- •Критерий Грасгофа. Характеристика критерия.
- •Виды и режимы теплообмена.
- •Стационарная теплопроводность.
- •Нестационарная теплопроводность.
- •Основной закон Стефана-Больцмена при излучении.
- •Закон Ньютона и коэффициент теплоотдачи.
- •Теплообмен между серыми телами в лучепрозрачной среде.
- •Излучение и поглощение в газах. Коэффициенты излучения некоторых тел и газов.
- •Сложный теплообмен и теплопередача.
- •Передача тепла через многослойную вертикальную стенку теплопроводностью.
- •Теплообмен излучением. Распределение лучистой энергии падающей на тело.
- •Изменение температуры по толщине однослойной цилиндрической стенки.
- •Понятие об условном топливе.
- •Химический состав топлива.
- •Теплота сгорания топлива. Определение теоретического объёма воздуха для горения метана.
Вопросы по «теплофизике»
Основы технической термодинамики.
Термодинамические параметры состояния (τ,ρ,V)
Термодинамическая система характеризуется определенными значениями ее свойств. Эти свойства термодинамического тела (системы) называются параметрами состояния.
Параметры состояния – любая величина, присущая телу, изменение которой определяется только начальным и конечным состоянием тела и не зависит от характера процесса изменения его состояния, при переходе его из первого состояния во второе. Параметры можно разделить на две группы:
Интенсивные – которые не зависят от количества вещества и при взаимодейтсвии тел выравниваются (температура, давление и т.п.);
Экстенсивные – зависящие от количества вещества, следующие закону сложения или, как говорят математики, закону аддитивности (масса, обьем, внутренняя энергия и т.п.).
Измерение экстенсивной величины производится сравнением ее с такой же по природе величиной, выбранной за единицу – эталон (метр, килограмм и т.п.). Измерение интенсивной величины основано на использовании объективной связи между изменениями этой интенсивной величины и какой-либо экстенсивной величины. Например, связь температуры и объема жидкости в термометре приводит к измерению температуры с помощью длины столбика жидкости в термометре.
Некоторые экстенсивные величины приобретают свойства интенсивных, если их рассматривают применительно к единице массы данного вещества (удельные объем, энтальпия и т.п.).
Все термодинамические параметры введены человеком для удобства изучения окружающего мира. Однако не все параметры поддаются измерению приборами. Ряд параметров, не поддающихся измерению, человек ввел для удобства расчета термодинамических процессов. Эти параметры получаются расчетным путем и имеют в размерности величину работы (энергии) Дж или кал. Например, к ним относятся энтальпия и энтропия. Такие параметры получили название – энергетических или калорических параметров, или функций состояния. Параметры, которые возможно измерить приборами, называются термическими. Например, к этим параметрам относятся температура и давление.
Основные законы идеальных газов. Уравнение состояния идеальных газов.
Уравнением состояния называется уравнение, связывающее параметры физической системы и однозначно определяющее ее состояние.
В 1834 г. французский физик Б. Клапейрон, работавший дли тельное время в Петербурге, вывел уравнение состояния идеального газа для постоянной массы газа. В 1874 г. Д. И. Менделеев вывел уравнение для произвольного числа молекул.
В МКТ и термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m.
Мы
знаем, что ![]() .
Следовательно,
.
Следовательно, ![]() .
Учитывая, что
.
Учитывая, что ![]() ,
получим:
,
получим: ![]() .
.
Произведение
постоянных величин есть величина
постоянная, следовательно: ![]() -
универсальная газовая постоянная
(универсальная, т.к. для всех газов
одинаковая).
-
универсальная газовая постоянная
(универсальная, т.к. для всех газов
одинаковая).
Таким образом, имеем:
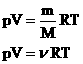 -
уравнение состояния (уравнение Менделеева
– Клапейрона).
-
уравнение состояния (уравнение Менделеева
– Клапейрона).
![]()
1. Закон Авогадро.
В равных объемах различных газов при одинаковых внешних условиях находится одинаковое число молекул (атомов).
Условие: V1=V2=…=Vn; p1=p2=…=pn; T1=T2=…=Tn
2. Закон Дальтона.
Давление смеси газов равно сумме парциальных (частных) давлений каждого газа.
Доказать: p=p1+p2+…+pn
Доказательство: 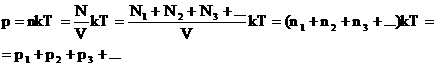
3. Закон Паскаля.
Давление, производимое на жидкость или газ, передается во все стороны без изменения.
