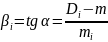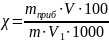- •Углеводы и методы их определения
- •Введение
- •1 Литературный обзор
- •1.1 Общая характеристика углеводов
- •1.2 Химические свойства моносахаридов и полисахаридов
- •1) Реакции карбонильной группы
- •2) Реакции гидроксильных групп
- •3) Кето – енольная таутомерия
- •4) Реакция Молиша
- •5) Реакция Селиванова
- •6) Реакции брожения
- •7) Важные производные моносахаридов
- •8) Реакция Майяра
- •9) Ферментативный гидролиз полисахаридов
- •2 Экспериментальная часть
- •2.1 Методика фотоколориметрического определения общего сахара в кондитерских изделиях
- •2.2 Определение крахмала в зерновом сырье по методу Эверса
- •2.3 Методика определения сахара в сухих винах с использованием колоночной хроматографии методом рефрактометрии
- •Область применения
- •Заключение
- •2) Определение крахмала в зерновом сырье по методу Эверса
- •Список основных источников
8) Реакция Майяра
Реакция Майяра — химическая реакция между аминокислотой и сахаром, которая, как правило, происходит при нагревании.
При взаимодействии аминогрупп белков и аминокислот с карбонильными группами углеводов происходит реакция меланоидинообразования. Это окислительно – восстановительный процесс с образованием различных промежуточных продуктов, конечные продукты реакции – меланоидины имеют коричневый цвет, влияют на цвет и вкус готовых продуктов. Реакция Майяра происходит при сушке солода, при кипячении сусла с хмелем, при выпечке хлеба, при варке сахарных сиропов, при переработке овощей и фруктов. Скорость и глубина реакции меланоидинообразования зависит от состава продукта, уровня рН среды (более благоприятна слабощелочная среда), температура, влажность. Меланоидинообразование снижает активность витаминов и ферментов, что приводит к снижению пищевой ценности продуктов.
Начальная стадия реакции Майяра:

 Н
– C
= O
H
– C
= NR
H
– C
= NNR
H2
–
C
– NNR
Н
– C
= O
H
– C
= NR
H
– C
= NNR
H2
–
C
– NNR
H OH +H2NR HO H H OH = O
HO H –H2O HO H HO H HO H
H OH H OH HO H H OH
H OH H OH H OH H OH
CH2 – OH CH2 – OH CH2 – OH CH2 – OH
глюкоза основание Шиффа енаминол соединение Амадори
9) Ферментативный гидролиз полисахаридов
Гидролиз крахмала осуществляют амилолитические ферменты. Фермент α – амилаза гидролизует крахмал действуя хаотично, разрывает 1,4 связь с образованием декстринов и небольшого количества мальтозы. Фермент α – амилаза действуя на крахмальное зерно образует каналы, раскалывая полисахарид на части.
2 Экспериментальная часть
2.1 Методика фотоколориметрического определения общего сахара в кондитерских изделиях
Общая характеристика метода
Определение состава вещества и контроль его чистоты являются важнейшими факторами при производстве пищевых продуктов. Наряду с химическими методами анализа в настоящее время широко применяются физические методы. Они позволяют осуществлять как быстрый контроль (в течении нескольких минут) больших партий продукции, так и специфический анализ продуктов, витаминов, упаковочных материалов, лекарств и т.д. Одним из таких физических методов является спектральный анализ, основанный на взаимодействии лучистой энергии с исследуемым образцом – метод абсорбционной спектрофотоколориметрии. Методы абсорбционной спектроскопии имеют высокую чувствительность (низкий предел обнаружения), они избирательны и точны. Методы могут быть применены для анализа больших и малых содержаний, но особенно ценной особенностью является возможность определения примесей (до 10−5 – 10−6 %). Важное значение имеет избирательность многих фотометрических методов, позволяющая проводить определения элементов в сложных пробах без химического разделения компонентов. Погрешность фотометрических методов обычно составляет 3 – 5%, уменьшаясь в благоприятных случаях до 1 – 2% и нередко до 0,5 – 1,0%.
Основной закон светопоглощения
Атом, ион или молекула, поглощая квант света, переходит в более высокое энергетическое состояние. Обычно это бывает переход с основного, невозбужденного уровня на один и более высокий, чаще всего на первый возбужденный уровень. Вследствие поглощения излучения при прохождении его через слой вещества интенсивность излучения уменьшается и тем больше, чем выше концентрация светопоглощающего вещества.
Закон Бугера – Ламберта – Бера (основной закон светопоглощения) связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя. Закон Бугера – Ламберта – Бера можно представить в виде графической зависимости оптической плотности от концентрации (см. рисунок 2.1).
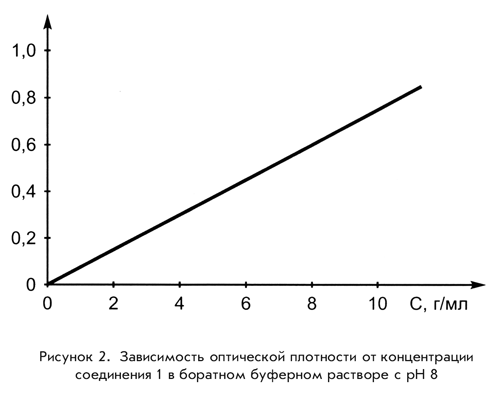
Рисунок 2.1 – Графическое изображение зависимости оптической плотности от концентрации
Чтобы учесть потери света на отражение и рассеяние, сравнивают интенсивности света, прошедшего через исследуемый раствор и растворитель (см. рисунок 2.2). При одинаковой толщине слоя в кюветах из одинакового материала, содержащих один и тот же растворитель, потери на отражение и рассеяние света будут примерно одинаковы у обоих пучков и уменьшение интенсивности света, будет зависеть от концентрации вещества.

Рисунок 2.2 – Прохождение света через окрашенный раствор и растворитель
Уменьшение интенсивности света, прошедшего через раствор, характеризуется коэффициентом пропускания (или просто пропусканием) Т:
|
|
(2.1) |
где I и I0 – соответственно интенсивности света, прошедшего через раствор и растворитель.
Взятый с обратным знаком логарифм Т называется оптической плотностью А:
|
|
(2.2) |
Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера – Ламберта – Бера:
|
|
(2.3) |
где ξ – молярный коэффициент поглощения (коэффициент экстинкции);
l – толщина светопоглощающего слоя;
С – концентрация раствора.
Физический смысл ε становится ясным, если принять l = 1 см и С = 1 моль/л, тогда А = ξ. Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора при толщине слоя 1 см.
Оптическая плотность раствора, содержащего несколько окрашенных веществ, обладает свойством аддитивности, которое иногда называют законом аддитивности светопоглощения. В соответствии с этим законом поглощение света, каким – либо веществом не зависит от присутствия в растворе других веществ. При наличии в растворе нескольких окрашенных веществ каждое из них будет давать свой аддитивный вклад в экспериментально определяемую оптическую плотность А:
|
A = A1 +A2 + A3 +…+ An, |
(2.4) |
где А1, А2, А3, …, An – оптическая плотность вещества 1, вещества 2 и т.д.
При учете уравнения (2.3) получаем:
|
A = l · (ξ1C1 + ξ 2C2 + ξ 3C3 + … + ξ nCn) |
(2.5) |
Оптимальные условия фотометрических определений
Выбор светофильтра
Для того, чтобы выделить лучи определенной длины волны, на пути светового потока помещают светофильтры. Светофильтры пропускают лучи лишь в определенном интервале длин волн и практически полностью поглощают лучи других длин волн. В качестве светофильтров применяют цветные стекла, пленки, окрашенные растворы.
Для каждого конкретного анализа светофильтр выбирают, исходя из спектра поглощения, таким образом, чтобы область максимального поглощения лучей исследуемым раствором и область максимального пропускания лучей светофильтром были одинаковы. При проведении анализа светофильтр подбирают экспериментально. Для этого приготавливают две пробы исследуемого раствора различной концентрации и измеряют их оптические плотности со всеми имеющимися светофильтрами. Затем для каждого светофильтра находят разность оптической плотности ∆А, соответствующую разности концентраций ∆С исследуемых проб. Тот светофильтр, для которого ∆А получается максимальной, выбирают для фотометрирования данного окрашенного раствора. Иногда используют менее точный, но более быстрый прием: выбирают светофильтр по цвету исследуемого раствора.
Таблица 2.1 – Выбор светофильтра по цвету исследуемого раствора
Цвет раствора |
Область максимального поглощения лучей раствором, нм |
Цвет светофильтра |
Желто − зеленый |
400 – 450 |
Фиолетовый |
Желтый |
450 – 480 |
Синий |
Оранжевый |
480 – 490 |
Зелено − синий |
Красный |
490 – 500 |
Сине − зеленый |
Пурпурный |
500 – 560 |
Зеленый |
Фиолетовый |
560 – 575 |
Желто − зеленый |
Синий |
575 – 590 |
Желтый |
Зелено − синий |
590 – 625 |
Оранжевый |
Сине − зеленый |
625 − 700 |
Красный |
Выбор длины волны поглощаемого излучения
Окрашенные соединения обладают избирательным поглощением света, т.е. А окрашенного раствора (а следовательно, и ελ) различна для различных длин волн падающего света.
Изучая поглощение данным окрашенным раствором монохроматических излучений различных длин волн, получают спектр поглощения (см. рисунок 2.3).
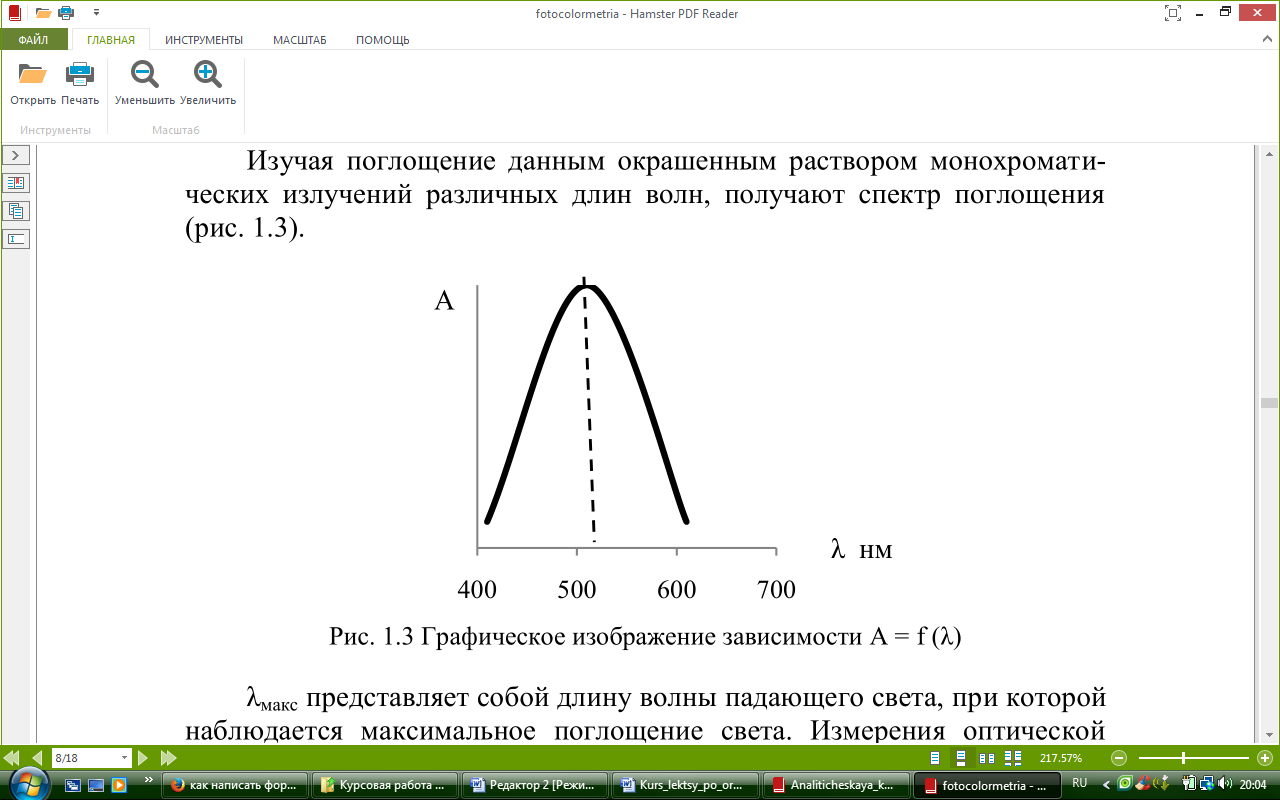
Рисунок 2.3 – Графическое изображение оптической плотности от длины волны
λmax представляет собой длину волны падающего света, при которой наблюдается максимальное поглощение света. Измерения оптической плотности окрашенных растворов обычно производят в области максимального поглощения, т.е. при длине волны падающего света близкой к λmax , при этом точность фотометрического определения увеличивается (см. рисунок 2.4).
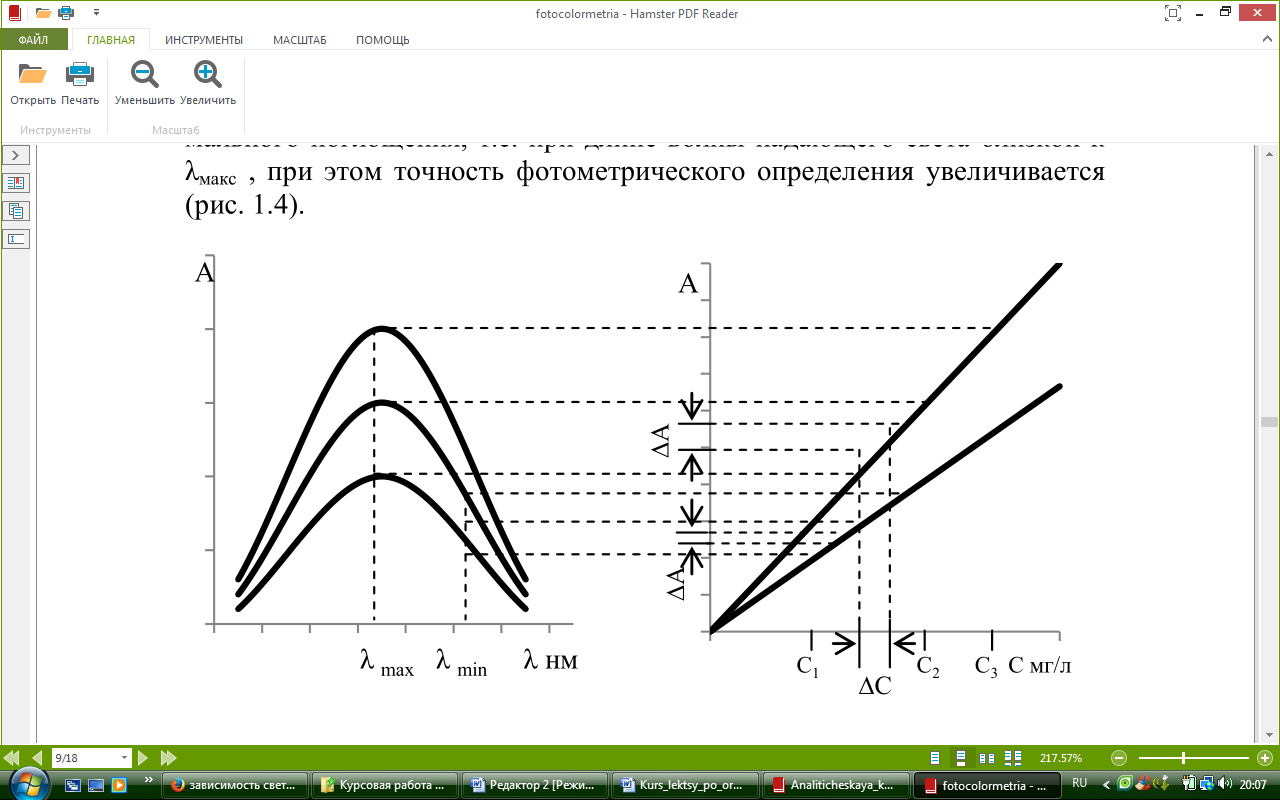
Рисунок 2.4 – Сравнение точности измерения оптической плотности раствора при различных длинах волн поглощаемого света
Сущность фотоколориметрического определения общего сахара в кондитерских изделиях
Определение основано на окислении сахаров сернокислым раствором двухромовокислого калия до углекислоты и воды при нагревании и колориметрии образующегося при этом иона Cr3+, количество которого эквивалентно количеству вступившего в реакцию сахара.
C12H22O11+ H2O → C6H12O6 + C6H12O6
сахароза глюкоза фруктоза
C6H12O6 + 4К2Сr2O7 + 16H2SO4 ↔ 6CO2 + 22H2O + Cr2(SO4)3 + 4K2SO4
Оборудование
1) Колориметр КФК − 2МП;
2) Аналитические весы;
3) Фарфоровая ступка с пестиком;
4) Колбы мерные объемом 250 см3 (1 шт.) и 50 см3 (5 шт.);
5) Баня водяная;
6) Пипетки объемом 5 см3 и 10 см3;
7) Химический стакан объемом 100 см3;
8) Фильтры бумажные.
Применяемые реактивы
1) Стандартный раствор сахарозы с концентрацией 4 мг/см3. Навеску 1 г сахарозы х.ч. количественно перенести в мерную колбу на 250 см3 через воронку, заполнить на ¾ дистиллированной водой и перемешать содержимое колбы до полного растворения сахарозы, объем колбы довести до метки дистиллированной водой.
2) Сернокислый раствор дихромата калия. Раствор №1 − навеску 49 г К2Сr2O7 растворить в 300 см3 дистиллированной воды. Раствор №2 − отдельно растворить 300 см3 H2SO4 (ρ = 1,84 г/ см3) в 300 см3 дистиллированной воды. Полученный раствор 1 и раствор 2 смешать при медленном и постепенном сливании, так как смешивание растворов сопровождается выделением тепла.
3) Раствор сульфата цинка.
4) Раствор гидроксида натрия.
5) Дистиллированная вода.
6) Карамель.
Колориметр фотоэлектрический концентрационный КФК−2МП
Колориметр фотоэлектрический концентрационный КФК−2МП предназначен для измерения оптической плотности растворов в отдельных участках диапазона длин волн 315 – 980 нм, выделяемых светофильтрами.
Принцип действия колориметра основан на поочередном измерении светового потока, прошедшего через растворитель (контрольный раствор), и потока, прошедшего через исследуемую среду. Внешний вид прибора представлен в соответствии с рисунком 2.5.
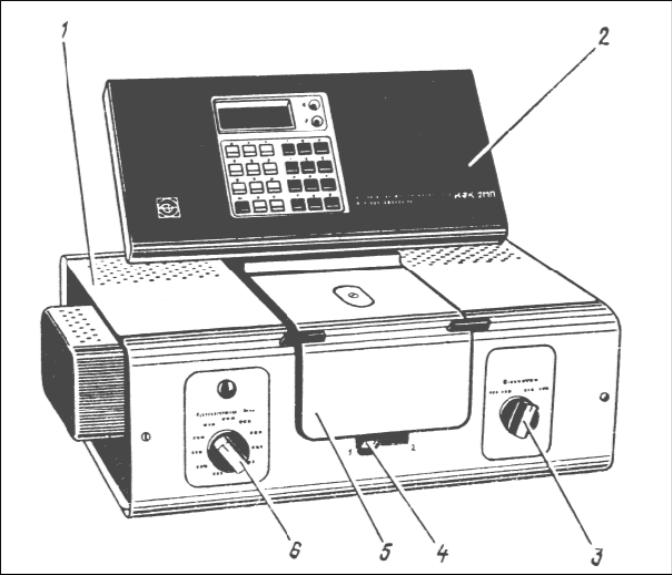
Рисунок 2.5 – Колориметр КФК − 2МП
1 – колориметрический блок с осветителем; 2 – вычислительный блок; 3 – ручка переключения фотоэлементов фотоколориметрического устройства; 4 – ручка перемещения кювет: в положении 1 в световой поток вводится кювета с растворителем (контрольным раствором), в положении 2 в световой поток вводится кювета с исследуемым раствором; 5 – крышка кюветного отделения; 6 – ручка переключения фотоэлементов колориметрического блока.
Порядок работы фотоколориметра
1) Открыть крышку кюветного отделения.
2) Включить тумблер на задней панели прибора не позднее, чем за 15 мин до начала работы. Внимание! При включенном приборе и пустом кюветном отделении закрывать крышку нельзя.
3) Нажать клавишу «Пуск», на цифровом табло появляется мигающая запятая и загорается индикатор «Р».
4) Нажать клавишу «Ш(0)». На цифровом табло справа от мигающей запятой высвечивается значение в интервале 0,001–1,000, а слева от запятой – «0».
5) С помощью ручки 6 выбрать нужное значение длины волны λ.
6) С помощью ручки 4 выбрать нужный светофильтр.
7) В одну кювету налить контрольный раствор до риски на боковой стенке кюветы, в другую – калибровочный раствор или образец. Протереть с внешней стороны фильтровальной бумагой.
8) В дальнее гнездо кюветодержателя (положение 1) установить кювету с контрольным раствором, в ближнее (положение 2) – кювету с образцом или калибровочным раствором. Закрыть крышку кюветного отделения.
9) Установить положение 1 кюветодержателя. Нажать клавишу «К(1)». На цифровом табло слева от мигающей запятой загорается символ «1».
10) Установить положение 2 кюветодержателя. Нажать клавишу «Д(5)». На световом табло, слева от мигающей запятой загорается символ «5», что свидетельствует о том, что оптическая плотность раствора замерена. Записать справа от мигающей запятой полученные цифры.
11) Повторить по 3 раза для калибровочных и испытуемого растворов п. 3 – 10 и найти среднее арифметическое значение оптической плотности для каждого раствора.
Выполнение работы
1) Подготовка образца к анализу
Навеску 1 г измельченного и хорошо перемешанного продукта (карамель) растворяют в химическом стаканчике с дистиллированной водой, нагретой до 60 – 70°С. Внимание! Далее в зависимости от состава изделия выполняют пункты (А) или (Б).
(А) Если изделие полностью растворимо, то полученный раствор охлаждают до комнатной температуры и переносят в мерную колбу объемом 250 см3, доводят дистиллированной водой до метки. Затем в мерную колбу объемом 50 см3 отбирают 5 см3 полученного раствора конфеты, 8 см3 дистиллированной воды и 13 см3 сернокислого раствора К2Cr2O7. Маркируют колбу цифрой 5.
(Б) Если изделие в своем составе имеет вещества, не растворимые в воде, то полученную охлажденную взвесь переносят в мерную колбу на 250 см3, тщательно смывая нерастворимые частицы дистиллированной водой в колбу, заполняя ее примерно до половины объема. Колбу помещают на водяную баню, нагретую до 60°С, выдерживают 15 мин., периодически помешивая содержимое. Далее раствор охлаждают, прибавляют 10 см3 раствора ZnSO4 и экспериментально установленный объем NaOH. Содержимое колбы перемешивают, доводят дистиллированной водой до метки, и фильтруют в чистую колбу. Затем в мерную колбу на 50 см3 отбирают 5 см3 полученного раствора конфеты, 8 см3 дистиллированной воды и 13 см3 сернокислого раствора К2Cr2O7.
2) Приготовление растворов для градуировочного графика
Растворы для градуировочного графика готовят в соответствии с таблицей 2.2.
Таблица 2.2 – Приготовление градуировочных растворов
№ колбы |
V (стандартного раствора сахарозы), см3 |
V (Н2Одист), см3 |
V (раствора K2Cr2O7), см3 |
1 |
– |
13,00 |
13,00 |
2 |
1,00 |
12,00 |
13,00 |
3 |
3,00 |
10,00 |
13,00 |
4 |
5,00 |
8,00 |
13,00 |
3) Проведение цветной реакции и измерения оптической плотности растворов
Поместить все колбы объемом 50 см3 (5 шт.), содержащие градуировочные растворы, контрольный и исследуемый растворы, в кипящую водяную баню на 10 мин. Затем охладить содержимое колб до комнатной температуры под водопроводной водой и довести дистиллированной водой до метки. Каждый раствор тщательно перемешать и измерить оптическую плотность с помощью КФК −2 − МП так, как указано в разделе «Порядок боты фотоколориметра» при λ = 670 нм в кюветах шириной 30 мм. Результаты записать в таблицу 2.3.
4) Обработка результатов эксперимента.
а) Рассчитать массу сахарозы в колбах 2 – 4 по формуле (2.6):
|
m = C ∙ V, |
(2.6) |
где С – концентрация стандартного раствора;
V – объем стандартного раствора сахарозы, внесенного в колбу.
Таблица 2.3 – Результаты эксперимента
№ колбы |
Масса сахарозы, мг |
Значение оптической плотности |
|||
А1 |
А2 |
А3 |
Аср |
||
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
– |
|
|
|
|
б) По данным таблицы 2.3 построить градуировочный график в координатах А = f(m).
в) Массовую долю общего сахара рассчитывают двумя способами:
1) по градуировочному графику
Используя градуировочный график и полученное значение оптической плотности раствора в колбе № 5, находят массу сахара m1 (мг) и рассчитывают массовую долю общего сахара в процентах по формуле (2.7):
|
|
(2.7) |
где χ – массовая доля общего сахара, %;
m – масса навески, г;
m1 – найденная масса сахара, мг;
V – вместимость мерной колбы, где растворяли навеску продукта, см3;
V1 – объем образца, взятого непосредственно для проведения реакции, см3.
2) с помощью вычислительного блока ФЭК.
По градуировочному графику определить коэффициенты «с» и «В»: с = D0, так как при концентрации С = 0 оптическая плотность D = 0, то и «с» = 0 (градуировочная кривая выходит из начала координат).
|
|
(2.8) |
где α – угол между градуировочной прямой и осью концентраций;
Di, mi – результаты, полученные для каждой точки градуировочного графика.
По полученным значениям рассчитать Вср. Ввести в память вычислительного блока коэффициенты «с» и «Вср». Для этого нажать соответствующую клавишу («с» или «В»), затем клавишу «СБР». При этом на цифровом табло слева высветится соответствующий символ. Далее набрать с помощью клавиатуры расчетные значения коэффициентов и нажать клавишу «УТВ». Измерить концентрацию исследуемого раствора. Для этого установить положение кюветодержателя 1 (контрольный раствор), нажать клавишу «К(1)».Установить положение кюветодержателя 2 (исследуемый раствор), нажать клавишу «С(4)». Измерения повторить дважды и вычислить средний арифметический результат.
Рассчитать массовую долю общего сахара в процентах по формуле (2.9):
|
|
(2.9) |
где mприб – найденная масса сахара в аликвоте по измерительному блоку прибора КФК − 2МП с использованием коэффициентов.
Остальные величины в формуле те же, что и в предыдущей формуле.
г) Сравнить значения массовой доли общего сахара, вычисленные двумя способами.
Обработка результатов эксперимента
1) Рассчитать массу сахарозы в колбах 2 – 4 по формуле (2.6)
Стандартный раствор сахарозы C(C12H22O11) = 4 мг/мл
m2 = C(C12H22O11) ∙ V2 = 4 мг/мл · 1 мл = 4 мг
m3 = C(C12H22O11) ∙ V3 = 4 мг/мл · 3 мл =12 мг
m4 = C(C12H22O11) ∙ V4 = 4 мг/мл · 5 мл =20 мг
Таблица 2.4 – Результаты эксперимента
№ колбы |
Масса сахарозы, мг |
Значение оптической плотности |
|||
А1 |
А2 |
А3 |
Аср |
||
2 |
4 |
0,152 |
0,153 |
0,149 |
0,151 |
3 |
12 |
0,487 |
0,484 |
0,487 |
0,486 |
4 |
20 |
0,819 |
0,819 |
0,798 |
0,812 |
5 |
– |
0,786 |
0,781 |
0,787 |
0,785 |
2) По данным таблицы 2.4 построить градуировочный график зависимости оптической плотности от массы сахарозы, мг.
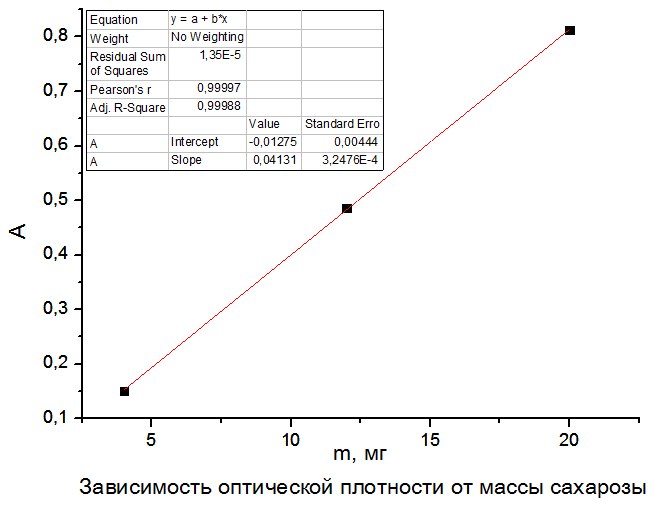
Рисунок 2.6 – график зависимости оптической плотности от массы сахарозы, мг
Оптическая плотность образца А = 0,785
Уравнение прямолинейной зависимости оптической плотности от массы сахарозы, мг: A = 0,04131 · m − 0,01275, следовательно:
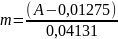
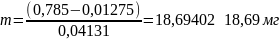
3) Массовая доля общего сахара рассчитанная по градуировочному графику

Анализируемое кондитерское изделие – карамель леденцовая «анисоментоловая»

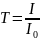

 ,
,