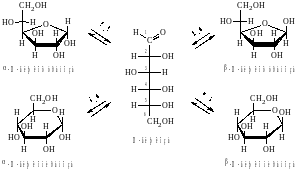- •Углеводы и методы их определения
- •Введение
- •1 Литературный обзор
- •1.1 Общая характеристика углеводов
- •1.2 Химические свойства моносахаридов и полисахаридов
- •1) Реакции карбонильной группы
- •2) Реакции гидроксильных групп
- •3) Кето – енольная таутомерия
- •4) Реакция Молиша
- •5) Реакция Селиванова
- •6) Реакции брожения
- •7) Важные производные моносахаридов
- •8) Реакция Майяра
- •9) Ферментативный гидролиз полисахаридов
- •2 Экспериментальная часть
- •2.1 Методика фотоколориметрического определения общего сахара в кондитерских изделиях
- •2.2 Определение крахмала в зерновом сырье по методу Эверса
- •2.3 Методика определения сахара в сухих винах с использованием колоночной хроматографии методом рефрактометрии
- •Область применения
- •Заключение
- •2) Определение крахмала в зерновом сырье по методу Эверса
- •Список основных источников
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение
высшего профессионального образования
УРАЛЬСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ
имени первого Президента России Б. Н. Ельцина
ИНСТИТУТ ЕСТЕСТВЕННЫХ НАУК
Департамент «ХИМИЧЕСКИЙ ФАКУЛЬТЕТ»
Кафедра аналитической химии
Углеводы и методы их определения
|
Курсовая работа
Гончарова Артема Олеговича
|
|
Научные руководители: к.х.н., доц. Н. В. Лакиза __________________ |
Екатеринбург 2014
Оглавление
ВВЕДЕНИЕ 3
1 ЛИТЕРАТУРНЫЙ ОБЗОР 4
1.1 Общая характеристика углеводов 4
1.2 Химические свойства моносахаридов и полисахаридов 13
2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 27
2.1 Методика фотоколориметрического определения общего сахара в кондитерских изделиях 27
2.2 Определение крахмала в зерновом сырье по методу Эверса 38
2.3 Методика определения сахара в сухих винах с использованием колоночной хроматографии методом рефрактометрии 49
Область применения 58
Заключение 62
Список основных источников 62
Введение
Для поддержания работоспособности и жизнедеятельности человек нуждается в ежедневном пополнении энергии. В качестве энергии выступает пищевая продукция, которая включат в себя нутриенты, то есть необходимые для жизнедеятельности питательные вещества. Нутриенты в свою очередь делятся на макронутриенты (содержание которых в живых организмах составляет больше 0,001 %) и микронутриенты (содержание менее 0,001 %). Макронутриенты включают в себя углеводы, жиры, белки и воду; микронутриенты – витамины и минералы. Так как пищевая продукция занимает главенствующее положение в жизни человека, то необходим соответствующий контроль её качества. Контроль заключается в оценке внешнего вида продукции и содержания макронутриентов и микронутриентов.
В данном курсовом проекте представлена общая характеристика углеводов и их основные химические свойства, а также методы их количественного определения различными методами анализа.
1 Литературный обзор
1.1 Общая характеристика углеводов
Углеводы – это органические вещества с общей формулой Сn(H2O)m, то есть многоатомные альдегидо− или кетоспирты (полиоксикарбональные соединения) и их производные.
Углеводы широко распространены в природе, являются компонентами продуктов питания. Сахар, мед, крахмал представляют собой чистые углеводы. В организмах растений и животных углеводы выполняют опорную, энергетическую, дыхательную функции. Важную роль играют соединения углеводов с другими классами веществ, такие как гликопротеиды, нуклеотиды.
Животные организмы не способны синтезировать углеводы и получают их с продуктами растительного происхождения. Растения и некоторые бактерии образуют углеводы из углекислого газа и воды в процессе фотосинтеза, общая схема которого может быть представлена уравнением:
hν
6 CO2↑
+ 6H2O
C6H12O6
+ 6O2↑
CO2↑
+ 6H2O
C6H12O6
+ 6O2↑
Ежегодно в результате фотосинтеза образуется около 100 млрд т органического вещества (более 15 т на каждого жителя планеты).
Классификация углеводов
Углеводы делятся на две большие группы простые (моносахариды) и сложные (полисахариды).
Моносахариды – простые углеводы, которые в растворе не гидролизируют, кроме гидроксильных и карбонильных групп, они могут содержать тиольные, карбоксильные и аминогруппы. К моносахаридам принято относить также продукты их окисления или восстановления, лишенные карбонильной группы.
Олигосахариды составляют промежуточный класс между моносахаридами и полисахаридами и содержат от двух до десяти моносахаридных остатков, соединенных гликозидными связями.
Дисахариды разделяют на восстанавливающие и невосстанавливающие дисахариды. К восстанавливающим относят дисахариды, имеющие свободный полуацетальный гидроксил, это мальтоза, целлобиоза, лактоза. К невосстаннавливающим относят дисахариды, у которых в образовании гликозидной связи участвует два полуацетальных гидроксила, это дисахариды сахароза и трегалоза.
В состав мальтозы входит α-D-глюкопираноза связь 1,4. Мальтоза образуется в качестве промежуточного продукта гидролиза крахмала или гликогена.
В состав лактозы входит ß-D-галактопираноза и α-D-глюкопираноза связь 1,4.
В состав сахарозы входит ß -D- фруктофураноза и α -D-глюкопираноза связь 1,2.
Полисахариды представляют собой продукты поликонденсации моносахаридов. Это типичные полимеры, часто построенные из тысяч моносахаридных остатков, причем молекулярная масса отдельных молекул, входящих в состав образца, может существенно различаться. К полисахаридам относят: крахмал, гликоген, целлюлоза.
Крахмал состоит из остатков α -D-глюкопиранозы. Связь 1,4 у линейной структуры крахмала, которая называется амилоза и связи 1,4 и 1,6 у разветвленной структуры крахмала, которая называется амилопектин.
Гликоген состоит из остатков α-D-глюкопиранозы, связь 1,4 и 1.6, разветвление у гликогена находятся через каждые 3-4 звена глюкозы.
Целлюлоза или клетчатка состоит из остатков ß-D-глюкопиранозы связь 1,4.
В свою очередь моносахариды классифициются:
а) по наличию альдегидной или кетонной группы моносахариды делят на альдозы и кетозы;
б) по числу углеродных атомов различают триозы (n = 3), тетрозы (n = 4), пентозы (n = 5), гексозы (n = 6). К пентозам относят: арабинозу, ксилозу, рибозу. К гексозам: глюкозу, фруктозу, галактозу;
в) по химической природе различают:
1) нейтральные сахара, содержащие только карбонильные и спиртовые группы;
2) аминосахара, обладающие помимо карбонильных и спиртовых групп еще и аминогруппой, обусловливающей основные свойства этих соединений;
3) кислые сахара, содержащие помимо обычных для этих соединений карбонильных и спиртовых групп еще карбоксильные группы.
Номенклатура моносахаридов
Номенклатура моносахаридов основывается на соединениях с не разветвленной цепью атомов углерода. Углеродные атомы нумеруют таким образом, чтобы карбонильный углерод имел наименьший номер. Заместители (атомы, функциональные группы) получают тот же номер, что и углеродный атом, с которым они соединены. Если в молекуле имеется более одной функциональной группы, они перечисляются в алфавитном порядке. Отсутствие ОН – группы отражается префиксом «дезокси».
 Н
– C
= O
H
– C
= O
Н
– C
= O
H
– C
= O
H NH2 H OAc
HO H AcO H
H OH AcO H
H OH H OH
CH2 –OH CH2 –OTr
2 – амино – 2 – дезокси – D – глюкоза 2, 3, 4 – три – О – ацетил –
(D – глюкоэамин) 6 – О – тритил – D – глюкоза
Нередко при написании моносахаридных звеньев (прежде всего в олиго– и полисахаридах) используют буквенные обозначения:
Ага − Арабиноза |
GlcA – Глюкуроновая кислота |
GalNAc – N – Ацетилгалактозамин |
Xyl – Ксилоза |
GlcNAc – N – Ацетилглюкозамин |
Man – Манноза |
ManNAc – N – Ацетилманнозамин |
Rha – Рамноза |
MurNAc – N – Ацетилмурамовая кислота |
Rib – Рибоза |
NeuNAc – N – Ацетилнейраминовая кислота |
Fru – Фруктоза Fuc – Фукоза |
Gal – Галактоза |
|
Glc – Глюкоза |
|
Стереоизомерия углеводов
Стереоизомерия или оптическая изомерия является одним из видов пространственной изомерии. Она обусловлена наличием хиральных центров и проявляется в способности некоторых соединений вращать плоскость поляризованного луча света в разные стороны. Наиболее распространенным хиральным центром является асимметрический атом углерода, т. е. углеродный атом, связанный с четырьмя различными заместителями. При наличии одного асимметрического атома углерода молекула может существовать в виде двух изомеров, относящихся друг к другу как несимметричный предмет к своему отражению:

Такие изомеры называются оптическими антиподами или энантиомерами. Один из них вращает плоскость поляризованного луча влево (L- или ()−форма), другой на такой же угол вправо (D− или (+)−форма). Принадлежность моносахарида к тому или иному генетическому ряду определяется по конфигурации его наиболее удаленного от альдегидной группы асимметрического углеродного атома. Если она соответствует конфигурации D−глицеринового альдегида, то моноза относится к D−ряду, если L−глицеринового альдегида – к L−ряду.

 Н
–
С
= О Н
–
С
= О
Н
–
С
= О Н
–
С
= О
СН2−ОН СН2−ОН
D – глицериновый альдегид L – глицериновый альдегид
Энантиомеры одинаковы по всем физическим и химическим свойствам и отличаются только отношением к плоскополяризованному свету. Смесь энантиомеров в соотношении 1:1 оптической активностью не обладает и называется рацемической. Общее число оптических изомеров можно определить по формуле Фишера: N = 2n , где n число оптических изомеров.
 Н
– С = О
Н
– С = О
Н – С = О Н * ОН
Н – С = О Н * ОН Н * ОН
Н – C = О Н * ОН Н * ОН Н * ОН
Н * OH Н * ОН Н * ОН Н * ОН
CH2−OH CH2−OH CH2−OH CH2−OH
альдотриозы альдотетрозы альдопентозы альдогексозы
N = 2 N = 22 = 4 N = 23 = 8 N = 24 = 16
Знак вращения или абсолютная конфигурация определяется методом рентеноструктурного анализа и помимо природы самого хирального соединения может зависеть от природы растворителя, температуры и др.
Пространственные изомеры с несколькими хиральными центрами, часть которых имеет одинаковую конфигурацию, называют диастереомерами. Пары диастеремеров, отличающиеся конфигурацией только асимметрического атома, называют эпимерами.
Асимметрия молекул приводит к тому, что низшие моносахариды трудно кристаллизуются. Действительно, для включения молекулы в кристаллическую решетку требуется ее единственная конфигурация, а в рацемической смеси присутствует набор по-разному ориентированных молекул.
Ниже приведен генетический D − ряд альдоз, родоначальником которых является D–глицериновый альдегид (данное деление генетического ряда можно осуществить экспериментально с помощью реакции Килиани−Фишера).

Простейшей кетозой, обладающей асимметрическим атомом углерода, является тетроза – D – тетрулоза. Ниже приведен генетический D – ряд кетоз.

Циклические формы и таутомерия моносахаридов
Альдозы проявляют далеко не все свойства, характерные для альдегидов. Так, они не дают реакции с фуксинсернистой кислотой и очень медленно реагируют с гидросульфитом натрия. В то же время наблюдается повышенная активность одной из гидроксильных групп, количество изомеров альдоз в два раза больше, чем предсказывает формула Фишера, кроме того, для альдоз характерно явление мутаротации – изменение угла вращения свежеприготовленных растворов.
Для объяснения этих противоречий в конце XIX в. была высказана мысль, что моносахариды могут существовать не только в линейной форме, но и в форме циклических внутренних полуацеталей, не содержащих карбонильной группы. В дальнейшем было доказано, что для моносахаридов характерна циклоцепная таутомерия: в кристаллическом состоянии они имеют циклическое строение, а в растворах существуют в виде циклических и открытоцепных форм, находящихся в динамическом равновесии.
Образование циклических форм моносахаридов происходит в результате реакции внутримолекулярного присоединения одной из гидроксильных групп по карбонильной группе. Наиболее устойчивыми являются пяти − и шестичленные циклы. Поэтому при образовании циклических форм углеводов образуются фуранозные (пятичленный) и пиранозные (шестичленный) циклы. Рассмотрим образование циклических форм на примерах глюкозы и рибозы.
Глюкоза при циклизации образует преимущественно пиранозный цикл. Пиранозный цикл состоит из 5 атомов углерода и 1 атома кислорода. При его образовании в присоединении участвует гидроксильная группа пятого (С5) атома углерода.
Образование циклических форм моносахаридов обусловлено взаимодействием альдегидной группы с гидроксилом, находящимся у С5, реже у С4 − атома: Образовавшееся соединение внутренний циклический полуацеталь. Поэтому циклические формы моноз называют полуацетальными.
В результате замыкания цикла в молекуле появляется новый асимметрический центр – это приводит к удвоению числа изомеров:
 Более
наглядно строение циклических форм
моносахаридов можно представить с
помощью «перспективных» формул Хеуорса:
Более
наглядно строение циклических форм
моносахаридов можно представить с
помощью «перспективных» формул Хеуорса:
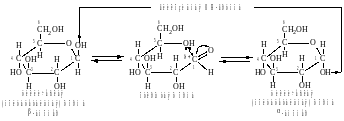 Группа
−ОН при первом углеродном атоме в
циклических формах называетя гликозидным
гидроксилом.
Он гораздо реакционноспособнее остальных
гидроксильных групп, легко реагирует
со спиртами или со второй молекулой
моносахарида с образованием гликозидов.
Группа
−ОН при первом углеродном атоме в
циклических формах называетя гликозидным
гидроксилом.
Он гораздо реакционноспособнее остальных
гидроксильных групп, легко реагирует
со спиртами или со второй молекулой
моносахарида с образованием гликозидов.
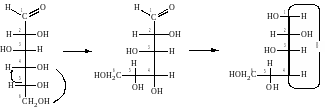
Переход от проекционных формул Фишера к формулам Хеуорса осуществляется по следующим правилам:
1) В формуле Фишера производится четное число перестановок заместителей у атома углерода, чья гидроксильная группа участвует в образовании циклического полуацеталя. Перестановка осуществляется таким образом, чтобы данная OH−группа располагалась на одной вертикали с карбонильной группой и находилась внизу.
Например, в образовании пиранозного цикла D−глюкозы участвует OH−группа при С5. Осуществляем две перестановки и записываем циклическую форму в проекции Фишера:

Аналогичным образом поступаем в случае образования фуранозного цикла. Теперь в образовании цикла участвует OH−группа при С4:
2) В зависимости от структуры цикла берется соответствующая «заготовка»:
|
|
для пиранозного цикла |
для фуранозного цикла |
Все заместители, находящиеся в фишеровской проекции справа от линии углеродной цепи, располагаются под плоскостью цикла; соответственно заместители, находящиеся слева над плоскостью.
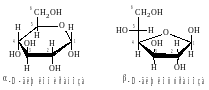
Отметим, что у пиранозных форм моносахаридов D−ряда группаCH2OH всегда располагается над плоскостью цикла. У −аномеров гликозидная OH−группа располагается под плоскостью цикла, а у −аномера над плоскостью.
Названия циклических форм строятся следующим образом: сначала указывают положение гликозидной группы (− или −), затем принадлежность сахарида к стереохимическому ряду (D− или L−), далее в корень тривиального названия сахарида вставляют смысловую часть названия цикла (−фуран− или −пиран−), заканчивая название суффиксом − оза.
В случаях, когда аномеризация не уточняется или речь идет о равновесной смеси аномеров, положение гликозидной группы обозначается волнистой линией:

Мутаротация
Фуранозные и пиранозные циклы, а также − и −аномеры обладают различной термодинамической устойчивостью. Однако в растворе моносахариды существуют как в открытой форме, так и во всех возможных циклических формах. Соотношение этих форм зависит от строения открытой формы моносахарида, природы растворителя и других факторов. В целом пиранозные циклы более устойчивы, чем фуранозные, а в полярных растворителях более устойчивы −аномеры благодаря экваториальной конформации заместителей.
В водном растворе возможны взаимные превращения фуранозных циклов в пиранозные, а −аномеров в −аномеры и наоборот. Такое динамическое равновесие между открытой и циклическими формами моносахарида называется цикло−оксо−таутомерией. Взаимопревращение − и −аномеров называется аномеризацией.
Изменение угла вращения свежеприготовленных растворов сахаров, связанное с переходом одних таутомерных форм в другие до наступления состояния равновесия, называется мутаротацией.