
- •Оглавление
- •1.Определение массы газа, находящегося в подземном резервуаре геометрической формы.
- •2. Находим изменение плотности газа при закачке.
- •3. Определяем абсолютную плотность смеси газообразных углеводородов при условиях хранения и нормальных условиях, а так же относительную плотность газовой смеси при н.У. По воздуху.
- •4. Определяем окислитель и восстановитель в реакциях полного сгорания. Определяем стехиометрические коэффициенты в уравнениях методом электронного баланса.
- •5. Определим объём воздуха, необходимый для полного сгорания смеси газов при н.У.
- •7. Определяем изменение энтропии и энергии Гиббса реакций сгорания углеводородов.
- •9. Самый лёгкий газ выделенный из смеси, участвует в изотермическом процессе. При этом получена зависимость между объёмом V и давлением р. Представьте этот цикл в диаграмме V, m?
- •10.Опишите пожароопасные свойства газообразных веществ, составляющих смесь, а также средства тушения пожаров с их участием?
- •Литература
- •Интернет ресурсы:
9. Самый лёгкий газ выделенный из смеси, участвует в изотермическом процессе. При этом получена зависимость между объёмом V и давлением р. Представьте этот цикл в диаграмме V, m?
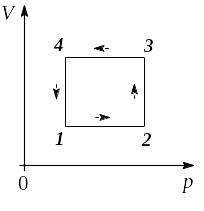
Определим, какой изопроцесс изображён на каждом участке графика 1-3, а также изменение термодинамических параметров:
участок 1→2: V=const, p увеличивается. Процесс изохорный.
участок 2→3: р=const, V увеличивается. Процесс изобарный.
участок 3→4: V=const, p уменьшается. Процесс изохорный.
участок 4→1: p=const, Vуменьшается. Процесс изобарный.
Физическое
состояние массы газа определяется тремя
термодинамическими параметрами:
давлением р, объемом V и температурой
Т. Между этими параметрами существует
определенная связь, называемая уравнением
состояния,
задаваемая в общем виде дается
выражением
![]() ,где
каждая из переменных является функцией
двух других.
,где
каждая из переменных является функцией
двух других.
Уравнение
-Клапейрона для массы m газа
![]()

Изобразим зависимость, представленную в координатах V = f(т) .

10.Опишите пожароопасные свойства газообразных веществ, составляющих смесь, а также средства тушения пожаров с их участием?
Этен, C2H4
Физико-химические свойства: Бесцветный газ. Мол масса 28,05; плотн по воздуху 0,974; т. кип. -103,70С; коэф.диф. газа в воздухе 0,13 см2/с; теплота сгорания -1318 кДж/моль; в воде растворим плохо.
Пожароопасные свойства: Горючий газ. Т.самовоспл. 4350С; конц.пределы распр.пл.: 2,7 – 34% об. в воздухе, 2,9 – 80% об. в кислороде, 5 – 40% об. в оксиде азота, 12,5 – 70,5% об в диоксиде азота; максимальное давление взрыва 830 кПа; максимальная скорость нарастания давления 37,7 МПа/с; минимальная энергия зажигания 0,12 мДж; максимальная норм. скор. распр. пл. 0,735 м/с.
Средства тушения: Инертные газы, аэрозольные составы. Для предупреждения взрыва при аварийном истечении этилена и тушения факела в закрытых объемах необходимая минимальная концентрация диоксида углерода составляет 42% об., азота 52% об.
Пропен, С3Н6
Физико-химические свойства: Бесцветный газ. Мол. масса 42,08; т. кип. –47,7°С;lgр = 5,94852 – 786,532/(247,243 + t) при т-ре от –107,3 до –47,1°С; плотн. газа по воздуху 1,45; тепл. c гop. –1919 кДж/моль; в воде раствор. незначительно.
Пожароопасные свойства: Горючий газ. Т. самовоспл. 455°С; конц. пределы
распр. пл.: в воздухе 2,4–11% об., в кислороде 2,1–53% об.; верхн. конц. предел
распр. пл. в гемиоксиде азота 28,8% об. макс. давл. взрыва 648 кПа; миним. энергия зажигания 0,24 мДж;; макс. норм. скорость распр. пл. 0,51 м/с.Для предупреждения взрыва при аварийном истечении пропилена и тушения факела в закрытых объемах миним. конц. диоксида углерода 30% об., азота 43%об.
Средства тушения: Инертные газы
Заключение
В ходе выполнения курсовой работы мною был сделан вывод о том, что температура самовоспламенения у этена меньше чем у пропена( 435оС <455°С) - это означает что этена более чувствителен к высоким температурам. Эти вещества можно потушить примерно одинаковыми средствами тушения, которыми являются газы. Смесь веществ хорошо горит на воздухе. Тепловые эффекты реакций сгорания углеводородов в смеси равны: ΔrHоI-793,776 (кДж/моль), ΔrHоII= -770,56 (кДж/моль).Определил энтропию и энергию Гиббса реакций сгорания углеводородов: Δ r SoII, 298 > 0, так как увеличивается число молекул газообразных веществ во всех реакциях. r GоI, 298 , r GоII, 298 , r GоIII, 298 << 0, следовательно, химические процессы термодинамически возможны, т.е. возможно самопроизвольное протекание процессов в прямом направлении. Узнал пожароопасность этена и пропена. При выполнении данной курсовой работы мною были расчитанны тепловые эффекты реакций сгорания углеводородов, изменение энтропии и энергии Гиббса реакций сгорания углеводородов. Данная курсовая работа открыла для меня много нового о данных веществах, углубленное изучение в ходе работы помогло понять всю важность и сущность изучения пожароопасных свойств химических веществ и химии в целом.
