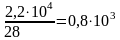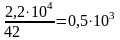- •Оглавление
- •1.Определение массы газа, находящегося в подземном резервуаре геометрической формы.
- •2. Находим изменение плотности газа при закачке.
- •3. Определяем абсолютную плотность смеси газообразных углеводородов при условиях хранения и нормальных условиях, а так же относительную плотность газовой смеси при н.У. По воздуху.
- •4. Определяем окислитель и восстановитель в реакциях полного сгорания. Определяем стехиометрические коэффициенты в уравнениях методом электронного баланса.
- •5. Определим объём воздуха, необходимый для полного сгорания смеси газов при н.У.
- •7. Определяем изменение энтропии и энергии Гиббса реакций сгорания углеводородов.
- •9. Самый лёгкий газ выделенный из смеси, участвует в изотермическом процессе. При этом получена зависимость между объёмом V и давлением р. Представьте этот цикл в диаграмме V, m?
- •10.Опишите пожароопасные свойства газообразных веществ, составляющих смесь, а также средства тушения пожаров с их участием?
- •Литература
- •Интернет ресурсы:
5. Определим объём воздуха, необходимый для полного сгорания смеси газов при н.У.
Найдем мольные доли веществ:


Найдем объемы, которые занимают составляющие газовой смеси в резеввуаре:
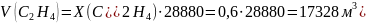
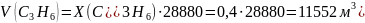
Для определения объёма воздуха, необходимого для полного сгорания смеси газов при н.у. воспользуемся следующими данными:
C2H4+3O2→2CO2+2H2O (I),
Вещества: |
C2H4 |
O2 |
1.Соотношения реагирующих веществ: |
1 |
3 |
2.Масса веществ при н.у., кг: |
2,2·104 |
- |
3.Количества реагирующих веществ, кмоль: |
|
0,8·103 · 3 = 2,4·103 |
4.Объём реагирующих веществ при н.у., м3: |
17,9·103 |
53,7·103 |


Сухой
воздух содержит 21 об.% О2.
Следовательно: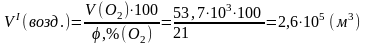 .
.
C3H6+4,5O2→3CO2+3H2O (II),
Вещества: |
C3H6 |
O2 |
1.Соотношения реагирующих веществ: |
1 |
4,5 |
2.Масса веществ при н.у., кг: |
2,2·104 |
- |
3.Количества реагирующих веществ, кмоль: |
|
0,5·103 · 4,5 = 2,3·103 |
4.Объём реагирующих веществ при н.у., м3: |
11,2·103 |
50,4·103 |
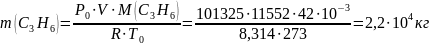

Сухой
воздух содержит 21 об.% О2.
Следовательно: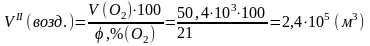 .
.
Определяем объём воздуха, необходимый для полного сгорания смеси углеводородов:

Ответ:

6. Определим тепловые эффекты реакций сгорания углеводородов в смеси, в расчёте на 1 моль газовой смеси.
Определим тепловые эффекты реакций сгорания углеводородов (I) ,(II) и (III), в расчете на 1 моль газовой смеси. Запишем термохимические уравнения протекающих реакций:
(I) C2H4(г) + 3O2(г) → 2CO2(г) + 2H2O(г) + ΔrHоIII (Дж/моль);
(II) C3H6(г) + 4,5O2(г) → 3CO2(г) + 3H2O(г) + ΔrHоII (Дж/моль)
Воспользуемся справочными данными для необходимых расчётов.
Справочные данные термодинамических функций при 298 К
Участники реакций |
Δ f Н°, кДж∙моль–1 |
Δ f G°, кДж∙моль–1 |
S°, Дж∙К–1∙моль–1 |
C2H4(г) |
52.3 |
68.1 |
219.5 |
C3H6 (г) |
20,41 |
62,7 |
266,94 |
Участники реакций |
Δ f Н°, кДж∙моль–1 |
Δ f G°, кДж∙моль–1 |
S°, Дж∙К–1∙моль–1 |
O2(г) |
0 |
0 |
205,138 |
CO2(г) |
-393,51 |
-394,36 |
213,74 |
H2O(г) |
-241,82 |
-228,57 |
188,83 |
По следствию из закона Гесса, которое позволяет рассчитывать тепловые эффекты химических реакций:
Стандартная энтальпия химической реакции
![]()
равна разности стандартных энтальпий образования продуктов реакции и реагентов (с учетом стехиометрических коэффициентов):
![]() ,
,
где Δ r HоТ – изменение энтальпии реакции (тепловой эффект реакции), νj, νi – стехиометрические коэффициенты перед формулами конечных и исходных веществ соответственно, Δ f HоТ (Вj ) – стандартная энтальпия образования продуктов реакции (конечных веществ), Δ f HоТ (А i ) – стандартная энтальпия образования исходных веществ реакции.
Получаем:
ΔrHоI, 298 = 2*Δ f Ho298(CО2(г)) +2·Δ f Ho298(H2O(г)) – (Δ f Ho298(C2Н4 (г)) + 3·Δ f Ho298(О2(г))) = –393,51·2 + (–241,82)·2 – (–52.3 + 3·0) = –1322.96 (кДж/моль);
ΔrHоII, 298 = 3·Δ f Ho298(CО2(г)) + 3·Δ f Ho298(H2O(г)) – (Δ f Ho298(C3Н6(г)) + 4,5·Δ f Ho298(О2(г))) = –393,51·3 + (–241,82)·3 – (–103,85 + 4,5·0) = –1926,4 (кДж/моль).
Все реакции экзотермичны (ΔrHо << 0), согласно принципу Бертло-Томсена – самопроизвольны.
Принцип Бертло-Томсена:
А+ВАВ при ΔH<0
A+BC+D при ΔH<0
Учитывая, что х(C2Н4) = 0.6, х(C3Н6) = 0,4 рассчитываем тепловые эффекты реакций на 1 моль газовой смеси:
ΔrHоI = ΔrHоI, 298 · х(C2Н4) = –1322.96 ·0,6 = -793,776(кДж/моль),
ΔrHоII = ΔrHоII, 298 · х(C3Н6) –1926,4 ·0,4 = -770,56 (кДж/моль).
Ответ: ΔrHоI= -793,776 (кДж/моль), ΔrHоII= -770,56 (кДж/моль),