
- •25. Теорія хімічної будови органічних сполук. Ізомерія.
- •26. Алкани. Будова , фізичні властивості. Ізомерія. Номенклатурні назви. Хімічні властивості , добування та застосування.
- •Добування алканів з природного газу та нафти.
- •2. Приєднання водню до алкенів та алкінів.
- •3. Взаємодія галогеналканів з металічним натрієм (реакція Вюрца).
- •4. Декарбоксилювання карбонових кислот
- •5. Добування метану.
- •27. Алкени. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування
- •28. Алкіни, Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
- •29. Алкадієни . Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
- •30. Застосування та добування полімерів,канчуків , гуми.
- •31. Арени, склад, електронна та структурна формула,, фізичні властивості. Номенклатурні назви аренів. Хімічні властивості бензену. Застосування бензену. Хімічні засоби захисту рослин.
- •32. Нафта, склад, добування, застосування, перегонка нафти, крекінг нафтопродуктів.
- •33. Одноатомні спирти., будова молекули, фізичні властивості , класифікація. Ізомерія спиртів , номенклатурна назва. Хімічні властивості спиртів . Застосування та добування спиртів.
- •34. Багатоатомні спирти,фізичні властивості . Ізомерія спиртів , номенклатурна назва, хімічні властивості спиртів. Якісна реакція на багатоатомні спирти. Застосування та добування спиртів.
- •38. Естери, фізичні властивості. Ізомерія та номенклатурні назви естерів Добування та застосування естерів, Хімічні властивості естерів.
- •39. Жири,будова молекули, фізичні властивості, класифікація жирів. Ізомерія та номенклатурні назви жирів. Хімічні властивості жирів. Добування та застосування жирів. Значення жирів у життєдіяльності
- •40. Синтетичні миючі засоби, мило. Охорона довкілля від смз
- •41. Моносахариди. Глюкоза – альдегідо спирт, склад, будова молекули. Фізичні властивості. Хімічні властивості , якісна реакція . Поширення в природі, добування , застосування.
- •42. Дисахариди. Сахароза – дисахарид, склад та будова молекули, фізичні та хімічні властивості. Поширення в природі, застосування , загальна схема виробництва цукру.
- •43. Полісахариди. Крохмаль та целюлоза – полісахариди , склад та будова молекули, фізичні та хімічні властивості. Поширення в природі, застосування.
- •44. Аміни. Класифікація амінів. Склад і будова молекули, фізичні властивості. Ізомерія та номенклатура амінів. Хімічні властивості амінів. Добування та застосування.
- •45. Анілін. Ізомерія та номенклатура. Хімічні властивості, якісна реакція на анілін. Склад і будова молекули, фізичні властивості. Добування та застосування.
- •48. Волокна, класифікація .Способи добування волокон, застосування волокон.
34. Багатоатомні спирти,фізичні властивості . Ізомерія спиртів , номенклатурна назва, хімічні властивості спиртів. Якісна реакція на багатоатомні спирти. Застосування та добування спиртів.
Спирти, молекули яких містять декілька гідроксильних груп відносять до багатоатомних спиртів.
Спирти, які містять дві гідроксильні групи біля одного атома Карбону нестабільні, вони розкладаються з виділенням молекули води та утворенням альдегідів чи кетонів. Тому найпростішим представником двоатомних спиртів є етиленгліколь або гліколь, триатомних спиртів – гліцерин.

Двоатомні спирти називають також діолами або гліколями (від гр. glykys – солодкий), через солодкий смак найпростіших представників цих спиртів; триатомні – триолами або гліцеринами, за назвою першого представника.
За замісниковою номенклатурою ІЮПАК назви дво- та триатомних спиртів утворюють від назви відповідного вуглеводню, додаючи суфікс –діол чи -тріол, позначаючи цифрами положення гідроксильних груп.
Способи добування.
Дво- та триатомні спирти добувають всіма способами, які застосують для синтезу одноатомних спиртів. Але існує і ряд специфічних методів синтезу.
1. Добування етиленгліколю. Вихідною речовиною для синтезу етиленгліколю є етилен, з якого одержують етиленгліколь в одну стадію – окисненням калій перманганатом в слабколужному середовищі (див. 26.3):
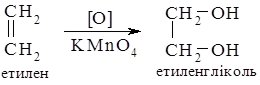
або в дві стадії – при дії на етилен бромом спочатку одержують 1,2-диброметан, який далі обробляють водним розчином лугу:
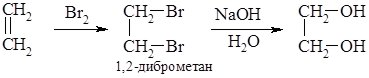
2. Добування гліцерину. Гліцерин добувають гідролізом рослинних чи тваринних жирів. Жири, як естери триатомного спирту гліцерину та вищих карбонових кислот, у кислому або лужному середовищі гідролізують до гліцерину:
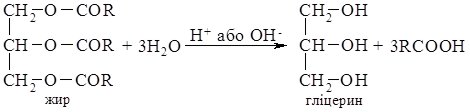
Існують також ефективні синтетичні методи добування гліцерину на основі пропену, які майже витіснили метод одержання гліцерину із жирів:
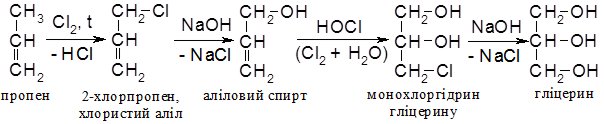
Фізичні властивості.
Етиленгліколь та гліцерин – безбарвні в’язкі рідини, з високою температурою кипіння, солодкі на смак. Змішуються у всіх співвідношеннях з водою та етиловим спиртом.
Хімічні властивості.
Багатоатомні спирти вступають в ті ж реакції, що й одноатомні; реакції відбувають за участю однієї або декількох гідроксильних груп. Наявність різної кількості гідроксильних груп в спиртах визначає і деякі їх особливості.
1. Кислотні властивості. Порівняно з одноатомними спиртами, багатоатомні спирти виявляють сильніші кислотні властивості. Це зумовлено електроноакцепторним впливом гідроксильних груп одна на одну і, як наслідок, більшою поляризацією зв’язку О–Н. Так, багатоатомні спирти утворюють алкоголяти не лише при взаємодії з лужними металами, але і з гідроксидами, в тому числі, важких металів.
Етиленгліколь при взаємодії з натрієм, залежно від співвідношення реагентів, утворює як повні так і неповні гліколяти:
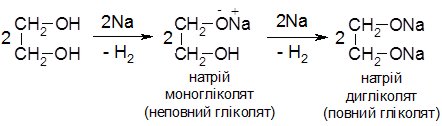
Утворення гліколятів спостерігається і при взаємодії з натрій гідроксидом:
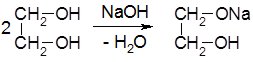
Особливістю багатоатомних спиртів є їх здатність розчиняти купрум (ІІ) гідроксид, при цьому з’являється характерне синє забарвлення розчину. При взаємодії багатоатомних спиртів з Cu(OH)2утворюються комплексні сполуки, у яких поряд з ковалентними зв’язками Cu–O є і донорно-акцепторні зв’язки Cu←O:
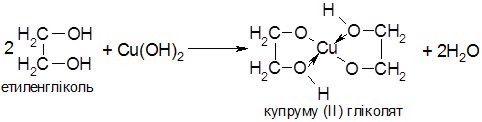
Такі внутрішньомолекулярні сполуки називають хелатними комплексами (гр. chelae – клешні); молекули етиленгліколю захоплюють атом металу, як клешнями. Взаємодія з Cu(OH)2 – якісна реакція на багатоатомні спирти.
2. Утворення естерів. Етиленгліколі та гліцерин, як і одноатомні спирти, здатні утворювати естери з мінеральними та карбоновими кислотами.
Найбільше значення має повний естер гліцерину з нітратною кислотою:
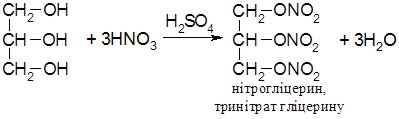
Тринітрат гліцерину або тринітрогліцерин – важка масляниста рідина, яку застосовують у виробництві ліків та вибухових речовин.
Естери гліцерину та вищих карбонових кислот – жири, тваринного та рослинного походження. Насичені кислоти входять до складу твердих жирів, а ненасичені – до складу олій.
Окремі представники.
Етиленгліколь (гліколь, 1,2-етандіол) НОСН2СН2ОН. В’язка безбарвна рідина без запаху, солодкувата на смак. Добре розчинна у воді, етиловому спирті, ацетоні. Сильна отрута. Відкрив Ш. Вюрц у 1856 р.
Етиленгліколь широко застосовують як складову антифризів (від гр. anti – префікс, що позначає протидію, та англ. freeze – замерзати). Найпоширенішими є антифризи на основі водного розчину етиленгліколю; вони мають низьку температуру замерзання і їх застосовують для охолодження двигунів внутрішнього згорання, в теплообмінниках та інших установках, які працюють при температурі нижче 00 С. В техніці, в основному, використовують антифризи, які містять 52,6 % та 66,0 % етиленгліколю; вони замерзають при температурі –400 С та –650 С відповідно.
Гліцерин (гр. glykeros – солодкий), 1,2,3-пропантріол НОСН2СНОНСН2ОН. Безбарвна в’язка рідина без запаху, солодкувата на смак. Змішується з водою, спиртом, ацетоном. Безводний гліцерин гігроскопічний, поглинає вологу з повітря.
Вперше гліцерин виділив шведський аптекар К. Шеєле у 1779 р. гідролізом оливкової олії (рослинного жиру). Але лише у 1854 р. Ш. Вюрц встановив, що гліцерин – триатомний спирт, а структурну формулу гліцерину запропонував у 1859 р. О.М. Бутлеров.
Гліцерин входить до складу природних жирів та олій. Його використовують для синтезу нітрогліцерину. Гліцерин додають для пом’якшення мазей, парфум, косметичних кремів, крему для взуття.
Нітрогліцерин (гліцеринтринітрат) О2NOСН(СН2ОNO2)2. Безбарвна масляниста рідина, добре розчинна в ацетоні, діетиловому етері, метанолі, бензені, погано – у воді, гліцерині.
Вперше тринітрат гліцерину синтезував італійський хімік А. Сомбреро у 1846 р. Уже під час Кримської війни нітрогліцерин використовували як вибухову речовину. Однак здатність нітрогліцерину вибухати при незначному ударі або терті перешкоджала його широкому використанню. Необхідно було підібрати умови, які б дозволяли безпечно перевозити вибухівку і щоб при цьому вона не втрачала своїх властивостей. Вирішив цю проблему Альфред Нобель, шведський вчений, чиє ім’я носить найпоширеніша наукова премія світу. У 1864 р. він запатентував спосіб добування нітрогліцерину, а у 1866 р. винайшов динаміт. Він помітив, як випадково пролитий тринітрогліцерин поглинув кізельгур – ґрунт, піднятий з дна моря – при цьому кізельгур залишався сухим і його можна було формувати в брикети. У цій суміші нітрогліцерин зберігав свої вибухові властивості. Її Нобель назвав “динаміт” (від гр. dynamis – сила). Динаміт, крім військової справи, застосовують у будівництві, при прокладанні тунелів, гірничій справі.
Нітрогліцерин використовують в медицині як лікарський препарат, що знімає гострі серцеві напади, сприяє розширенню кровоносних судин серця, знімає біль (спазми).
35. Феноли, будова молекули, фізичні властивості , Ізомерія спиртів , номенклатурна назва. Хімічні властивості спиртів. Якісна реакція на феноли. Охорона довкілля від промислових відходів , що містять фенол. Застосування та добування спиртів.
Феноли – гідроксильні похідні ароматичних вуглеводнів, у яких гідроксильна група безпосередньо зв’язана з бензольним ядром. Сполуки, що містять гідроксил в боковому ланцюзі, відносять до ароматичних спиртів.
Як і спирти, феноли можуть містити одну, дві, три або більше гідроксильних груп. Найпростішими представниками фенолів є гідроксибензен або фенол; найближчі його гомологи о-, м-, п-крезоли:
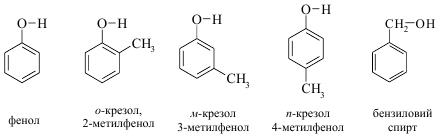
Бензиловий спирт (ароматичний) – ізомер крезолів. Це – міжкласова ізомерія.
Номенклатура.
За замісниковою номенклатурою ІЮПАК назви фенолів утворюють, як і для спиртів, тобто до назви вуглеводню додають суфікс –ол. Згідно цього найпростіший представник фенолів С6Н5ОН слід називати бензенол. Однак на практиці його називають тривіальною назвою – фенол, а похідні – як заміщені феноли. Номенклатура ІЮПАК дозволяє вживати тривіальні назви для похідних фенолів: крезоли, тимол тощо. Нумерацію атомів у молекулі починають з атома Карбону, зв’язаного з гідроксильною групою:
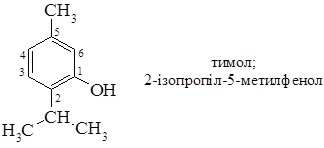
Способи добування.
З кам‘яновугільної смоли. Кам‘яновугільна смола, що утворюється при коксуванні вугілля – чорна в‘язка рідина з характерним фенольним запахом. Феноли виділяють з легкого масла – фракції одержаної при розгонці кам‘яновугільної смоли (to= 80 ‑ 170o С), в основному вона містить фенол і крезоли.
Взаємодія галогенаренів з лугами. Заміщення галогену в бензеновому ядрі відбувається за жорстких умов: при температурі 200 – 300о С і підвищеному тиску із застосуванням каталізатора – міді і солей купруму (І):
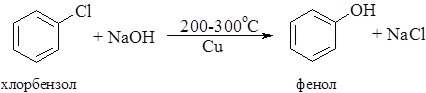
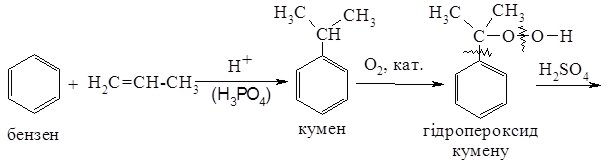
3. Кумольний метод. Промисловий метод синтезу фенолу, що дозволяє поряд із фенолом одержати цінний продукт – ацетон. Кумол (ізопропілбензен), одержаний при взаємодії бензену з пропеном, окиснюють киснем повітря, а утворений гідропероксид кумену розкладають нагріванням з розведеною сульфатною кислотою:
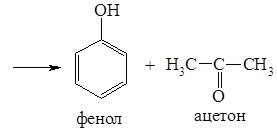
Фізичні властивості.
Феноли – безбарвні кристалічні речовини або рідини з характерним запахом. Як правило, вони погано розчинні у воді; при зберіганні на повітрі окиснюються (темніють).
Хімічні властивості.
Для фенолів характерні реакції, що відбуваються за участю гідроксильної групи та бензенового ядра.
В молекулі фенолу гідроксильна група безпосередньо зв’язана з бензеновим ядром. Внаслідок цього одна з неподілених пар електронів атома Оксигену гідроксильної групи взаємодіє з π-електронами бензенового ядра. Це веде до зміщення електронної густини з атома Оксигену в бік ароматичного ядра. У результаті спостерігається зменшення електронної густини на атомі Оксигену гідроксильної групи та її збільшення в бензеновому ядрі, що впливає на реакційну здатність ОН-групи і бензенового ядра.
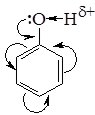
Реакції за участю гідроксильної групи.
1. Кислотні властивості.
Зменшення
електронної густини на атомі Оксигену
веде до підвищення полярності зв’язку
–О–Н, оскільки атом Оксигену сильніше,
ніж у молекулі спирту, відтягає спільну
пару електронів від атома Гідрогену.
Атом Гідрогену набуває більшого
часткового позитивного заряду ![]() і
легко може відщеплюватись у вигляді
протону Н+,
тому феноли виявляють сильніші кислотні
властивості, ніж спирти. Так, феноли
реагують не тільки з металами, але і з
гідроксидами, утворюючі феноляти:
і
легко може відщеплюватись у вигляді
протону Н+,
тому феноли виявляють сильніші кислотні
властивості, ніж спирти. Так, феноли
реагують не тільки з металами, але і з
гідроксидами, утворюючі феноляти:
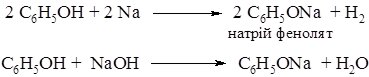
У 1835 р. Ф. Рунге дав назву фенолу “карболова кислота”, за його здатність взаємодіяти з лугом.
Утворені феноляти, на відміну від алкоголятів, не розкладаються водою. Водні розчини фенолятів мають лужну реакцію. Однак, при дії кислот, навіть такої слабкої як карбонатна відбувається розклад фенолятів:
![]()
2. Утворення етерів. Зручними методом синтезу фенілових етерів є взаємодія фенолятів лужних металів з галагенопохідними вуглеводнів:
![]()
![]()
Дифеніловий етер одержують у присутності каталізатора – порошку міді.
Реакції по бензеновому ядру.
У результаті зміщення електронної густини з гідроксильної групи на бензенове ядро, значно зростає реакційна здатність останнього.
3. Нітрування фенолу відбувається за кімнатної температури, при обробці розведеною нітратною кислотою з утворенням суміші орто- і пара-нітрофенолів. Використання концентрованої нітратної кислоти у цій реакції призводить до утворення 2,4,6-тринітрофенолу:
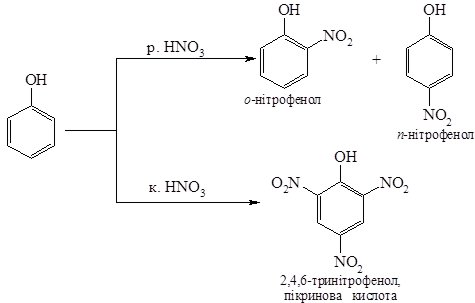
4. Бромування. Якщо бензен галогенується тільки за наявності каталізатора, то фенол бромується вже за кімнатної температури бромною водою. Відбувається заміщення атомів Гідрогену в о- і п- положеннях:
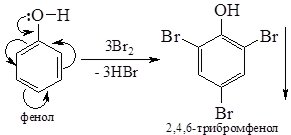
2,4,6-Трибромфенол не розчиняється у воді і випадає у вигляді білого осаду, що використовують для виявлення фенолу.
Якісні реакції
Сплавление аренсульфокислот со щелочью: C6H5-SO3Na + NaOH → C6H5-OH + Na2SO3 3. Взаимодействие галогенпроизводных ароматических УВ со щелочами: C6H5-Cl + NaOH → C6H5-OH + NaCl или с водяным паром: C6H5-Cl + H2O → C6H5-OH + HCl
Відходи
- Речовина фенетол використовується як проміжний продукт у виробництві органічних барвників. його одержують шляхом нагрівання йодистого етилу з натрій фенолятом. Напишіть рівняння відповідних реакцій і визначте, до якого класу належить фенетол.
- Натрій пентахлорфенолят використовують як засіб боротьби з бур’янами. Обчисліть масу розчину з масовою часткою речовини 0,8, яку необхідно взяти для обробки 5 га ґрунту, якщо норма внесення становить 32 кг/га.
Але треба зважати на те, що фенол вбиває не лише шкідливі мікроорганізми. Потрапляючи в довкілля, він згубно діє на флору і фауну. Тому виробництво і промислове використання фенолу тісно пов’язане з питаннями екології, з охороною природи від промислових відходів, що містять фенол. З цією метою застосовують різні методи: гази, що містять фенол, піддають каталітичному окисненню, видаляють фенол розчинниками тощо. Ведеться постійна робота з удосконалення цих методів. Так, великого значення набуває біохімічний метод, який забезпечує глибоке очищення стічних вод від фенолу. Перспективним є також обробка їх озоном. Запровадження таких методів очищення дає можливість перейти до замкнутих безвідхідних технологій з багаторазовим використанням промислових вод.
36. Альдегіди, склад, будова молекули, фізичні властивості. Ізомерія та номенклатурні назви альдегідів. Хімічні властивості альдегідів, якісні реакції на карбонільну групу. Добування та застосування альдегідів
Альдегіди і кетони – похідні вуглеводнів, що містять в своєму складі карбонільну групу (>С=О). Тому їх ще називають карбонільними сполуками.
Назву “альдегіди” запропонував у 1835 р. Ю. Лібіх для сполук, які містили на два атоми Гідрогену менше, ніж спирти. Він утворив її від Alcohol dehydrogenatus – сприт дегідрований. Лібіх також правильно помітив, що альдегіди – проміжні продукти в окисненні спирту до кислоти.
Назва “кетони” походить від назви першого представника цього ряду – ацетону – acetone.
В
альдегідах карбонільна група зв’язана
з вуглеводневим радикалом і атомом
Гідрогену. Групу –СОН
називають альдегідною. Загальна
формула альдегідів 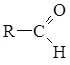 , .У
кетонах карбонільна група зв’язана з
двома вуглеводневими радикалами.
Карбонільну групу у кетонах часто
називаютькетогрупою. Загальна
формула кетонів
, .У
кетонах карбонільна група зв’язана з
двома вуглеводневими радикалами.
Карбонільну групу у кетонах часто
називаютькетогрупою. Загальна
формула кетонів 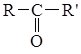 .
.
Номенклатура та ізомерія
В номенклатурі альдегідів і кетонів використовують тривіальні та систематичні назви.Тривіальні назви альдегідів походять від назв карбонових кислот, у які вони перетворюються при окисненні. Так, альдегід, при окисненні якого одержують мурашину кислоту, називають мурашиний альдегід (формальдегід – від лат. acidum formicum – кислота мурашина); альдегід при окисненні якого утворюється оцтова кислота – оцтовий альдегід або ацетальдегід (від лат. acidum aceticum – кислота оцтова) і.т.д.
За замісниковою номенклатурою ІЮПАК назву альдегіду утворюють від назви вуглеводню з тією ж кількістю атомів Карбону, включаючи атом Карбону карбонільної групи та додаючи суфікс –аль(суфікс утворений від альдегід). Нумерацію головного карбонового ланцюгу починають з атома Карбону альдегідної групи.

Для кетонів широко використовують радикало-функціональну номенклатуру, згідно якої назви утворюють з назв вуглеводневих радикалів при карбонільній групі перераховуючи їх в алфавітному порядку та додаючи слово кетон. За замісниковою номенклатурою назви кетонів утворюють від назв насичених вуглеводнів, що містять таку ж кількість атомів Карбону, додаючи суфікс –он(суфікс утворено від кетон) і цифрою позначаючи атом Карбону, що входить до складу кетогрупи. Нумерацію при цьому здійснюють так, щоб атом Карбону карбонільної групи отримав якомога менший номер.
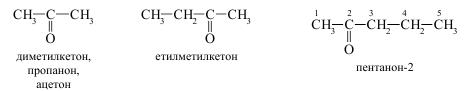
Для деяких кетонів збереглись тривіальні назви, зокрема диметилкетон частіше називають ацетон.
Для карбонільних сполук характерна структурна ізомерія.
Альдегіди і кетони, що містять однакову кількість атомів Карбону, ізомерні між собою. Так, пропанон і пропаналь є структурними ізомерами, які містять різні функціональні групи.

Ізомерія альдегідів і кетонів може бути також пов’язана з різною структурою карбонового ланцюга:
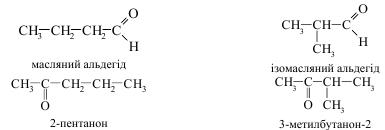
Для кетонів, крім того, характерна ізомерія зумовлена положенням карбонільної групи:

Способи добування
1. Окиснення спиртів. Первинні спирти окиснюються до альдегідів, а вторинні – до кетонів.
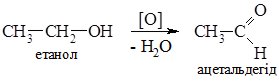
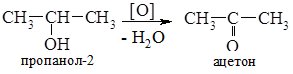
2. Гідратація алкінів (реакція Кучерова). З ацетилену в умовах реакції утворюється ацетальдегід, всі інші алкіни дають кетони:
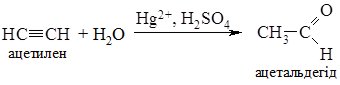
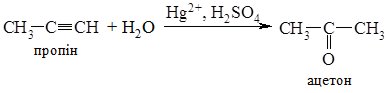
Гідратацією ацетилену в промисловості одержують оцтовий альдегід, а з нього відновленням – етиловий спирт; окисненням – оцтову кислоту. 3. Гідроліз дигалогеналканів. При гідролізі дигалогеналканів з атомами галогену біля первинного атома Карбону утворюються альдегіди, а біля вторинного – кетони. Особливо легко гідроліз відбувається в лужному середовищі:
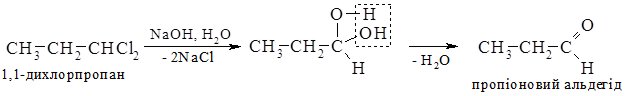
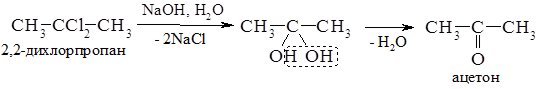
4. Оксосинтез. В промисловості альдегіди одержують взаємодією алкенів з карбон (ІІ) оксидом, воднем при підвищених температурі та тиску в присутності платинового або кобальтового каталізаторів. Зазвичай утворюється суміш ізомерів:
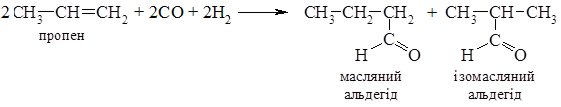
Фізичні та хімічні властивості
Мурашиний альдегід – газ, нижчі альдегіди і кетони – леткі рідини. Альдегіди і кетони добре розчиняються в органічних розчинниках, нижчі – розчинні у воді. Більшість альдегідів і кетонів мають характерний запах. Альдегіди, що містять 8 – 12 атомів Карбону – пахучі речовини, їх використовують у парфумерії.
Хімічні властивості альдегідів та кетонів визначаються наявністю в їх складі карбонільної групи.
Атоми Карбону та Оксигену в карбонільній групі перебувають у стані sp2‑гібридизації і зв’язані подвійним зв’язком, який складається з s- та p‑зв’язків. Атом Оксигену, як більш електронегативний, зміщує на себе електронну густину подвійного зв’язку. Внаслідок цього на атомі Карбону утворюється частковий позитивний (δ+), а на атомі Оксигену частковий негативний заряд (δ–):
![]()
Завдяки такій поляризації карбонільної групи, альдегіди і кетони є високореакційноздатними сполуками і вступають у реакції приєднання з реагентами, що мають неподілену пару електронів, або молекули яких містять атом з підвищеною електронною густиною або атом з негативним зарядом. Реакція починається з атаки атома Карбону карбонільної групи. Тому реакційна здатність карбонільних сполук в реакціях приєднання визначається величиною часткового позитивного заряду (δ+) на атомі карбону С=О-групи: чим він більший, тим вища їх реакційна здатність.
Альдегіди, як правило, більш реакційноздатні, ніж кетони. Алкільні радикали за рахунок +І-ефекту зміщують електронну густину у бік С=О-групи, зменшуючи позитивний заряд на атомі Карбону карбонільної групи. Наявність в молекулі кетону двох алкільних груп біля карбонільної групи, веде до більшого зниження величини позитивного заряду, ніж в молекулі альдегіду.
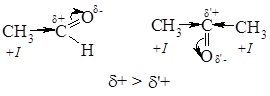
Всі реакції альдегідів та кетонів можна умовно поділити на групи:
– реакції приєднання;
– реакції окиснення і відновлення;
– реакції полімеризації.
Реакції приєднання.
Приєднання синильної кислоти відбувається по карбонільній групі альдегідів або кетонів з утворення ціангідринів (гідроксинітрилів).
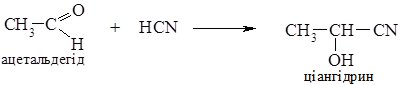
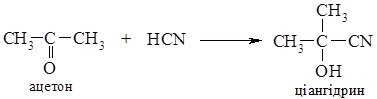
Реакція прискорюється в присутності основи; утворені ціангідрини використовують в синтезі гідрокси- та амінокислот.
2. Приєднання натрій гідроген сульфіту до альдегідів і найпростіших кетонів веде до утворення “бісульфітних сполук”. Реакція проходить без каталізатора.
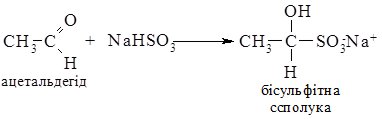
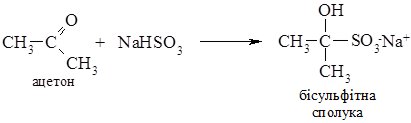
Бісульфітні сполуки погано розчинні у воді, тому ця реакція є якісною на карбонільну групу, також її використовують для виділення і очищення альдегідів і кетонів.
3. При взаємодії з амоніаком альдегіди утворюють альдіміни.
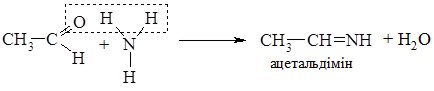
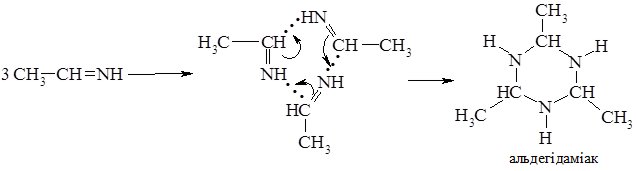
Альдіміни – нестійкі сполуки, вони самовільно полімеризуються (циклізуються). Три молекули ацетальдіміну самовільно циклізуються з утворенням альдегідаміаку:
4. При взаємодії карбонільних сполук з гідроксиламіном (NH2OH) утворюються оксими, у випадкуальдегідів – альдоксими, кетонів – кетоксими.
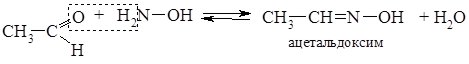
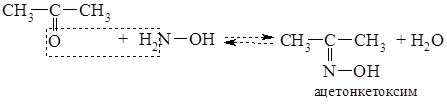
Альдоксими і кетоксими – тверді кристалічні речовини з чіткими температурами плавленнями, реакцію їх утворення використовують для виділення та ідентифікації альдегідів і кетонів.
Реакції відновлення та окиснення.
1. Реакції відновлення альдегідів та кетонів широко застосовують для одержання спиртів (альдегіди відновлюються до первинних, а кетони – до вторинних спиртів). У промисловості проводять гідрування карбонільних сполук у присутності каталітичних кількостей кобальту, нікелю або платини:
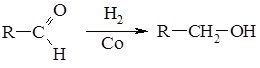
2. Окиснення альдегідів та кетонів відбувається по-різному. Альдегіди дуже легко окиснються, навіть при дії слабких окисників (Ag+, Cu+), вони перетворюються в карбонові кислоти:
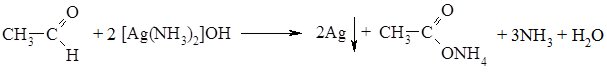
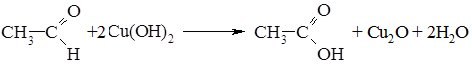
Реакцію окиснення альдегідів амоніачним розчином аргентум (І) оксиду називають реакцією “срібного дзеркала”. Іон Аргентуму в цій реакції відновлюється до вільного металу, яке виділяється у вигляді дзеркала на стінках пробірки.
Окиснення кетонів відбувається лише сильними окисниками – калій перманганатом або дихроматом, реакція супроводжується розривом зв’язків С‑С у молекулі кетону.
Реакції полімеризації.
Альдегіди, на відміну від кетонів здатні полімеризуватись. Процес проходить за звичайних умов і прискорюється кислотами. Полімеризація формальдегіду проходить з утворенням полімеру лінійної структури:
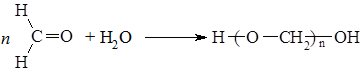
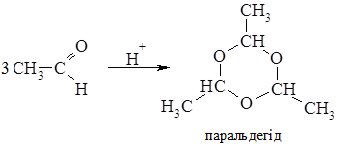
Полімеризація ацетальдегіду за наявності слідів сульфатної кислоти веде до утворення циклічного продукту – тримеру – паральдегіду:
Застосування
У промисловості формальдегід застосовують у виробництві фенол-формальдегідних, сечовиноформальдегідних та інших смол, необхідних в електропромисловості та машинобудуванні.
37 – 40% Водний розчин формальдегіду, що містить 6 – 15% метанолу (інгібітор полімеризації формальдегіду) відомий під назвою “формалін”, використовують як антисептичний, дубильний засіб.
У техніці одержують дегідруванням або окисненням етанолу над срібним каталізатором, гідратацією ацетилену та окисненням етилену у водному розчині киснем за наявності PdCl2 i CuCl2:
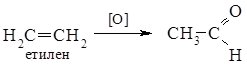
Ацетальдегід використовують в основному для одержання оцтової кислоти та деяких її похідних, як відновник при виробництві дзеркал.
У промисловості ацетон одержують в основному з кумену (кумольний метод); з пропілену реакцією гідратації з наступним оксиненням утвореного ізопропілового спирту; прямим окисненям пропілену в присутності PdCl2 у водному середовищі:
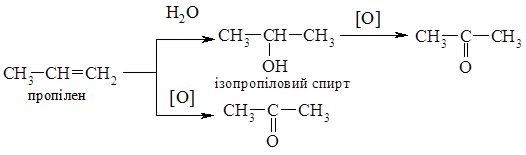
Ацетон використовують як розчинник органічних сполук (лаки, нітроцелюлоза), він є сировиною для синтезу багатьох органічних сполук.
37. Насичені одноосновні карбонові кислоти, склад та будова молекул, фізичні властивості. Ізомерія та номенклатура карбонових кислот. Хімічні властивості карбонових кислот. Добування та застосування карбонових кислот.
Карбонові
кислоти
— це органічні сполуки, до складу молекул
яких входить
карбоксильна функціональна
група:
–![]() Насичені
одноосновні карбонові кислоти містять
одну карбоксильну групу й ординарні
карбон-карбонові зв’язки.
У результаті
взаємного впливу атомів у карбоксильній
групі:
— зв’язок С=О міцніший, ніж в
альдегідній групі;
— зв’язок O–H
менш міцний, ніж у спиртах;
— атом
Гідрогену більш рухливий і
реакційноздатний.
Міжнародні
систематичні назви карбонових кислот
утворюються від назв відповідних
вуглеводнів із додаванням закінчення
-ова
і слова кислота.
Наприклад,
метанова кислота.
Загальна формула
насичених одноосновних карбонових
кислот
Насичені
одноосновні карбонові кислоти містять
одну карбоксильну групу й ординарні
карбон-карбонові зв’язки.
У результаті
взаємного впливу атомів у карбоксильній
групі:
— зв’язок С=О міцніший, ніж в
альдегідній групі;
— зв’язок O–H
менш міцний, ніж у спиртах;
— атом
Гідрогену більш рухливий і
реакційноздатний.
Міжнародні
систематичні назви карбонових кислот
утворюються від назв відповідних
вуглеводнів із додаванням закінчення
-ова
і слова кислота.
Наприклад,
метанова кислота.
Загальна формула
насичених одноосновних карбонових
кислот
![]() або
або
![]() .
Представники
гомологічного ряду насичених одноосновних
карбонових кислот
.
Представники
гомологічного ряду насичених одноосновних
карбонових кислот
Формула |
Назва за міжнародною систематичною номенклатурою |
Тривіальна назва |
НСООН |
Метанова кислота |
Мурашина кислота |
СН3СООН |
Етанова кислота |
Оцтова кислота |
С2Н5СООН |
Пропанова кислота |
Пропіонова кислота |
С3Н7СООН |
Бутанова кислота |
Масляна кислота |
С4Н9СООН |
Пентанова кислота |
Валеріанова кислота |
Ізомерія
карбонових кислот зумовлена зміною
будови карбонового скелета. Ізомери
утворюються у кислот з більш ніж чотирма
атомами Карбону, починаючи з бутанової
кислоти. Нумерація атомів Карбону
починається з Карбону, що входить до
складу карбоксильної групи. Наприклад:
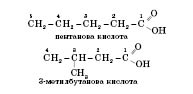
Фізичні властивості карбонових кислот.
Мурашина
кислота
— безбарвна рідина з різким запахом,
температура плавлення
![]() ,
кипіння
,
кипіння
![]() .
Розчиняється у воді в будь-яких
кількостях.
Оцтова
кислота
— за кімнатної температури безбарвна
рідина з різким характерним запахом.
За температури нижчої за
.
Розчиняється у воді в будь-яких
кількостях.
Оцтова
кислота
— за кімнатної температури безбарвна
рідина з різким характерним запахом.
За температури нижчої за
![]() (температура
плавлення) кристалізується і стає схожою
на лід, тому її називають«крижаною»
оцтовою кислотою.
Температура кипіння
(температура
плавлення) кристалізується і стає схожою
на лід, тому її називають«крижаною»
оцтовою кислотою.
Температура кипіння
![]() .
Розчиняється у воді в будь-яких кількостях:
3—9%-й розчин називається оцтом, 70—80%-й
розчин —
оцтовою есенцією.
.
Розчиняється у воді в будь-яких кількостях:
3—9%-й розчин називається оцтом, 70—80%-й
розчин —
оцтовою есенцією.
Оцтова кис-лота — безбарвна рідина, летка, має різкий специфіч-ний запах, змішується з водою в будь-яких пропорціях, розчин кислий на смак. У побуті відома у вигляді 3—9%-го водного розчину (столовий оцет) або 80% -го водного розчину (оцтова есенція). Хімічні властивості оцтової кислоти. Вони зумовлені наявністю функціональної карбоксильної групи. Електронна густина зв'язку О—Н зміщується до атома Оксигену як більш електронегативного елемента. Внаслідок цього зв'язок О—Н поляризується, атом Гідрогену в результаті набуває додаткової рухливості (здатності відщеплюватися), що й зумов-лює кислотні властивості оцтової кислоти. Як представник класу карбонових кислот оцтова кислота має особливості порівняно з неорганічними кислотами. У цьому можна переконатися на такому досліді (мал. 6). До суміші етилового спирту з суль-фатною кислотою (це каталізатор реакції) додамо оц-тової кислоти і суміш нагріємо. З'являється приємний ефірний запах, що свідчить про утворення етилового естеру оцтової кислоти — речовини, що належить до класу естерів. Застосування оцтової кислоти. Оцтова кислота у вигляді винного оцту відома людям здавна, оскільки утворюється в результаті оцтовокислого бродіння (скисання) вина. Проте виділили її в чистому вигляді лише у VIII ст. На початку XIX ст. було визначено склад оцтової кислоти, а її структурну формулу було запропоновано в середині XIX ст. У великих кількостях оцтова кислота використовується в органічному синтезі, під час виробництва лікар-ських препаратів, штучного волокна, хімічних засобів захисту рослин. Вона має широке застосування і як розчинник. У харчовій промисловості застосовується як консервувальний засіб та смакова приправа.
Біологічна дія.
Кислоти викликають хімічні опіки на шкірі. Мурашина кислота міститься у виділеннях залоз мурах, а також у деяких рослинах (наприклад у листі кропиви).
Добування карбонових кислот.
Загальний
спосіб добування карбонових кислот —
окиснення альдегідів або спиртів із
гідроксигрупою біля першого атома
Карбону:
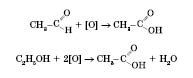
Хімічні властивості карбонових кислот (на прикладі оцтової кислоти).
Властивості,
подібні до властивостей неорганічних
кислот:
1)
Дисоціація у водних розчинах:
![]() Кислотний
залишок називається
ацетат-іоном.
2)
Взаємодія з основами:
Кислотний
залишок називається
ацетат-іоном.
2)
Взаємодія з основами:
![]() 3)
Взаємодія з основними оксидами:
3)
Взаємодія з основними оксидами:
![]() 4)
Взаємодія з солями слабкіших
кислот:
4)
Взаємодія з солями слабкіших
кислот:
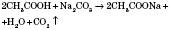 Властивості,
характерні для карбонових кислот:
5)
Взаємодія з галогенами:
Властивості,
характерні для карбонових кислот:
5)
Взаємодія з галогенами:
![]() Одержана
хлороцтова кислота сильніша за оцтову.
6)
Взаємодія зі спиртами:
Одержана
хлороцтова кислота сильніша за оцтову.
6)
Взаємодія зі спиртами:
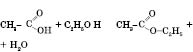 Утворюються
складні естери.
Цей естер називається
етилацетат,
або
етиловий естер оцтової кислоти.
Утворюються
складні естери.
Цей естер називається
етилацетат,
або
етиловий естер оцтової кислоти.
Застосування карбонових кислот.
Мурашина кислота застосовується як протрава для фарбування шерсті, консервант фруктових соків і силосу, використовується для дезінфекції місткостей у харчовій промисловості, у хімічних синтезах. Оцтова кислота застосовується для добування пластмас, барвників, ліків, штучних волокон, кіноплівки в хімічних синтезах. Вона використовується як приправа до їжі, для консервації овочів. Солі оцтової кислоти використовують для фарбування тканин, а також для боротьби зі шкідниками сільського господарства.
