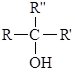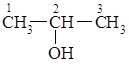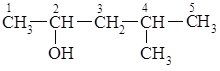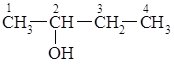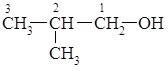- •25. Теорія хімічної будови органічних сполук. Ізомерія.
- •26. Алкани. Будова , фізичні властивості. Ізомерія. Номенклатурні назви. Хімічні властивості , добування та застосування.
- •Добування алканів з природного газу та нафти.
- •2. Приєднання водню до алкенів та алкінів.
- •3. Взаємодія галогеналканів з металічним натрієм (реакція Вюрца).
- •4. Декарбоксилювання карбонових кислот
- •5. Добування метану.
- •27. Алкени. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування
- •28. Алкіни, Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
- •29. Алкадієни . Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
- •30. Застосування та добування полімерів,канчуків , гуми.
- •31. Арени, склад, електронна та структурна формула,, фізичні властивості. Номенклатурні назви аренів. Хімічні властивості бензену. Застосування бензену. Хімічні засоби захисту рослин.
- •32. Нафта, склад, добування, застосування, перегонка нафти, крекінг нафтопродуктів.
- •33. Одноатомні спирти., будова молекули, фізичні властивості , класифікація. Ізомерія спиртів , номенклатурна назва. Хімічні властивості спиртів . Застосування та добування спиртів.
- •34. Багатоатомні спирти,фізичні властивості . Ізомерія спиртів , номенклатурна назва, хімічні властивості спиртів. Якісна реакція на багатоатомні спирти. Застосування та добування спиртів.
- •38. Естери, фізичні властивості. Ізомерія та номенклатурні назви естерів Добування та застосування естерів, Хімічні властивості естерів.
- •39. Жири,будова молекули, фізичні властивості, класифікація жирів. Ізомерія та номенклатурні назви жирів. Хімічні властивості жирів. Добування та застосування жирів. Значення жирів у життєдіяльності
- •40. Синтетичні миючі засоби, мило. Охорона довкілля від смз
- •41. Моносахариди. Глюкоза – альдегідо спирт, склад, будова молекули. Фізичні властивості. Хімічні властивості , якісна реакція . Поширення в природі, добування , застосування.
- •42. Дисахариди. Сахароза – дисахарид, склад та будова молекули, фізичні та хімічні властивості. Поширення в природі, застосування , загальна схема виробництва цукру.
- •43. Полісахариди. Крохмаль та целюлоза – полісахариди , склад та будова молекули, фізичні та хімічні властивості. Поширення в природі, застосування.
- •44. Аміни. Класифікація амінів. Склад і будова молекули, фізичні властивості. Ізомерія та номенклатура амінів. Хімічні властивості амінів. Добування та застосування.
- •45. Анілін. Ізомерія та номенклатура. Хімічні властивості, якісна реакція на анілін. Склад і будова молекули, фізичні властивості. Добування та застосування.
- •48. Волокна, класифікація .Способи добування волокон, застосування волокон.
32. Нафта, склад, добування, застосування, перегонка нафти, крекінг нафтопродуктів.
На́фта – такожземляна́ олі́я, теку́чка або кип'я́чка — горюча корисна копалина, складна суміш вуглеводніврізних класів з невеликою кількістю органічних кисневих, сірчистих і азотних сполук, що являє собою густу оліїсту рідину. Забарвлення в неї червоно-коричневе, буває жовто-зелене і чорне, іноді зустрічається безбарвна нафта. Нафта має характерний запах, легша за воду, у воді нерозчинна.
Елементний склад, %: вуглець 80-88, водень 11-14,5, сірка 0,01-5, кисень 0,05-0,7, азот 0,01-0,6.
Густина — 760–990 кг/м³
Теплота згоряння — 43,7-46,2 МДж/кг.
Найважливіше джерело рідкого палива, мастил, сировина для синтетичних матеріалів тощо.
Застосування
Нафта — найважливіше джерело рідкого палива, мастил, сировина для синтетичних матеріалів тощо. Нафта займає провідне місце в світовому паливно-енергетичному господарстві. Її частка в загальному споживанні енергоресурсів безперервно зростає: 3% в 1900 р., 5% перед Першою світовою війною 1914–1918 рр., 17,5% напередодні Другої світової війни 1939–1945 рр., 24% у 1950 р., 41,5% у 1972 р., 48% в 2004 р. У перспективі ця частка буде меншати внаслідок зростання застосування атомної і інших видів енергії, а також збільшення вартості видобутку.
СХЕМА ВИДОБУВАННЯ ТА ПЕРЕРОБКИ НАФТИ СПРОЩЕНО
1 РОЗВІДУВАННЯ
СУПУТНИК
Глобальна система позиціонування подає сигнали, які використовуються для геологорозвідування.
ГЕОФОНИ
МАШИНА ІЗ СЕЙСМОВІБРАТОРОМ
ГІДРОФОНИ
КОРАБЕЛЬ ІЗ СЕЙСМОВІБРАТОРОМ
Сейсмічне зондування — один із методів розвідування, при якому реєструють штучно створені сейсмічні хвилі, що відбиваються від підземних порід.
2 ДОБУВАННЯ
НАЗЕМНІ СВЕРДЛОВИНИ
МОРСЬКА НАФТОВА ПЛАТФОРМА
ПІДВОДНА СВЕРДЛОВИНА
Нафту видобувають з материкових, шельфових та глибоководних свердловин. Для підтримування необхідного тиску в нафтоносних пластах, туди нагнітають гази або воду.
ШЕЛЬФОВЕ РОДОВИЩЕ
Для встановлення видобувного обладнання на дні моря використовуються підводні плавальні механізми з дистанційним керуванням.
ГОРИЗОНТАЛЬНЕ БУРІННЯ
За допомогою дистанційного управління оператор керує роботою двигунів, які обертають бур, а датчики аналізують склад ґрунту.
3 ТРАСПРОРТУВАННЯ
НАФТОПРОВІД
ТАНКЕР
За допомогою трубопроводів нафту транспортують суходолом, під землею та під водою. Крім того, її перевозять танкерами, баржами і залізничними цистернами.
Крекінг нафтопродуктів
Крекінг нафтопродуктів полягає в розщепленні довгих молекул вуглеводів, що входять у висококиплячі фракції, на більш короткі молекули легких, низько киплячих продуктів.
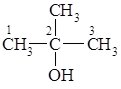
33. Одноатомні спирти., будова молекули, фізичні властивості , класифікація. Ізомерія спиртів , номенклатурна назва. Хімічні властивості спиртів . Застосування та добування спиртів.
Одноатомні спирти
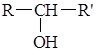
Загальна формула одноатомних спиртів R–OH. Залежно від того, з яким атомом Карбону (первинним, вторинним чи третинним) зв’язана гідроксильна група, розрізняють первинні, вторинні і третинні спирти.
R–CH2–OH первинний спирт |
вторинний спирт |
третинний спирт |
Номенклатура та ізомерія.
Для назви спиртів найчастіше використовують дві номенклатури: замісникову та радикало-функціональну.
За замісниковою номенклатурою ІЮПАК назви спиртів утворюють від назв відповідних вуглеводнів шляхом додавання суфікса –ол (від алкоголь) і цифрою позначають атом Карбону, з яким зв’язана гідроксильна група. Нумерацію ланцюга починають з того боку, до якого ближче знаходиться гідроксильна група. Згідно з радикало-функціональною номенклатурою спирти називають за назвою радикала з яким зв’язана гідроксильна група, та додаванням до цієї назви закінчення –овий та слова спирт. Остання номенклатура зручна лише для найпростіших спиртів:
СН3ОН |
метанол |
метиловий спирт |
СН3–СН2–ОН |
етанол |
етиловий спирт |
|
пропанол –1 |
пропіловий спирт |
|
пропанол-2 |
ізопропіловий спирт |
|
4-метилпентанол-2 |
|
Для спиртів характерна структурна ізомерія.
Ізомерія у ряду спиртів розпочинається з третього члена гомологічного ряду. Ці ізомери відрізняються положенням гідроксильної групи.
C3H8O |
пропанол-1 |
пропанол-2 |
Для наступного члена гомологічного ряду структурна ізомерія обумовлена не тільки положенням гідроксилу, але й будовою карбонового ланцюга.
С4Н10О |
бутанол-1 |
бутанол-2 |
2-метилпропанол-1 |
2-метилпропанол-2 |
Способи добування.
Гідроліз галогенопохідних. При обробці галагенопохідних водним розчином лугу, іде заміщення галогену на гідроксил.
СН3СН2Br + NaOH → СН3СН2OH + NaBr
брометан етанол
2. Гідратація алкенів. Приєднання води до алкенів відбувається в присутності кислот (сульфатної або фосфатної):
СН2=СН2 + Н2О → СН3СН2OH
етен етанол
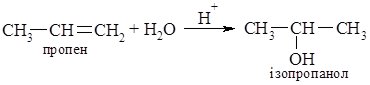
Гідратацією алкенів одержують вторинні та третинні спирти; з первинних спиртів таким способом можна добути лише етиловий. Цей метод використовують для промислового одержання спиртів.
3. Відновлення альдегідів та кетонів. При відновленні альдегідів утворюються первинні спирти, а кетонів – вторинні.
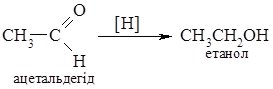
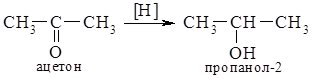
Фізичні властивості.
Нижчі спирти – безбарвні рідини з характерним запахом; вищі спирти – тверді речовини.
Спирти мають високі температури кипіння. Це обумовлено тим, що спирти, як і вода, є асоційованими рідинами. Їх молекули здатні утворювати міжмолекулярні водневі зв’язки, сполучаючись при цьому в довгі ланцюги – асоціати.

Перші члени гомологічного ряду спиртів змішуються з водою в усіх співвідношеннях, зі збільшенням числа атомів Карбону в молекулі розчинність у воді швидко зменшується, вищі спирти у воді не розчинні.
Хімічні властивості.
Реакції, в які вступають спирти, супроводжуються розривом зв’язків О–Н або С–О.
1. Кислотні властивості спиртів. Утворення алкоголятів.
Спирти не змінюють колір лакмусового паперу, проте виявляють слабкі кислотні властивості. Кислотний характер спиртів обумовлений високою полярністю зв’язку в гідроксильній групі. Атом Оксигену, як більш електронегативний, зміщує на себе спільну пару електронів від атома Гідрогену; на останньому виникає частковий позитивний заряд:
![]()
Спирти взаємодіють з лужними металами, утворюючи алкоголяти:
2СН3СН2ОН + 2Na → 2СН3СН2ONa + Н2
натрій етилат
Під дією води алкоголяти розкладаються з утворенням спирту та лугу, оскільки вода виявляє сильніші кислотні властивості:
СН3СН2ОNa + H2O → СН3СН2OH + NaOH
З лугами спирти практично не взаємодіють, оскільки серед продуктів реакції з’являється вода, яка розкладає утворений алкоголят:
СН3СН2ОH + NaOH ↔ СН3СН2ONa + H2O
Для зміщення рівноваги в бік утворення алкоголяту, з реакційної суміші слід видаляти воду.
2. Взаємодія з карбоновими кислотами.
При нагріванні спиртів з карбоновими кислотами в присутності концентрованої сульфатної кислоти утворюються естери (складні ефіри).
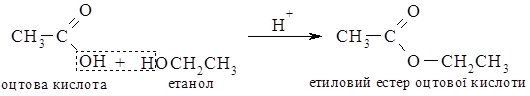
Це – реакція еcтерифікації.
3. Взаємодія з галагеноводнями.
При взаємодії спиртів з галогеноводневими кислотами відбувається заміщення гідроксильної групи на атом галогену.
СН3СН2ОН + HCl → СН3СН2Cl + Н2O
хлоретан
4. Дегідратація спиртів.
Залежно від умов реакції, відщеплення молекули води може відбуватися внутрішньомолекулярно або міжмолекулярно. Внутрішньо-молекулярна дегідратація спиртів відбувається за температури близько 1800 С у присутності концентрованих сульфатної або фосфатної кислот, алюміній оксиду. При цьому утворюються алкени.
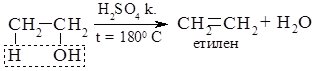
При нижчій температурі та наявності каталітичної кількості мінеральної кислоти відбувається міжмолекулярна дегідратація:
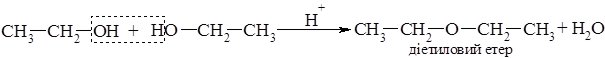
В результаті відщеплення молекули води від двох молекул спирту, утворюються етери.
Етери – органічні сполуки, у молекулах яких два вуглеводневих радикали з’єднані між собою через атом Оксигену. Їх загальна формула R–O–R.
Діетиловий етер або ефір (С2Н5ОС2Н5) одна із перших речовин, яку почали застосовувати у медицині, як препарат для загального наркозу. Ще у 1832 р. Лонг (США) застосував ефір як анестезуючий засіб при хірургічних втручаннях.
5. Реакції окиснення. Первинні, вторинні та третинні спирти окиснюються по-різному. Первинні та вторинні спирти легко окиснюються з утворенням карбонільних сполук – відповідно альдегідів чи кетонів. Як окисники використовують калій перманганат або хромову суміш, які оксинюють спирти вже за кімнатної температури.
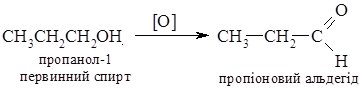
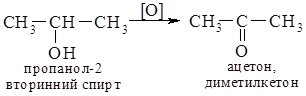
Третинні спирти за цих умов не окиснюються. В більш жорстких умовах оксиснення супроводжується розривом С–С зв’язків з утворенням суміші карбонових кислот.
При горінні спиртів утворюється карбон (IV) оксид та вода:
С2Н5ОН + 3О2 → 2СО2 + 3Н2О
Окремі представники.
Метиловий спирт (метанол, деревний спирт) СН3ОН – родоначальник гомологічного ряду спиртів. Безбарвна рідина, легко змішується з водою, спиртами, іншими органічними розчинниками.Одержують метанол із синтез-газу при нагріванні за наявності каталізатора:
СО2 + Н2 → СН3ОН + Н2О
або з карбон (ІІ) оксиду та водню при нагріванні:
СО + 2Н2 → СН3ОН
До 1923 р. метанол одержували виключно сухою перегонкою деревини, тому його ще називаютьдеревний спирт.
Вперше метиловий спирт у чистому вигляді виділили Ж.Дюма та Е. Пеліго у 1834 р. і встановили його формулу (СН3ОН), а також сформували уявлення про спирти, як окремий клас органічних сполук. Вперше метанол синтезував П. Бертло у 1858 р.:
CH3Cl + KOH → CH3OH + KCl
хлорметан
Метиловий спирт надзвичайно отруйний. Попадання в організм людини біля 30 г метанолу викликають смерть, а менші дози руйнують зоровий нерв і ведуть до втрати зору.
Етиловий спирт (від гр. aether – повітря, етер, та hyle – дерево, речовина)(етанол, винний спирт) С2Н5ОН. Безбарвна легко рухлива рідина, з характерних запахом і пекучим смаком. Змішується у всіх співвідношеннях з водою, іншими спиртами. Входить до складу алкогольних напоїв. У невеликих кількостях викликає стан алкогольного сп’яніння, збільшення дози веде до наркотичного стану.
У середні віки спирт вважали найкращими ліками і навіть називали “вода життя” (лат. aqua vitae). Інша назва етанолу – “вогняна вода” (лат. aqua ardens) вказувала на його властивості.
Етиловий сприт широко застосовують як сировину в органічному синтезі, як розчинник, у фармації та медицині для виготовленні настоянок, екстрактів, як дезинфікуючий засіб.
У промисловості етанол одержують бродінням вуглеводів рослинного походження та гідратацією етилену у присутності концентрованої H2SO4:
C6H12O6 ![]() 2СН3СН2OH
+ 2CO2
2СН3СН2OH
+ 2CO2
глюкоза етанол
СН2=СН2 +
Н2О ![]() СН3СН2OH
СН3СН2OH
етен етанол
Вперше цю реакцію здійснив французький хімік П. Бертло, який був не тільки чудовим хіміком, але й очолював Міністерство народної освіти та вишуканих мистецтв, а також був Міністром іноземних справ Французької республіки.