
- •25. Теорія хімічної будови органічних сполук. Ізомерія.
- •26. Алкани. Будова , фізичні властивості. Ізомерія. Номенклатурні назви. Хімічні властивості , добування та застосування.
- •Добування алканів з природного газу та нафти.
- •2. Приєднання водню до алкенів та алкінів.
- •3. Взаємодія галогеналканів з металічним натрієм (реакція Вюрца).
- •4. Декарбоксилювання карбонових кислот
- •5. Добування метану.
- •27. Алкени. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування
- •28. Алкіни, Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
- •29. Алкадієни . Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
- •30. Застосування та добування полімерів,канчуків , гуми.
- •31. Арени, склад, електронна та структурна формула,, фізичні властивості. Номенклатурні назви аренів. Хімічні властивості бензену. Застосування бензену. Хімічні засоби захисту рослин.
- •32. Нафта, склад, добування, застосування, перегонка нафти, крекінг нафтопродуктів.
- •33. Одноатомні спирти., будова молекули, фізичні властивості , класифікація. Ізомерія спиртів , номенклатурна назва. Хімічні властивості спиртів . Застосування та добування спиртів.
- •34. Багатоатомні спирти,фізичні властивості . Ізомерія спиртів , номенклатурна назва, хімічні властивості спиртів. Якісна реакція на багатоатомні спирти. Застосування та добування спиртів.
- •38. Естери, фізичні властивості. Ізомерія та номенклатурні назви естерів Добування та застосування естерів, Хімічні властивості естерів.
- •39. Жири,будова молекули, фізичні властивості, класифікація жирів. Ізомерія та номенклатурні назви жирів. Хімічні властивості жирів. Добування та застосування жирів. Значення жирів у життєдіяльності
- •40. Синтетичні миючі засоби, мило. Охорона довкілля від смз
- •41. Моносахариди. Глюкоза – альдегідо спирт, склад, будова молекули. Фізичні властивості. Хімічні властивості , якісна реакція . Поширення в природі, добування , застосування.
- •42. Дисахариди. Сахароза – дисахарид, склад та будова молекули, фізичні та хімічні властивості. Поширення в природі, застосування , загальна схема виробництва цукру.
- •43. Полісахариди. Крохмаль та целюлоза – полісахариди , склад та будова молекули, фізичні та хімічні властивості. Поширення в природі, застосування.
- •44. Аміни. Класифікація амінів. Склад і будова молекули, фізичні властивості. Ізомерія та номенклатура амінів. Хімічні властивості амінів. Добування та застосування.
- •45. Анілін. Ізомерія та номенклатура. Хімічні властивості, якісна реакція на анілін. Склад і будова молекули, фізичні властивості. Добування та застосування.
- •48. Волокна, класифікація .Способи добування волокон, застосування волокон.
29. Алкадієни . Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
Алкадієни – ненасичені вуглеводні аліфатичного ряду, які містять два подвійних зв’язки. Їх також називають дієнами, або дієновими вуглеводнями.
Назва дієни, дієнові вуглеводні утворилась шляхом об’єднання множної приставки ді– (два) та суфікса ‑ен, яким позначають подвійний зв’язок в молекулі вуглеводню. Загальна формула класу – CnH2n–2
Назви дієнів за замісниковою номенклатурою ІЮПАК утворюють від назв насичених вуглеводнів шляхом заміни останньої літери на суфікс –дієн.
Алкадієни з кумульованими подвійними зв’язками – у них подвійні зв’язки розташовані біля одного атома Карбону. Найпростішим представником цієї групи дієнів є ален (пропадієн-1,2) СН2=СН=СН2, тому їх називають аленами.
Алкідієни із кон’югованими подвійними зв’язками – у них подвійні зв’язки розділені одним простим зв’язком. Спрощено їх називають кон’югованими дієнами. Найпростішим представником є бутадієн-1,3 або дивініл СН2=СН‑СН=СН2.
Алкадієни з ізольованими подвійними зв’язками – у них подвійні зв’язки перебувають один від одного на відстані двох або більше простих зв’язків. Найпростішим представником цієї групи дієнів є пентадієн-1,4 СН2=СН‑СН2‑СН=СН2.
Фізичні властивості:
Низькомолярні алкадієни — це безбарвні рідини з низькими температурами кипіння (ізопрен кипить за 34 °C, 2,2-диметил-1,3-бутадієн за 68.78 °C, 1,3-циклопентадієн зі 41.5 °C). Пропадієн та бутадієн суть газами (Tкип −4,5 °C та −34 °C відповідно) за нормальних умов.
Спряжені дієни можуть мати цис- і транс-конформації відносно проміжного одинарного зв'язку, які здатні переходити одне в одну. Стійкішою є транс-форма.
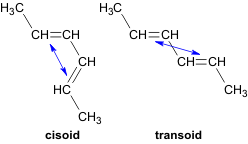
Номенклатура
Подібно до інших ненасичених вуглеводнях, положення кратних зв'язків зазначається перед наростком «-дієн», лічба ланцюга починаться з кінця до якого подвійний зв'язок найближче, та корінь визначається довжиною головного ланцюга. Наприклад, ізомери пентадієну: CH2=CH-CH=CH-CH3 — це пента-1,3-дієн, CH2=CH-CH2-CH=CH2 — це пента-1,4-дієн. Так само як і в алкенів, саме кратний зв'язок є головним структурним елементом.
Залежно від взаємного розміщення подвійних зв¢язків алкадієни поділяються на три групи: -ізольовані, в яких подвійні зв’язки в ланцюгу розділені одним чи декількома sp3-гібридизованими атомами карбону: >C=CH-(CH2)n-CH=C<, де n = 1,2,3…; Ізольовані алкадієни виявляють хімічні властивості, подібні до звичайних алкенів з тією лише різницею, що у реакцію може вступати не один, а два подвійних зв'язки незалежно один від одного; -кумульовані алкадієни, в яких обидва подвійні зв'язки знаходяться поруч і належать одному атому карбону, наприклад: СН2=С=СН2 Пропадієн (ален) Цю групу алкадієнів часто називають аленовими вуглеводнями за першим членом гомологічного ряду; аленові вуглеводні є нестійкими сполуками, вони швидко ізомеризуються в алкіни, тому не мають самостійного значення; -спряжені алкадієни, в яких подвійні зв'язки розділені лише одним s-зв'язоком С-С: >C=CH-CH=C<. Саме спряжені алкадієни мають найважливіше значення в органічному синтезі.
Для алкадієнів найбільш характерними є реакції електрофільного приєднання АЕ, однак на відміну від алкенів наявність спряженої системи дає деякі особливості в реакціях АЕ. Це зумовлює можливість одержання двох продуктів. Один з них отримується за рахунок приєднання за місцем будь-якого подвійного зв¢язку – такийшлях реакції позначають терміном 1,2-приєднання. А інший продукт утворюється внаслідок приєднання до крайніх атомів С, що складають спряжену систему, – так зване 1,4-приєднання. Переважний напрямок проходження реакції залежить від умов її проведення та природи реагентів.
6. Одержання алкадієнів Завдяки великому промисловому значенню алкадієнів розроблено багато способів їх добування. 1 Ступеневе дегідрування бутану та ізопентану над змішаним каталізатором – оксидом хрому (ІІІ) на оксиді алюмінію:
t0, kat t0, kat СН3-СН2-СН2-СН2 –––––à CH3-CH2-CH=CH2 –––––à –H2 –H2 ––––––> CH2=CH-CH=CH2. 2Реакція Лебедєва – одночасне дегідрування і дегідратація етанолу: 4400C 2СН3-СН2-ОН –––––––à CH2=CH-CH=CH2 + 2H2O + H2. ZnO/Al2O3 Лабораторні способи -дегалогенування віцинальних тетрагалогеналканів за допомогою цинку чи магнію: CH2Br-CHBr-CHBr-CH2Br +2 Zn à CH2=CH-CH=CH2 +2 ZnBr2. 1,2,3,4-Тетрабромбутан Дивініл -дегідрогалогенування 1,4-дигалогеналканів спиртовим розчином лугу: CH2Br-CH2-CH2-CH2Br+2КОН(спирт.)à 1,4-Дибромбутан ––––>CH2=CH-CH=CH2+2KBr+ 2H2O. Дивініл -дегідратація g-гліколів (двоатомних спиртів з гідроксильними групами в 1,4-положеннях): СН2-СН2-СН2-СН2 t0 ½ ½ –––––––––à CH2=CH-CH=CH2 + 2H2O. OH OH H2SO4(к) Бутандіол-1,4 7. Застосування алкадієнів Алкадієни (ізопрен, дивініл) використовуються для одержання синтетичних каучуків. Натуральний каучук – високоеластичний матеріал природного походження, який одержують із латексу – соку каучуконосних рослин (гевея, гваюла, кок-сагиз, тау-сагиз та ін.) - при дії на нього коагулянтом – оцтовою кислотою. За складом і будовою натуральний каучук являє собою ізопреновий полімерний ланцюг із цис-конфігурацією, при якій всі однакові групи (у даному випадку –СН2–) розміщені з одного боку від подвійного зв’язку. Такий полімер називається стереорегулярним: Макромолекула натурального каучуку складається у середньому з 250 елементарних ланок, а молекулярна маса коливається у межах 150000-500000. Для надання каучуку міцності та стійкості до зношування, перепадів температур, дії розчинників і агресивних хімічних реагентів, його піддають вулканізації – нагріванню із сіркою (вулканізатор) у суміші з наповнювачем (найчастіше це сажа), внаслідок чого ланцюги нормальної будови зшиваються у сітчасті тривимірні макромолекули. Вулканізований каучук називають гумою. Гума містить значно менше подвійних зв¢язків, ніж каучук, оскільки частина їх руйнується при взаємодії із сіркою (рис. 2). Якщо вміст сірки досягає 32%, подвійних зв¢язків не залишається, окремі ланцюги фіксуються сульфідними містками, а каучук перетворюється на ебоніт –– тверду речовину з іншими властивостями. Натуральний каучук – дефіцитний дорогий продукт, тому розроблені способи добування синтетичних каучуків із заданими властивостями. Для цього застосовують процес сополімеризації – сумісної полімеризації алкадієнів з іншими ненасиченими сполуками, які можна розглядати як похідні етилену: з вінілхлоридом СН2=СНСl, стиреном СН2=СН-С6Н5, акрилонітрилом СН2=СН-CN. Наприклад, сополімер бутадієну і стирену – бутадієнстиреновий каучук, який завдяки великій міцності та стійкості до зношування використовується для виробництва автомобільних шин. Схема сополімеризації: n CH2=CH-CH=CH2 + n CH2=CH ---à
