
- •25. Теорія хімічної будови органічних сполук. Ізомерія.
- •26. Алкани. Будова , фізичні властивості. Ізомерія. Номенклатурні назви. Хімічні властивості , добування та застосування.
- •Добування алканів з природного газу та нафти.
- •2. Приєднання водню до алкенів та алкінів.
- •3. Взаємодія галогеналканів з металічним натрієм (реакція Вюрца).
- •4. Декарбоксилювання карбонових кислот
- •5. Добування метану.
- •27. Алкени. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування
- •28. Алкіни, Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
- •29. Алкадієни . Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
- •30. Застосування та добування полімерів,канчуків , гуми.
- •31. Арени, склад, електронна та структурна формула,, фізичні властивості. Номенклатурні назви аренів. Хімічні властивості бензену. Застосування бензену. Хімічні засоби захисту рослин.
- •32. Нафта, склад, добування, застосування, перегонка нафти, крекінг нафтопродуктів.
- •33. Одноатомні спирти., будова молекули, фізичні властивості , класифікація. Ізомерія спиртів , номенклатурна назва. Хімічні властивості спиртів . Застосування та добування спиртів.
- •34. Багатоатомні спирти,фізичні властивості . Ізомерія спиртів , номенклатурна назва, хімічні властивості спиртів. Якісна реакція на багатоатомні спирти. Застосування та добування спиртів.
- •38. Естери, фізичні властивості. Ізомерія та номенклатурні назви естерів Добування та застосування естерів, Хімічні властивості естерів.
- •39. Жири,будова молекули, фізичні властивості, класифікація жирів. Ізомерія та номенклатурні назви жирів. Хімічні властивості жирів. Добування та застосування жирів. Значення жирів у життєдіяльності
- •40. Синтетичні миючі засоби, мило. Охорона довкілля від смз
- •41. Моносахариди. Глюкоза – альдегідо спирт, склад, будова молекули. Фізичні властивості. Хімічні властивості , якісна реакція . Поширення в природі, добування , застосування.
- •42. Дисахариди. Сахароза – дисахарид, склад та будова молекули, фізичні та хімічні властивості. Поширення в природі, застосування , загальна схема виробництва цукру.
- •43. Полісахариди. Крохмаль та целюлоза – полісахариди , склад та будова молекули, фізичні та хімічні властивості. Поширення в природі, застосування.
- •44. Аміни. Класифікація амінів. Склад і будова молекули, фізичні властивості. Ізомерія та номенклатура амінів. Хімічні властивості амінів. Добування та застосування.
- •45. Анілін. Ізомерія та номенклатура. Хімічні властивості, якісна реакція на анілін. Склад і будова молекули, фізичні властивості. Добування та застосування.
- •48. Волокна, класифікація .Способи добування волокон, застосування волокон.
44. Аміни. Класифікація амінів. Склад і будова молекули, фізичні властивості. Ізомерія та номенклатура амінів. Хімічні властивості амінів. Добування та застосування.
Амі́ни — нітрогеновмісні органічні хімічні сполуки, похідні амоніаку (NH3), в якому атоми гідрогену заміщені однією чи багатьма групами інших атомів — вуглеводневими радикалами.
Якщо амін створений заміщенням одного атома гідрогену в NH3, він називається первинним аміном (формула RNH2), якщо двох — вторинним аміном (R2NH), а якщо трьох — третинним аміном (R3N). Четвертинні аміни мають чотири замісники при атомі нітрогену, внаслідок чого атом нітрогену в цих амінах має електричний заряд +1.
Залежно від природи радикалів аміни називаються: аліфатичними, ароматичними та гетероциклічними. Нижчі аліфатичні аміни — гази, вищі — рідини й тверді речовини. Найважливішим ароматичним аміном є анілін.
Фізичні та хімічні властивості
Найпростіші аліфатичні аміни – метиламін, диметиламін, триетиламін – безбарвні гази із запахом амоніаку, алкіламіни з більшою кількістю атомів Карбону – рідини з неприємним запахом, вищі аміни – тверді речовини. Ариламіни за звичайних умов – безбарвні рідини або кристалічні речовини. Нижчі аміни аліфатичного ряду добре розчинні у воді, вищі алкіламіни та ариламіни у воді не розчинні.
Хімічні перетворення амінів визначаються в основному наявністю пари електронів на атомі Нітрогену. Як і амоніак, вони виявляють основні властивості.
1. Основність амінів обумовлена наявністю на атомі Нітрогену аміногрупи вільної пари електронів, за рахунок якої він здатний приєднувати протон. Аміни взаємодіють з кислотами з утворенням солей:
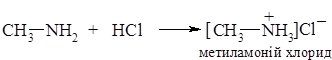
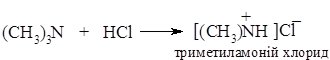
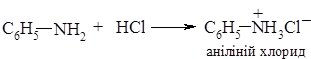
Приєднання протону відбувається за донорно-акцепторним механізмом. Атом Нітрогену (донор) надає неподілену пару електронів на утворення ковалентного зв’язку з протоном (акцептор), через що набуває позитивного заряду (утворюється катіон амонію).
Через здатність амінів утворювати солі з мінеральними кислотами їх часто називають органічним основами.
Основні властивості амінів залежать від природи вуглеводневого радикалу, замісники, які збільшують електронну густину в основному центрі, збільшують основність. Алкіламіни – найсильніші основи, їх водні розчини створюють лужне середовище внаслідок проходження реакції:
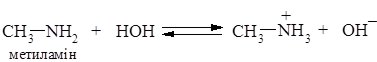
Алкіламіни є сильнішими основами, ніж амоніак. Алкількі радикали виявляють електронодонорні властивості, відштовхуючи від себе електрони, тим самим збільшують електронну густину на атомі Нітрогену (порівняно з амоніаком), що полегшує приєднання протону.
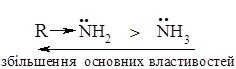
Основні властивості ариламінів нижчі ніж у алкіламінів і амоніаку. Водний розчин аніліну не дає реакції на індикатори. Зменшення основних властивостей аніліну пов’язане зі зменшенням електронної густини на атомі Нітрогену аміногрупи. Неподілена пара електронів атому Нітрогену вступає у взаємодію з p-електронами бензенового ядра, внаслідок чого електронна густина з аміногрупи зміщується в бік фенільного радикалу:
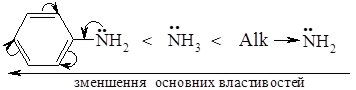
2. Алкілування амінів. Метиламін та етиламін вперше виділив Ш. Вюрц у 1849 р. В цьому ж році А. Гофман розробив загальний метод синтезу первинних, вторинних та третинних амінів і четвертинних амонієвих солей, що базувався на взаємодії аміну з алкілгалогенідами (див. способи добування). Цей метод дозволяє одержувати вторинні та третинні амін з різними замісниками біля атома Нітрогену.
![]()
3. Ацилювання амінів (первинних і вторинних) відбувається при взаємодії з похідними карбонових кислот:
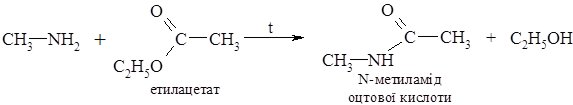
Третинні аміни не ацилюються через відсутність атома Гідрогену біля атома Нітрогену.
4. Реакції за участю ароматичного ядра ариламінів. Аміногрупа зв’язана з бензеновим ядром виявляє електронодонорні властивості, внаслідок чого в бензеновому ядрі підвищується електронна густина, що полегшує реакції заміщення:
Аміногрупа орієнтант І роду, вона підвищує електронну густину на всіх атомах Карбону бензенового циклу, але в більшій мірі на атомах Карбону в орто- та пара-положеннях.
При взаємодії аніліну з бромною водою, практично з кількісним виходом утворюється 2,4,6-триброманілін:
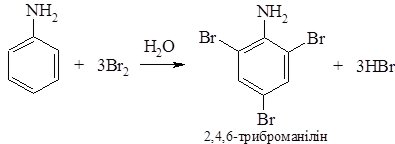
Електронодонорний вплив аміногрупи настільки великий, що заміщення відразу відбувається за трьома положеннями. Реакцію бромування використовують для ідентифікації аніліну, оскільки триброманілін випадає у вигляді біло-жовтого осаду. Ця реакція настільки чутлива, що довгий час використовувалась для визначення вмісту брому в морській воді.
5. Горіння. На відміну від амоніаку, аміни згорають в атмосфері кисню з утворенням азоту, карбон (IV) оксиду та води.
4CH3CH2NH2 + 15O2 → 2N2 + 8CO2 + 14H2O
Способи добування
1. Реакція галогеналканів з амоніаком при нагріванні веде до утворення суміші солей первинних, вторинних та третинних амінів і солі четвертинної амонієвої основи:
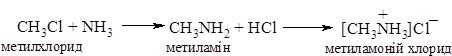
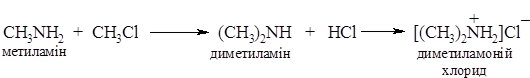
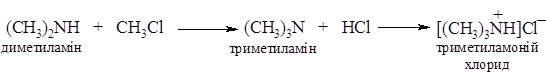
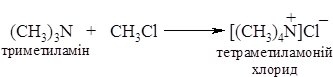
Аміни виділяють із солей при дії основ:
![]()
2. Відновлення
нітроаренів (реакція
Зініна). Послідовність реакцій
вуглеводень ![]() нітросполука
нітросполука ![]() амін
є однією з найкращих схем синтезу
первинних ароматичних амінів. Відновлення
нітроаренів проводять у нейтральному,
кислому або лужному середовищі:
амін
є однією з найкращих схем синтезу
первинних ароматичних амінів. Відновлення
нітроаренів проводять у нейтральному,
кислому або лужному середовищі:
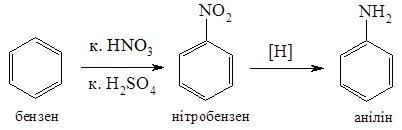
Окремі представники
Анілін C6H5NH2 – безбарвна рідина х характерним запахом, дуже малорозчинна у воді, змішується з більшістю органічних розчинників.
Анілін вперше виділив Унфердорбен при перегонці індиго у 1826 р. і назва його “кристалін”. Індиго (лат. indigo, через лат. indicum від гр. indicos – індійський) один із найдавніших природних барвників. Одержували цей темно-синій барвник із тропічних рослин роду Indigofera. Протягом декількох століть індиго і марена були основними барвниками в усьому світі. У 1840 р. Ю. Фріцше запропонував покращений метод добування аніліну із індиго і ввів його сучасну назву – анілін (від португальського anil – індиго з араб. an-nil, санскритом nile – синій).
Анілін широко використовують у синтезі барвників, лікарських речовин, пестицидів. По-суті промисловий органічний синтез бере свій початок від синтезу пеших барвників на основі аніліну, так званих “анілінових барвників”.
