
- •25. Теорія хімічної будови органічних сполук. Ізомерія.
- •26. Алкани. Будова , фізичні властивості. Ізомерія. Номенклатурні назви. Хімічні властивості , добування та застосування.
- •Добування алканів з природного газу та нафти.
- •2. Приєднання водню до алкенів та алкінів.
- •3. Взаємодія галогеналканів з металічним натрієм (реакція Вюрца).
- •4. Декарбоксилювання карбонових кислот
- •5. Добування метану.
- •27. Алкени. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування
- •28. Алкіни, Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
- •29. Алкадієни . Гомологічний ряд , загальна формула. Будова молекули , фізичні і хімічні властивості. Правило Марковнікова, полімеризація. Ізомерія та номенклатурні назви. Добування та застосування .
- •30. Застосування та добування полімерів,канчуків , гуми.
- •31. Арени, склад, електронна та структурна формула,, фізичні властивості. Номенклатурні назви аренів. Хімічні властивості бензену. Застосування бензену. Хімічні засоби захисту рослин.
- •32. Нафта, склад, добування, застосування, перегонка нафти, крекінг нафтопродуктів.
- •33. Одноатомні спирти., будова молекули, фізичні властивості , класифікація. Ізомерія спиртів , номенклатурна назва. Хімічні властивості спиртів . Застосування та добування спиртів.
- •34. Багатоатомні спирти,фізичні властивості . Ізомерія спиртів , номенклатурна назва, хімічні властивості спиртів. Якісна реакція на багатоатомні спирти. Застосування та добування спиртів.
- •38. Естери, фізичні властивості. Ізомерія та номенклатурні назви естерів Добування та застосування естерів, Хімічні властивості естерів.
- •39. Жири,будова молекули, фізичні властивості, класифікація жирів. Ізомерія та номенклатурні назви жирів. Хімічні властивості жирів. Добування та застосування жирів. Значення жирів у життєдіяльності
- •40. Синтетичні миючі засоби, мило. Охорона довкілля від смз
- •41. Моносахариди. Глюкоза – альдегідо спирт, склад, будова молекули. Фізичні властивості. Хімічні властивості , якісна реакція . Поширення в природі, добування , застосування.
- •42. Дисахариди. Сахароза – дисахарид, склад та будова молекули, фізичні та хімічні властивості. Поширення в природі, застосування , загальна схема виробництва цукру.
- •43. Полісахариди. Крохмаль та целюлоза – полісахариди , склад та будова молекули, фізичні та хімічні властивості. Поширення в природі, застосування.
- •44. Аміни. Класифікація амінів. Склад і будова молекули, фізичні властивості. Ізомерія та номенклатура амінів. Хімічні властивості амінів. Добування та застосування.
- •45. Анілін. Ізомерія та номенклатура. Хімічні властивості, якісна реакція на анілін. Склад і будова молекули, фізичні властивості. Добування та застосування.
- •48. Волокна, класифікація .Способи добування волокон, застосування волокон.
25. Теорія хімічної будови органічних сполук. Ізомерія.
Поняття «хімічна будова» вперше ввів О. М. Бутлеров у 1861 р. Він зауважував, що властивості речовин визначаються не тільки їхнім складом (якісним і кількісним), як вважалося раніше, а й внутрішньою структурою молекул, тобто порядком з'єднання атомів один з одним, які входять до складу молекули. Цей порядок і є хімічною будовою молекули. У поняття «хімічна будова» О. М. Бутлеров включав також характер зв'язку атомів, їхній взаємний вплив один на одного. Наприклад, водень і кисень, утворивши воду, настільки змінилися від взаємного впливу, що вода вже не має властивостей ні водню, ні кисню, хоча й містить Гідроген і Оксиген, що входили до складу відповідно водню і кисню. У молекулі фенолу С6Н5ОН бензольне ядро впливає на властивості гідроксильної групи, посилюючи її кислотність (аналогія зі спиртами):
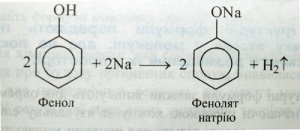
Гідроксильна група, у свою чергу, впливає на властивості бензольного ядра і полегшує заміщення в ньому атомів Гідрогену:
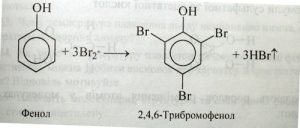
Так, на прикладах з неорганічної та органічної хімії ми спостерігаємо взаємний вплив атомів. Хімічну будову молекул виражають за допомогою структурних формул.
Ізомерія — це явище існування речовин з однаковим якісним і кількісним складом, але різною хімічною будовою, а тому й різними властивостями.
26. Алкани. Будова , фізичні властивості. Ізомерія. Номенклатурні назви. Хімічні властивості , добування та застосування.
Алкани, насичені вуглеводні — насичені ациклічні вуглеводні, що мають загальну формулу CnH2n+2, їх також називають парафінами. За агрегатним складом алкани діляться на газоподібні (С1-С4), рідкі (С5-С17) і тверді (починаючи з С18), що кристалізуються при 200 °C.
Назва вуглеводню |
Формула |
Агрегатний стан при звичайній температурі |
Метан |
СН4 |
Газ |
Етан |
С2Н6 |
Газ |
Пропан |
С3Н8 |
Газ |
Бутан |
С4Н10 |
Газ |
Пентан |
С5Н12 |
Рідина |
Гексан |
С6Н14 |
Рідина |
Гептан |
С7Н16 |
Рідина |
Октан |
С8Н18 |
Рідина |
Нонан |
С9Н20 |
Рідина |
Декан |
С10Н22 |
Рідина |
Ундекан |
С11Н24 |
Рідина |
Додекан |
С12Н26 |
Рідина |
Тридекан |
С13Н28 |
Рідина |
Тетрадекан |
С14Н30 |
Рідина |
Пентадекан |
С15Н32 |
Рідина |
Гексадекан (цетан) |
С16Н34 |
Тверда речовина |
Гептадекан |
С17Н36 |
Тверда речовина |
Октадекан |
С18Н38 |
Тверда речовина |
Нонадекан |
С19Н40 |
Тверда речовина |
Ейкозан |
С20Н42 |
Тверда речовина |
Генейкозан |
С21Н44 |
Тверда речовина |
Докозан |
С22Н46 |
Тверда речовина |
Трикозан |
С23Н48 |
Тверда речовина |
Тетракозан |
С24Н50 |
Тверда речовина |
Пентакозан |
С25Н52 |
Тверда речовина |
Гентріаконтан |
С31Н64 |
Тверда речовина |
Дотриаконтан |
С32Н66 |
Тверда речовина |
Фізичні властивості
Г а з о п о д і б н а. здатні з водою утворювати, особливо під тиском, молекулярні сполуки — газогідрати, для яких температура розкладу при тиску 0,1 МПа і критична температура відповідно рівні: з метаном — 29 і 21,50 °C, з етаном — 15,8 і 14,50 °C, з пропаном 0 і 8,50 °C.
Р і д к а. особливо нормальної будови, можуть у порівняно м'яких умовах окиснюватися киснем повітря. Вони є компонентами моторного палива: бензину, газотурбінних (авіаційних, наземних, морських) і дизельних.
Т в е р д а. виділяються із нафтової сировини при виробництві змащувальних олив, оскільки вони викристалізовуються із оливи, зменшуючи її рухомість і зумовлюючи застигання при високих температурах. Тверді алкани діляться на дві групи речовин — власне парафін і церезин.
Хімічні властивості
Насичені вуглеводні за хімічними властивостями дуже подібні один до одного. При звичайній температурі вони мало активні. Як і метан, всі вони досить стійкі проти дії кислот, лугів і окисників. Насичені вуглеводні при звичайних умовах вступають у реакцію лише з хлором і бромом, внаслідок чого їх атоми водню послідовно заміщаються атомами галогенів. Однак при нагріванні з сильними окисниками вони окиснюються. Із збільшенням молекулярної маси стійкість насичених вуглеводнів до дії високих температур зменшується.
Ізомерія
Для алканів здебільшого характерні структурні ізомери. Перші три члени гомологічного ряду алканів мають тільки по одному ізомеру. Тим часом бутан має вже два ізомерні вуглеводні:
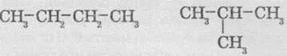
Пентан має вже три ізомери:
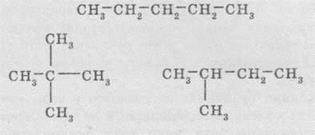
Застосування алканів
Наприклад, газоподібні речовини використовують як цінне джерело палива. Прикладом може служити метан, з якого і складається природний газ, а також пропанобутанової суміш.
Ще одне джерело алканів – нафту , значення якої для сучасного людства переоцінити важко. До нафтовим продуктам відносять:
бензини – використовуються в якості палива;
гас;
дизельне паливо, або легкий газойль;
важкий газойль, який застосовують в якості мастильного олії;
залишки нафтової перегонки використовують для виготовлення асфальту.
Нафтові продукти також використовуються для отримання пластмас, синтетичних волокон, каучуків і деяких миючих засобів.
Але застосування алканів набагато ширше. Деякі рідкі форми цих речовин використовуються як розчинники, а також в якості ракетного палива.
Вазелін і вазелінове масло – продукти, які складаються з суміші алканів. Їх використовують у медицині і косметології (в основному для приготування мазей і кремів), а також у парфумерії.
Парафін – ще один всім відомий продукт, які представляє собою суміш твердих алканів. Це тверда біла маса, температура топлення якої становить 50 – 70 градусів. У сучасному виробництві парафін використовується для виготовлення свічок. Цим же речовиною просочують сірники. У медицині за допомогою парафіну проводять різного роду теплові процедури.
Способи добування
