
- •1.Белки, их структура и функции. Классификация белков.
- •2.Основные классы аминокислот.
- •3. Физико-химические свойства белков. Качественные реакции на белки.
- •4. Количественные методы определения аминокислот.
- •5.Первичная структура белков. В чем разница между первичной и вторичной структурами белков.
- •6. Какие типы химических связей встречаются в белковой молекуле и какова их роль в структуре белков.
- •7. Физико-химические свойства аминокислот.
- •8. Усвоение азотистых соединений растительными организмами.
- •9. Первичный синтез аминокислот. Реакции аминирования и переаминирования.
- •10. Вторичное образование аминокислот при гидролизе. Пептидгидролазы.
- •11. Основные этапы биосинтеза белка.
- •12. Нуклеиновые кислоты и биосинтез белка.
- •13. Ген, генетический код. Характерные особенности генетического кода.
- •14. Основные стадии сборки полипептидной цепи в процессе трансляции.
- •15. Механизм действия ферментов.
- •16. Основные особенности ферментов как биологических катализаторов.
- •17. Строение ферментов.
- •18. Влияние концентрации субстрата на скорость ферментативной реакции. Константа Михаэлиса.
- •19. Влияние температуры, кислотности среды на работу фермента.
- •20. Влияние ингибиторов и активаторов на работу ферментов.
- •21.Обратимые и необратимые ингибирование.
- •23. Характеристика класса оксидоредуктаз.
- •24. Характеристика класса гидролаз.
- •25. Характеристика класса лиаз.
- •26. Характеристика классов изомераз и лигаз.
- •27. Характеристика подкласса олигаз и полиаз и их значение для пищевых технологий.
- •28. Характеристика подкласса протеаз.
- •29. Реакции, катализируемые оксидазами и значение этих ферментов для пищевых технологий.
- •30. Пероксидаза и каталаза и значение этих ферментов для пищевых технологий.
- •31. Классификация липидов. Основные функции липидов.
- •32. Жиры и их свойства, ферментативный гидролиз.
- •33. Полярные липиды (фосфо- и гликолипиды). Участие в построении биологических мембран и роль в пищевой промышленности.
- •34. Неомыляемые липиды – терпены и стероиды.
- •35. Прогоркание жиров. Кислотное, йодное число и число омыления.
- •36. Кофермент а и его роль в процессе обмена липидов.
- •37. Важнейшие стадии β-окисленя жирных кислот. Локализация этого процесса в клетке.
- •38. Сколько циклов β-окисления необходимо для полного окисления пальмитиновой кислоты и каков энергетический выход этого процесса.
- •39. Назовите основные отличия процессов синтеза и окисления жирных кислот.
- •40. Основные функции углеводов в живых организмах.
- •41. Основные этапы синтеза триацилглицеролов.
- •42. Классификация углеводов.
- •43. Моносахариды. Их структура и свойства. Важнейшие представители моносахаридов.
- •44. Вид изомерии моносахаридов.
- •46. Гликозидная связь и ее значение. Роль гликозидов в пещевой промышленности.
- •47. Взаимодействие углеводов со спиртами, кислотами и продукты, образующиеся в процессе этих реакций.
- •49. Реакция меланоидинообразования и карамелизации и значение их для пищевой промышленности.
- •51.Полисахариды второго порядка. Крахмал и гликоген как запасная форма полисахаридов.
- •53. Нуклеиновые кислоты. Химическое строение, свойства и биологические функции.
- •54. Какие нуклеиновые кислоты вы знаете и как они распределены в клетке. Биологическая роль нуклеиновых кислот.
- •56. При помощи каких связей формируется структура нуклеиновых кислот.
- •58. Назовите важнейшие нуклеотиды, не входящие в состав нуклеиновых кислот.
- •59. Физико-химические свойства нуклеиновых кислот и их функции.
- •61.Какую физиологическую роль выполняют витамины в организме животных и человека?
- •62. Важнейшие жирорастворимые витамины и заболевания, связанные с их недостатком. Что такое авитаминоз.
- •63. Важнейшие водорастворимые витамины и заболевания, связанные с их недостатком. Что такое гипо- и гипервитаминоз.
- •64. Витамины группы а. Распространение в природе и физиологическая функция этих витаминов. Особенности химического строения.
- •65. Витамины группы д. Распространение в природе и заболевания, связанные с недостатком этого витамина.
- •66.Витамины группы е. Распространение в природе и заболевания, связанные с недостатком этого витамина. Физиологические функции витамина е.
- •67. Витамины группы к. Распространение в природе и физиологические функции витамина к.
- •68. Витамин в1(тиамин). Распространение в природе. Физиологические функции витамина и заболевания, связанные с недостатком этого витамина.
- •69. Витамин в2 (рибофлавин). Физиологическая функция, связанная с особенностями строения витамина.
- •70. Витамин в6(пиридоксин). Физиологическая функция витамина в6, связанная с коферментной ролью его в работе некоторых ферментов.
- •71.Витамин в12.Распространение в природе и заболевания,вызванные недостатком этого витамина
- •72. Витамин рр.Расространение в природе и физиологическая функция
- •73.Витамин с.Физиологическая функция, связанная с особенностями химического строения этого витамина.
- •74.Пантотеновая к-та,ее химическое строение.Как связана пантотеноавя к-та с коферментом а.
- •75.Биотин,его роль в реакциях карбоксилирования.Распространение в природе.
- •76.Антивитамины и их действие на организм
- •77. Что такое фотосинтез .Роль фотосинтеза в природе.
- •78. Химизм фотосинтеза
- •79. Какие продукты образуются в ходе световой фазы реакции.
- •80. Что такое цикл Кальвина,какие продукты образуются в ходе этого процесса
- •81. Что такое дыхание. Напишите общее уравнение дыхания. Какие 2 типа дыхания вы знаете?
- •82. Что такое брожение? Типы брожения. Отрасли промышленности, в которых применяются различные типы брожения.
- •85. Биологическое значение процесса брожения.
- •87. Анаэробный путь превращения пировиноградной кислоты.
- •88.Основные этапы гликолиза.
- •89. Основные стадии аэробной фазы дыхания.
- •90.Процессы, происходящие при дыхании растительного сырья.
- •91.Химическая природа и биологическая роль каратиноидов. Важнейшие представители у растений.
- •92.Влияние температуры и влажности на дыхание растительного сырья.
- •93. Химизм процесса дыхания. Цикл Кребса. Цикл Кребса
- •Реакции цтк
- •94. Энергетика процесса дыхания.
- •95. Роль процесса дыхания в жизнедеятельности организма.
- •96. Биологические функции аминокислот и их роль в пищевой промышленности.
28. Характеристика подкласса протеаз.
Протеазы растений могут быть разделены на две группы: протеиназы и пептидазы. Протеиназы – это ферменты, гидролизующие внутренние пептидные связи в белках и пептидах. Изучение протеиназ растений показало, что они действуют не на все, а только на определенные пептидные связи т.е. имеют узкую субстратную спецефичность. Например попаин предпочтительно гидролизует пептидные связи, в которых участвуют аминокислотные остатки оснавных аминокислот, а также аминокислот с алифатическими и ароматическими боковыми цепями. По строению активного центра протеиназы растений разделяют на две группы. К первой относится толовые протеиназы, или папаиназы, по анологии с хорошо изученным ферментом папаином. Это ферменты, содержащие в активном центре сульфгидральную группу. Как правило, они представляют собой однокомпонентные ферменты, характерным свойством которых является отношение к восстановителям и окислителям. Пептидазы. Протеолитические ферменты протеиназ всегда присутствуют в клетках совместно с ферментами типа пептидаз, которые катализируют гидролитическое расщепление пептидных связей в молекулах пептидов. Пептидазы растений в большинстве своем – металлоферменты и имеют весьма узкую субстратную спецефичность. Таким образом, при совместном действии протеиназ, карбоксипептидаз, аминопептидаз и дипептидаз белки полностью расщепляются до составляющих их аминокислот. Освободившиеся в процессе распада аминокислоты могут передвигаться дезаминированно с выделением аммиака и органических кислот или вступать в другие реакции.
29. Реакции, катализируемые оксидазами и значение этих ферментов для пищевых технологий.
Оксидазы- это аэробные дегидрогеназы. Они переносят водород от окисляемого вещ-ва непосредственно на кислород воздуха.
Простейшая окислительно-восстановительная система состоит из окисляемого субстрата, оксидазы и кислорода. Водород субстрата с помощью оксидазы переносится из кислорода воздуха, т.е. акцептором водорода яв-ся кислород.
АН2+О2=А+Н2О2
Перекись водорода расщепляется зетем с помощью каталазы:
2Н2О2+каталаза=2Н2О2+О2
Но такой простой путь окисления встречается очень редко. Обычно водород переносят анаэробные дегирдогеназы передавая его промежут-м переносчикам водорода.
Представители аэробных дегидрогеназ
Лактатоксидаза катализирует превращение молочной кислоты в уксусную
Альдегидоксидаза участвует в окислении альд-в до соответствующих кислот с образ-м перекиси водорода. если окисление подвергается уксусный альдегид, то под действием альдегидоксидазы он превращается в уксус.к-ту
Аскорбиноксидаза катализирует окисление аскорбиновой кислоты
Образующаяся при окислении дегидроаскорбиновая кислота легко распадается , поэтому при окислении снижается содержание витамина С в продуктах.
30. Пероксидаза и каталаза и значение этих ферментов для пищевых технологий.
В подкласс 1.11, к которому принадлежит пероксидаза, входит ряд ферментов, использующих в качестве окислителей Н202.Систематическое название фермента пероксидазы — донор: Н202-оксидоредуктаза. Она катализирует реакцию
ROOH + АН2→H20 + ROH+A
где в качестве ROOH могут быть пероксид водорода НООН или органические перекиси, т. е. она высокоспецифична в отношении акцептора водорода и совсем не специфична в отношении донора водорода. Подвергаться окислению могут многочисленные фенолы, аминофено-лы, диамины, индофенолы, аскорбат и некоторые аминокислоты. Таким образом, пероксидаза является ферментом, обладающим относительной специфичностью.Механизм действия пероксидазы может быть описан следующим образом:
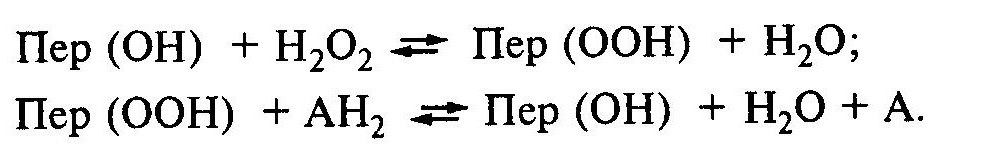
Пероксидаза с перекисью водорода образует промежуточное комплексное соединение, наличие которого было доказано спектрофотометрическими методами, в результате чего пероксид активируется и действует как акцептор водорода.Пероксидаза — это двухкомпонентный фермент, простетическая группа которого содержит гем. Так как пероксидаза действует на фенолы, окисляя их, она наряду с полифенолоксидазой играет важную роль в дыхании растений.При ферментации чая и табака пероксидаза наряду с полифенолоксидазой способствует образованию окрашенных и ароматизированных компонентов.
Каталаза включена в подкласс 1.11 по той причине, что по структуре и свойствам она подобна пероксидазам, а также способна окислять ряд субстратов с участием перекиси водорода. Систематическое название — Н202-Н202-оксидоредуктаза.
![]() Каталаза
дегидрирует молекулу перекиси водорода.
Отнятый от субстрата водород переносится
на вторую молекулу перекиси водорода,
образуя воду и кислород:
Каталаза
дегидрирует молекулу перекиси водорода.
Отнятый от субстрата водород переносится
на вторую молекулу перекиси водорода,
образуя воду и кислород:
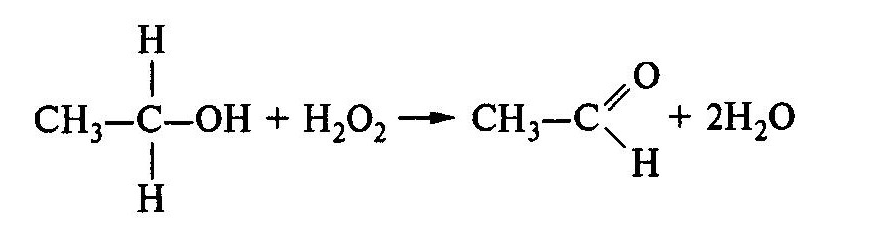 Вместо
пероксида водорода фермент может
использовать в качестве субстрата и
органические перекиси. К роме того,
донорами водорода могут служить метанол,
этанол и другие спирты:
Вместо
пероксида водорода фермент может
использовать в качестве субстрата и
органические перекиси. К роме того,
донорами водорода могут служить метанол,
этанол и другие спирты:
Каталаза — двухкомпонентный фермент, простетическая группа фермента содержит 4 геминовые группы, каждая из которых прочно связана с белком. Катализ не сопровождается изменением валентности железа.
В пищевой промышленности препараты каталазы применяются там, где желательна обработка перекисью водорода, но через определенный срок Н20, необходимо удалить. Так, каталаза используется для удаления избытка перекиси водорода при обработке молока в сыроварении, где Н202 применяется в качестве консерванта.
