
- •1.Белки, их структура и функции. Классификация белков.
- •2.Основные классы аминокислот.
- •3. Физико-химические свойства белков. Качественные реакции на белки.
- •4. Количественные методы определения аминокислот.
- •5.Первичная структура белков. В чем разница между первичной и вторичной структурами белков.
- •6. Какие типы химических связей встречаются в белковой молекуле и какова их роль в структуре белков.
- •7. Физико-химические свойства аминокислот.
- •8. Усвоение азотистых соединений растительными организмами.
- •9. Первичный синтез аминокислот. Реакции аминирования и переаминирования.
- •10. Вторичное образование аминокислот при гидролизе. Пептидгидролазы.
- •11. Основные этапы биосинтеза белка.
- •12. Нуклеиновые кислоты и биосинтез белка.
- •13. Ген, генетический код. Характерные особенности генетического кода.
- •14. Основные стадии сборки полипептидной цепи в процессе трансляции.
- •15. Механизм действия ферментов.
- •16. Основные особенности ферментов как биологических катализаторов.
- •17. Строение ферментов.
- •18. Влияние концентрации субстрата на скорость ферментативной реакции. Константа Михаэлиса.
- •19. Влияние температуры, кислотности среды на работу фермента.
- •20. Влияние ингибиторов и активаторов на работу ферментов.
- •21.Обратимые и необратимые ингибирование.
- •23. Характеристика класса оксидоредуктаз.
- •24. Характеристика класса гидролаз.
- •25. Характеристика класса лиаз.
- •26. Характеристика классов изомераз и лигаз.
- •27. Характеристика подкласса олигаз и полиаз и их значение для пищевых технологий.
- •28. Характеристика подкласса протеаз.
- •29. Реакции, катализируемые оксидазами и значение этих ферментов для пищевых технологий.
- •30. Пероксидаза и каталаза и значение этих ферментов для пищевых технологий.
- •31. Классификация липидов. Основные функции липидов.
- •32. Жиры и их свойства, ферментативный гидролиз.
- •33. Полярные липиды (фосфо- и гликолипиды). Участие в построении биологических мембран и роль в пищевой промышленности.
- •34. Неомыляемые липиды – терпены и стероиды.
- •35. Прогоркание жиров. Кислотное, йодное число и число омыления.
- •36. Кофермент а и его роль в процессе обмена липидов.
- •37. Важнейшие стадии β-окисленя жирных кислот. Локализация этого процесса в клетке.
- •38. Сколько циклов β-окисления необходимо для полного окисления пальмитиновой кислоты и каков энергетический выход этого процесса.
- •39. Назовите основные отличия процессов синтеза и окисления жирных кислот.
- •40. Основные функции углеводов в живых организмах.
- •41. Основные этапы синтеза триацилглицеролов.
- •42. Классификация углеводов.
- •43. Моносахариды. Их структура и свойства. Важнейшие представители моносахаридов.
- •44. Вид изомерии моносахаридов.
- •46. Гликозидная связь и ее значение. Роль гликозидов в пещевой промышленности.
- •47. Взаимодействие углеводов со спиртами, кислотами и продукты, образующиеся в процессе этих реакций.
- •49. Реакция меланоидинообразования и карамелизации и значение их для пищевой промышленности.
- •51.Полисахариды второго порядка. Крахмал и гликоген как запасная форма полисахаридов.
- •53. Нуклеиновые кислоты. Химическое строение, свойства и биологические функции.
- •54. Какие нуклеиновые кислоты вы знаете и как они распределены в клетке. Биологическая роль нуклеиновых кислот.
- •56. При помощи каких связей формируется структура нуклеиновых кислот.
- •58. Назовите важнейшие нуклеотиды, не входящие в состав нуклеиновых кислот.
- •59. Физико-химические свойства нуклеиновых кислот и их функции.
- •61.Какую физиологическую роль выполняют витамины в организме животных и человека?
- •62. Важнейшие жирорастворимые витамины и заболевания, связанные с их недостатком. Что такое авитаминоз.
- •63. Важнейшие водорастворимые витамины и заболевания, связанные с их недостатком. Что такое гипо- и гипервитаминоз.
- •64. Витамины группы а. Распространение в природе и физиологическая функция этих витаминов. Особенности химического строения.
- •65. Витамины группы д. Распространение в природе и заболевания, связанные с недостатком этого витамина.
- •66.Витамины группы е. Распространение в природе и заболевания, связанные с недостатком этого витамина. Физиологические функции витамина е.
- •67. Витамины группы к. Распространение в природе и физиологические функции витамина к.
- •68. Витамин в1(тиамин). Распространение в природе. Физиологические функции витамина и заболевания, связанные с недостатком этого витамина.
- •69. Витамин в2 (рибофлавин). Физиологическая функция, связанная с особенностями строения витамина.
- •70. Витамин в6(пиридоксин). Физиологическая функция витамина в6, связанная с коферментной ролью его в работе некоторых ферментов.
- •71.Витамин в12.Распространение в природе и заболевания,вызванные недостатком этого витамина
- •72. Витамин рр.Расространение в природе и физиологическая функция
- •73.Витамин с.Физиологическая функция, связанная с особенностями химического строения этого витамина.
- •74.Пантотеновая к-та,ее химическое строение.Как связана пантотеноавя к-та с коферментом а.
- •75.Биотин,его роль в реакциях карбоксилирования.Распространение в природе.
- •76.Антивитамины и их действие на организм
- •77. Что такое фотосинтез .Роль фотосинтеза в природе.
- •78. Химизм фотосинтеза
- •79. Какие продукты образуются в ходе световой фазы реакции.
- •80. Что такое цикл Кальвина,какие продукты образуются в ходе этого процесса
- •81. Что такое дыхание. Напишите общее уравнение дыхания. Какие 2 типа дыхания вы знаете?
- •82. Что такое брожение? Типы брожения. Отрасли промышленности, в которых применяются различные типы брожения.
- •85. Биологическое значение процесса брожения.
- •87. Анаэробный путь превращения пировиноградной кислоты.
- •88.Основные этапы гликолиза.
- •89. Основные стадии аэробной фазы дыхания.
- •90.Процессы, происходящие при дыхании растительного сырья.
- •91.Химическая природа и биологическая роль каратиноидов. Важнейшие представители у растений.
- •92.Влияние температуры и влажности на дыхание растительного сырья.
- •93. Химизм процесса дыхания. Цикл Кребса. Цикл Кребса
- •Реакции цтк
- •94. Энергетика процесса дыхания.
- •95. Роль процесса дыхания в жизнедеятельности организма.
- •96. Биологические функции аминокислот и их роль в пищевой промышленности.
18. Влияние концентрации субстрата на скорость ферментативной реакции. Константа Михаэлиса.
При низких концентрациях субстрата скорость реакции увеличивается пропорцианально его концентрации. Однако по мере увеличения концентрации эта пропорцианальность нарушается. Скорость реакции растет все медленнее. Происходит насыщение субстрата. Константа Михаэлиса равна той концентрации субстрата при которой наблюдается скорость реакции равная половине максимальной.
Зависимость скорости (v) ферментативного превращения субстрата от его концентрации [S] описывается уравнением Михаэлиса – Ментен:
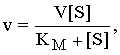
где KM – константа Михаэлиса, характеризующая активность фермента, V – максимальная скорость реакции при данной суммарной концентрации фермента. Из этого уравнения следует, что при малых [S] скорость реакции возрастает пропорционально концентрации субстрата. Однако при достаточно большом увеличении последней эта пропорциональность исчезает: скорость реакции перестает зависеть от [S] – наступает насыщение, когда все молекулы фермента оказываются занятыми субстратом.
19. Влияние температуры, кислотности среды на работу фермента.
С увеличением температуры на 100 скорость реакции увеличивается в 2..4 раза(правило Вант-Гоффа). Для каждого фермента характерна определенная область оптимального значения рН при этом фермент проявляет максимальную активность. Влияние рН среды на действие фермента основано на том, что происходит изменение заряда различных групп белка в активном центре фермента, вызывающие существенные изменения полипептидной цепи. рН среда влияет на изменение зарядов водородной и гидроксильной групп, может нейтрализовать различные частицы активного центра, конфигурация активного центра изменяется.
20. Влияние ингибиторов и активаторов на работу ферментов.
Активаторы – увеличивают скорость реакции. К ним относятся ионы некоторых металлов, так же органические в-ва, содержащие амино- и сульфгидрильные группы(цистеин, трипептид). Ингибиторы – снижают скорость реакции. Бывают необратимые и обратимые ингибиторы. Необратимые ингибиторы связывают или разрушают функциональные группы молекул фермента, необходимые для проявления его каталитической активности, при этом активность не восстанавливается, даже если ингибитор удалить. Необратимыми ингибиторами являются цианиды, действующие на ряд окислительно-восстановительных ферментов, содержащих в качестве кофакторов металлы. Обратимые ингибиторы - ферменты, к-е не подвергают глубоким изменениям молекулы белка. При этом в основном сохраняются первичные свойства белка,т.е белки не подвергаются заметной денатурации.
21.Обратимые и необратимые ингибирование.
Необратимые ингибиторы связывают или разрушают функциональные группы молекулы фермента, необходимые для проявления его каталитической активности, при этом активность фермента не восстанавливается даже в том случае, если ингибитор удаляется каким-либо способом. Существенное влияние на активность ферментов оказывают белковые осадители, вызывающие денатурацию белковой части фермента. Такими веществами являются соли тяжелых металлов — меди, свинца, ртути, олова, мышьяка и концентрированные кислоты и щелочи, дубильные вещества, таннины, полярные соединения — трихлоруксусная кислота.
Обратимые ингибиторы подразделяют на конкурентные, бесконкурентные и неконкурентные.
Соединения, близкие по своей структуре к субстрату и присоединяющиеся к ферменту в том же активном центре, что и субстрат, называются конкурентными ингибиторами. Ингибитор и субстрат конкурируют за один и тот же активный центр с образованием комплекса фермент-субстрат или фермент-ингибитор, при этом промежуточное соединение фермент-субстрат-ингибитор не образуется.
Вещества, взаимодействующие с фермент-субстратным комплексом, а не со свободным ферментом, называются бесконкурентными ингибиторами.
Неконкурентный ингибитор связывается не с активным центром, а с каким-то другим участком глобулы фермента. Они могут присоединиться как к свободному ферменту, так и к фермент-субстратному комплексу. По типу обратимого ингибирования может осуществляться регуляция ферментативных реакций в организме. Активаторами называются вещества, которые увеличивают скорость ферментативных реакций. К ним относятся ионы некоторых металлов. Для активирования цитохромоксидазы, каталазы, пероксидазы необходимы ионы железа, полифенолоксидазы — ионы меди, гексо-киназы — ионы магния и т. д. К активаторам относятся также органические вещества, содержащие амино- и сульфгидрильные группы.
22. Классификация ферментов.Ферменты делят на группы в зависимости от типа катализируемой реакции на подгруппы, более точно характеризующие эту реакцию. Каждый фермент получает название, состоящее из названия субстрата, определяющего тип катализируемой реакции.
Международная комиссия по ферментам разработала систему присвоения кодовых чисел(шифров) индивидуальным ферментам. Шифр каждого фермента содержит четыре числа, разделенные точками. Он составляется по следующему принципу:
А. первое число показывает к какому классу принадлежит данный фермент. Различают шесть классов ферментов:
1. Оксидоредуктазы – к этому классу принадлежит ферменты, катализирующие окислительно - восстановительные реакции и переносящие электроны или протоны водорода.
2. Трансферазы – ферменты,переносящие ту или иную группу:метильную, гликозидную,эминную,фосфорную – от одного соединения(донора) к другому (акцептору этой группы)
3. Гидролазы – ферменты, катализирующие гидролитическое расщепление связей [-с-о- . –с-N-. –с-с-] и некоторых других.
Рекомендуемое название этих ферментов во многих случаях образуются из названия субстрата с присоединением окончания –аза. Следовательно, если мы встречаемся с ферментом, состоящим из названия субстрата с окончанием –аза, значит, мы имеем дело с гидролитическим ферментом (сахарозой,мальтозой)
4. Лиазы – ферменты, отщепляющие ( но не путем гидролиза) от субстрата ту или иную группу, с образованием двойных связей или, наоборот, присоединяющие определенные группы по двойным связям.
5. Изомеразы – ферменты, катализирующие геометрические или структурные изменения в пределах одной молекулы т.е. реакции изомеризации.
6. Лигазы (синтетазы) – ферменты, катализирующие соединения друг с другом двух молекул, сопряженное с гидролизом пирофосфатной связи в молекуле АТР.
Б. Второе число, которое присваивается ферменту по классификации, обозначают подкласс. У оксидоредуктаз оно указывает на природу той группы в молекуле донора, которая подвергается окислению (1. Обозначает спиртовую группу –сн-н. 2. Альдегидную или кетонную группу и т.д.); у трансфераз – природу транспортируемой группы; у гидролаз – тип гидролизуемой связи; у лиаз – тип связи подвергающейся разрыву(между отщепляемой группой и остатком молекулы); у изомераз – тип катализируемой реакции изомеризации; у лигаз – тип вновь образуемой связи.
В. Третье число обозначает подподкласс. У оксидоредуктаз оно указывает для каждой группы доноров тип участвующего акцептора( 7 обозначает кофермент NAD+ или NADP+; 2- цитохром,3-молекулярный кислород и т.д.); у трансфераз 3 число обозначает тип транспортируемой группы; у гидролаз уточняет тип гидролизуемой связи; а у лиаз тип отщепляемой группы; у изомераз оно уточняет характер превращения субстрата.а у лигаз природу образующего соединения.
Г. 4 число обозначает порядковый номер в данном подподклассе.
