
- •1.Белки, их структура и функции. Классификация белков.
- •2.Основные классы аминокислот.
- •3. Физико-химические свойства белков. Качественные реакции на белки.
- •4. Количественные методы определения аминокислот.
- •5.Первичная структура белков. В чем разница между первичной и вторичной структурами белков.
- •6. Какие типы химических связей встречаются в белковой молекуле и какова их роль в структуре белков.
- •7. Физико-химические свойства аминокислот.
- •8. Усвоение азотистых соединений растительными организмами.
- •9. Первичный синтез аминокислот. Реакции аминирования и переаминирования.
- •10. Вторичное образование аминокислот при гидролизе. Пептидгидролазы.
- •11. Основные этапы биосинтеза белка.
- •12. Нуклеиновые кислоты и биосинтез белка.
- •13. Ген, генетический код. Характерные особенности генетического кода.
- •14. Основные стадии сборки полипептидной цепи в процессе трансляции.
- •15. Механизм действия ферментов.
- •16. Основные особенности ферментов как биологических катализаторов.
- •17. Строение ферментов.
- •18. Влияние концентрации субстрата на скорость ферментативной реакции. Константа Михаэлиса.
- •19. Влияние температуры, кислотности среды на работу фермента.
- •20. Влияние ингибиторов и активаторов на работу ферментов.
- •21.Обратимые и необратимые ингибирование.
- •23. Характеристика класса оксидоредуктаз.
- •24. Характеристика класса гидролаз.
- •25. Характеристика класса лиаз.
- •26. Характеристика классов изомераз и лигаз.
- •27. Характеристика подкласса олигаз и полиаз и их значение для пищевых технологий.
- •28. Характеристика подкласса протеаз.
- •29. Реакции, катализируемые оксидазами и значение этих ферментов для пищевых технологий.
- •30. Пероксидаза и каталаза и значение этих ферментов для пищевых технологий.
- •31. Классификация липидов. Основные функции липидов.
- •32. Жиры и их свойства, ферментативный гидролиз.
- •33. Полярные липиды (фосфо- и гликолипиды). Участие в построении биологических мембран и роль в пищевой промышленности.
- •34. Неомыляемые липиды – терпены и стероиды.
- •35. Прогоркание жиров. Кислотное, йодное число и число омыления.
- •36. Кофермент а и его роль в процессе обмена липидов.
- •37. Важнейшие стадии β-окисленя жирных кислот. Локализация этого процесса в клетке.
- •38. Сколько циклов β-окисления необходимо для полного окисления пальмитиновой кислоты и каков энергетический выход этого процесса.
- •39. Назовите основные отличия процессов синтеза и окисления жирных кислот.
- •40. Основные функции углеводов в живых организмах.
- •41. Основные этапы синтеза триацилглицеролов.
- •42. Классификация углеводов.
- •43. Моносахариды. Их структура и свойства. Важнейшие представители моносахаридов.
- •44. Вид изомерии моносахаридов.
- •46. Гликозидная связь и ее значение. Роль гликозидов в пещевой промышленности.
- •47. Взаимодействие углеводов со спиртами, кислотами и продукты, образующиеся в процессе этих реакций.
- •49. Реакция меланоидинообразования и карамелизации и значение их для пищевой промышленности.
- •51.Полисахариды второго порядка. Крахмал и гликоген как запасная форма полисахаридов.
- •53. Нуклеиновые кислоты. Химическое строение, свойства и биологические функции.
- •54. Какие нуклеиновые кислоты вы знаете и как они распределены в клетке. Биологическая роль нуклеиновых кислот.
- •56. При помощи каких связей формируется структура нуклеиновых кислот.
- •58. Назовите важнейшие нуклеотиды, не входящие в состав нуклеиновых кислот.
- •59. Физико-химические свойства нуклеиновых кислот и их функции.
- •61.Какую физиологическую роль выполняют витамины в организме животных и человека?
- •62. Важнейшие жирорастворимые витамины и заболевания, связанные с их недостатком. Что такое авитаминоз.
- •63. Важнейшие водорастворимые витамины и заболевания, связанные с их недостатком. Что такое гипо- и гипервитаминоз.
- •64. Витамины группы а. Распространение в природе и физиологическая функция этих витаминов. Особенности химического строения.
- •65. Витамины группы д. Распространение в природе и заболевания, связанные с недостатком этого витамина.
- •66.Витамины группы е. Распространение в природе и заболевания, связанные с недостатком этого витамина. Физиологические функции витамина е.
- •67. Витамины группы к. Распространение в природе и физиологические функции витамина к.
- •68. Витамин в1(тиамин). Распространение в природе. Физиологические функции витамина и заболевания, связанные с недостатком этого витамина.
- •69. Витамин в2 (рибофлавин). Физиологическая функция, связанная с особенностями строения витамина.
- •70. Витамин в6(пиридоксин). Физиологическая функция витамина в6, связанная с коферментной ролью его в работе некоторых ферментов.
- •71.Витамин в12.Распространение в природе и заболевания,вызванные недостатком этого витамина
- •72. Витамин рр.Расространение в природе и физиологическая функция
- •73.Витамин с.Физиологическая функция, связанная с особенностями химического строения этого витамина.
- •74.Пантотеновая к-та,ее химическое строение.Как связана пантотеноавя к-та с коферментом а.
- •75.Биотин,его роль в реакциях карбоксилирования.Распространение в природе.
- •76.Антивитамины и их действие на организм
- •77. Что такое фотосинтез .Роль фотосинтеза в природе.
- •78. Химизм фотосинтеза
- •79. Какие продукты образуются в ходе световой фазы реакции.
- •80. Что такое цикл Кальвина,какие продукты образуются в ходе этого процесса
- •81. Что такое дыхание. Напишите общее уравнение дыхания. Какие 2 типа дыхания вы знаете?
- •82. Что такое брожение? Типы брожения. Отрасли промышленности, в которых применяются различные типы брожения.
- •85. Биологическое значение процесса брожения.
- •87. Анаэробный путь превращения пировиноградной кислоты.
- •88.Основные этапы гликолиза.
- •89. Основные стадии аэробной фазы дыхания.
- •90.Процессы, происходящие при дыхании растительного сырья.
- •91.Химическая природа и биологическая роль каратиноидов. Важнейшие представители у растений.
- •92.Влияние температуры и влажности на дыхание растительного сырья.
- •93. Химизм процесса дыхания. Цикл Кребса. Цикл Кребса
- •Реакции цтк
- •94. Энергетика процесса дыхания.
- •95. Роль процесса дыхания в жизнедеятельности организма.
- •96. Биологические функции аминокислот и их роль в пищевой промышленности.
1.Белки, их структура и функции. Классификация белков.
Белки – высокомолекулярные азотосодержащие органические вещества, молекулы которых построены из остатков аминокислот. Существует 1012 видов белков. В организме человека ~ 50 тыс. различных белков. Все белки состоят из структурных блоков, которые представлены остатками аминокислот. Всего 20 аминокислот. Набор аминокислот в белке определяется наследственной информацией, записанной в ДНК.
Вес белков колеблется где то от 6 тыс и выше ДА=1,661*10-24г
Функции белков
Структурная (коллаген, эластин, кератин);
Каталитическая (ферменты);
Транспортная (гемоглобин, альбумины, глобулины);
Сократительная (актин, миозин);
Защитная (иммуноглобулины, фибриноген, плазминоген, лизоцим);
Регуляторная (гормоны, рецепторы);
Онкотическое давление (белки сыворотки крови);
Буферная (гемоглобин, белки сыворотки крови).
Структурная организация белка:
-Первичная структура – последовательность в расположение аминокислотных остатков в полипептидной цепи.
-Вторичная структура – укладка полипептидной цепи в спираль. Не хаотично, а в соответствие с программой заложенной в первичной структуре. Альфа-спираль строение глобулярных белков. Закручивается по часовой стрелке. Через каждые 5 витков идет повторение последовательности остатков аминокислот, а совпадают они через каждые 3,8 витков.
-Третичная структура – ориентирование полипептидной спирали, содержит уникальную информацию, все свойства молекулы белка связаны с 3-ой структурой.
- Четвертичная структура - подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования.
Классификация белков.
При делении на группы учитывают и их состав (строение), физико-химические свойства (растворимость, щёлочность), происхождение и роль в организме. Делят на простые - протеины, состоящие только из аминокислот, и сложные - протеиды, в состав молекулы которых входят, кроме аминокислот, и другие соединения.
Простые:
Альбумины – белки растворимые в воде
Глобулины- растворимые в солях
Гистоны
Глутелины – извлекаются из растений при помощи щелочей
Проламины – рвтворяются в спиртах
Протамины - белки щелочного характера
2.Основные классы аминокислот.
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. amphoteros – двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения α-аминокислот может быть представлен в следующем виде:
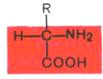
Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. Неполярные:глицин, аланин, валин, лейцин, изолейцин, пролин; Полярные:серин, треонин, цистеин, метионин, аспарагин, глутамин; Ароматические:фенилаланин, тирозин, триптофан; Отрицательно заряженные:аспарагиновая кислота, глутаминовая кислота; Положительно заряженные:лизин, гистидин,аргинин.
