
- •1. Какие соединения относят к алканам?
- •2. Приведите структурные формулы и названия алканов нормального строения, содержащие от одного до шести атомов углерода.
- •3. Рядом приведена структурная формула бутана. Объясните, как Вы понимаете утверждение, что каждый атом углерода в этом соединении четырехвалентен?
- •4. Что такое метильная, этильная, н-пропильная и изопропильная группы?
- •5. Приведите систематические названия для следующих соединений:
- •6. Изобразите структурные формулы следующих соединений:
- •7. Какие реакции наиболее характерны для алканов?
- •8. Приведите структурную формулу 2-метилбутана и укажите первичные, вторичные и третичные атомы углерода.
- •9. Что Вы знаете про закономерности, характерные для реакции бромирования алканов? с чем связаны эти закономерности?
- •10. Приведите продукты фотохимического бромирования следующих алканов: ответ:
- •11. Как Вы понимаете смысл приведенной ниже схемы? Где в ней указан субстрат, реагент, что означает надпись «- hBr» под стрелкой?
- •12. Способен ли бутан существовать в виде цис и транс-изомеров? Что такое конформации?
- •16. Что такое электрофил и нуклеофил? Приведите примеры таких частиц.
- •17. Приведите все структурные формулы и названия изомерных соединений следующего состава:
- •18. Определите тип гибридизации атомов углерода в молекулах метана, этилена, формальдегида, синильной кислоты и ацетилена.
- •19. Каково строение молекул метана, этилена и ацетилена, каково значение валентных углов в этих молекулах?
- •22. Какие частицы образуется при гомолитическом разрыве связи с‑н в молекуле метана? Какое отношение имеют эти частицы к химическим реакциям алканов (в частности, метана)?
- •23. Приведите механизм реакции хлорирования метана, приводящей к хлорметану.
- •24. Какие соединения относят к классу алкенов?
- •25. Назовите следующие соединения по систематической номенклатуре iupac:
- •26. Поясните, как Вы понимаете тот факт, что бутен-2 способен существовать в виде цис и транс-изомеров?
- •27. Какие реакции наиболее характерны для алкенов? Приведите несколько примеров.
- •28. Приведите структурные формулы продуктов следующих реакций, приведите названия образующихся продуктов:
- •29. Приведите структурные формулы продуктов следующих реакций, приведите названия образующихся продуктов:
- •30 Приведите структурные формулы следующих соединений: а) бензола б) толуола; в) фенола; г) бензальдегида; д) бензойной кислоты; е) 2,4,6‑тринитротолуола.
- •31. Какой тип реакций наиболее характерен для бензола и его производных?
- •32. Приведите структурные формулы продуктов следующих реакций, приведите названия образующихся продуктов:
- •33. Что такое орто-, мета- и пара-положения?
- •34. Какие заместители относятся к мета-ориентантам? Как вы понимаете понятие «мета-ориентанты»?
- •35. Какие заместители относятся к орто/пара-ориентантам? Как вы понимаете понятие «орто/пара -ориентанты»?
- •36. Приведите структурные формулы продуктов следующих реакций, приведите названия образующихся продуктов:
- •37. Среди указанных ароматических соединений, укажите: какое из них наиболее реакционоспособно в реакциях электрофильного ароматического замещения, а какое наименее реакционоспособно. Ответ поясните.
- •38. Какие заместители являются активирующими, то есть ускоряют протекание реакций электрофильного замещения в бензольном кольце?
- •39. Какие заместители относятся к дезактивирующими, то есть замедляют протекание реакций электрофильного замещения в бензольном кольце?
- •40. Поясните протекание следующей реакции:
- •41. Какой тип реакций наиболее характерен для алкилгалогенидов (моногалогенпроизводных алканов)?
- •42. Что такое первичные, вторичные и третичные алкилгалогениды?
- •43. Приведите структурные формулы продуктов следующих реакций, приведите названия образующихся продуктов:
- •44. Какие примеры сильных оснований Вы знаете?
- •45. Что Вы знаете про кислотные свойства спиртов?
- •46. Что Вы знаете про кислотные свойства фенолов?
- •47. Каковы особенности реакций нуклеофильного замещения гидроксильной группы в спиртах?
- •48. Приведите структурные формулы продуктов следующих реакций, приведите названия образующихся продуктов:
- •49. Что такое многоатомные спирты? Приведите примеры.
- •50. Каково строение молекул жиров? Остатки каких кислот входят в их состав?
- •51. Приведите механизм реакции присоединения хлороводорода к молекуле этилена:
- •52. Какова теоретическая интерпретация правила Марковникова?
- •52. Известно, что ряд стабильности алкильных катионов имеет следующий вид:
- •53. Приведите механизм следующего превращения:
- •53. Изобразите (в виде набора крайних структур) резонансную стабилизацию аллильного катиона.
- •54. Какими электронными эффектами обладают алкильные группы? Являются ли эти группы электронодонорными или электроноакцепторными?
- •55. Какими электронными эффектами обладает группа он (гидроксильная, или спиртовая)?
- •56. Какими электронными эффектами обладают атомы галогенов (f, Cl, Br, I)?
- •60. Укажите продукты присоединения протона к следующим соединениям, в продуктах протонирования правильно укажите формальные целочисленные заряды.
- •62. Метанол (н3с-он) и этанол (с2н5он) смешивается с водой в любых отношениях, тогда как жидкие углеводороды (алканы, алкены) ив воде почти нерастворимы. Как это можно объяснить?
51. Приведите механизм реакции присоединения хлороводорода к молекуле этилена:
Ответ: Алкенам характерны реакции электрофильного присоединения (AdE, Addition Electrophilic). Механизм может быть представлен следующим образом:
![]()

ПОЯСНЕНИЕ: ХЛОРОВОДОРОД ДИССОЦИИРУЕТ НА ПРОТОН И ХЛОРИД-АНИОН (ХЛОРОВОДОРОД- СИЛЬНАЯ КИСЛОТА). ПОСЛЕДУЮЩЕЕ ПРИСОЕДИНЕНИЕ ЭЛЕКТРОФИЛА (ЧАСТИЦЫ С ВАКАНТНОЙ ОРБИТАЛЬЮ) К ДВОЙНОРЙ СВЯЗИ МОЖЕТ ОСУЩЕСТВЛЯТЬСЯ ЛИШЬ ПУТЕМ ГЕТЕРОЛИТИЧЕСКОГО РАЗРЫВА π-СВЯЗИ («ПИ»-СВЯЗИ). ОБРАЗУЮЩИЙСЯ ПОСЛЕ ПРИСОЕДИНЕНИЯ ПРОТОНА (Н+) ЭТИЛЬНЫЙ КАТИОН ЯВЛЯЕТСЯ ЭЛЕКТРОФИЛЬНОЙ ЧАСТИЦЕЙ (так как содержит вакантную орбиталь на положительно заряженном атоме углерода) и реагирует с нуклеофильным хлорид-анионом, образуя связь С-Cl по донорно-акцепторному механизму и приводя к конечному продукту реакции.
52. Какова теоретическая интерпретация правила Марковникова?
Ответ: Правило Марковникова гласит, что в реакциях присоединения галогеноводородов (HHal) и воды (Н2О) атом водорода присоединяется к более гидрогенизированному атому углерода.
Рассмотрим эту стадию на примере присоединения протона к молекуле изобутилена. С точки зрения механизма реакции, на первой стадии процесса происходит присоединение протона (Н+), причем можно представить себе два пути присоединения к несимметричным алкенам:

В любом случае суть первой стадии сводится к: 1. Разрыву π-связи (гетеролитическому). 2. Присоединению протона к одному из двух углеродных атомов, которые ранее образовывали эту π-связь. 3. Формированию на втором углеродном атоме (который остался трехвалентным) формального целочисленного положительного заряда (+).
Как видно из вышеприведенной схемы при присоединении протона к молекуле изобутилена могут альтернативно образовываться два изомерных катиона: трет‑бутильный или изобутильный. Трет-бутильный катион более стабилен по сравнению с первичным изобутильным катионом, поскольку является третичным (карбокатионный центр С+ образует три связи С-С).
Реакция идет именно через более стабильный катион, то есть по пути, изображенному в верхней части схемы, то есть именно по правилу Марковникова, ведь для образования трет-бутильного катиона протон присоединился именно к более гидрогенизированному атому углерода. Последующее присоединение хлорид-аниона приводит к конечному продукту реакции.
52. Известно, что ряд стабильности алкильных катионов имеет следующий вид:
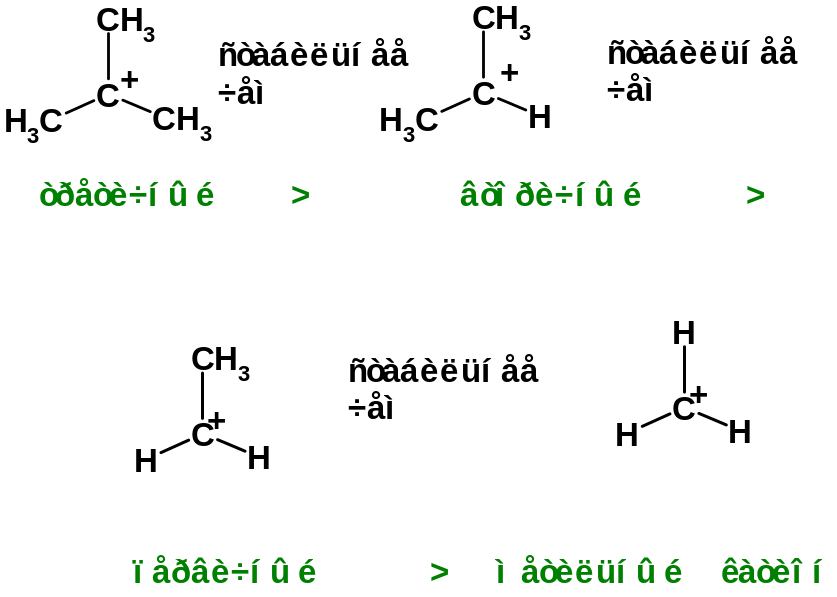
ПОЯСНИТЕ. КАК ВЫ ПОНИМАЕТЕ ЭТУ ЗАКОНОМЕРНОСТЬ.
Ответ: Во всех карбокатионах имеется трехвалентный атом углерода, несущий положительный заряд (+). Углерод является неметаллом, а потому ему несвойственно отдавать валентные электроны и существовать в виде катионов (подобно Na+, K+).
Электронодонорные группы, связанные с электронодефицитным центром (С+), должны стабилизировать карбокатион. Поскольку алкильные группы являются электронодонорными (проявляют +I эффект), то чем большее их количество связано с электронодефицитным центром (С+), тем стабильнее должен быть катион.
Третичные карбокатионы являются наиболее стабильными, поскольку с электронодефицитным центром (С+) связаны три алкильный группы. В метильном катионе (СН3+) с атомом углерода связаны лишь атомы водорода и ни одной донорной алкильной группы, в связи с чем этот катион является наименее стабильным из всех алкильных.

