
21 Билет
Электролиз – это совокупность процессов, происходящих в системе, состоящей из двух электродов и электролита при пропускании через них электрического тока. Электрод, подключенный к отрицательному источнику тока – катод, он имеет отрицательный заряд. Электрод, подключенный к положительному источнику тока – анод, он имеет положительный заряд. На катоде происходит восстановление, на аноде – окисление. MgCl2↔Mg2++2Cl-; катод: Mg2++2e-→Mg0; анод: 2Cl—2e-→Cl2
Если в качестве электролита выступают не расплавы солей, а их водные растворы, то в системе присутствуют 2 вещества: соль и вода: 2 типа катионов (H2+ и Ме+) и 2 типа анионов (OH- и кислотный остаток-).
От стандартного потенциала металла будет зависеть, какой именно процесс будет протекать на катоде. Преимущественно будет восстанавливаться тот металл, чей потенциал более электроположительный. На аноде преимущественно будет окисляться тот металл, чей потенциал более электроотрицателен.
Катодные процессы. Необходимо учитывать величину потенциального процесса восстановления H2 (фи 2H+/H2=-0,41В). Если потенциал металла более электроположительный, то на катоде будет выделяться H2. Если потенциал металла более электроотрицательный, то на катоде будет выделяться металл.
Анодные процессы. Инертный анод – материал, который не претерпевает изменений в ходе электролиза (уголь, платина). Активный анод – материал, который окисляется в ходе электролиза.
22 Билет
С количественной стороны процесс электролиза изучал английский физик Фарадей, который установил при этом 2 закона:
1)
Масса образующегося при электролизе
вещества пропорциональна количеству
электричества, прошедшему через раствор
или расплав электролита
 ,
где F
– постоянная Фарадея (F=96500кл/моль)
,
где F
– постоянная Фарадея (F=96500кл/моль)
2) Количество образовавшихся на катоде веществ равны их эквиваленту
23 Билет
Электрохимическая поляризация. Перенапряжение
Когда электрод находится при потенциале, равном равновесному, на нем устанавливается электрохимическое равновесие: Ox+ne-↔Red
При смещении потенциала электрода в положительную или в отрицательную сторону на нем начинают протекать процессы окисления или восстановления. Электрохимическая поляризация - это отклонение потенциала электрода от его равновесного значения.
В связи с этим поляризация в отрицательную сторону называется катодной поляризацией, а в положительную — анодной.
24, 25 Билет
Гальванический элемент (химический источник тока - ХИТ) – это устройство, которое преобразовывает энергию ОВР в электрическую. Если в ХИТе протекает практически необратимая реакция, то он одноразовый и его нельзя перезаряжать. Если протекают практически обратимые реакции, то он перезаряжаемый.
В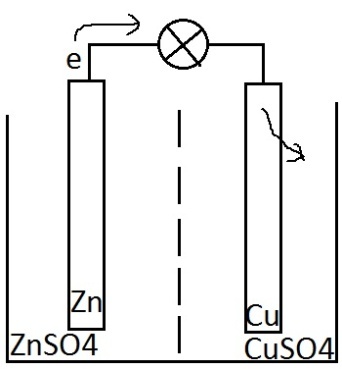 простом случае ХИТ состоит из 2-х пластин
или стержней, изготовленных их разных
металлов и погруженных в раствор
электролитов. Пример: медно-цинковый
гальванический элемент (элемент
Экоби-Даниэля), на основе которого лежит
реакция Zn+Cu2+→Cu+Zn2+,
где цинковый электрод – анод, медный –
катод. Весь процесс состоит из двух фаз:
1) Атомы цинка отдают электроны; 2)
Ионы меди забирают электроны.
простом случае ХИТ состоит из 2-х пластин
или стержней, изготовленных их разных
металлов и погруженных в раствор
электролитов. Пример: медно-цинковый
гальванический элемент (элемент
Экоби-Даниэля), на основе которого лежит
реакция Zn+Cu2+→Cu+Zn2+,
где цинковый электрод – анод, медный –
катод. Весь процесс состоит из двух фаз:
1) Атомы цинка отдают электроны; 2)
Ионы меди забирают электроны.
Электрический ток, который протекает по внешней цепи, может совершать полезную работу A=Z*F*U, где Z – число электронов, F – число фарадея, U – разность потенциалов. В предельных случаях, когда реакция протекает обратимо, напряжение будет максимальным и оно будет называться ЭДС Amax=Z*F*E. При постоянной температуре и давлении, максимальная работа будет равна изменении энергии Гипса, взятой с обратным знаком ∆Б=-Z*F*E. Если концентрация веществ, учувствовавших в реакции равно 1, то ЭДС называется стандартным ∆Б0=-Z*F*E0.
Т.к. ОВР делится на 2
полуреакции, ЭДС представляют в виде
двух величин разности потенциалов анода
и катода. E=фикат-фиан.
Величина потенциалов зависит от природы
веществ, от концентрации веществ и
температуры системы
 , где Ox – окислительная
форма, Red – восстановленная
форма (при T=298К)
, где Ox – окислительная
форма, Red – восстановленная
форма (при T=298К)
