
18 Билет
Степень окисления – это заряд элемента, вычисленный исходя из предположения, что соединение состоит только из ионов.
Имперические правила расчета степени окисления:
1) В простых веществах степень окисления равна нулю
2) постоянную степень окисления имеют: а) щелочные металлы (1гр., гл.п/гр) Li, Na, K, Rb, Cs (+1); б) щелочноземельные металлы (2гр., гл.п/гр) Mg, Ca, Sr, Ba (+2); в) F (-1); г) H(+1) (искл. с s-элементами – щелочно-земельными металлами (-1) д) O(-2) (искл. H2O2(-1); OF2(+2))
3) Степень окисления иона равна заряду иона
ОВР – это реакции, в результате которых изменяется степень окисления элементов
2Li0+F20→2Li+1F-1
Процесс отдачи электронов, который сопровождается повышением степени окисления элементов, называется окислением, а вещество, в состав которого входит окисляющийся элемент – восстановителем (Li0-1e-→Li+ окисление (восстановитель))
Процесс приема электронов, который сопровождается понижением степени окисления элементов, называется восстановлением, а вещество, в состав которого входит восстанавливающийся элемент – окислителем (F20+2e-→2F- восстановление (окислитель))
19 Билет
Окислитель содержит в своём составе элемент, понижающий степень окисления, а восстановитель – элемент, степень которого повышается. Окислителями могут быть соединения высших, а восстановители – низших степеней окисления.
Металлы проявляют с соединениях либо высшую положительную степень окисления, либо низшую степень окисления – равную нулю (т.е. с чистых металлах происходит окисление, а на металлах, имеющих высшую степень окисления - восстановление).
Неметаллы проявляют как положительную, так отрицательную степень окисления. Неметаллы, имеющие высшую (положительную) степень окисления могут только восстанавливаться, а имеющие низшую (отрицательную) степень – только окисляться.
Окислительно-восстановительная двойственность – это способность вступать в реакцию как с окислителями, так и с восстановителями.
Классы ОВР:
1) Межмолекулярные ОВР (окислители и восстановители – разные элементы, входящие в состав различных молекул)
2) Реакции самоокисления и самовосстановления – диспропорционирование (один и тот же элемент является окислителем и восстановителем) Cl2+H2O→HCl-+HCl+O; восстановление Cl0+1e-→Cl-; окисление Cl0-1e-→Cl+
3) Внутримолекулярное окисление и восстановление (при которых одна часть молекул как окислитель, а другая – как восстановитель) 2H2O→2H2+O2; восстановление H2++2e-→H20; окисление 2O2--4e-→O20
20 Билет
Электрохимия – это раздел химии, который изучает явления возникновения электрического тока в результате ОВР, которые протекают на электродах, а так же изучает химические процессы, обусловленные действием электрического тока на вещества. Электрохимия делится на 2 основных раздела:
1) Учение о химическом действии электрического тока (электролиз и гальванотехника)
2) Учение о химических источниках энергии (гальванические элементы и аккумуляторы)
На электрохимическом явлении основано большое количество химических процессов. Можно выделить их следующие способности: 1) Электрохимические реакции относятся к числу ОВР. 2) протекают только в пограничной области, на границе раздела фаз электрода и электролита. 3) при протекании электродных реакций наблюдается взаимное превращение электрической и химической энергии.
Э
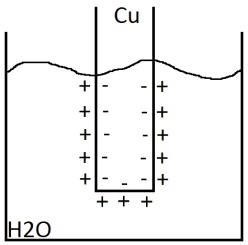 лектродный
потенциал. Если в воду опустить медную
пластинку, то ионы на поверхности металла
будут гидратироваться полярными
молекулами воды. При этом связь этих
ионов будет ослабляться и металл будет
как-бы поверхностно растворяться. На
поверхности металла останутся отрицательно
заряженные электроны. Но из-за
электростатического притяжения между
металлом и катионами, металл не продолжает
растворяться, в системе возникает
равновесие, которое характеризуется
равными скоростями растворения и
осаждения металла. В связи с этим металл
заряжается отрицательно, а прилегающая
жидкость – положительно. Возникает
разность потенциалов. Если жидкая среда
вода – то картина для всех металлов
одинакова. Если среда - раствор соли, то
состояние равновесия сместится.
Образуется новая разность потенциалов.
лектродный
потенциал. Если в воду опустить медную
пластинку, то ионы на поверхности металла
будут гидратироваться полярными
молекулами воды. При этом связь этих
ионов будет ослабляться и металл будет
как-бы поверхностно растворяться. На
поверхности металла останутся отрицательно
заряженные электроны. Но из-за
электростатического притяжения между
металлом и катионами, металл не продолжает
растворяться, в системе возникает
равновесие, которое характеризуется
равными скоростями растворения и
осаждения металла. В связи с этим металл
заряжается отрицательно, а прилегающая
жидкость – положительно. Возникает
разность потенциалов. Если жидкая среда
вода – то картина для всех металлов
одинакова. Если среда - раствор соли, то
состояние равновесия сместится.
Образуется новая разность потенциалов.
Электродный потенциал – это разность электростатического потенциала на границе металла и жидкостью Величина потенциала зависит от концентрации в растворе катионов металла, а так же от валентности и температуры.
