
11 Билет
В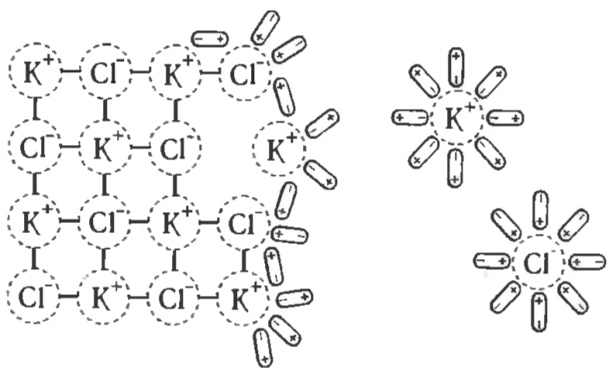 одные
растворы кислот, оснований и солей
способны проводить электрический ток.
При этом безводные соли, основания и
кислоты не способны проводить ток.
Вещества, распадающиеся в расплавах
или растворах на ионы, называются
электролитами.
одные
растворы кислот, оснований и солей
способны проводить электрический ток.
При этом безводные соли, основания и
кислоты не способны проводить ток.
Вещества, распадающиеся в расплавах
или растворах на ионы, называются
электролитами.
Электролитическая диссоциация. При растворении в воде все электролиты распадаются на положительные и отрицательные заряженные ионы. Положительные: катионы K+, Ca2+, Zn2+; отрицательные: анионы OH-, ионы кислотного остатка. Процесс диссоциации показан уравнением NaCl↔Na++Cl-. Когда кристаллы соли попадают в воду, то его ионы притягивают к себе молекулы воды (ион-дипольное взаимодействие). К катионам притягиваются отрицательные полюса воды, а к анионам – положительные. Ионы притягивают молекулы воды с такой же силой, как и вода ионы. Притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в постоянном движении. Эти толчки вместе с тепловым движением достаточны для отделения иона от кристаллов.
Иначе дело протекает с полярными молекулами. Молекула воды притягивается к концам полярной молекулы соответствующим образом (диполь-дипольное взаимодействие) и вызывает расхождение полюсов у молекулы (поляризует её). Такая поляризация вместе с колебательным движением и непрерывным движением воды приводит к разрыву молекул на ионы. Пришедшие в раствор ионы остаются в связи с молекулами и образуют гидрат-ионы.
12 Билет
Т.к
не все молекулы вещества диссоциируют
на ионы, было введено понятие степени
диссоциации (отношение числа
продиссоциировавших молекул к общему
числу молекул в растворе)
 .
.
Если а>70, электролит сильный (HCl, HNO3, H2SO4), если а<30 – слабый (HNO2, H2SO3, CH3COOH)
К
равновесию, которое устанавливается в
растворе слабого электролита, можно
применить законы химического равновесия
и записать выражение константой
равновесия CH3COOH↔CH3COO-+H+.
 .
Константа диссоциации слабого электролита
зависит от природы электролита и
растворителя и от температуры. Не зависит
от концентрации растворов. Чем выше
способность кислоты или основания
распадаться на ионы, тем выше её
способность диссоциировать. Слабые
многоосновные кислоты и слабые основания
многовалентных Ме подвергаются
диссоциации ступенчато: 1) H2CO3↔H++CO3-
.
Константа диссоциации слабого электролита
зависит от природы электролита и
растворителя и от температуры. Не зависит
от концентрации растворов. Чем выше
способность кислоты или основания
распадаться на ионы, тем выше её
способность диссоциировать. Слабые
многоосновные кислоты и слабые основания
многовалентных Ме подвергаются
диссоциации ступенчато: 1) H2CO3↔H++CO3-
 , 2) HCO3↔H++CO3-
, 2) HCO3↔H++CO3-
 .
С каждой последующей ступенью Kg
понижается.
.
С каждой последующей ступенью Kg
понижается.
13 Билет
Ионные реакции – это реакции между ионами, на которые распадаются молекулы веществ. Диссоциации подвергаются растворимые соли, сильные кислоты (HCl, NH3, H2SO4) и сильные основания (LiOH, NaOH, KOH).
Основные типы ионных реакций:
1) Обратимые (NaCl + KNO3 ↔ KCl + NaNO3; Na++Cl-+K++NO3- ↔ K++ Cl-+ Na++ NO3-) Степень диссоциации всех солей так велика, что образующиеся ионы находятся в равновесии с небольшим количеством недиссоциированных молекул.
2) Осаждения (NaCl+ArNO3→ArCl↓+NaNO3). Т.к. хлорид серебра нерастворим в воде, он удаляется из раствора, поэтому обратная реакция ослабляется настолько, что не играет роли
3) Образование газообразных веществ (Na2CO3+2HCl→2NaCl+H2O+CO2) – взаимодействие карбонатов с кислотами.
4) Нейтрализация (NaOH+HCl→NaCl+H2O)
