
7 Билет
Все химические реакции делятся на: 1) необратимые (протекают до конца, т.е. до полного расходования одного из реагирующих веществ) 2) обратимые (протекают не до конца, т.е.ни одно из реагирующих веществ не расходуется полностью)
Необратимая реакция протекает в одном направлении, а обратимая – как в прямом, так и в обратном. 3H2+N2↔2NH3
Реакция необратима, если в ходе её протекания образуется газообразное либо нерастворимое вещество, а так же в случае образования слабых электролитов Zn+4HNO3→Zn(NO3)2↓+2NO2↑+2H2O;
В случае обратимых реакций при смешивании исходных веществ изначально скорость прямой реакции велика, а скорость обратной равна нулю. Но по мере протекания реакции исходных веществ становится меньше, а количество продуктов увеличивается. В результате скорость прямой реакции понижается, а обратной – растет. Наступает момент, когда концентрация продуктов становится больше, чем концентрация реагирующих веществ. Следовательно, в этот момент скорость обратной реакции становится больше и начинается обратная реакция.
8 Билет
Химическое равновесие – это момент, когда скорость прямой и обратной реакции становятся равными.
Пусть H2+I2=2HI; Uпрям=K1[H2][I2], Uобр=K2[HI]2, тогда K1/K2=[HI]2/[H2][I2]=Kp, где Кр – константа равновесия. Она зависит он природы и концентрации реагирующих веществ, не зависит от катализаторов.
Смещение химического равновесия. Система будет находиться в равновесии до тех пор, пока внешние условия остаются постоянными. Если они изменяются, то произойдет изменение скоростей прямого и обратного процесса.
1) Влияние концентраций: Если в равновесную концентрацию внести дополнительное количество исходного вещества, то скорость прямой реакции увеличится и следовательно равновесие в системе сместится в сторону протекания прямой реакции. 3H2+N2↔2NH3; ↑[H2] →, ↑[NH3] ←, ↓[H2] ←
2) Изменение давления: при увеличении давления путем сжатия системы равновесие смещается в сторону понижения давления 3H2+N2↔2NH3; ↑Р →
3) Изменение температуры: тепловой эффект - это фактор, который определяет направление смещения равновесия. При повышении температуры равновесие смещается в сторону эндотермической реакции (поглощение теплоты), а при понижении – в сторону экзотермической реакции (выделение теплоты) 3H2+N2↔2NH3+Q , ∆H<0, ↑T ←, ↓T →
Принцип Ле-Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что указанное воздействие уменьшится.
9 Билет
Одним из методов классификации растворов является их деление на растворы, которые могут проводить электрический ток и не могут. Которые проводят – электролиты, которые не проводят – неэлектролиты.
Раствором называют твердую или жидкую гомогенную систему, состоящей из двух или более компонентов, относительное количество которых может меняться в больших пределах. Любой раствор состоит из растворителя и растворённых в нем веществ. Растворителем называется тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и получаемый раствор. Если же вещества до смешивания находятся в одинаковых агрегатных состояниях, то растворителем является тот компонент, который находится в растворе в большем количестве.
В свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в химических соединениях.
Способы выражения состава раствора. Раствор, который находится в равновесии с растворяющимся веществом, называется насыщенным раствором. Ими пользуются редко. Чаще применяют ненасыщенные растворы, в них концентрация растворённого вещества меньше, чем в насыщенном. Концентрацией раствора называют количество растворённого вещества, содержащегося в определённом количестве раствора или растворителя. Растворы с большой концентрацией - концентрированные, с малой - разбавленные.
Наиболее употребительные способы выражения состава раствора:
1) Массовая доля (какая часть от массы данного раствора составляет масса растворённого вещества)

2) Мольная доля (отношение числа молей данного растворенного вещества к общему числу молей, составляющих раствор)
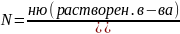
3) Молярная концентрация (молярность). Число молей растворенного вещества, содержащимся в 1 литре раствора

4)
Молярная концентрация эквивалента
(число молей эквивалента растворенного
вещества, содержащегося в 1л раствора)

5) Моляльная концентрация ( Число молей растворенного вещества, который содержится в 1000г растворителя)
 6)
Титр раствора (масса растворенного
вещества (г), содержащегося в 1мл раствора)
6)
Титр раствора (масса растворенного
вещества (г), содержащегося в 1мл раствора)

