
- •С.В. Шапиро Курс физики Учебное пособие
- •Рецензенты:
- •Содержание
- •Раздел 1. Механика……………………………………...……….………………..8
- •Раздел 2. Термодинамика..……………………………………………………...45
- •Раздел 3. Электричество и магнетизм………………………………………...86
- •Раздел 5. Физические основы строения материи…………………………..175
- •Цель и задачи курса
- •Раздел первый. Механика глава первая. Кинематика
- •1.1. Материальная точка и основные характеристики ее движения
- •Декартовой системе координат
- •1.2. Вращательное движение материальной точки
- •Векторное изображение угловой скорости (б)
- •1.3. Кинематика твердого тела. Разложение произвольного движения на поступательное и вращательное
- •1.4. Относительное движение
- •1.5. Релятивистские эффекты в кинематике
- •Масштаба длины (в)
- •Вопросы по первой главе:
- •Глава вторая. Динамика
- •2.1. Взаимодействие материальных точек. Понятие силы
- •2.2. Законы статики изолированного множества материальных точек
- •1 Закон статики.
- •2 Закон статики.
- •2.3. Закон сохранения импульса изолированного множества материальных точек. Центр масс
- •2.4. Закон сохранения момента импульса изолированного множества материальных точек. Теорема Штейнера
- •2.5. Работа, энергия, закон сохранения энергии
- •Материальной точки Mq: а, б – под действием одной материальной точки Mp;
- •2.6. Взаимодействие двух изолированных множеств материальных точек
- •2.7. Связи абсолютно-твердых тел
- •2.8. Релятивистская масса
- •2.9. Гравитационное взаимодействие
- •2.10. Динамика упругого тела
- •Вопросы по второй главе:
- •Раздел II. Термодинамика глава третья. Идеальный газ
- •3.1. Основные характеристики идеального газа
- •Движением всех корпускул, входящих в газ (а), их упорядоченным движением (б) и в промежуточной ситуации (в)
- •3.2. Уравнение состояния Менделеева–Клапейрона
- •3.3. Работа идеального газа. Теплота и внутренняя тепловая энергия. Первый закон термодинамики
- •3.4. Энтропия. Второй принцип термодинамики
- •Аналогично для второго газа записываем
- •Если принять отношения
- •3.5. Адиабатические, изотермические, изохорические, изобарические процессы
- •3.6. Неравновесные системы
- •При теплообмене: 1 – источник тепловой энергии; 2 – приемник тепловой энергии (холодильник); 0 – объем идеального газа (открытая система)
- •Риc. 3.7. К раcчёту процесса преобразования теплового движения в упорядоченное в простейшей неравновесной системе
- •3.7. Цикл Карно
- •3.8. Распределение молекул газа по скоростям
- •Вопросы по третьей главе:
- •Глава четвёртая. Реальный газ и основы кинетики газа
- •4.1. Уравнение Ван дер-Ваальса
- •4.2. Столкновения молекул. Средняя длина свободного пробега. Скорость дрейфа
- •При столкновении корпускул идеального газа
- •Модель движения материальной точки под действием постоянной силы в условиях дескретно – повторяющегося столкновения с препятствиями (б) и зависимость V(τ) для такого движения
- •4.3. Явления переноса в газе
- •4.4. Диффузия газов
- •4.5. Теплопроводность
- •4.6. Внутреннее трение в газах (вязкость)
- •4.7. Основы аэро- и гидродинамики. Возникновение вихрей
- •В сплошной среде (б, в)
- •Вопросы по четвертой главе:
- •Раздел третий. Электричество и магнетизм глава пятая. Электростатика
- •5.1. Закон Кулона
- •Электрического взаимодействия; б – воздействие (n-1) зарядов на заряд qN;
- •5.2. Электрическое поле и его основные характеристики
- •И эквипотенциальными поверхностями (а) и поток вектора напряженности через инфинитезимальную поверхность (б)
- •5.3. Теорема Гаусса–Остроградского
- •5.4. Примеры применения теоремы Гаусса–Остроградского
- •Бесконечной длины: а – выбор замкнутой поверхности;
- •5.5. Электростатическое поле в диэлектрике
- •5.6. Электростатическая индукция. Теорема Гаусса-Остроградского для поля в разнородной среде
- •В разнородной среде
- •5.7. Энергия электростатического поля
- •Вопросы по пятой главе:
- •Глава шестая. Магнетизм
- •6.1. Взаимодействие движущихся зарядов и проводников с токами
- •С движущимися электронами; б – иллюстрация закона Био-Савара-Лапласа
- •6.2. Основные характеристики магнитного поля.
- •6.3. Закон полного тока
- •Магнитное поле торроидальной катушки
- •6.5. Электромагнитная индукция
- •Наводимого электромагнитной индукцией потока
- •6.6. Пара-, диа- и ферромагнетики
- •6.7. Явление взаимоиндукции. Идеальный трансформатор
- •Его схематическое изображение (б)
- •6.8. Энергия магнитного поля
- •Вопросы по шестой главе:
- •Глава седьмая. Электрический ток
- •7.1. Основные элементы цепи постоянного тока. Законы Ома и Джоуля–Ленца
- •7.2. Законы Кирхгофа для разветвленной цепи
- •(К описанию законов Кирхгофа)
- •7.3. Переменный синусоидальный ток
- •Векторами: а – единичный вектор во вращающейся системе координат;
- •7.4. Переменная синусоидальная эдс. Законы Ома и Кирхгофа в комплексном виде
- •И участок цепи синусоидального тока (в)
- •7.5. Переходные процессы в электрических цепях
- •Вопросы по седьмой главе:
- •Глава восьмая. Электромагнитное поле
- •8.1. Уравнения Максвелла
- •8.2. Теорема Умова–Пойнтинга
- •Двухпроводной линии (а) и круглого провода (б)
- •8.3. Плоское электромагнитное поле в диэлектрике
- •Плоской электромагнитной волны в диэлектрике
- •П(х); г – формирование е0(х)
- •8.4. Плоское синусоидальное электромагнитное поле в диэлектрике
- •8.5. Плоская электромагнитная волна в проводящей среде
- •8.6. Плоское синусоидальное электромагнитное поле в смешанной среде
- •8.7. Сферическое электромагнитное поле в диэлектрике
- •Вопросы по восьмой главе:
- •Для выбора основных цветов:1 – красный;2 – зелёный;3 – синий
- •9.2. Интерференция света
- •Монохроматических волн; в – интерференция сферических волн
- •Предмета на фотоплёнку при облучении его лазером (монохроматическим когерентным светом;б)получение объёмного (стереоскопического) изображения этого предмета
- •9.3. Дифракция света
- •9.4. Отражение и преломление волн на границе двух сред
- •9.5. Геометрическая оптика
- •Вопросы по девятой главе:
- •Глава десятая. Акустика
- •10.1. Акустические волны в газе. Волновое уравнение
- •10.2. Поперечные упругие колебания протяжённых твердых тел и поверхностей жидкостей
- •10.3. Распространение гармонического звука в газе
- •10.4. Негармонические звуковые колебания
- •Вопросы по десятой главе:
- •Раздел пятый. Физические основы строения материи глава одиннадцатая. Элементы квантовой механики
- •1.1. Принцип неопределенности
- •11.2. Волна вероятности. Уравнение Шредингера
- •Вероятность её нахождения вдоль оси X(б)
- •11.3. Волна вероятности ускоряющейся частицы. Волновой пакет
- •При ускорении частицы (а) и его структура (б)
- •11.4. Движение электрического заряда в центрально-симметричном электрическом поле
- •А) при числе эпициклов,равном 1; б) при числе 2
- •Вопросы по одиннадцатой главе:
- •Глава двенадцатая. Физические основы строения материи
- •12.1. Элементарные частицы
- •Камере в результате столкновения π ––мезона с протоном р(а). В результате реакции появились k0 – мезон и λ0 – гиперон.Они на фотографии
- •12.2. Модели ядра
- •12.3. Ядерные процессы
- •12.4. Структура атома. Энергетические уровни
- •12.5. Некоторые физические явления, обусловленные квантовыми процессами в атомах
- •12.6. Формирование молекулярных структур
- •Атомов от расстояния между их центрами
- •12.7. Агрегатные состояния вещества
- •12.8. Твердое тело
- •Двух молекул от расстояния между ними
- •В кристаллах
- •Вопросы по двенадцатой главе:
- •Приложения
- •Примеры решения задач Несколько советов
- •Несколько предварительных замечаний
- •1. Кинематика.
- •2. Статика Задача № п.2
- •Решение
- •3. Динамика Задача № п.3
- •Решение
- •4. Термодинамика Задача№ п.4
- •Решение
- •5. Электростатика Задача № п.5
- •Решение
- •6. Магнитное поле Задача № п.6
- •Решение
- •7. Электрический ток Задача № п.7
- •Решение
- •8. Переменное электромагнитное поле Задача № п.8
- •Решение
- •9. Акустика Задача № п.9
- •Решение
- •10. Оптика Задача № п.10
- •Решение
- •11. Атомная и ядерная физика Задача № п.11
- •Решение
- •12. Молекулы и кристаллы Задача № п.12
- •Решение
- •Некоторые сведения из векторного анализа
- •Международная система единиц
- •3.1. Основные единицы и их эталоны
- •3.2. Единицы механических величин
- •П.3.3. Единицы тепловых величин
- •3.4. Единицы электромагнитных величин.
- •3.5. Единицы электромагнитного излучения и освещенности
- •Основные хронологические даты истории физики
- •Приложение 5 основные физические константы
- •Список литературы
- •Шапиро Семен Валентинович
- •450078, Г. Уфа, ул. Чернышевского, 145, к. 206; тел. (347) 241-69-85.
12.6. Формирование молекулярных структур
Хотя атомы являются электрически нейтральными частицами, тем не менее, благодаря электромагнитному взаимодействию они соединяются друг с другом, образуя молекулы. Основным фактором, обеспечивающим такое соединение, является массовая несимметрия носителей положительных и отрицательных зарядов – ядра и электронной оболочки. Масса ядер, как указывалось выше, в несколько тысяч раз больше массы всех электронов атома.
Поэтому носитель отрицательных зарядов значительно более подвижен: его центр масс может смещаться относительно ядра, он может распадаться на отдельные, не связанные в единый конгломерат части.
Особенно подвержены подобной деформации наружные электроны оболочки атома. Они именуются валентными (от латинского valio – имеющие ценность, значение). Именно благодаря им и происходит соединение атомов в молекулу и вообще все многообразие молекулярных процессов и структур.
В обобщенном виде соединение атомов в молекулу можно пояснить с помощью графика рис.12.4.На этом рисунке дана зависимость потенциальной энергии взаимодействия двух атомов Wn от расстояния между их центрами масс (фактически – между ядрами).
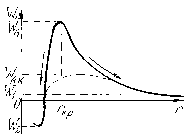
Рис. 12.4. Зависимость потенциальной энергии взаимодействия
Атомов от расстояния между их центрами
По мере их сближения потенциальная энергия возрастает – находящиеся на наружных орбиталях оболочки валентные электроны обоих атомов отталкиваются друг от друга. Если кинетическая энергия сближения этих атомов мала – меньше энергии активации WA (максимальной потенциальной энергии взаимодействия), атомы спустя некоторое время начинают расходиться. Во множестве большого числа таких атомов это постоянное сближение и расхождение частиц ничем не отличается от процесса хаотического движения внутри идеального газа, рассмотренного в § 3.1.
Если же кинетическая энергия движения атомов больше максимума WA, их центры масс сходятся на расстоянии, меньше rкр, соответствующего энергии активации. Атомы “сваливаются” в совместную потенциальную яму и оказываются прочными соединенными друг с другом. Для того, чтобы их взаимная кинетическая энергия Wk была больше WA, множество атомов должно быть нагрето до температуры T0p> соответствующей T0a:
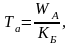 (12.12)
(12.12)
где KБ – постоянная Больцмана.
Добавление в смесь, состоящую из двух типов объединяющихся атомов, небольшого количества другого вещества (именуемого катализатором) может уменьшить величину WA до WA.K < WA (см. рис. 12.4). Такое явление именуется катализом. Оно лежит в основе процесса управления химическими реакциями.
После объединения атомов в молекулу в окружающее пространство излучается электромагнитная энергия Wэ.м равная W1 – W2, где W2 – потенциальная энергия атомов в связанном состоянии, а W1 – их энергия до объединения (см. рис. 12.4). Кинетическая энергия атомов Wк превращается частично в кинетическую энергию движения молекулы, частично в кинетическую энергию вращения молекулы вокруг своего центра масс и колебательного движения ядер атомов внутри молекулы (см. главу третью). Излученная электромагнитная энергия вместе с кинетической энергией движения молекулы передается другим атомам смеси, инициируя их объединение в молекулы. Таким образом, процесс объединения атомов в молекулу принимает непрерывный характер и именуется химической реакцией. Часть Wэ.м выходит за пределы объема, в котором протекает химическая реакция, превращаясь в тепловую энергию, нагревающую окружающую среду. Если умножить Wэ.м на число частиц, вступивших в реакцию, то мы получим энтальпию Н. Эта энергия расходуется на создание внутренней энергии реагирующих частиц (т.е. энергию их теплового, хаотического движения Wвн), излучаемую во внешнюю среду свободную энергию Wс и на работу по расширению объема массы атомов, вступивших в реакцию, - pV:
H=Wвн+Wc+pV. (12.13)
Величина Wc именуется свободной энергией Гельмгольца WGg, а сумма (Wc+pV) – свободной энергией Гиббса WG. Обе эти величины показывают, какое количество тепловой энергии излучается данным объемом реагирующих веществ в окружающую среду при изменении их объема (WGg) или при неизменном объеме (WG).
Все сказанное выше относится не только к объединению в одну молекулу двух атомов, но и для более сложных видов химических реакций. Только среди этих последних возможны ситуации, когда разность (W1-W2)<0, т.е. для протекания реакции в зону, где она происходит, извне необходимо постоянно подводить тепловую энергию. Ясно, что энтальпия процессов имеет противоположный знак. Именуются они эндотермическими в отличие от первых – экзотермических.
Связи атомов в молекулах бывают четырех видов: ковалентная, ионная, металлическая и Ван-дер-Ваальса.
Ковалентная связь характеризуется тем, что два или более атомов объединяют один или более своих валентных электронов. Эти электроны движутся по орбиталям, принадлежащим всем входящим в молекулу атомам.
Ионная связь характеризуется тем, что атом одного элемента присоединяет к себе валентный электрон другого атома. Такое происходит с теми веществами, энергия связи валентных электронов которых со своими ядрами разная. При сближении этих атомов – антиподов валентный электрон покидает оболочку того ядра, с которым он слабо связан и присоединяется к тому, связь наружной оболочки которого больше (разумеется, если в ней есть вакансии – см. § 12.2). В результате возникают два иона – положительный (с отсутствующим электроном) и отрицательный, которые притягиваются друг к другу в соответствии с законом Кулона.
Металлическая связь возникает вследствие того, что у металлов энергия наружных орбиталей нескольких соседних атомов сливаются друг с другом и соответствующие валентные электроны блуждают по всему объему, принадлежа одновременно всем его атомам. Эта связь обеспечивает высокую прочность материала и его пластичность.
Связь Ван-дер-Ваальса обусловлена диполь - дипольным взаимоздействием, т. е. возникает между молекулами с несимметричным расположением зарядов. На рис. 12.5 показано, как могут появится связи Ван-дер-Ваальса между молекулами воды. В этих молекулах один из атомов водорода имеет положительный заряд – его электрон отобрал атом кислорода. В результате молекулы объединяются в полимолекулу (H2O)n. Конфигурация полимолекулы во многом определяется начальными условиями ее формирования. Силы Ван-дер-Ваальса являются самыми слабыми из всех формирующих молекулы.
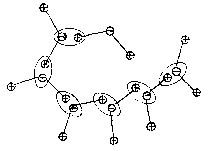
Рис. 12.5. Образование макромолекулы воды под действием сил Ван-дер-Ваальса
