
- •С.В. Шапиро Курс физики Учебное пособие
- •Рецензенты:
- •Содержание
- •Раздел 1. Механика……………………………………...……….………………..8
- •Раздел 2. Термодинамика..……………………………………………………...45
- •Раздел 3. Электричество и магнетизм………………………………………...86
- •Раздел 5. Физические основы строения материи…………………………..175
- •Цель и задачи курса
- •Раздел первый. Механика глава первая. Кинематика
- •1.1. Материальная точка и основные характеристики ее движения
- •Декартовой системе координат
- •1.2. Вращательное движение материальной точки
- •Векторное изображение угловой скорости (б)
- •1.3. Кинематика твердого тела. Разложение произвольного движения на поступательное и вращательное
- •1.4. Относительное движение
- •1.5. Релятивистские эффекты в кинематике
- •Масштаба длины (в)
- •Вопросы по первой главе:
- •Глава вторая. Динамика
- •2.1. Взаимодействие материальных точек. Понятие силы
- •2.2. Законы статики изолированного множества материальных точек
- •1 Закон статики.
- •2 Закон статики.
- •2.3. Закон сохранения импульса изолированного множества материальных точек. Центр масс
- •2.4. Закон сохранения момента импульса изолированного множества материальных точек. Теорема Штейнера
- •2.5. Работа, энергия, закон сохранения энергии
- •Материальной точки Mq: а, б – под действием одной материальной точки Mp;
- •2.6. Взаимодействие двух изолированных множеств материальных точек
- •2.7. Связи абсолютно-твердых тел
- •2.8. Релятивистская масса
- •2.9. Гравитационное взаимодействие
- •2.10. Динамика упругого тела
- •Вопросы по второй главе:
- •Раздел II. Термодинамика глава третья. Идеальный газ
- •3.1. Основные характеристики идеального газа
- •Движением всех корпускул, входящих в газ (а), их упорядоченным движением (б) и в промежуточной ситуации (в)
- •3.2. Уравнение состояния Менделеева–Клапейрона
- •3.3. Работа идеального газа. Теплота и внутренняя тепловая энергия. Первый закон термодинамики
- •3.4. Энтропия. Второй принцип термодинамики
- •Аналогично для второго газа записываем
- •Если принять отношения
- •3.5. Адиабатические, изотермические, изохорические, изобарические процессы
- •3.6. Неравновесные системы
- •При теплообмене: 1 – источник тепловой энергии; 2 – приемник тепловой энергии (холодильник); 0 – объем идеального газа (открытая система)
- •Риc. 3.7. К раcчёту процесса преобразования теплового движения в упорядоченное в простейшей неравновесной системе
- •3.7. Цикл Карно
- •3.8. Распределение молекул газа по скоростям
- •Вопросы по третьей главе:
- •Глава четвёртая. Реальный газ и основы кинетики газа
- •4.1. Уравнение Ван дер-Ваальса
- •4.2. Столкновения молекул. Средняя длина свободного пробега. Скорость дрейфа
- •При столкновении корпускул идеального газа
- •Модель движения материальной точки под действием постоянной силы в условиях дескретно – повторяющегося столкновения с препятствиями (б) и зависимость V(τ) для такого движения
- •4.3. Явления переноса в газе
- •4.4. Диффузия газов
- •4.5. Теплопроводность
- •4.6. Внутреннее трение в газах (вязкость)
- •4.7. Основы аэро- и гидродинамики. Возникновение вихрей
- •В сплошной среде (б, в)
- •Вопросы по четвертой главе:
- •Раздел третий. Электричество и магнетизм глава пятая. Электростатика
- •5.1. Закон Кулона
- •Электрического взаимодействия; б – воздействие (n-1) зарядов на заряд qN;
- •5.2. Электрическое поле и его основные характеристики
- •И эквипотенциальными поверхностями (а) и поток вектора напряженности через инфинитезимальную поверхность (б)
- •5.3. Теорема Гаусса–Остроградского
- •5.4. Примеры применения теоремы Гаусса–Остроградского
- •Бесконечной длины: а – выбор замкнутой поверхности;
- •5.5. Электростатическое поле в диэлектрике
- •5.6. Электростатическая индукция. Теорема Гаусса-Остроградского для поля в разнородной среде
- •В разнородной среде
- •5.7. Энергия электростатического поля
- •Вопросы по пятой главе:
- •Глава шестая. Магнетизм
- •6.1. Взаимодействие движущихся зарядов и проводников с токами
- •С движущимися электронами; б – иллюстрация закона Био-Савара-Лапласа
- •6.2. Основные характеристики магнитного поля.
- •6.3. Закон полного тока
- •Магнитное поле торроидальной катушки
- •6.5. Электромагнитная индукция
- •Наводимого электромагнитной индукцией потока
- •6.6. Пара-, диа- и ферромагнетики
- •6.7. Явление взаимоиндукции. Идеальный трансформатор
- •Его схематическое изображение (б)
- •6.8. Энергия магнитного поля
- •Вопросы по шестой главе:
- •Глава седьмая. Электрический ток
- •7.1. Основные элементы цепи постоянного тока. Законы Ома и Джоуля–Ленца
- •7.2. Законы Кирхгофа для разветвленной цепи
- •(К описанию законов Кирхгофа)
- •7.3. Переменный синусоидальный ток
- •Векторами: а – единичный вектор во вращающейся системе координат;
- •7.4. Переменная синусоидальная эдс. Законы Ома и Кирхгофа в комплексном виде
- •И участок цепи синусоидального тока (в)
- •7.5. Переходные процессы в электрических цепях
- •Вопросы по седьмой главе:
- •Глава восьмая. Электромагнитное поле
- •8.1. Уравнения Максвелла
- •8.2. Теорема Умова–Пойнтинга
- •Двухпроводной линии (а) и круглого провода (б)
- •8.3. Плоское электромагнитное поле в диэлектрике
- •Плоской электромагнитной волны в диэлектрике
- •П(х); г – формирование е0(х)
- •8.4. Плоское синусоидальное электромагнитное поле в диэлектрике
- •8.5. Плоская электромагнитная волна в проводящей среде
- •8.6. Плоское синусоидальное электромагнитное поле в смешанной среде
- •8.7. Сферическое электромагнитное поле в диэлектрике
- •Вопросы по восьмой главе:
- •Для выбора основных цветов:1 – красный;2 – зелёный;3 – синий
- •9.2. Интерференция света
- •Монохроматических волн; в – интерференция сферических волн
- •Предмета на фотоплёнку при облучении его лазером (монохроматическим когерентным светом;б)получение объёмного (стереоскопического) изображения этого предмета
- •9.3. Дифракция света
- •9.4. Отражение и преломление волн на границе двух сред
- •9.5. Геометрическая оптика
- •Вопросы по девятой главе:
- •Глава десятая. Акустика
- •10.1. Акустические волны в газе. Волновое уравнение
- •10.2. Поперечные упругие колебания протяжённых твердых тел и поверхностей жидкостей
- •10.3. Распространение гармонического звука в газе
- •10.4. Негармонические звуковые колебания
- •Вопросы по десятой главе:
- •Раздел пятый. Физические основы строения материи глава одиннадцатая. Элементы квантовой механики
- •1.1. Принцип неопределенности
- •11.2. Волна вероятности. Уравнение Шредингера
- •Вероятность её нахождения вдоль оси X(б)
- •11.3. Волна вероятности ускоряющейся частицы. Волновой пакет
- •При ускорении частицы (а) и его структура (б)
- •11.4. Движение электрического заряда в центрально-симметричном электрическом поле
- •А) при числе эпициклов,равном 1; б) при числе 2
- •Вопросы по одиннадцатой главе:
- •Глава двенадцатая. Физические основы строения материи
- •12.1. Элементарные частицы
- •Камере в результате столкновения π ––мезона с протоном р(а). В результате реакции появились k0 – мезон и λ0 – гиперон.Они на фотографии
- •12.2. Модели ядра
- •12.3. Ядерные процессы
- •12.4. Структура атома. Энергетические уровни
- •12.5. Некоторые физические явления, обусловленные квантовыми процессами в атомах
- •12.6. Формирование молекулярных структур
- •Атомов от расстояния между их центрами
- •12.7. Агрегатные состояния вещества
- •12.8. Твердое тело
- •Двух молекул от расстояния между ними
- •В кристаллах
- •Вопросы по двенадцатой главе:
- •Приложения
- •Примеры решения задач Несколько советов
- •Несколько предварительных замечаний
- •1. Кинематика.
- •2. Статика Задача № п.2
- •Решение
- •3. Динамика Задача № п.3
- •Решение
- •4. Термодинамика Задача№ п.4
- •Решение
- •5. Электростатика Задача № п.5
- •Решение
- •6. Магнитное поле Задача № п.6
- •Решение
- •7. Электрический ток Задача № п.7
- •Решение
- •8. Переменное электромагнитное поле Задача № п.8
- •Решение
- •9. Акустика Задача № п.9
- •Решение
- •10. Оптика Задача № п.10
- •Решение
- •11. Атомная и ядерная физика Задача № п.11
- •Решение
- •12. Молекулы и кристаллы Задача № п.12
- •Решение
- •Некоторые сведения из векторного анализа
- •Международная система единиц
- •3.1. Основные единицы и их эталоны
- •3.2. Единицы механических величин
- •П.3.3. Единицы тепловых величин
- •3.4. Единицы электромагнитных величин.
- •3.5. Единицы электромагнитного излучения и освещенности
- •Основные хронологические даты истории физики
- •Приложение 5 основные физические константы
- •Список литературы
- •Шапиро Семен Валентинович
- •450078, Г. Уфа, ул. Чернышевского, 145, к. 206; тел. (347) 241-69-85.
Вопросы по третьей главе:
Что такое идеальный газ?
Что такое давление идеального газа?
Что такое температура?
Что такое степень свободы молекулы?
Сколько степеней свободы у одноатомной, двухатомной и многоатомной молекул?
Сформулируйте закон Менделеева–Клапейрона.
Что такое теплоёмкость?
Что такое энтропия?
Сформулируйте второй принцип термодинамики.
Что такое адиабатический процесс?
Как изменяются давление и температура при изменении объёма в ходе адибатического процесса?
Что такое изотермический процесс?
Что такое внутренняя энергия идеального газа?
Как изменяется давление газа при изменении объёма в ходе изотермического процесса?
За счет какой энергии газ совершает работу в ходе изотермического процесса?
Что такое изобарический процесс?
Как изменяется температура при изменении объёма газа в ходе изобарического процесса?
Чему равна удельная теплоёмкость газа при постоянном давлении?
Что такое изохорический процесс?
Какую работу совершает газ при изохорическом процессе?
Чему равна удельная теплоёмкость газа при постоянном его объёме?
Как изменяется давление газа с ростом температуры при изохорическом процессе?
Опишите качественно процесс конвекции.
Что такое неравновесная система?
Как изменяется энтропия в неравновесных системах?
Что такое открытая система?
Из каких основных элементов состоит неравновесная система?
Приведите примеры неравновесных систем.
Опишите качественно цикл Карно.
Чему равна работа в двигателе Карно?
Чему равен коэффициент полезного действия двигателя Карно?
Сформулируйте законы распределения молекул идеального газа по потенциальный энергиям и скоростям (законы Больцмана и Максвелла ).
Глава четвёртая. Реальный газ и основы кинетики газа
4.1. Уравнение Ван дер-Ваальса
Реальный газ отличается от идеального тем, что, во-первых, частицы имеют конечные размеры (порядка 10 -10 м), а во-вторых, притягиваются друг к другу электромагнитными силами, возникающими на расстоянии порядка 10-9 м. В связи с первым фактором фактический объем, в которых частицы имеют возможность хаотически двигаться, уменьшается. Второй фактор приводит к тому, что силовое воздействие частиц друг на друга, сводящееся, в конечном счете, к давлению p, возрастает, причем тем больше, чем больше их плотность, т.е. чем меньше объем. Эти кинетические рассуждения голландский физик Вам дер-Ваальс оформил в виде формулы реального газа:
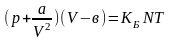 (4.1)
(4.1)
На рис. 4.1,а дана
зависимость
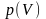 при Т=const,
соответствующая формуле (4.1). Как видим,
она состоит из трех участков:
при Т=const,
соответствующая формуле (4.1). Как видим,
она состоит из трех участков: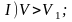
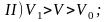
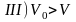 .
На участке I
газ ведет себя, как идеальный,
т.е. его термодинамические свойства
описываются уравнениями, данными в
предыдущей главе.
.
На участке I
газ ведет себя, как идеальный,
т.е. его термодинамические свойства
описываются уравнениями, данными в
предыдущей главе.
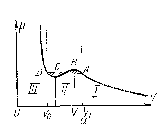
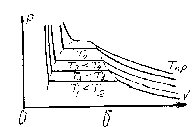
Рис. 4.1. Зависимости p(V) по уравнению Ван дер-Ваальса (а) и реального газа (б)
Экспериментальные
характеристики
на участке
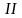 отличаются
от рассчитанных по уравнению Ван
дер-Ваальса тем, что вместо петли АВСD
фактически имеет место прямая
АD,
соответствующая уравнению
отличаются
от рассчитанных по уравнению Ван
дер-Ваальса тем, что вместо петли АВСD
фактически имеет место прямая
АD,
соответствующая уравнению
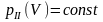 (4.2)
(4.2)
На этом участке газ превращается в жидкость, т.е. имеет место смесь газа и жидкости. Отношение
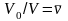 (4.3)
(4.3)
именуется влажностью газа.
На участке III вещество находится уже не в газообразном, а в жидком состоянии, главным признаком которого является соотношение
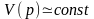 (4.4)
(4.4)
С увеличением
температуры размеры II
участка
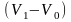 уменьшаются – рис. 4.1, б. При некоторой
критической температуре
уменьшаются – рис. 4.1, б. При некоторой
критической температуре
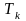 жидкость превращается в газ без
промежуточной стадии II
смеси газа и жидкости. Если
жидкость превращается в газ без
промежуточной стадии II
смеси газа и жидкости. Если
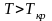 ,
вещество находится в состоянии
пересыщенного пара - гибрида жидкости
и газа.
,
вещество находится в состоянии
пересыщенного пара - гибрида жидкости
и газа.
