
- •С.В. Шапиро Курс физики Учебное пособие
- •Рецензенты:
- •Содержание
- •Раздел 1. Механика……………………………………...……….………………..8
- •Раздел 2. Термодинамика..……………………………………………………...45
- •Раздел 3. Электричество и магнетизм………………………………………...86
- •Раздел 5. Физические основы строения материи…………………………..175
- •Цель и задачи курса
- •Раздел первый. Механика глава первая. Кинематика
- •1.1. Материальная точка и основные характеристики ее движения
- •Декартовой системе координат
- •1.2. Вращательное движение материальной точки
- •Векторное изображение угловой скорости (б)
- •1.3. Кинематика твердого тела. Разложение произвольного движения на поступательное и вращательное
- •1.4. Относительное движение
- •1.5. Релятивистские эффекты в кинематике
- •Масштаба длины (в)
- •Вопросы по первой главе:
- •Глава вторая. Динамика
- •2.1. Взаимодействие материальных точек. Понятие силы
- •2.2. Законы статики изолированного множества материальных точек
- •1 Закон статики.
- •2 Закон статики.
- •2.3. Закон сохранения импульса изолированного множества материальных точек. Центр масс
- •2.4. Закон сохранения момента импульса изолированного множества материальных точек. Теорема Штейнера
- •2.5. Работа, энергия, закон сохранения энергии
- •Материальной точки Mq: а, б – под действием одной материальной точки Mp;
- •2.6. Взаимодействие двух изолированных множеств материальных точек
- •2.7. Связи абсолютно-твердых тел
- •2.8. Релятивистская масса
- •2.9. Гравитационное взаимодействие
- •2.10. Динамика упругого тела
- •Вопросы по второй главе:
- •Раздел II. Термодинамика глава третья. Идеальный газ
- •3.1. Основные характеристики идеального газа
- •Движением всех корпускул, входящих в газ (а), их упорядоченным движением (б) и в промежуточной ситуации (в)
- •3.2. Уравнение состояния Менделеева–Клапейрона
- •3.3. Работа идеального газа. Теплота и внутренняя тепловая энергия. Первый закон термодинамики
- •3.4. Энтропия. Второй принцип термодинамики
- •Аналогично для второго газа записываем
- •Если принять отношения
- •3.5. Адиабатические, изотермические, изохорические, изобарические процессы
- •3.6. Неравновесные системы
- •При теплообмене: 1 – источник тепловой энергии; 2 – приемник тепловой энергии (холодильник); 0 – объем идеального газа (открытая система)
- •Риc. 3.7. К раcчёту процесса преобразования теплового движения в упорядоченное в простейшей неравновесной системе
- •3.7. Цикл Карно
- •3.8. Распределение молекул газа по скоростям
- •Вопросы по третьей главе:
- •Глава четвёртая. Реальный газ и основы кинетики газа
- •4.1. Уравнение Ван дер-Ваальса
- •4.2. Столкновения молекул. Средняя длина свободного пробега. Скорость дрейфа
- •При столкновении корпускул идеального газа
- •Модель движения материальной точки под действием постоянной силы в условиях дескретно – повторяющегося столкновения с препятствиями (б) и зависимость V(τ) для такого движения
- •4.3. Явления переноса в газе
- •4.4. Диффузия газов
- •4.5. Теплопроводность
- •4.6. Внутреннее трение в газах (вязкость)
- •4.7. Основы аэро- и гидродинамики. Возникновение вихрей
- •В сплошной среде (б, в)
- •Вопросы по четвертой главе:
- •Раздел третий. Электричество и магнетизм глава пятая. Электростатика
- •5.1. Закон Кулона
- •Электрического взаимодействия; б – воздействие (n-1) зарядов на заряд qN;
- •5.2. Электрическое поле и его основные характеристики
- •И эквипотенциальными поверхностями (а) и поток вектора напряженности через инфинитезимальную поверхность (б)
- •5.3. Теорема Гаусса–Остроградского
- •5.4. Примеры применения теоремы Гаусса–Остроградского
- •Бесконечной длины: а – выбор замкнутой поверхности;
- •5.5. Электростатическое поле в диэлектрике
- •5.6. Электростатическая индукция. Теорема Гаусса-Остроградского для поля в разнородной среде
- •В разнородной среде
- •5.7. Энергия электростатического поля
- •Вопросы по пятой главе:
- •Глава шестая. Магнетизм
- •6.1. Взаимодействие движущихся зарядов и проводников с токами
- •С движущимися электронами; б – иллюстрация закона Био-Савара-Лапласа
- •6.2. Основные характеристики магнитного поля.
- •6.3. Закон полного тока
- •Магнитное поле торроидальной катушки
- •6.5. Электромагнитная индукция
- •Наводимого электромагнитной индукцией потока
- •6.6. Пара-, диа- и ферромагнетики
- •6.7. Явление взаимоиндукции. Идеальный трансформатор
- •Его схематическое изображение (б)
- •6.8. Энергия магнитного поля
- •Вопросы по шестой главе:
- •Глава седьмая. Электрический ток
- •7.1. Основные элементы цепи постоянного тока. Законы Ома и Джоуля–Ленца
- •7.2. Законы Кирхгофа для разветвленной цепи
- •(К описанию законов Кирхгофа)
- •7.3. Переменный синусоидальный ток
- •Векторами: а – единичный вектор во вращающейся системе координат;
- •7.4. Переменная синусоидальная эдс. Законы Ома и Кирхгофа в комплексном виде
- •И участок цепи синусоидального тока (в)
- •7.5. Переходные процессы в электрических цепях
- •Вопросы по седьмой главе:
- •Глава восьмая. Электромагнитное поле
- •8.1. Уравнения Максвелла
- •8.2. Теорема Умова–Пойнтинга
- •Двухпроводной линии (а) и круглого провода (б)
- •8.3. Плоское электромагнитное поле в диэлектрике
- •Плоской электромагнитной волны в диэлектрике
- •П(х); г – формирование е0(х)
- •8.4. Плоское синусоидальное электромагнитное поле в диэлектрике
- •8.5. Плоская электромагнитная волна в проводящей среде
- •8.6. Плоское синусоидальное электромагнитное поле в смешанной среде
- •8.7. Сферическое электромагнитное поле в диэлектрике
- •Вопросы по восьмой главе:
- •Для выбора основных цветов:1 – красный;2 – зелёный;3 – синий
- •9.2. Интерференция света
- •Монохроматических волн; в – интерференция сферических волн
- •Предмета на фотоплёнку при облучении его лазером (монохроматическим когерентным светом;б)получение объёмного (стереоскопического) изображения этого предмета
- •9.3. Дифракция света
- •9.4. Отражение и преломление волн на границе двух сред
- •9.5. Геометрическая оптика
- •Вопросы по девятой главе:
- •Глава десятая. Акустика
- •10.1. Акустические волны в газе. Волновое уравнение
- •10.2. Поперечные упругие колебания протяжённых твердых тел и поверхностей жидкостей
- •10.3. Распространение гармонического звука в газе
- •10.4. Негармонические звуковые колебания
- •Вопросы по десятой главе:
- •Раздел пятый. Физические основы строения материи глава одиннадцатая. Элементы квантовой механики
- •1.1. Принцип неопределенности
- •11.2. Волна вероятности. Уравнение Шредингера
- •Вероятность её нахождения вдоль оси X(б)
- •11.3. Волна вероятности ускоряющейся частицы. Волновой пакет
- •При ускорении частицы (а) и его структура (б)
- •11.4. Движение электрического заряда в центрально-симметричном электрическом поле
- •А) при числе эпициклов,равном 1; б) при числе 2
- •Вопросы по одиннадцатой главе:
- •Глава двенадцатая. Физические основы строения материи
- •12.1. Элементарные частицы
- •Камере в результате столкновения π ––мезона с протоном р(а). В результате реакции появились k0 – мезон и λ0 – гиперон.Они на фотографии
- •12.2. Модели ядра
- •12.3. Ядерные процессы
- •12.4. Структура атома. Энергетические уровни
- •12.5. Некоторые физические явления, обусловленные квантовыми процессами в атомах
- •12.6. Формирование молекулярных структур
- •Атомов от расстояния между их центрами
- •12.7. Агрегатные состояния вещества
- •12.8. Твердое тело
- •Двух молекул от расстояния между ними
- •В кристаллах
- •Вопросы по двенадцатой главе:
- •Приложения
- •Примеры решения задач Несколько советов
- •Несколько предварительных замечаний
- •1. Кинематика.
- •2. Статика Задача № п.2
- •Решение
- •3. Динамика Задача № п.3
- •Решение
- •4. Термодинамика Задача№ п.4
- •Решение
- •5. Электростатика Задача № п.5
- •Решение
- •6. Магнитное поле Задача № п.6
- •Решение
- •7. Электрический ток Задача № п.7
- •Решение
- •8. Переменное электромагнитное поле Задача № п.8
- •Решение
- •9. Акустика Задача № п.9
- •Решение
- •10. Оптика Задача № п.10
- •Решение
- •11. Атомная и ядерная физика Задача № п.11
- •Решение
- •12. Молекулы и кристаллы Задача № п.12
- •Решение
- •Некоторые сведения из векторного анализа
- •Международная система единиц
- •3.1. Основные единицы и их эталоны
- •3.2. Единицы механических величин
- •П.3.3. Единицы тепловых величин
- •3.4. Единицы электромагнитных величин.
- •3.5. Единицы электромагнитного излучения и освещенности
- •Основные хронологические даты истории физики
- •Приложение 5 основные физические константы
- •Список литературы
- •Шапиро Семен Валентинович
- •450078, Г. Уфа, ул. Чернышевского, 145, к. 206; тел. (347) 241-69-85.
3.3. Работа идеального газа. Теплота и внутренняя тепловая энергия. Первый закон термодинамики
На рис. 3.4,б изображен
все тот же объем V
газа, что и на рис. 3.4,а, только
предполагается, что стенка
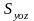 подвижна. При этом с противоположной
объему V
стороны этой стенки на нее ничего
не воздействует. Следовательно, стенка
находится под воздействием только силы
подвижна. При этом с противоположной
объему V
стороны этой стенки на нее ничего
не воздействует. Следовательно, стенка
находится под воздействием только силы
 ,
определенной в предыдущем параграфе:
,
определенной в предыдущем параграфе:
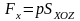 (3.23,а)
(3.23,а)
При перемещении
стенки SXOZ
на расстояние
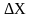 под действием этой силы осуществляется
работа
под действием этой силы осуществляется
работа
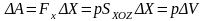 (3.23,б)
(3.23,б)
Ясно, что заключительное выражение формулы (3.23,б) справедливо и в тех случаях, когда подвижными будут другие стенки объема V идеального газа. Более того, эта формула может быть отнесена и для деформации любого произвольного объема идеального газа. Поскольку эта работа производится за счет хаотического движения молекул идеального газа, она обусловлена уменьшением внутренней энергии газа V
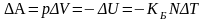 (3.23,в)
(3.23,в)
Как правило, любой замкнутый объем газа находится в тепловом взаимодействии с окружающей средой. Например, воздух, находящийся в аудитории, нагревается находящимися в ней студентами, а охлаждается через стекла и стены. Поэтому баланс тепловой энергии любого объема равен
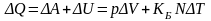 (3.23,г)
(3.23,г)
В этой формуле
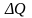 - тепловая энергия (или просто теплота),
поступающая в данной объем газа из вне.
(Ясно, что если
- тепловая энергия (или просто теплота),
поступающая в данной объем газа из вне.
(Ясно, что если
 ,
то речь идет о передаче теплоты из
данного объема в окружающую среду).
,
то речь идет о передаче теплоты из
данного объема в окружающую среду).
Формула (3.23,г) именуется первым началом термодинамики. Фактически она определяет более общий закон сохранения энергии применительно к тепловым процессам.
3.4. Энтропия. Второй принцип термодинамики
Тепловое (хаотическое) движение частиц обладает особым свойством – оно не может превратиться в другие (упорядоченные) формы движения, не увеличив в еще большей степени хаос в природе.
Имеется особая физическая величина – энтропия, которая характеризует возможность того или иного процесса с точки зрения возрастания хаоса в природе.
Для определения этой величины рассмотрим, какие энергетические соотношения связывают постепенный переход от хаотического состояния (рис. 3.2, а) к упорядоченному (рис.3.2, б).
На рис. 3.2, в изображено промежуточное состояние в момент времени t– в объеме V1 частицы по-прежнему двигаются хаотически, а в объеме V2 – упорядоченно.
(V1+V2= V).
Через интервал времени ∆t еще в одном участке объема V1 – ΔV с числом частиц ΔN1=nΔV все молекулы из хаотического состояния переходят в упорядоченное. Следовательно, энергия хаотического движения частиц уменьшилась на ΔN1wxаос. Эта энергия передалась в объем (V1-ΔV) и частично в окружающее пространство
Δ N1 wxаос = (N1 -Δ N1) Δ w1.cр – Δ Q1, (3.24,а)
где Δ w1.cр – величина, на которую увеличилась средняя энергия молекул объема V1 за счет передачи ему части энергии из объема ΔV, (-ΔQ1) – часть энергии, высвободившейся в объеме ΔV и переданной в окружающее пространство.
Из (3.23, а) получаем:
+ Δ Q1 = N1 Δ w1.cр – Δ N1 wxаос. (3.24,б)
(слагаемое ΔN1Δw1.cр отбрасываем, как величину второго порядка малости).
Как видим, увеличение порядка в объеме V сопровождается уменьшением тепловой энергии в этом объеме на величину (-ΔQ1). Однако изменение энергии не в полной мере характеризует степень упорядоченности. Поясним это на таком примере. Предположим, что студент, вернувшись с занятий к себе домой, обнаружил, что он забыл убрать постель. После того, как он постелил ее, ему удалось восстановить дома порядок. На следующий день, кроме неубранной кровати, в раковине оказалась еще и невымытая посуда. Затратив ту же энергию, что и накануне, он убрал постель, однако порядок так и не был восстановлен. Следовательно, порядок должен оцениваться не только затраченной на его приведение энергией, но и ее отношением к средней энергии хаоса в этом объёме:
 (3.24,в)
(3.24,в)
Умножая правую и левую часть на коэффициент пересчета а, получим физическую величину, характеризующую количественно меру хаоса или порядка – ΔS1:
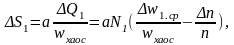 (3.23, г)
(3.23, г)
где
а
– пересчетный коэффициент, принимаемый
для удобства технических расчетов.
Отношение
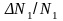 заменено на
заменено на
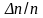 ,
так как при этом формула приобрела более
универсальный характер. Коэффициент
пропорциональности а
принимается равным:
,
так как при этом формула приобрела более
универсальный характер. Коэффициент
пропорциональности а
принимается равным:
- в термодинамике:
а
= KБ
= 1,38 × 10 –23
[ ];
(3.25,а)
];
(3.25,а)
- в информатике и кибернетике [10]:
а = 1 [нат]; (3.25,б) а = 1 / ln2 [бит]; (3.25,в)
а = 1 /ln8 [байт]; (3.25,г)
а = 1/210ln8 [килобайт]; (3.25,д) а = 1/220ln8 [мегабайт]. (3.25,е)
Если величина ∆S увеличивается, то возрастает степень хаоса газа, т.е. либо увеличивается энергия хаотического движения, либо уменьшается количество молекул в единице объема газа.
Параметр S именуется энтропией. С учетом сказанного, его можно определить, как величину, изменение которой пропорционально алгебраической сумме изменений относительной величины кинетической энергии частиц газа и относительной величины плотности частиц газа в единице объема.
Величина, противоположная по знаку энтропии, называется информацией I [10]:
I =-S. (3.26,а)
Покажем, как связаны между собой термодинамическое определение энтропии (информации), данное формулой (3.25), и вероятностное, применяемое в кибернетике и теории информации.
Сначала представим себе, что плотность частиц в объеме V не меняется (n=const), зато туда из окружающего пространства поступает (или в окружающее пространство убывает) тепловая энергия dQ. Согласно (3.24), (3.25) и (3.11) имеем:
 (3.26,б)
(3.26,б)
т.е. обычную термодинамическую формулу энтропии [1, 3, 4, 14, 15, 17-20].
Затем представим себе, что объем V увеличивается на инфинитезимальную (бесконечно – малую) величину dV. Согласно (3.24,г) энтропия изменится на величину
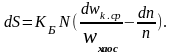 (3.26,в)
(3.26,в)
Произведение
 (3.27,а)
(3.27,а)
где dU = NdwК.ср; а Т = wхаос/KБ согласно (3.11). Величина U, напомним, именуется внутренней тепловой энергией системы (см. § 3.1).
Второе слагаемое правой части равенства (3.26) можно преобразовать следующим образом:
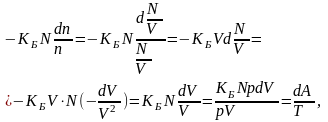 (3.27,б)
(3.27,б)
где dA =pdV – работа по увеличению объема V на величину dV, а Т=pV/KБN согласно (3.22, а).Подставляя (3.27, а) и (3.27, б) в (3.26), получаем
TdS = dU + dA. (3.28)
Произведение TS именуется термодинамическим потенциалом.
Теперь представим себе, что рядом расположены два объёма V1 и V2, в каждом из которых располагаются комплекты отличающихся друг от друга частиц m1 и m2 . Эти частицы могут различаться массой или радиусом сферы. Для простоты и прозрачности расчёта примем, что средняя кинетическая энергия и плотность частиц в объёмах V1 и V2 одинаковы:
w1ср. = w2ср.= wср; n1 = n2 = n.
Следовательно, - см. (3.9) и (3.11) - равны температуры:
Т1 = Т2 = Т
Уберём перегородку П, разделяющую оба объёма. Вследствие хаотического движения частицы m1 и m2 через некоторое время равномерно распределятся по объёму
V = V1 + V2.
При этом, естественно, ни температура, ни плотность частиц не изменятся.
Согласно (3.26) и (3.27, б) имеем:
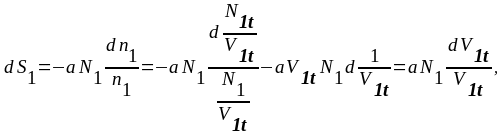 (3.29,а)
(3.29,а)
где
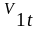 - объём,
занимаемый частицами m1
в промежуточный
момент t
процесса
диффузии газов внутри объёмов V1
+ V2.
- объём,
занимаемый частицами m1
в промежуточный
момент t
процесса
диффузии газов внутри объёмов V1
+ V2.
