
I. Основные термодинамические процессы
ИДЕАЛЬНОГО ГАЗА
I.I. Методика исследования термодинамических процессов
При изучении термодинамических процессов идеальных газов должны быть решены задачи:
первая - сводится к определению уравнения процесса устанавливающего закономерность изменения состояния рабочего тела в процессе;
вторая - выявлению возможности преобразования подведенной к рабочему телу теплоты между изменением внутренней энергии и работой, совершаемой рабочим телом.
Основой
решения первой задачи является уравнение
первого закона термодинамики, записанное
согласно условий, присущих рассматриваемому
процессу; и уравнение состояния идеального
газа.
Решение этих уравнений дает
возможность получать соотношения
различных параметров газа в виде
и
ST.
Вторая задача решается определением
изменения внутренней энергии и работы.
Изменение внутренней энергии для всех
процессов определяется одинаково: du=![]() ,
если
известна теплоемкость
,
если
известна теплоемкость
![]() .
Внешняя работа и располагаемая работа
L
и
определяются
как:
.
Внешняя работа и располагаемая работа
L
и
определяются
как:
![]() и
и
![]()
![]()
О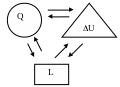 пределив
эти
величины,
по
уравнению
первого закона термодинамики,
определяют
количество
подведенной или
отведенной теплоты.
Характер
преобразования
теплоты в термодинамическом процессе
удобно изображать в виде схемы, включающей
три составные части уравнения
первого
закона термодинамики (рис.1).
пределив
эти
величины,
по
уравнению
первого закона термодинамики,
определяют
количество
подведенной или
отведенной теплоты.
Характер
преобразования
теплоты в термодинамическом процессе
удобно изображать в виде схемы, включающей
три составные части уравнения
первого
закона термодинамики (рис.1).
Стрелками, связывающие эти три составные части, показаны лишь направление преобразования энергии. Они не затрагивают количественной стороны.
В общем случае в термодинамических процессах два параметра их трех могут изменяться произвольно. Однако изучение работы теплотехнических устройств показывает, что наибольший интерес для практики представляют следующие процессы изохорический, изобарический, изотермический, адиабатический и политропный.
Последний процесс при определенных условиях может рассматриваться в качестве обобщающего по отношению ко всем предыдущим термодинамическим процессам.
1.2 И30х0рный процесс.
Изохорный процесс происходит при нагревании или охлаждении газа в постоянном объеме. Подобный процесс может совершаться рабочим телом в резервуаре постоянного объема.
Уравнение изохорного процесса =const. Соотношение между параметрами состояния в процессе в соответствии с законом Шарля я идеальных газов будет
![]()
Работа газа при d=0 не совершается, т.е.

В PV – координатах изохорный процесс изображают отрезком прямой параллельной оси ординат (рис.2). При нагревании газа q0 его давление и температура повышаются, а при охлаждении q0 – уменьшается.
![]()

 P
2
P
2
 q0
q0
1
q0
2

V
Рис. 2 PV - диаграмма изохорного процесса
Так как L=0,
то подводимая к газу теплота
![]() идет на изменение его внутренней энергии.
Поэтому в изохорном процессе с подводом
теплоты внутренняя энергия газа и его
температура повышаются, а с её отводом
снижаются.
идет на изменение его внутренней энергии.
Поэтому в изохорном процессе с подводом
теплоты внутренняя энергия газа и его
температура повышаются, а с её отводом
снижаются.
Принимая теплоемкость газа не зависящей от температуры, теплота изохорного процесса
![]()
Если теплоемкость в процессе переменная, то
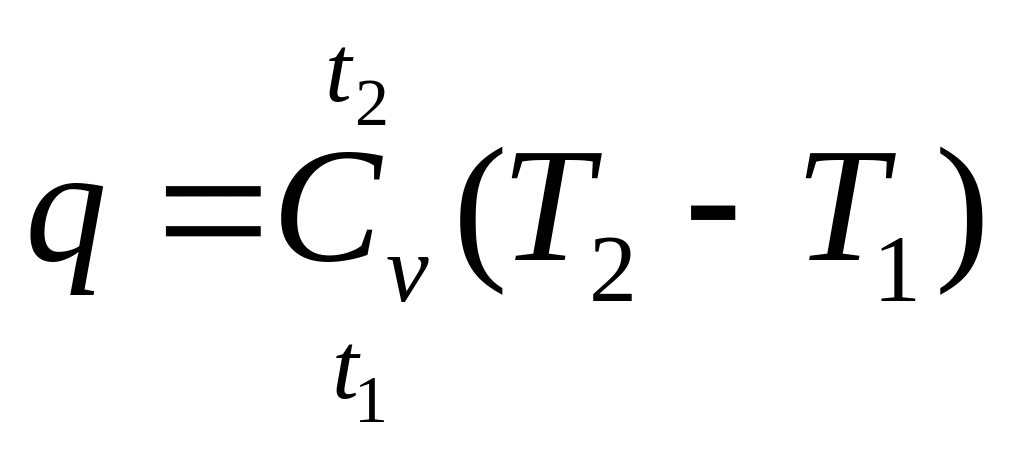
Для произвольного количества массы или объема газа

где
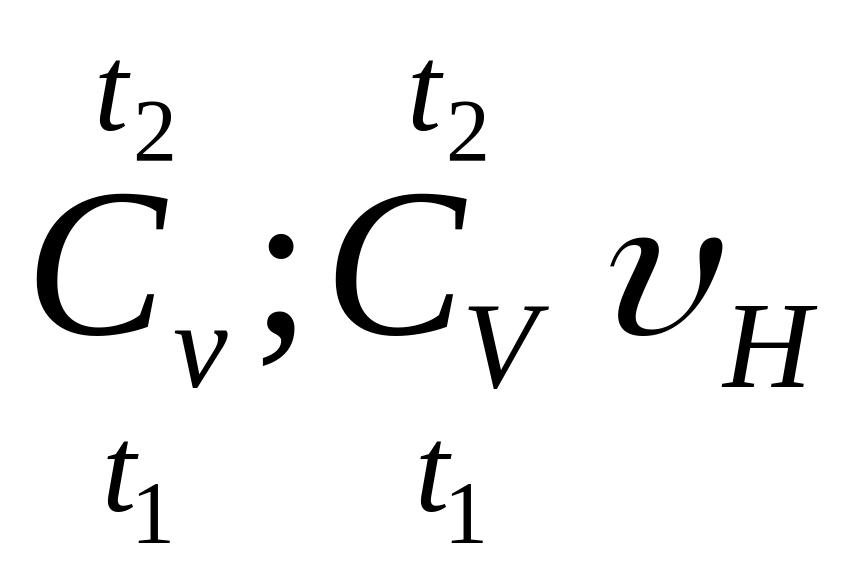 - соответственно средняя массовая и
объемная теплоемкость;
- соответственно средняя массовая и
объемная теплоемкость;
![]() -
объем, приведенный к нормальным
физическим условиям;
-
объем, приведенный к нормальным
физическим условиям;
М - масса газа. Изменение энтропии в изохорном процессе можно определить по выражению:
 ;
если
=const
;
если
=const
то после интегрирования получаем:
![]()
 Полученное
соотношение показывает, что изохорный
процесс в
Полученное
соотношение показывает, что изохорный
процесс в
T
Т
Распределение теплоты в изохорном процессе выразится схемой (рис.4),которая показывает, что вся теплота подведенная к рабочему телу, расходуется на увеличение внутренней энергии.

Рис.4 Схема распределения теплоты в изохорном процессе.
