
- •Элементы квантовой физики атомов, молекул и твердых тел.
- •Модели атома Томпсона и Резерфорда.
- •Линейчатый спектр атома водорода.
- •3. Постулаты Бора.
- •4.Энергетический спектр водородоподобных атомов.
- •5. Корпускулярно - волновой дуализм свойств вещества.
- •6. Некоторые свойства волн де Бройля.
- •7. Соотношения неопределенностей Гейзенберга.
Элементы квантовой физики атомов, молекул и твердых тел.
Модели атома Томпсона и Резерфорда.
Согласно первой пудинговой модели, предложенной английским физиком Джозефом Джоном Томсоном, положительный заряд как бы размазан внутри объема атома. В атом как бы вкраплены отдельные электроны, нейтрализующие положительный заряд.
Модель атома Томсона
Модель атома Томсона
Резерфорд предложил ядерную (планетарную) модель строения атома, в которой атом представлен в виде миниатюрной Солнечной системы. Согласно этой модели, весь положительный заряд и почти вся масса атома (99,4%) сосредоточены в атомном ядре. Размер ядра ничтожно мал по сравнению с размером атома. Вокруг ядра по замкнутым эллиптическим орбитам движутся электроны, образуя электронную оболочку атома. Заряд ядра равен суммарному заряду электронов.

Линейчатый спектр атома водорода.
Спектр излучения атомарного водорода состоит из отдельных спектральных линий, которые располагаются в определенном порядке. В 1885 г. Бальмер установил, что длины волн (или частоты) этих линий могут быть представлены формулой. Действительно, из (7) с учетом (6) для водорода (Z = 1), следует, что
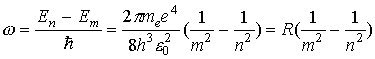 ,
(8)
,
(8)
где R = 2,07 1016 с -1 - постоянная Ридберга
Учитывая, что 1/ = v/с = /2с и используя (8), найдем
![]() ,
(9)
,
(9)
где R =1,0974107 м-1 - называется также постоянной Ридберга.
На рис. 1 изображена схема энергeтических уровней атома водорода, расчитанных согласно (6) при z=1.
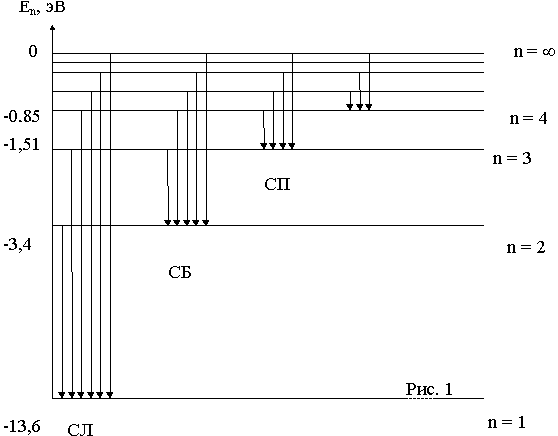
При переходе электрона с более высоких энергетических уровней на уровень n = 1 возникает ультрофиолетовое излучение или излучение серии Лаймана (СЛ). Когда электроны переходя на уровень n = 2 возникает видимое излучение или излучение серии Бальмера (СБ). При переходе электронов с более высоких уровней на уровень n = 3 возникает инфракрасное излучение, или излучение серии Пашена (СП) и т.д.
Частоты или длины волн, возникающего при этом излучения, определяются по формулам (8) или (9) при m=1 - для серии Лаймана, при m=2 - для серии Бальмера и при m = 3 - для серии Пашена. Энергия фотонов определяется по формуле (7), которую с учетом (6) можно привести для водородоподобных атомов к виду :
![]() эВ(10)
эВ(10)
Теория Бора сыграла огромную роль в создании атомной физики.В период ее развития (1913 - 1925 г.) были сделаны важные открытия , например, в области атомной спектроскопии. Однако в теории Бора обнаружились существенные недостатки, например, с ее помощью невозможно создать теорию более сложных, чем атом водорода, атомов. Поэтому становилось очевидным, что теория Бора представляет собой переходной этап на пути создания последовательной теории атомных и ядерных явлений. Такой последовательной теорией явилась квантовая (волновая) механика.
3. Постулаты Бора.
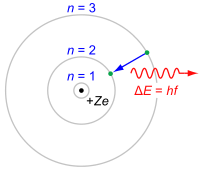
Постулаты Бора — основные допущения, сформулированные Нильсом Бором в 1913 году для объяснения закономерности линейчатого спектра атома водорода и водородоподобных ионов (формула Бальмера-Ридберга) и квантового характера испускания и поглощения света. Бор исходил из планетарной модели атома Резерфорда.
Постулаты
![]()
Модель атома Бора
Атом и атомные системы могут длительно пребывать только в особенных стационарных или квантовых состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн.
Излучение света происходит при переходе электрона из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний.
Для получения энергетических уровней в атоме водорода в рамках модели Бора записывается второй закон Ньютона для движения электрона по круговой орбите в поле кулоновской силы тот притяжения
![]()
где m — масса электрона, e — его заряд, Z — количество протонов в ядре (атомный номер) и k — кулоновская константа, зависящая от выбора системы единиц. Это соотношение позволяет выразить скорость электрона через радиус его орбиты:
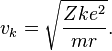
Энергия электрона равна разности кинетической энергии движения и его потенциальной энергии:
![]()
Используя правило квантования Бора, можно записать:
![]()
откуда радиус орбиты выражается через квантовое число n. Подстановка радиуса в выражение для энергии даёт:
![]() ≈
13,6 эВ
≈
13,6 эВ
