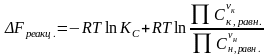- •Тема 5. Химические равновесия
- •Вывод условия химического равновесия:
- •Стандартный изобарный потенциал химической реакции
- •Влияние давления.
- •Расчет равновесий в конденсированных системах
- •Тепловая теорема Нернста (Третий закон т/д).
- •1 Следствие(об аддитивности теплоемкости):
- •2 Следствие
- •3 Следствие
- •Вычисление констант равновесия химических реакций по приведенным энергиям Гиббса
- •Спектроскопия и спектры.
- •Тема 6.Адсорбционные равновесия
- •Изотермы адсорбции
- •Изотерма Генри
- •2. Теория мономолекулярной адсорбции. Изотерма Ленгмюра.
- •Теория полимолекулярной адсорбции. Изотерма бэт.
- •Изотерма Фрейндлиха
- •Адсорбция на границе газ-жидкост. Изотерма Гиббса.
- •Закономерности адсорбции на твердой поверхности из раствора. Ионнообменная адсорбция.
- •Изобары и изостеры адсорбции.
- •Хроматография.
Тема 5. Химические равновесия
Лекция №27
Все химические
реакции в той или иной степени обратимы
и с течением времени скорость прямого
процесса
 понижается, а скорость обратной реакции
понижается, а скорость обратной реакции
 повышается. Химическое равновесие
характеризуется равенством
и
.
повышается. Химическое равновесие
характеризуется равенством
и
.
В состоянии равновесия количество молекул реагирующих веществ остается неизменным при постоянстве внешних условий. Химическое равновесие является динамическим (при изменении внешних условий происходит смещение равновесия, а при возвращении внешних условий к прежним значениям, химическое равновесие возвращается в исходное состояние).
Химическое равновесие часто называют химической термодинамикой, так как при смещении (изменении) внешних условий на бесконечно малую величину, химическое равновесие так же смещается бесконечно мало, а, следовательно, химическую реакцию можно рассматривать как обратимый термодинамический процесс и применять к ней общие условия термодинамического равновесия.
Например:
-
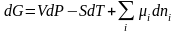
- для системы, в которой протекает химическая реакция.
dn1, dn2, dn3 … dni - изменение масс участников реакции. Оно пропорционально стехиометрическому коэффициенту, а, следовательно, все dniучастников реакции связаны между собой. Со знаком «+» берутся изменения масс конечных веществ, а со знаком «-» - изменения масс начальных веществ.
Условия, при которых часто протекает химическая реакция:
ПриT = const VdP = 0
P = const SdT = 0
|
|
Вывод условия химического равновесия:
2А B - - - - - - - - - - - (1)
dG = μBdnB – μAdnA.
По уравнению реакции dnB = 1/2dnA; а dnA = 2dnB.
Тогда в момент равновесия
dG = μBdnB – μA∙2dnВ,
(μB – 2μA)∙dnB = 0
dnB ≠ 0 μB – 2μA= 0 – условие равновесия реакции (1).
Условие равновесия в общем виде:
-
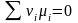
, где νi – стехиометрический коэффициент.
II. Закон действия масс (термодинамический вывод).
Впервые был выведен кинетическим путем Гульдбергом и Вааге.
Например:
2А B
В момент равновесия μB – 2μA = 0.
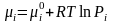 ;где
;где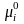 = constприТ
= const.
= constприТ
= const.
 ;
;
 ;
;
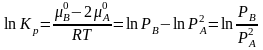 .
.
-

- для реакции (1).
Кр= constприТ = const.
-
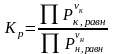
- закон действия масс в общем виде.
Например: 2NH3N2 + 3H2,
 .
.
Величина КР для идеальной газовой смеси не зависит от внешнего давления, а зависит только от парциальных давлений компонентов. При участии же в реакции реальных газов, Кp зависит от внешнего давления и, следовательно, для реальных газов используется Кf(константа равновесия, выраженная через летучести):
Числовое значение константы равновесия Кр и ее вид зависят от того, каким образом записаны уравнения реакции:
Например:
а) N2
+ 3H2
2NH3; 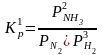 ;
;
б) 1/2N2
+ 3/2H2
2NH3;  ;
;
в) 2NH3N2
+ 3H2; 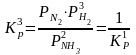 .
.
• Гетерогенное равновесие.
Сгр
+ О2
СО2; Кр′
=
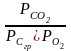
 и очень мало,
,
его можно внести в константу равновесияКр.
и очень мало,
,
его можно внести в константу равновесияКр.
Кр
= Кр′∙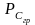 =
=
 .
.
Парциальное давление над твердой и жидкой фазой достаточно мало и поддерживается постоянным при Т = const.
• Способы выражения констант равновесия и связь между ними.
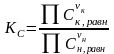
Кр ≠ КС ≠ Кх.

а) Связь КР с КС. аА + bBdD
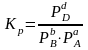 ; PV
= nRT;
; PV
= nRT;  ;
;
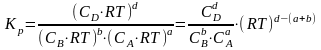 ;
;
|
,
где
|
б) Связь КР и Кх.
. По закону Дальтона Рi = Pхi, гдеР – общее давление.
 ;
;

КС и Кр не зависят от давления идеальных газов, а Кх - зависит.
Если алгебраическая сумма коэффициентов равна 0, то Кр = КС = Кх.
 Кр
= КС∙(RT)0
= Kx∙P0
= Kn.
Кр
= КС∙(RT)0
= Kx∙P0
= Kn.
-

,n – равновесное количество вещества.
• Изобарно-изотермический потенциал химической реакции
(изотерма Вант - Гоффа)
2А В
dG = (μB - 2μA)dnB. Если реакция протекает слева направо, то dG< 0.
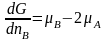
Если изменения масс участников реакции достаточно велики, то можно дифференциал заменить интегральной формой:
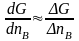 . При
ΔnB
= 1
ΔG
= μB
- 2μA
. При
ΔnB
= 1
ΔG
= μB
- 2μA
 (т.к. реакция протекает);
(т.к. реакция протекает);
 ;
;
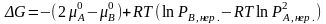 .
.
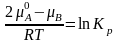 ;
;  .
.
 - при протекании
химической реакции.
- при протекании
химической реакции.
|
- изотерма химической реакции (Вант – Гоффа) (для газов). |
ΔG< 0 – «→»
ΔG> 0 – «←»
ΔG = 0 – равновесие.
-

- при всех
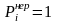 .
.
• Изохорно-изотермический потенциал химической реакции.
|
- изотерма Вант – Гоффа (для газовых систем и растворов) |




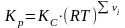
 (алгебраическая сумма стехиометрических
коэффициентов)
(алгебраическая сумма стехиометрических
коэффициентов)