
- •Краткий конспект по частной биохимии(мышечная, нервная и соединительная ткань)
- •1. Биохимия мышечной ткани
- •Миофибриллярные (сократительные) белки
- •Молекулярный механизм мышечного сокращения
- •Источники энергии мышечного сокращения
- •Механизмы энергообеспечения мышечного сокращения
- •2. Биохимия нервной ткани
- •3. Биохимия соединительной ткани
Краткий конспект по частной биохимии(мышечная, нервная и соединительная ткань)
1. Биохимия мышечной ткани
Мышцы составляют у взрослого человека 40 % от массы тела.
Функция мышц — напряжение и укорочение с последующим расслаблением.
Значение мышц — обеспечение подвижности организма и сопротивление механической силе, в том числе и статические нагрузки.
Механизм работы мышц — превращение химической энергии в механическую.
К мышечной ткани относятся:
скелетная мускулатура;
сердечная мышца;
гладкая мускулатура.
Скелетная и сердечная мышцы под микроскопом имеют поперечно-полосатое строение, а гладкая — нет. Мышечные клетки состоят из миофибрилл, а функциональной единицей миофибрилл является саркомер.
![]()
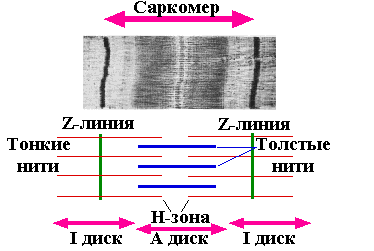
При рассмотрении
миофибриллы под электронным микроскопом
видны темные и светлые полосы или диски
(А и I
диски). Центральная зона А диска (H
зона) при этом кажется менее оптически
плотной, чем остальная его часть. I
участок (или I
диск) как бы делится на две части очень
плотной и узкой Z-линией.
Также видны два типа вытянутых нитей.
Один тип — это толстая
нить, соответствующая А диску. Второй
тип — тонкая
нить,
расположена в I![]() диске и проходит в А диск, не достигая
Н зоны.
диске и проходит в А диск, не достигая
Н зоны.
Около 25 % массы мышц составляют белки. Белки мышц делят на 3 группы:
миофибриллярные (сократительные) белки;
белки саркоплазмы;
белки стромы.
Миофибриллярные (сократительные) белки
1. Миозин — основа толстых нитей. Молекулярная масса ≈ 500.000 Да. Молекула миозина имеет вытянутую часть, состоящую из двух спиралей, накрученных одна на другую. Каждая спираль имеет на одном конце глобулярную головку и называется тяжёлой цепью. Возле головок спиралей располагается по 2 лёгких цепи.
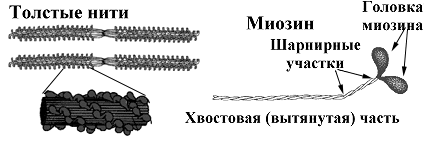
При обработке ферментами молекула миозина распадается на 2 больших фрагмента: тяжёлый меромиозин (обе головки и часть двойной спирали) и лёгкий меромиозин (остальная часть двойной спирали).
Функции миозина:
структурная — около 400 молекул миозина соединяются между собой «хвост» в «хвост» и образуют толстую нить;
каталитическая — головка миозина способна расщеплять АТФ;
контактная — соединяется с актином своими головками, которые в таком случае называются «поперечные мостики».
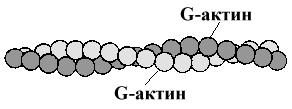
2. Актин — белок тонких нитей. Молекулярная масса — 42.000 Да. Форма молекул — шаровидная, поэтому он и называется G-актин (от англ. globular). Молекулы G-актина соединяются между собой и образуют F-актин (фибриллярный) в виде двойной спирали.
3. Тропомиозин — также белок тонких нитей. Молекулярная масса — 65.000 Да. Состоит из двух α-спиралей в форме палочки. Располагается в бороздках, идущих вдоль обеих сторон актина. Каждая его молекула лежит на 7 молекулах актина.
4. Тропонин — ещё один белок тонких нитей. Молекулярная масса — 80.000 Да. Состоит из 3 субъединиц: С — для связывания с ионами кальция; I — ингибиторная, которая блокирует преждевременное соединение головок миозина с актином; Т — для связывания с тропомиозином.

5. α-актинин. Входит в Z-линию и фиксирует там тонкие нити.
6. β-актинин. Регулирует длину тонких нитей.
7. М-белок. Входит в М-линию и фиксирует там толстые нити.
8. С-белок. Регулирует длину толстых нитей.
9. Десмин. Содержится между Z-линиями соседних миофибрилл, обеспечивая совпадение границ всех их саркомеров.
Белки саркоплазмы. К ним относятся миоглобин, ферменты гликолиза, тканевого дыхания, кальмодулин и кальсеквестрин, способные обратимо связываться с ионами кальция.
Белки стромы. Это коллаген и эластин.
Мышцы, помимо белков, содержат небелковые азотистые соединения — АТФ, КФ (креатинфосфат), фосфолипиды, глутамат, глутамин, карнозин и анзерин (два последних способны увеличивать амплитуду мышечного сокращения); безазотистые соединения — гликоген, лактат, пируват, нейтральные жиры, холестерол. Остальная масса — Н2О.
