
- •Химический состав и строение молекулы воды. Водородные взаимодействия.
- •24. Жёсткость воды. Ед.Измерения. Методы реагентного умягчения воды, их эфф-ть, контроль процессов реагентного умягчения
- •25. Умягчение воды методом ионного обмена. Термический метод умягчения воды. Импфирование?
- •27. Иониты(катиониты и аниониты), их природа, строение, св-ва, характер-ка?
- •28.Опреснение воды методом ионного обмена. Опреснение воды – методы удаления из нее растворенных солей и других примесей. Эту группу можно в свою очередь разделить на химические и физические методы..
- •43. Биологические фильтры.
- •47. Метановое брожение, характеристика микрофлоры кислотой и щелочной фаз брожения. Оптимальные условия существования микроорганизмов, осуществляющих процесс брожения
Химический состав и строение молекулы воды. Водородные взаимодействия.
В состав молекулы воды входят два атома водорода и один атом кислорода, атомы связаны ковалентной полярной связью, валентный угол составляет 104,5о. Молекула воды имеет структуру как бы равнобедренного треугольника: в вершине этого треугольника расположен атом кислорода, а в основании его — два атома водорода. Вода – бесцветная летучая жидкость, в толстом слое – голубая, без запаха, плотность – 1г/см3(при 40С), tпл. = 00С, tкип. = 1000С. вода является хорошим растворителем. Водородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода
2. Агрегатные состояния воды. Аномалии воды. Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами. Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазму. Изменения агрегатного состояния это термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация; из жидкого в твёрдое — кристаллизация. По состоянию различают: Твёрдое — лёд, Жидкое — вода, Газообразное — водяной пар, Типы снежинок При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твердое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (температура 0 °C и 100 °C были специально выбраны как температура таяния льда и кипения воды при создании температурной шкалы «по Цельсию» в системе СИ). При давлении в 611,73 Па (около 0,006 атм.) температура кипения и плавления совпадает и становится равной 0,01 °C. Такое давление и температура называются тройной точкой воды. Сублимация — переход вещества из твёрдого состояния сразу в газообразное, минуя жидкое. Аномальные свойства воды свидетельствуют о том, что молекулы Н2О в воде довольно прочно связаны между собой и образуют характерную молекулярную конструкцию, которая сопротивляется любым разрушающим воздействиям, например, тепловым, механическим, электрическим. По этой причине, например, необходимо затратить много тепла, чтобы превратить воду в пар. Эта особенность объясняет сравнительно высокую удельную теплоту испарения воды.
3. Химические свойства воды При пропускании через подкисленный раствор электрического тока вода разлагается на простые вещества: кислород и водород: 2Н2О ? 2Н2 + О2. Вода вступает во взаимодействие со щелочными и щелочноземельными металлами при обычных условиях, при этом в молекуле воды один атом водорода замещается на атом металла и образуются щёлочь и водород. Реакция протекает с выделением большого количества теплоты. 2Na + 2H2O = 2NaOH + H2 При взаимодействии основных оксидов с водой образуется щёлочь. Например, при взаимодействии оксида кальция (негашёной извести) с водой образуется гидроксид кальция (гашёная известь): CaO + H2O = Ca(OH)2.
Кислотные оксиды растворяются в воде с образованием кислот, например, оксид серы(IV) при растворении в воде образует сернистую кислоту: SO2 + H2O = H2SO3.
4. Растворы Неэлектролитов, бинарные или многокомпонентные мол. системы, состав которых может изменяться непрерывным образом (по крайней мере, в некоторых пределах). В отличие от растворов электролитов. в растворы неэлектролитов (мол. растворах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют.растворы неэлектролитов могут быть твердыми, жидкими и газообразными. В данной статье рассматриваются жидкие растворы; см. также Твердые растворы.
Взаимная растворимость двух жидкостей при заданных температуре Т и давлении р м. б. полной (неограниченной) или ограниченной. В последнем случае растворы в некоторой области составов расслаиваются, т. е. разделяются на две жидкие фазы, отличающиеся по концентрации. В многокомпонентных расслаивающихся растворах число сосуществующих жидких фаз м. б. более двух. Если один (или более) из компонентов растворы неэлектролитов в чистом состоянии при заданных Т и р является газом или твердым телом. область существования растворы неэлектролитов простирается от чистой жидкости (смеси жидкостей), выступающей в роли растворителя, до состава, отвечающего насыщ. раствору.
растворы неэлектролитов служат средой, в которой протекают многие прир. и пром. процессы. Изучение и прогнозирование свойств этих систем тесно связаны с такими практич. проблемами, как подбор растворителей для реализации технол. процессов, получение систем с заданными свойствами, разделение прир. и пром. смесей (включая газы и нефти), глубокая очистка веществ
5. Электролитами называются вещества, которые в расплавленном или растворенном состоянии проводят электрический ток. молекулы электролита в воде или другой среде, характеризующейся большой диэлектрической проницаемостью* , распадаются на ионы – положительные (катионы) и отрицательные (анионы). Процесс распада вещества на ионы получил название электролитической диссоциации. Для слабых электролитов она протекает обратимоПо современным представлениям электролитическая диссоциация в растворе происходит в результате сложного физико–химического взаимодействия молекул электролита с полярными молекулами растворителя.
Взаимодействие ионов с полярными молекулами растворителя называется сольватацией (для водных растворов - гидратацией) ионов. Сольватация приводит к образованию в растворе ассоциаций между ионами (катионами и анионами) и молекулами растворителя. Процесс растворения вещества К+А- в воде, являющегося соединением с типичной ионной связью, может быть записан следующим образом:
6. Растворимость, способность вещества образовывать с другим веществом (или веществами) гомогенные смеси с дисперсным распределением компонентов (см. Растворы). Обычно растворителем считают вещество, которое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся раствор. Если до растворения оба вещества находились в одном и том же агрегатном состоянии, растворителем считается вещество, присутствующее в смеси в существенно большем кол-ве.
Растворимость определяется физическим и химическим сродством молекул растворителя и растворяемого вещества, соотношением энергий взаимодействием однородных и разнородных компонентов раствора. Как правило, хорошо растворимы друг в друге подобные по физ. и хим. свойствам вещества (эмпирич. правило "подобное растворяется в подобном"). В частности, вещества, состоящие из полярных молекул, и вещества с ионным типом связи хорошо раств. в полярных растворителях (воде, этаноле, жидком аммиаке), а неполярные вещества хорошо раств. в неполярных растворителях (бензоле, сероуглероде). произведение концентраций ионов в насыщенном растворе труднорастворимого электролита при постоянной температуре является постоянной величиной. Эта величина называется произведением растворимости
7. Ионное произведение воды- жидкости соприкасающиеся с твердыми телами, газы соприкасающиеся с жидкостями или твердыми телами, смеси нерастворимых друг в друге жидкостей, смеси твердых тел различного состава, за исключением смешаных кристалов Буферный раствор, поддерживает при изменении состава среды постоянство значения какой-либо характеристики, например рН (кислотно-основной буферный раствор) или окислительного-восстановительного потенциала (окислительно-восстановительный буферный раствор).
Значение рН кислотно-основного буферного раствор зависит от концентраций компонентов буферной смеси, находящихся в химическом равновесии, и мало меняется при концентрировании и разбавлении раствора, введении относительно небольших количеств веществ, взаимодействующих с одним из компонентов буферного раствора. Диссоциация воды-Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде
8. При титровании раствора кислоты щелочью ионы гидроксила связывают прежде всего свободные ионы водорода. По мере уменьшения концентрации этих ионов происходит диссоциация новых молекул кислоты. В результате в реакцию может вступить весь содержащийся в кислоте водород, а не только находившийся в виде свободных ионов в исходном раствореОбщая кислотность называется аналитической, или титруемой кислотностью.
Активная кислотность представляет собой лишь часть общей кислотности и не может быть больше ее
Кислотно-основные индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). Индикаторы широко используют в титровании в аналитической химии и биохимии. Их преимуществом является дешевизна, быстрота и наглядность исследования. Однако из-за субъективности определения цвета и невысокой точности индикаторы pH не всегда удобны; поэтому для точного измерения pH используют pH-метры с цифровой индикацией.
Индикаторы обычно используют, добавляя несколько капель водного или спиртового раствора, либо немного порошка (например, смесь мурексида с хлоридом натрия) к пробе исследуемого раствора. Так, при титровании, в аликвоту исследуемого раствора добавляют индикатор, и наблюдают за изменениями цвета в точке эквивалентности.
9. Определение: Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Пример 1. Гидролиз сульфата меди(II): CuSO4 = Cu2+ + SO42–
Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр); α = (cгидр/cобщ)·100 % где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
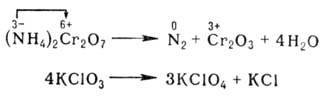
10. Окислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается. Первоначально окислением называли только реакции веществ с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует.
В
неорганической химии
окислительно-восстановительные реакции
(ОВР) формально могут рассматриваться
как перемещение электронов от атома
одного реагента (восстановителя) к атому
другого (окислителя), например:![]()
При этом окислитель восстанавливается, а восстановитель - окисляется. При протекании реакций в гальваническом элементе переход электронов осуществляется по проводнику, соединяющему электроды элемента, и изменение энергии Гиббса ΔG в данной реакции может быть превращено в полезную работу. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно. При окислительно-восстановительных реакциях атомы в высшей степени окисления являются только окислителями, в низшей - только восстановителями; атомы в промежуточной степени окисления в зависимости от типа реакции и условий ее протекания могут быть окислителями или восстановителями. Многие окислительно-восстановительные реакции (ОВР) – каталитические. По формальным признакам окислительно-восстановительные реакции (ОВР) разделяют на межмолекулярные (например, 2SO2 + O2 → SO3) и внутримолекулярные, например:
11. 1. Дисперсные системы. Дисперсные системы – это гетерогенные системы, состоящие из двух или большего числа фаз с сильно развитой поверхностью раздела между ними. 2. Классификация дисперсных систем. По размеру частиц дисперсной фазы различают грубодисперсные системы (взвеси) с размером частиц более 500 нм и тонкодисперсные (коллоидные растворы или коллоиды) с размерами частиц от 1 до 500 нм. Дисперсные системы можно классифицировать по многим признакам, что связано с огромным множеством объектов, которые изучает коллоидная химия. В качестве основного классификационного признака можно выделить размер частиц дисперсной фазы: -Грубодисперсные (> 10 мкм): сахар-песок, грунты, туман, капли дождя, вулканический пепел, магма и т. п. -Среднедисперсные (0,1-10 мкм): эритроциты крови человека, кишечная палочка и т. п. -Высокодисперсные (1-100 нм): вирус гриппа, дым, муть в природных водах, искусственно полученные золи различных веществ, водные растворы природных полимеров (альбумин, желатин и др.) и т. п. -Наноразмерные (1-10 нм): молекула гликогена, тонкие поры угля, золи металлов, полученные в присутствии молекул органических веществ, ограничивающих рост частиц, углеродные нанотрубки, магнитные нанонити из железа, никеля и т. п.
12. 1. Методы получения дисперсных систем. Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Процесс диспергирования осуществляется различными методами: механическим размалыванием вещества в т.н. коллоидных мельницах, электродуговым распылением металлов, дроблением вещества при помощи ультразвука. 2. Строение коллоидной частицы.Коллоидные частицы имеют сложное строение. Они состоят из ядер и адсорбированных и притянутых ионов.
13. 1. Поверхностное натяжение, важнейшая термодинамическая характеристика поверхности раздела фаз (тел), определяемая как работа обратимого изотермического образования единицы площади этой поверхности. 2.Поверхностно-активные вещества. Вещества, способные накапливаться (сгущаться) на поверхности соприкосновения двух тел, называемой поверхностью раздела фаз, или межфазной поверхностью. На межфазной поверхности П.-а. в. образуют слой повышенной концентрации — адсорбционный слой.
14. АДСОРБИЦИОННЫЕ РАВНОВЕСИЯ. Адсорбция Понятие адсорбции. Автоадсорбция. Адсорбент и адсорбат. Абсолютная и Гиббсовская адсорбция. Единицы измерения адсорбции. Зависимость величины адсорбции от концентрации, давления и температуры. Изотерма, изобара, изопикна, изостера адсорбции Адсорбция - процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемом фазы.
Адсорбция может наблюдаться в многокомпонентных системах и при перераспределении в поверхностный слой уходит тот компонент, который сильнее понижает поверхностное натяжение. В однокомпонентной системе при формировании поверхностного слоя происходит изменение его структуры - уплотнение, которое называется автоадсорбцией. В общем случае адсорбция может происходить не только благодаря стремлению поверхностной энергии к уменьшению, но и за счет химической реакции компонентов
с поверхностью вещества. В этом случае поверхностная энергия может даже увеличиваться на фоне снижения энергии всей системы. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а вещество, которое перераспределяется – адсорбатом. Обратный процесс перехода вещества с поверхности в объем фазы - десорбция. В зависимости от агрегатного состояния фаз различают адсорбцию газа на твердых адсорбентах, твердое
тело – жидкость, жидкость - жидкость, жидкость - газ. Для количественного описания адсорбции применяют две величины: первая измеряется числом молей или граммами, приходящимися на единицу поверхности или массы адсорбента: А = m1/m2 - абсолютная адсорбция, А = ni/S. Величина, определяемая избытком вещества в поверхностном слое, также отнесенным к единице площади поверхности или массы адсорбента, называется
15. ОСОБЕННОСТИ ХИМИЧЕСКОГО СОСТАВА ПРИРОДНЫХ ВОД. КЛАСИФИКАЦИЯ ПРИРОДНЫХ ВОД НА ОСНОВЕ ИХ ФАЗАВО-ДИСПЕРНОЙ ХАРАКИСТИКИ 1. растворенных в природных водах минеральных и органических веществ в ионном, молекулярном, комплексном и коллоидном состояниях (ГОСТ 17403-72). В природных водах растворены почти все известные на Земле химические элементы, из 87 стабильных химических элементов, установленных в земной коре, в настоящее время в природных водах обнаружены около 80. При повышении чувствительности аналитических методов, очевидно, будут установлены и остальные. Распределение химических элементов в водных объектах определяется типом природной системы и свойствами самих элементов (их распространенностью в земной коре и растворимостью в воде). Х.с.п.в. представляет собой сложный комплекс растворенных газов, различных минеральных солей и органических соединений. Его условно делят на шесть групп: главные ионы (см. макрокомпоненты природных вод); растворенные газы (см. газовый состав природных вод); биогенные вещества (см.); органические вещества; микроэлементы (см.) и загрязняющие вещества (см.). Сложность Х.с.п.в. определяется не только присутствием в них большого числа химических элементов и многообразием их форм и соединений, но и разным содержанием каждого из них, которое к тому же меняется в различных типах вод, что связано с особенностями условий их формирования (табл. 1). Под формированием химического состава природных вод понимается совокупность процессов, приводящих к образованию того или иного химического состава природной воды (ГОСТ 17403-72). Количество растворенных веществ в воде будет зависеть, с одной стороны, от состава тех веществ, с которыми она соприкасается в процессе своего круговорота, с другой — от условий, в которых происходили эти взаимодействия. Факторы, определяющие формирование Х.с.п.в. могут быть разделены на прямые и косвенные. Прямые — факторы, непосредственно влияющие на состав воды (т.е. действие веществ, которые могут обогащать воду растворимыми соединениями, или, наоборот, выделять их из воды). К ним относятся: горные породы, живые организмы, обмен с другими типами природных вод, а также деятельность человека. К косвенным относятся факторы, определяющие условия, в которых протекает взаимодействие веществ с водой: климат (см.), рельеф (см.), водный режим (см.), растительность (см.), гидрогеологические и гидродинамические условия и пр.
2. Природная вода – сложная дисперсная система, содержащая множество разнообразных минеральных и органических примесей.
Дисперсная система состоит из мелких частиц вещества, распределенного в другом веществе (среде). Система называется гомогенной, если внутри нее нет поверхностей раздела, отделяющих друг от друга части системы, различающиеся по свойствам. Гетерогенные системы – системы, внутри которых есть такие поверхности раздела. Гомогенная система – однофазная, гетерогенная – состоит из не менее двух фаз.
При размере частиц примесей воды меньше 10-3 мкм – это гомогенная система (однофазная из двух или более индивидуальных веществ). Если размер частиц ≥10-3 мкм, то примеси образуют с водой гетерогенную (неоднородную многофазную) систему.
Истинные растворы, где примеси находятся в молекулярно-растворенном виде или в виде ионов, – это гомогенные системы. Гетерогенные системы – коллоиды (размер частиц: 10-2 – 10-1мкм) или суспензии (частицы >10-1 мкм). Суспензии могут быть представлены взвесями, эмульсиями, пенами (частный случай эмульсий).
Вода – один из лучших растворителей. Изначально в Мировом океане были – в той или иной степени – растворены все вещества Земли. И это растворение продолжается: количество поровых вод илов и горных пород составляет около 19% всей гидросферы.
Уже несколько столетий разрабатываются системы классификации природных вод и способы как можно более краткой характеристики качества воды (индекс качества воды). Выделено 625 и даже более классов, групп, типов и разновиднотей вод. В.И. Вернадский считал, что число видов природных вод больше 1500 единиц.
Однако чем более детально разрабатывалась классификация вод, тем больше исследователи удалялись от желаемой краткости и ясности в определении качества воды. Оказалось невозможным оценить пригодность воды для питьевых, технических, других целей только на основе предложенных универсальных индексов воды. По-прежнему качество воды, пригодность ее для использования оценивается по комплексу показателей, и нужно признать, что такой подход дает лишь приблизительное знание о качестве воды. Этим, в частности, можно объяснить большое (до нескольких десятков) количество нормируемых показателей для каждого из возможных применений. Говорить о качестве воды имеет смысл лишь в связи с конкретной областью ее дальнейшего использования.
16. Физические показатели качества воды. Для определения физических показателей качества воды (температура, запах, вкус, прозрачность или мутность, количество взвешенных веществ и цветность) разработаны, методы, используемые при ее анализе.[ ...]Температура определяется немедленно после взятия пробы воды или непосредственно в водоеме термометром с делением 0,1°С, который должен выдерживаться в воде не менее 5 мин.[ ...]Для определения характера запаха испытуемую воду наливают в широкогор-лую колбу емкостью 150—250 мл на 2/3 ее объема, накрывают часовым стеклом, встряхивают вращательными движениями в закрытом состоянии, открывают и органолептически определяют зэлах.[ ...]Вкус и привкус воды оцениваются органолептически по качеству и интенсивности. Различают четыре вида вкуса: соленый, горький, сладкий, кислый. Остальные вкусовые ощущения называются привкусами. Интенсивность вкуса и привкуса также оценивают по пятибалльной системе.[ ...]Прозрачность воды зависит от количества и степени дисперсности взвешенных в воде веществ (глины, ила, органических взвесей). Она выражается в сантиметрах водяного столба, через который видны линии толщиной в 1 мм, образующие крест (определение по «кресту») или шрифт № 1 (по Снеллену или по «шрифту»).[ ...]Визуальное определение мутности в мутномере может быть заменено более объективным определением при помощи фотоэлектронного тиндалепетра . В этом случае измерение мутности основано на эффекте Тиндаля (рассеяние света взвешенными частицами). Тиндалеметр имеетпрямоугольную кювету из органического стекла, которая помещается в светонепроницаемый кожух. В одном конце его находится осветитель с электрической лампочкой, а фотоэлемент размещен под прямым углом к направлению луча света из осветителя. Таким образом, на него попадает только рассеянный свет из кюветы. Фотоэлемент соединен с усилителем постоянного тока и микроампер-■метром.[ ...]
17. ХИМИЧЕСКИЕ ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ Активная реакция воды - степень её кислотности или щёлочности - определяется концентрацией водородных ионов. Обычно выражается через рН - отрицательный логарифм концентрации ионов водорода. При рН = 7,0 реакция воды нейтральная, при рН<7,0 среда кислая, при рН>7,0 среда щелочная. По нормам СанПиН 2.1.4.559-96 рН питьевой воды должен быть в пределах 6,0…9,0 Жесткость воды определяется содержанием в воде солей жесткости (кальция и магния). Она выражается в миллиграмм-эквивалентах на литр (мг-экв/л). Различают следующие виды жесткости: Карбонатная - характеризуется содержанием в воде гидрокарбоната кальция, который при кипячении разлагается на практически нерастворимый карбонат и углекислый газ. Поэтому её еще называют временной жесткостью. Некарбонатная или постоянная жесткость- содержание некарбонатных солей кальция и магния. Общая - сумма карбонатной и некарбонатной жесткости. Вода поверхностных источников, как правило, относительно мягкая (3…6 мг-экв/л) и зависит от географического положения - чем южнее, тем жесткость воды выше. Щёлочность воды. Под общей щёлочностью воды подразумевается сумма содержащихся в ней гидратов и анионов слабых кислот (угольной, кремниевой, фосфорной и т.д Хлориды присутствуют практически во всех водах. В основном их присутствие в воде связано с вымыванием из горных пород наиболее распространённой на Земле соли - хлорида натрия (поваренной соли). Повышенное содержание хлоридов в совокупности с присутствием в воде аммиака, нитритов и нитратов может свидетельствовать о загрязнённости бытовыми сточными водами. ПДК хлоридов в воде питьевого качества - 300…350 мг/л (в зависимости от стандарта). Сульфаты попадают в подземные воды в основном при растворении гипса, находящегося в пластах. Повышенное содержание сульфатов в воде приводит к расстройству желудка (тривиальные названия сульфата магния и сульфата натрия (солей, обладающих слабящим эффектом) - "английская соль" и "глауберова соль" соответственно). ПДК сульфатов в воде питьевого качества - 500 мг/л. Бор и селен присутствуют в некоторых природных водах в качестве микроэлементов в весьма незначительной концентрации, однако при их превышении возможно серьёзное отравление. Окисляемость обусловлена содержанием в воде органических веществ и отчасти может служить индикатором загрязнённости источника сточными водами.
18. Флота́ция (фр. flottation, от flotter — плавать) — один из методов обогащения полезных ископаемых, который основан на различии способности минералов удерживаться на межфазовой поверхности, обусловленный различием в удельных поверхностных энергиях. Гидрофобные (плохо смачиваемые водой) частицы минералов избирательно закрепляются на границе раздела фаз, обычно газа и воды, и отделяются от гидрофильных (хорошо смачиваемых водой) частиц. При флотации пузырьки газа или капли масла прилипают к плохо смачиваемым водой частицам и поднимают их к поверхности. Флотация применяется также для очистки воды от органических веществ и твёрдых взвесей, разделения смесей, ускорения отстаивания в химической, нефтеперерабатывающей, пищевой и др. отраслях промышленности.
Масляная флотация была предложена первой, на которую В. Хайнсу (Великобритания) в 1860 году был выдан патент. При перемешивании измельченной руды с маслом и водой сульфидные минералы избирательно смачиваются маслом и всплывают вместе с ним на поверхность воды, а порода (кварц, полевые шпаты) осаждается. В России масляная флотация графита была осуществлена в 1904 году в Мариуполе.
Пленочная. Способность гидрофобных минеральных частиц удерживаться на поверхности воды, в то время как гидрофильные тонут в ней, была использована А. Нибелиусом (США, 1892) и Маквистеном (Великобритания, 1904) для создания аппаратов плёночной флотации, в процессе которой из тонкого слоя измельченной руды, находящегося на поверхности потока воды, выпадают гидрофильные частицы. Пенная — при которой через смесь частиц с водой пропускают мелкие пузырьки воздуха, частицы определённых минералов собираются на поверхности раздела фаз «воздух-жидкость», прилипают к пузырькам воздуха и выносятся с ними на поверхность в составе трехфазной пены (с добавлением пенообразователя, который регулирует устойчивость пены). Пену в дальнейшем сгущают и фильтруют. В качестве жидкости чаще всего используется вода, реже насыщенныерастворы солей (разделение солей, входящих в состав калийных руд) или расплавы (обогащение серы). Электрофлотация — перспективный метод для применения в химической промышленности, заключается во всплытии на поверхности жидкости дисперсных загрязнений за счет выделения электролитических газов и флотационного эффекта. Для очистки воды, а также извлечения компонентов из разбавленных растворов в 1950-х годах был разработан метод ионной флотации, перспективный для переработки промышленных стоков
19. Коагуляция (лат. coagulatio — свёртывание, сгущение, укрупнение) — объединение мелких диспергированных частиц в бо́льшие по размеру агрегаты. Коагуляция влиозолях вызывает выпадение хлопьевидного осадка — коагулята или образование сетчатой структуры (застудневание). Коагулирование воды — процесс осветления и обесцвечивания воды с применением химических реактивов-коагулянтов, которые при взаимодействии сгидрозолями и растворимыми примесями воды образуют осадок. Используется при очистке водопроводной воды перед отстаиванием и фильтрацией. Цель коагулирования состоит в том, чтобы в процессе флокуляции примеси образовали «флокулы» — хлопьевидные скопления, которые из-за их большого размера легко удалить из воды отстаиванием или фильтрованием. Без коагулирования удаление мелкодисперсных примесей в отстойнике может быть непрактичным, так как требует больших интервалов времени (до нескольких лет). Оптимальный размер флокул — несколько миллиметров. Стабильность коллоидной смеси поддерживается в основном за счёт электростатического отталкивания и стерических эффектов, потому коагулирование применяет следующие методы: предотвращение электростатического отталкивания с помощью добавления солей или изменения кислотности; это даёт возможность коллоидным частицам сблизиться на расстояние, на котором силы Ван-дер-Ваальса приведут к слипанию частиц; Процесс коагулирования проводится в два этапа: быстрое смешивания химиката с водой. Обычно продолжается около одной минуты (меньшие интервалы приводят к худшему распределению коагулянта; бо́льшие могут привести к разрушению уже образовавшихся флокул). Смешивание обычно производится в специальном резервуаре-смесителе; собственно флокуляция (обычно от получаса до 45 минут). В процессе флокуляции вода проходит через несколько резервуаров с постепенно уменьшающейся скоростью перемешивания воды.
20. ФЛОКУЛЯНТЫ, в-ва, вызывающие в жидких дисперсных системах флокуляцию - образование рыхлых хлопьевидных агрегатов (флокул) из мелких частиц дисперсной фазы Наиб. практич. значение имеет флокуляция в водной среде, вызванная высокомол. флокулянтами- полиэлектролитами или неионо-генными полимерами. При этом наиб. вероятна т. наз. адсорбционная флокуляция - соединение частиц в результате адсорбции отдельных сегментов макромол. цепи флокулянтов на разных частицах. Катионные флокулянты особенно эффективны при обработке дисперсных систем с отрицательно заряженными частицами. Слабоосновные катионные флокулянты- поливиниламин, полиэтилен-имин, поливинилпиридины и др., содержащие в молекуле первичные, вторичные и третичные атомы азота, сильноосновные - полиэлектролиты с четвертичными аммониевыми или пиридиниевыми группами (получают исчерпывающим алкилирование атомов N слабоосновных флокулянтов или полимеризацией соответствующих мономерных соединений). В качестве катионных флокулянтов могут быть использованы полимеры аминоал-киловых эфиров AK и МАК, винилпиридинов, диаллиламина, диаллилдиметиламмонийхлорида (напр., полиэлектролит ВПК-402), продукты алкилирования полидиметиламиноэтил-метакрилата и полидиэтиламиноэтилметакрилата (ВА-102, ВА-112), продукты последоват. хлорметилирования и амини-рования полистирола или поливинилтолуола (ВА-2, ВПК-01), модифицированный формальдегидом и вторичным амином (по р-ции Манниха) ПАА, содержащий в макромолекуле до 30 мол. % катионных звеньев (напр., КФ-4 и КФ-6, в к-рых помимо аминогрупп имеются амидные, карбоксильные и метоксильные группы) Из анионных флокулянтов в пром-сти применяют: частично гидроли-зованный ПАА, содержащий в макромолекуле 20-40% карбоксилатных звеньев; продукты неполного щелочного (напр., реагенты гипан, К-4, К-6, К-9) или кислотного (напр., "Ока") гидролиза полиакрилонитрила с разл. соотношением нит-рильных, амидных и карбоксильных (или карбоксилатных) групп; гомо- и сополимеры акриловой (AK) и метакриловой (МАК) K-T [напр., "Комета" - полиметакриловая к-та, на 50-60% нейтрализованная щелочью, метас (метасол) - сополимер метакриламида и МАК (или Na-соли МАК) при эквимолярном соотношении сомономеров, метакрил M-14 BB (лакрис 20) - сополимер метилметакрилата и МАК (или ее смешанной соли) при молярном соотношении 1:4]. К анионным флокулянтам с карбоксильными (карбоксилатными) группами относятся также сополимеры малеиновой и фумаровой K-T. Практич. интерес представляют флокулянты с сильнокислотными группами (напр., сульфогруппами) на основе полистирола (напр., BK-1), ПАА и др. полимеров.
21. Хлори́рование — способ дезинфекции и окисления воды. Применяется наряду с другим способом окисления — озонированием. Хлорирование применяется при подготовке воды для: очистки окислением. При окислении загрязняющие вещества разрушаются хлором и озоном (хлором или озоном). Образовавшиеся продукты распада удаляютсяфильтрованием или сорбентами. Другими способами очистки являются: коагуляция, фильтрование, окисление озоном (озонирование). дезинфекции (обеззараживания воды). Основной способ. Как правило сочетается с озонированием или обеззараживанием ультрафиолетовым излучением. Ни озонирование, ни ультрафиолетовое излучение не обладают бактерицидным последействием, поэтому их не допускается использовать в качестве самостоятельных средств обеззараживания воды при подготовке воды бассейнов. Озониpование и ультрафиолетовое обеззараживаниe применяются как дополнительные методы дезинфекции, вместе с хлорированием, повышают эффективность хлорирования и снижают количество добавляемых хлорсодержащих реагентов.
Хлорсодержащие реагенты (хлорреагенты) — реагенты на основе хлора и соединений хлора. Растворяются в воде и образуют хлорноватистую кислоту и (или)гипохлорит-ионы. Для дезинфекции воды применяют следующие реагенты: гипохлорит натрия марки А по ГОСТ 11086-76 Гипохлорит натрия. Технические условиягипохлорит натрия, получаемый методом электролиза на месте применения гипохлорит кальция по ГОСТ 25263-82 Кальция гипохлорит нейтральный. Технические условия газообразный хлор, получаемый из жидкого хлора по ГОСТ 6718-93 (ИСО 2120-72, ИСО 2121-72) Хлор жидкий. Технические условия газообразный хлор, получаемый методом электролиза на месте применения Преимущества хлорирования: Ни один альтернативный метод так и не смог приблизиться к нему по результативности: облучение лучами ультрафиолета является эффективным только при высокой степени прозрачности воды; озонирование, в принципе, позволяет добиться необходимых параметров чистоты, но остается слишком дорогостоящим для массового применения способом. Кроме этого, только хлорирование не только позволяет обеззаразить воду в момент обработки, но и дает возможность гарантировать ее чистоту при прохождении через водопроводную систему. Существенные недостатки (в частности, для жидкого хлора) такие как: высокая токсичность, определяющая опасность при обращении с ним; взрывоопасность из-за высокой реакционной способности хлора - сильного окислителя; возможность образования побочных токсичных хлорпроизводных в процессе хлорирования примесей воды; высокая коррозионная активность водных растворов хлора и недостаточное воздействие на спорообразующие бактерии.
22. Озонирование — технология очистки, основанная на использовании газа озона — сильного окислителя. Озонатор вырабатывает озон из кислорода, содержащегося в атмосферном воздухе. При производстве озона необходимо удалять влагу из воздуха, иначе в озонаторе будет образовываться азотная кислота. При взаимодействии с окисляющимися химическими веществами и микроорганизмами (все они с химической точки зрения — хорошо окисляющиеся соединения углерода) озон превращается в обычный кислород. Вещества, подвергшиеся окислению, могут перейти в газообразную фазу, выпасть в осадок или не представлять такой опасности, как исходные вещества. Преимущества озонирования: Озон уничтожает все известные микроорганизмы: вирусы, бактерии, грибки, водоросли, их споры, цисты простейших и т. д. Не существует и не может возникнуть устойчивых к озону форм Остаточный озон стерилизует поверхность резервуара. Озон действует очень быстро — в течение секунд Озон удаляет некоторые запахи и привкусы, которые некоторым людям кажутся неприятными. Озонирование не придаёт дополнительных вкусов и запахов. Озонирование не изменяет кислотность воды и не удаляет из неё необходимые человеку вещества. Остаточный озон быстро превращается в дикислород (O2). Озон может вырабатываться только на месте, поскольку его хранение и транспортировка невозможны. Для выработки озона нужен свободный газообразный дикислород. Озон уничтожает известные микроорганизмы в 300-3000 раз быстрее, чем любые другие дезинфекторы. Недостатки озонирования: Дороговизна озонатора. Необходимость специальной подготовки воздуха (осушка) или работа на кислороде. Недостаточная способность озона к разрушению фенольных соединений. Необходимость длительного контакта озона с загрязнителем в случае комплексных соединений. Озон является очень сильным окислителем и чрезвычайно ядовит даже в низких концентрациях. Озон относится к самому высокому классу опасности вредных веществ, поэтому его использование должно контролироваться специальными датчиками. Однако, очень быстро распадается на кислород, становясь совершенно безопасным и не оставляя токсичных элементов. 2.Метод разделения – концентрирование примесей в локальном объёме раствора без существенного изменения фазово-дисперсных свойств извлекаемых из сточных вод веществ. Достоинства этого метода– компактность установок, отсутствие потребности в реагентах. Нед-ки: повышенный расход электроэнергии.
23. Электрохимическое и безреагентное обеззараживание, достоинства и недостатки, области использования? Безреагентное обеззараживание производят при помощи бактерицидного излучения и ультразвуком. Безреагентное обеззараживание обладает высокой эффектив-тью и низкой стоимостью эксплуатации. Оно применяется при обезжелезивании воды. Электрохимические методы очистки относятся к физико-химическим процессам (метод превращения, метод разделения и комбинированные) и применяются для очистки сточных вод. 1.Метод превращения –обеспечение изменения физико-химического фазово-дисперсного характера загрязнений сточных вод с целью их обезвреживания.
